Labā priekškambara audu morfoloģiskās pārmaiņas dažādu iedzimtu sirdskaišu gadījumos: pilotpētījums
Labā priekškambara audu morfoloģiskās pārmaiņas dažādu iedzimtu sirdskaišu gadījumos: pilotpētījums
Kopsavilkums
Ievads. Iedzimtās sirds slimības pasaulē sastopamas vidēji astoņiem bērniem no 1000 dzīvi dzimušajiem. Iedzimto sirdskaišu etioloģija un morfoloģija vēl joprojām tiek pētīta. Iedzimtu sirdskaišu gadījumā viens no galvenajiem notikumiem ir apoptoze, kas tiek saistīta ar sirds muskuļa audu išēmiju. Iedzimtu sirdskaišu gadījumā svarīga nozīme ir arī sirds muskuļa inervācijai, asinsvadu stāvoklim un sirds muskuļa homeostāzei.
Darba mērķis. Izvērtēt sirds labā priekškambara austiņā programmētu kardiomiocītu nāvi, endoteliālos faktorus, sirds muskuļa homeostāzi un inervāciju iedzimtu sirdskaišu gadījumos.
Materiāls un metodes. Materiāls tika iegūts no Rīgas Stradiņa universitātes Anatomijas un antropoloģijas institūta kolekcijas. Tika izmantoti piecu bērnu – divu meiteņu un trīs zēnu – miokarda audi, kas iegūti sirds patoloģiju korekcijas operācijas laikā no labā priekškambara austiņas.
Vispārējā pārskata iegūšanai materiāli no katra parauga tika krāsoti ar hematoksilīnu un eozīnu un, pielietojot imūnhistoķīmiju, arī ar antivielām pret proteīngēnvielu 9,5 (PGP), vaskulāro endoteliālo augšanas faktoru (VEGF), endotelīnu-1 (ET), ātriju nātrijurētisko peptīdu (ANP) un hromogranīnu (CHR). Apoptozes noteikšanai tika lietota TUENL metode, iezīmēto struktūru daudzuma izvērtēšanai – puskvantitatīvā skaitīšanas metode.
Rezultāti. Visos gadījumos redzēja dažāda izmēra kardiomiocītus, kuros tika novērota vakuolizācija. Vienā gadījumā bērnam ar acianotiskā tipa sirdskaiti starp muskuļu šūnām tika novēroti ieauguši saistaudi.
VEGF gandrīz visos gadījumos tika konstatēts lielā un ļoti lielā daudzumā šūnu. ET netika atrasts gandrīz nevienā preparātā, kas nesaskan ar literatūras datiem, jo iedzimtas sirdskaites parasti tiek saistītas ar palielinātu endotelīna daudzumu audos.
Visos preparātos tika konstatēts liels daudzums apoptotisku šūnu, kas bērniem ar iedzimtām sirdskaitēm liecina par miokarda išēmiju.
PGP 9,5 saturošās neiroendokrīni aktīvās šķiedras ļoti daudz tika novērotas visos preparātos, kas norāda uz miokarda hiperinervāciju un ir pretstatā literatūras datiem, kuros iedzimtas sirdskaites tiek saistītas ar inervācijas vājumu.
ANP un CHR variēja no vidēji daudz līdz ļoti daudz šūnu, norādot uz sirds tilpuma un slodzes homeostāzi.
Secinājumi. Izteiktais VEGF saturošo endoteliocītu skaits iedzimtu sirds patoloģiju gadījumā ļauj pamatot sirds muskuļa išēmiju, kas korelē ar programmēto šūnu bojāeju.
Izteiktā neiropeptīdus saturošā inervācija vērtējama kā kompensatora reakcija uz kopējā sirds muskuļa veselības pasliktināšanās (išēmijas, apoptozes) fona.
ANP un hromogranīna daudzums miokardā ir atbilstošs saglabātai sirds muskuļa kontrakciju un tilpuma homeostāzei sirdī.
Ievads
Iedzimtās sirds slimības pasaulē sastopamas vidēji astoņiem bērniem no 1000 dzīvi dzimušajiem [21]. Eiropā šis rādītājs ir septiņi bērni no 1000 dzīvi dzimušajiem [9], savukārt Latvijā vidēji gadā no 1000 dzīvi dzimušajiem desmit bērni piedzimst ar iedzimtām sirds patoloģijām [1].
Viens no sirds slimību iedalījumiem ir cianotiskās sirds slimības un acianotiskās sirds slimībās [1]. Cianotiskās sirds slimības ir tās patoloģijas, kam raksturīgs samazināts skābekļa daudzums asinīs. Cianotiskās sirds slimības izpaužas ar cianozi, paātrinātu elpošanu un nemieru bērnam uzreiz pēc dzimšanas. Dažkārt cianotisko sirds slimību gadījumā jaundzimušajam var novērot bezsamaņas epizodes [28]. Acianotisko sirds slimību gadījumā asinis ir pietiekami piesātinātas ar skābekli, tāpēc jaundzimušajam uzreiz pēc dzemdībām šāda simptomātika netiek novērota.
Acianotiskās sirdskaites lielākoties tiek atklātas, veicot augļa ehokardioskopiju grūtniecības laikā, pēcdzemdību regulārajās pārbaudēs vai arī izmeklējot ar sirds slimībām nesaistītus simptomus, piemēram, malnutrīciju, pastiprinātu bērna miegainību vai augšanas un attīstības aizturi [27]. Ir veikti daudzi pētījumi, kas parāda sirds muskuļa morfoloģiskās izmaiņas dažādu iedzimtu sirds patoloģiju gadījumā, galvenokārt pētot sirds muskuļa metabolismu, asinsvadu stāvokli, sirds muskuļa inervāciju un faktorus, kas izraisa programmēto šūnu nāvi [2].
Apoptoze ir endogēnu faktoru izraisīta šūnu bojāeja. Tas ir no enerģijas atkarīgs process, ko regulē ģenētiskā programma [18]. Miokarda šūnu apoptoze ir novērojama hipoksijas ietekmē un miokarda attīstības procesa laikā [29]. Pētījumos ar žurku embrijiem žurku miokarda attīstības laikā apoptotiskas miokarda šūnas tika diagnosticētas līdz 11. postnatālajai dienai [17].
Citā gadījumā, miokardu pakļaujot išēmijai, miocītu mitohondriju membrānās tika novērota proteīnu aktivizācijas kaskāde, kas beidzās ar šūnas nāvi. B šūnu limfomas-2 (BLC-2) un BLC-2 asociētā proteīna X (BAX) aktivizēšanas ietekmē tika sekmēta K+ un Cl− kanālu aktivitāte, izmainot mitohondrija pH līmeni. Izmainoties mitohondrija pH, tika novērota citohroma C (Cyt c) atbrīvošanās mitohondrija membrānā un nonākšana citosolā, kur Cyt c aktivēja kaspāžu ķēdi [31]. Cyt c ir hēma proteīns, kurš piedalās elektronu transportēšanā mitohondrija iekšējā membrānā, bet hipoksijas ietekmē Cyt c, nonākot citosolā, saistās ar apoptotisko proteāzes aktivējošo faktoru-1 (Apaf-1) [16], aktivējot kaspāzi-9, kas ir apoptozes ķēdes kaspāzes posms [30]. Kaspāžu ķēde beidzas ar kaspāzes-3 inducētu mitohondriju DNS fragmentēšanos jeb miocīta apoptozi [18].
Sirds funkcionēšanā liela nozīme ir miokarda inervācijai. Tomēr tieši simpātiskajai nervu sistēmai ir lielākā nozīme miokarda fizioloģijā. Simpātiskās nervu šķiedras inervē kardiomiocītus, kuri, inervācijas ietekmē kontrahējoties, nodrošina asins plūsmu [7]. Pētījumi liecina, ka sirds mazspējas gadījumos, ko izraisa iedzimtas vai iegūtas sirds patoloģijas, būtiska nozīme ir simpātiskajai nervu sistēmai [20]. Kvantitatīvai miokarda inervācijas pētīšanai izmanto proteīna gēnvielu (PGP 9,5) noteikšanu. PGP 9,5 atklāja zinātnieki Džeksons un Tomsons 1983. gadā, sākotnēji uzskatot, ka PGP 9,5 ir nespecifisks neironos sastopams proteīns. Abi zinātnieki izteica hipotēzi, ka ar PGP 9,5 var noteikt nervu sistēmas attīstības pakāpi, kā arī konstatēt nervu sistēmas bojājumus [11].
Šobrīd ir pierādīts, ka PGP 9,5 ir specifisks neirālajām un neiroendokrīnajām šūnām, kaut gan PGP 9,5 niecīgā daudzumā ir atrasts arī nieru kanāliņu epitēlijā, ovocītos, melanocītos, prostatas sekretorajā epitēlijā, sēklinieka piedēklī, krūts dziedzeru epitēlija šūnās, Mekeļa šūnās un ādas fibroblastos [4]. PGP 9,5 noteikšanu izmanto arī neiroendokrīno šūnu audzēju diagnostikā [4]. Izvērtējot miokarda inervāciju ar PGP 9,5, tiek noteikts adrenerģisko šķiedru daudzums histoloģiskajā materiālā [6]. Ir izpētīts, ka iedzimtu sirdskaišu gadījumos nervu šķiedru daudzums miokardā ir vairākkārt samazināts, tāpēc inervācijas trūkums būtiski ietekmē sirds funkcijas [12].
Endotelīns-1 ir endoteliocītu sintezēts peptīds, kuram piemīt vazokonstriktīvs un šūnu proliferāciju stimulējošs efekts gan kardiovaskulārajā sistēmā, gan ārpus tās. Endotelīns-1 stimulē citokīnu proliferāciju, vaskulārā endoteliālā augšanas faktora un fibroblastu augšanas faktora produkciju [23]. Endotelīna līmenim plazmā paaugstinoties, tas stimulē vazokonstrukciju asinsvadu miokarda gludajā muskulatūrā, nieru un citos ķermeņa asinsvados. Minēto izmaiņu dēļ paaugstinās arteriālais asinsspiediens, samazinās sirdsdarbības frekvence un samazinās diurēze.
Ir pētījumi, kuros paaugstinātu endotelīna-1 līmeni plazmā saista ar pulmonālu hipertensiju, arteriālu hipertensiju, otrā tipa cukura diabētu, nieru mazspēju un miokarda hipertrofiju [3]. Endotelīns- 1 tiek saistīts arī ar aterosklerozi. Pētījumos ir aprakstīta endotelīna saistība ar hiperholisterinēmiju un aterosklerotisko plātnīšu veidošanās stimulāciju fibroblastu un putu makrofāgu stimulēšanas rezultātā [23]. Endotelīna līmenis plazmā palielinās pēc proinflammatoro citokīnu un brīvo radikāļu stimulācijas, kā arī pēc audu išēmijas vai plašiem iekaisuma procesiem [19].
Vaskulāro endoteliālo augšanas faktoru (VEGF) izstrādā makrofāgi, trombocīti, nieru mezangiālās šūnas un keratinocīti. VEGF ir saistīts ar normāliem fizioloģiskiem procesiem kaulu attīstībā, brūču dzīšanā, hematopoēzē un orgānu attīstībā [13]. VEGF inducē endotēlija proliferāciju, sekmē šūnu migrāciju vaskuloģenēzes laikā un inhibē apoptozi. Ir pierādīts, ka VEGF inducē angioģenēzi un ir svarīgākais asinsvadu formēšanā [25]. Palielināts VEGF daudzums miokardā tiek saistīts ar hipoksijas ietekmi. VEGF normālos apstākļos veicina mezenhīmas proliferāciju endokardā. Ja šis sirds attīstības process tiek pakļauts hipoksijai, tiek stimulēta VEGF produkcija, kas izraisa iedzimtas sirds patoloģijas atrioventrikulārajā reģionā. VEGF nozīme iedzimtu sirds patoloģiju gadījumā ir neskaidra un tiek vēl pētīta [10].
Ātriju nātrijurētiskais peptīds (ANP) ir asins straumē cirkulējošs hormons, ko izdala priekškambara miocīti [8]. ANP funkcija ir uzturēt asins tilpumu un piedalīties arteriālā asinsspiediena regulācijā. ANP sekretējas priekškambara miocītos priekškambaru iestiepuma dēļ. ANP saistās ar specifiskiem ANP receptoriem, nieru kanāliņu aferentā daļa dilatējas, glomerulos pieaug spiediens, tāpēc palielinās glomerulu filtrācijas ātrums. Šo izmaiņu dēļ samazinās sistoliskais asinsspiediens. Papildus ANP atslābina asinsvadu gludo muskulatūru, samazina aldosterona sintēzi un inhibē ketaholamīnu vazokonstriktīvos efektus, samazinot arteriālo asinsspiedienu [8].
ANP ir nozīmīga loma sirds patoloģiju gadījumā, piemēram, ANP samazina miokarda hipertrofiju, samainot kopējo cirkulējošo asins tilpumu un sirds minūtes tilpumu. Ir novērots ANP līmeņa pieaugums sirds nepietiekamības un miokarda infarkta gadījumā, bet patofizioloģiskais mehānisms vēl līdz galam nav skaidrs. Viens no iespējamiem mehānismiem išēmiskas sirds patoloģijas gadījumos ir ANP neitrofilu un makrofāgu adhēzijas un aktivācijas bloķējoša darbība, kas samazina išēmijas radītas apoptozes raksturīgās pārmaiņas audos, kā arī iespējamos bojājumus pēc miokarda asins cirkulācijas atjaunošanās [26]. ANP līmeņa palielināšanās postnatālā periodā ir saistīta ar perinatālu asfiksiju, ductus arteriosus neslēgšanos, FALOT tetrādi, ventrikulu septāliem defektiem un citām iedzimtām sirds patoloģijām. ANP ir būtisks postoperatīvajā periodā, kas liecina par tā nozīmi jaundzimušo sirds patoloģiju diagnostikā [32].
Hromogranīns A ir neiroendokrīns sekretors proteīns, kas tiek sintezēts ventrikulu miokarda neiroendokrīnajās šūnās. Hromogranīna A funkcijas ir kontrakciju un relaksāciju regulācija miokardā. Vēl hromogranīns A piedalās adrenerģiskās un endotelīnerģiskās aktivitātes regulācijā. Kopā ar ANP hromogranīns tiek uzskatīts par faktoru, kas uztur miokarda homeostāzi [2]. Ir aprakstīts hromogranīna A līmeņa pieaugums plazmā pēc miokarda infarkta, išēmijas stāvokļiem un sirds nepietiekamības. Tādējādi ir pamats uzskatīt, ka hromogranīna A noteikšanai ir prognostiska nozīme sirds slimību attīstībā [5].
Darba mērķis
Darba mērķis bija izvērtēt sirds labā priekškambara austiņā programmētu šūnu nāvi, endoteliālos faktorus, sirds muskuļa homeostāzi un inervāciju iedzimtu sirdskaišu gadījumos.
Materiāls un metodes
Materiāls tika iegūts no Rīgas Stradiņa universitātes Anatomijas un antropoloģijas institūta kolekcijas. Tika izmantoti piecu bērnu – divu meiteņu un trīs zēnu – miokarda audi, kas iegūti sirds patoloģiju korekcijas operācijas laikā no labā priekškambara austiņas. Pētījumam ar lēmumu Nr. 14 / 30.04.2015 tika saņemta Rīgas Stradiņa universitātes Ētikas komitejas atļauja.
Sirds ķirurģiskā korekcija tika veikta diviem bērniem ar cianotiskā tipa sirdskaitēm (16 dienu vecam zēnam un sešus mēnešus vecai meitenei) un trim bērniem ar acianotiskā tipa sirdskaitēm. Bērnu vecums operāciju laikā bija no 16 dienām līdz vienam gadam un diviem mēnešiem.
Iegūtie audi tika ievietoti fiksatorā, kas sastāvēja no 2% formaldehīda un 0,2% pikrīnskābes, 0,1 M fosfātu bufera ar pH 7,2. Fiksatora šķīdums tika izskalots no audiem 12 stundu laikā, lietojot tiroīda bufera šķīdumu, ko veidoja tiroīda fosfātu buferis un saharoze ar pH 7. Pēc tam audu gabaliņi tika ieguldināti parafīnā.
Parafīnā ieslēgtā materiāla bloki tika sagriezti ar mikrotomu 6–7 μm biezumā.
Griezumi tika deparafinizēti un krāsoti ar hematoksilīnu un eozīnu vispārējā pārskata iegūšanai, kā arī tika lietotas imūnhistoķīmiskās metodes, lai novērtētu dažādu proteīnu daudzumu kardiomiocītos.
Izmantojot imūnhistoķīmiskās metodes, materiāls tika iezīmēts ar antivielām pret 1) proteīngēnvielu 9,5, PGP 9,5 (Anti-PGP 9,5, 439273A, kas iegūta no truša; Zymed Laboratories, ASV), 2) vaskulāro endoteliālo faktoru, VEGF (VGEF, M 7273, iegūts no peles, DakoCytomation, Dānija), 3) endotelīnu-1, ET (Endothelin-1, ab 2786, iegūts no peles, Abcam, Lielbritānijas un Ziemeļīrijas Apvienotā Karaliste), 4) ātriju nātrijurētisko peptīdu, ANP (ANP, DakoCytomation, Dānija), 5) hromogranīnu, CHR (CH, A 0430, iegūts no truša, DakoCytomation, Dānija).
Apoptozes noteikšanai saskaņā ar Negoescu [24] tika lietota deoksinukleotidiltransferāzes dUTP iezīmētā gala marķēšana jeb TUNEL metode (TUNEL, Nr. 11684817910, Roche, Vācija).
Iezīmēto struktūru daudzuma novērtēšanai tika izmantota puskvantitatīvā skaitīšanas metode. Tika lietoti šādi apzīmējumi: (−) – netika redzēta neviena pozitīva struktūra, (0) – retas pozitīvas struktūras redzes laukā, (+) – maz pozitīvu struktūru redzes laukā, (++) – vidēji daudz pozitīvu struktūru redzes laukā, (+++) – daudz pozitīvu struktūru redzes laukā, (++++) – ļoti daudz pozitīvu struktūru redzes laukā (Pilmane, 1997) (sk. 1. tab.).
Rezultāti
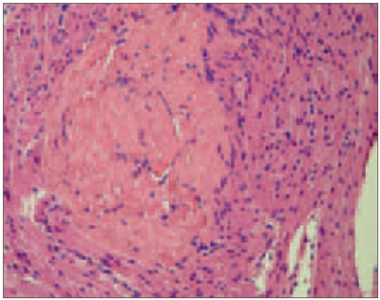
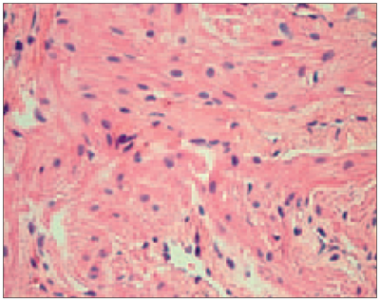
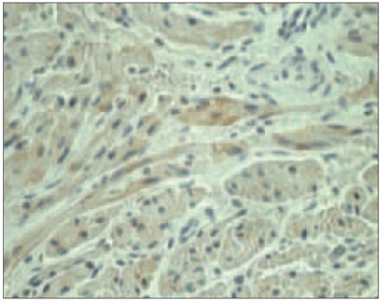
Hematoksilīna un eozīna krāsojumā visos gadījumos bija redzamas dažāda izmēra šūnas, kurās tika novērota vakuolizācija. Vienā gadījumā bērnam ar acianotiskā tipa sirdskaiti tika novēroti starp muskuļu šūnām ieauguši saistaudi (sk. 1. un 2. att.).
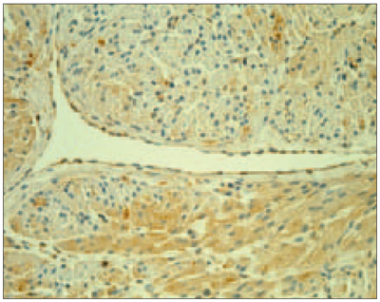
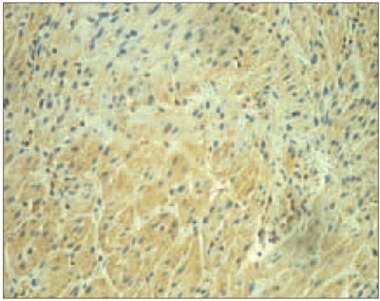
Visiem pacientiem ar acianotiskā tipa sirdskaitēm un pacientiem ar cianotiskā tipa sirdskaitēm VEGF tika atrasts ļoti daudz endoteliocītos visos preparātos (sk. 1. tab.), izņemot divus gadījumus: vienu ar cianotiskā tipa sirdskaiti un citu gadījumu ar acianotiskā tipa sirdskaiti, kuros VEGF saturošo endoteliocītu bija maz vai tie vispār netika novēroti (sk. 3. att.).
Endotelīns netika novērots vai tika novērojams maz endoteliocītos (sk. 1. tab.), izņemot vienu gadījumu: bērnam ar cianotiskā tipa sirdskaiti endotelīns tika novērots vidēji daudz endoteliocītos.
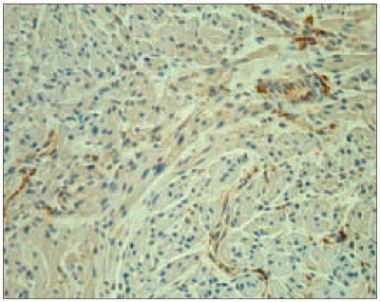
Visiem pacientiem miokarda audos tika atrastas ļoti daudz PGP 9,5 saturošas nervšķiedras (sk. 4. att.).
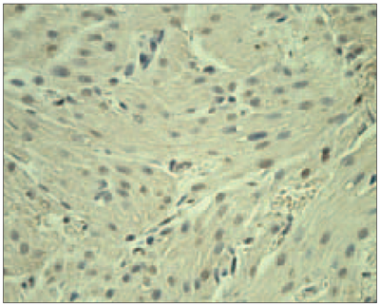
Vidēji daudz līdz daudz ANP saturošus kardiomiocītus novēroja vienam bērnam ar cianotiskā tipa sirdskaiti un trīs bērniem ar acianotiskā tipa sirdskaiti (sk. 5. att.). Citā gadījumā – bērnam ar acianotiskā tipa sirdskaiti – novēroja maz ANP saturošus kardiomiocītus (sk. 1. tab.).
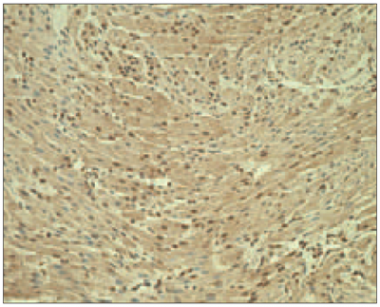
Vidēji daudz līdz daudz hromogranīna pozitīvi kardiomiocīti tika novēroti visos gadījumos (sk. 6. att.).
Apoptotisko kardiomiocītu skaits visos gadījumos bija no 161 ± 15,3 līdz 229 ± 39,5, vidēji 186 ± 44,4, izņemot vienu gadījumu, – bērnam ar acianotiskā tipa sirdskaiti apoptotisko kardiomiocītu skaits bija 124 ± 9,5 (sk. 7., 8. att., 1. tab.).
1. tabula. Dažādus faktorus saturošo struktūru relatīvā daudzuma salīdzinājums iedzimtu sirdskaišu gadījumos / Various factors containing structure relative quantity comparison in case of congenital heart disease
| Nr. p. k | VEGF | ET | PGP | ANP | CHR | TUNEL |
|---|---|---|---|---|---|---|
| 1. | ++ / +++ | ++ | ++ / +++ | + / ++ | +++ | 161 ± 15,3 |
| 2. | + | 0 / + | ++++ | ++ | ++ / +++ | 229 ± 39,5 |
| 3. | 0 / + | – | ++++ | +++ | +++ | 194 ± 45,6 |
| 4. | ++++ | 0 / + | ++++ | ++ | +++ | 124 ± 9,5 |
| 5. | ++++ | 0 / + | ++++ | + | +++ | 202 ± 25,2 |
| Kopā: | 186 ± 44,4 | |||||
(−) – nav atrasta neviena pozitīva struktūra redzes laukā, (0) – retas pozitīvas struktūras, (+) – maz pozitīvu struktūru redzes laukā, (++) – vidēji daudz pozitīvu struktūru redzes laukā, (+++) – daudz pozitīvu struktūru redzes laukā, (++++) – ļoti daudz pozitīvu struktūru redzes laukā.
ANP – ātriju nātrijurētiskais peptīds, CHR – hromogranīns, ET – endotelīns, PGP – proteīna gēna produkts 9,5, TUNEL – deoksinukleotidiltransferāzes mediētais deoksiuridīna trifosfāta gala marķējums, VEGF – vaskulārais endoteliālais augšanas faktors.
1. attēls. Ar iedzimtu sirdskaiti sirgstoša bērna miokards ar fibrozi (hematoksilīns / eozīns, × 200) / Myocardium of child with congenital heart disease with fibrosis (hematoxilin / eosin, × 200) | 2. attēls. Ar acianotiskā tipa sirdskaiti sirgstoša bērna miokards ar kardiomiocītu vakuolizāciju (hematoksilīns / eozīns, × 400) / Myocardium of child with acyanotic congenital heart disease with cardiomyocites vacualization (hematoxilin / eosin, × 400) |
|
|
3. attēls. Ar cianotiskā tipa sirdskaiti sirgstoša bērna miokards ar daudz VEGF saturošiem endoteliocītiem (VEGF IMH, × 250) / Myocardium of child with cyanotic congenital heart disease with numerous of VEGF positive endotheliocytes (VEGF IMH, × 250) | 4. attēls. Ar cianotiskā tipa sirdskaiti sirgstoša bērna miokards ar ļoti daudz PGP 9,5 saturošām nervšķiedrām (PGP 9,5 IMH, × 250) / Myocardium of child with cyanotic congenital heart disease with abundant number of PGP 9.5 positive nerve fibers (PGP 9.5 IMH, × 250) |
|
|
5. attēls. Ar acianotiskā tipa sirdskaiti sirgstoša bērna miokards ar vidēji daudz ANP pozitīviem kardiomiocītiem (ANP IMH, × 400) / Myocardium of child with acyanotic congenital heart disease with moderate nummer of ANP positive cardiomyocites (ANP IMH, × 400) | 6. attēls. Ar cianotiskā tipa sirdskaiti sirgstoša bērna miokards ar daudz CHR saturošiem kardiomiocītiem (CHR IMH, × 250) / Myocardium of child with cyanotic congenital heart disease with numerous of CHR positive cardiomyocites (CHR IMH, × 250) |
|
|
7. attēls. Ar cianotiskā tipa sirdskaiti sirgstoša bērna miokards ar apoptotiskiem kardiomiocītiem (TUNEL, × 400) / Myocardium of child with cyanotic congenital heart disease with apoptotic cardiomyocites (TUNEL, × 400) | 8. attēls. Ar cianotiskā tipa sirdskaiti sirgstoša bērna miokards ar apoptotiskiem kardiomiocītiem (TUNEL, × 200) / Myocardium of child with cyanotic congenital heart disease with apoptotic cardiomyocites (TUNEL, × 200) |
|
|
Diskusija
VEGF ir viens no galvenajiem faktoriem, kas inducē endotēlija proliferāciju un endoteliocītu migrāciju, sekmējot vaskuloģenēzi [13]. VEGF produkcija ir novērojama visā audu attīstības periodā, bet pastiprinātu VEGF produkciju audos saista ar hipoksijas ietekmi [10]. Mūsu pētījumā trijos no pieciem gadījumiem tika novērota pastiprināta VEGF ekspresija. Iespējams, ka pastiprināta VEGF ekspresija miokarda audos iedzimtu sirds patoloģiju gadījumā ir kompensatora reakcija išēmijai adekvātas oksigenācijas atjaunošanai.
Endotelīnu-1 miokarda audos nelielā daudzumā novērojām vienā gadījumā, bet pārējos gadījumos tas gandrīz vispār netika novērots. Lai gan endotelīnam-1 ir būtiska loma miokarda proliferācijā, vaskulārā endoteliālā faktora un fibroblastu augšanas faktora izdales stimulācijā un tam piemīt arī vazokonstruktīvs efekts miokardā [23], mēs uzskatām, ka endotelīnam-1 nav būtiskas nozīmes iedzimtu sirds patoloģiju gadījumā.
Zināms, ka PGP 9,5 ir viens no pamata marķieriem, ar ko kvantitatīvi izvērtē nervu šķiedras miokarda audos [11]. Mēs uzskatām, ka PGP 9,5 pozitīvo struktūru izteiktā atrade varētu norādīt uz miokarda hiperinervāciju kā iespējamu kompensācijas mehānismu iedzimtu sirdskaišu gadījumos, kas ir pretstatā pētījumiem, kuros iedzimtas sirds patoloģijas ir asociētas ar inervācijas vājumu [12], tomēr jāuzsver, ka minētās atšķirības varētu būt tieši atkarīgas no sirdskaites tipa, tādēļ šis aspekts vēl būtu jāpēta.
Visbiežāk tika konstatēti maz līdz vidēji daudz ANP saturoši kardiomiocīti, kas liecina par uzturētu priekškambaru tilpuma un spiediena homeostāzi miokardā iedzimto sirdskaišu gadījumos [32]. ANP produkcija ir svarīga sirds minūtes tilpuma, kontrakcijas spēka un miokarda trofikas regulācijā, nodrošinot optimālu miokarda noslodzi [26]. Iespējams, ka ANP produkcijas rezultātā, samazinot sirds slodzi, tiek nodrošināta optimāla sirds funkcija un kavēta turpmāka išēmijas attīstība, kas radusies iedzimtu sirds patoloģiju gadījumā.
Gandrīz visos preparātos tika konstatēti ļoti daudz hromogranīnu saturoši kardiomiocīti. Hromogranīnam liela nozīme ir miokarda kontrakciju un relaksācijas regulācijā. ANP kopā ar hromogranīnu tiek uzskatīti par galvenajiem homeostāzi uzturošajiem faktoriem miokardā [2]. Šī pētījuma dati atbilst iepriekšējiem pētījumiem, kur pastiprināta hromogranīna ekspresija tiek asociēta ar postišēmisku stāvokli [5]. Mēs pieņemam, ka sirds priekškambaru tilpuma un spiediena homeostāze ir saglabāta visos viņu pētītajos gadījumos.
Visos preparātos tika atrasts daudz un ļoti daudz apoptotisko šūnu. Šāds stāvoklis, iespējams, ir postišēmiskas sekas iedzimtu sirds patoloģiju dēļ un miokarda neizbēgamas traumēšanas rezultāts ķirurģiskās manipulācijas laikā, kas summējoties rada izteiktu apoptozes ainu, apstiprinot išēmijas ietekmi, kuras dēļ rodas kardiomiocītu nāve.
Secinājumi
Izteiktais vaskulāro endoteliālo augšanas faktoru saturošo endoteliocītu skaits iedzimtu sirds patoloģiju gadījumā pamato sirds muskuļa išēmiju, kas korelē ar programmēto šūnu bojāeju.
Izteiktā neiropeptīdus saturošā inervācija vērtējama kā kompensatora reakcija uz kopējā sirds muskuļa veselības pasliktināšanās (išēmijas, apoptozes) fona.
Ātriju nātrijurētiskā peptīda un hromogranīna daudzums miokardā atbilst saglabātai sirds muskuļa kontrakciju un tilpuma homeostāzei sirdī.
Abstract
Right Atrium Tissue Structure and Histochemical Changes in Case of Congenital Heart Disease: Pilot Research
The incidence of children with congenital heart diseases is 8 children per 1000 new-borns. Morphological and histochemical myocardial changes of congenital heart diseases are still being researched. One of the most important pathological events in myocardium is apoptosis which has been associated with ischemia.
Tissues from five children were used, two with cyanotic and three children with acyanotic congenital heart disease, whose surgery was performed between the ages of 16 days to 14 months.
To evaluate different pathological changes in myocardium, such factors as vascular endothelial growth factor (VEGF) and endothelin (ET) were used, which are indicators of vasculogenesis and has been associated with ischemia in case of congenital heart disease. Protein gene product 9.5 (PGP 9.5) was used to evaluate the innervation of myocardium. Atrial natriuretic peptide (ANP) as with chromogranin (CHR) are indicators of homeostasis in the myocardium and the elevation of these factors is associated with ischemia in the heart in children with congenital heart disease. Terminal deoxynucleotidyl transferase dUTP nick end labelling (TUNEL) was used for detection of apoptosis.
Cardiomyocytes demonstrated different sizes, with vacuoles and in one case ingrowth of connective tissue fibres among the myocardial tissue was detected. Almost all cases showed VEGF in numerous cells, but ET was seen in few endotheliocytes or was not detected at all. In all cases, abundant number of PGP 9.5-containing fibres was observed. ANP varied from few to numerous numbers of immunoreactive cardiomyocytes, while CHR was detected in numerous cells in all cases. TUNEL showed a large quantity of apoptotic cells with an average value of 186 ± 44.4.
Large number of VEGF containing endotheliocytes in case of congenital heart disease correlates with apoptosis.
Highly expressed neuropeptides containing innervation were evaluated as reaction of myocardium homeostasis impairment (ischemia and apoptosis).
The number of ANP and CHR positive cells gave evidence about partially disturbed but still compensated homeostasis of myocardium in children with congenital heart diseases.
Literatūra
- Zīdere V., Lubaua I., Lācis A. Prenatāla ehokardiogrāfiska diagnostika un rezultāti Latvijā. Kopsavilkums promocijas darba aizstāvēšanai, 2004; 1.–35. lpp.
- Angelone T., Mazza R., Cerra M. Chromogranin-A: A Multifaceted Cardiovascular Role in Health and Disease. Current Medicinal Chemistry, 2012; 19 (24): 4042–4050.
- Böhm F., Pernow J. The importance of endothelin-1 for vascular dysfunction in cardiovascular disease. Cardiovascular Research, 2007; 76: 8–18.
- Campbell L. K., Thomas J. R., Lamps L. W., et al. Protein gene product 9.5 (PGP 9.5) is not a specific marker of neural and nerve sheath tumors: an immunohistochemical study of 95 mesenchymal neoplasms. Modern Pathology, 2003; 16 (10): 963–969.
- Ceconi C., Ferrari R., Bachetti T., et al. Chromogranin A in heart failure. A novel neurohumoral factor and a predictor for mortality. European Heart Journal, 2002; 23 (12): 967–974.
- Chow L., Chow S., Anderson R., Gosling J. Innervation of the human cardiac conduction system at birth. British Heart Journal, 1993; 69 (5): 430–435.
- Dae M. W. Imaging of myocardial sympathetic innervation with metaiodobenzylguanidine. Journal of Nuclear Cardiology, 1994; 1 (2): 23–30.
- Dietz J. Mechanisms of atrial natriuretic peptide secretion from the atrium. Cardiovascular Research, 2005; 68: 8–17.
- Dolk H., Loane M., Garne E. Congenital Heart Defects in Europe: Prevalence and Perenatal Mortality. Circulation, 2011; 123: 841–849.
- Dor Y., Camenisch T. D., Itin A., et al. Novel role for VEGF in endocardial cushion formation and its potential contribution to congenital heart defect. Development, 2001; 128: 1531–1538.
- Doran J. F., Jackson P., Kynoch P. A., Thompson R. J. Isolation of PGP 9.5, a new human neurone-specific protein detected by high-resolution two-dimensional electrophoresis. Journal of Neurochemistry, 1983; 40 (6): 1542–1547.
- Drobysheva A., Ahmad M., White R., et al. Cardiac sypathetics innervation and PGP 9.5 expression by cardiomyocytes after myocardial infarction. Heart and Circulatory Physiology, 2013; 305 (12): 1817–1829.
- Duffy A., Bouchier-Hayes D., Harmey J. Vascular Endothelial Growth Factor (VEGF) and its Role in Non-Endothelial Cells: Autocrine Signalling by VEGF. http://www.ncbi.nlm.nih.gov/books/NBK6434/?report=reader (sk.12.02.2015).
- He B., Xiao J., Ren A., et al. Role of miR-1 and miR-133a in myocardial ischemic postconditioning. Journal of Biomedical Science, 2011; 18 (1): 22.
- Hou Q., Hsu Y. Bax translocates from cytosol to mitochondria in cardiac cells during apoptosis: development of a GFPBax- stable H9c2 cell line for apoptosis analysis. American Journal of Physiology – Heart and Circulatory Physiology, 2005; 289: 477–487.
- Josephs T. M., Liptak M. D., Hughes G., et al. Conformational change and human cytochrome c function: mutation of residue 41 modulates caspase activation and destabilizes Met-80 coordination. Journal of Biological Inorganic Chemistry, 2013; 18 (3): 289–297.
- Kajsutra J., Mansukhani M., Cheng M., et al. Programmed Cell Death and Expression of the Protooncogene bcl-2 in Myocytes during Postnatal Maturation of the Heart. Experimental Cell Research, 1995; 219: 110–121.
- Khoynezhad A., Jalali Z., Tortolani A. Apoptosis: Pathophysiology and Therapeutic Implications for the Cardiac Surgeon. The Annals of Thoracic Surgery, 2004; 78: 1109–1118.
- Larysz-Brysz M., Lewin-Kowalik J., Czuba Z., et al. Interleukin-1β Increases Release of Endothelin-1 and Tumor Necrosis Factor as Well as Reactive Oxygen Species by Peripheral Leukocytes During Experimental Subarachnoid Hemorrhage. Current Neurovascular Research, 2012; 9 (3): 159–166.
- Leineweber K., Heusch G., Schulz R. Regulation and Role of the Presynaptic and Myocardial Na+/H+ Exchanger NHE1: Effects on the Sympathetic Nervous System in Heart Failure. Cardiovascular Drug Reviews, 2007; 25 (2): 123–131.
- Linde D., Konings E., Slager M., et al. Birth Prevalence of Congenital Heart Disease Worldwide. Journal of the American College of Cardiology, 2011; 58: 2241–2247.
- Long A. B., Kaiser W. J., Mocarski E. S., Caspary T. Apaf1 apoptotic function critically limits Sonic hedgehog signaling during craniofacial development. Cell Death and Differentiation, 2012; 20: 1510–1520.
- Luscher T., Barton M. Endothelins and Endothelin Receptor Antagonists. Circulation, 2000; 102: 2434–2440.
- Negoescu A., Lorimier P., Labat-Moleur F., et al. In situ apoptotic cell labeling by the TUNEL method: improvement and evaluation on cell preparations. Journal of Histochemistry and Citochemistry, 1996; 44 (9): 959–968.
- Neufeld G., Cohen T., Gengrinovitch S., Poltarok Z. Vascular endothelial growth factor (VEGF) and its receptors. Federation of American Societies for Experimental Biology Journal, 1999; 13: 19–22.
- Nishikimi T., Maeda N., Matsuoka H. The role of natriuretic peptides in cardioprotection. Cardiovascular Research, 2006; 69: 318–328.
- Rao P. S. Congenital Heart Defects – A Review. Congenital Heart desease – Selected Aspects, 2012. Pp. 300–364.
- Rao P. S., Diagnosis and Management of Cyanotic Congenital Heart Disease: Part I. Indian Journal of Pediatrics, 2009; 76 (1): 57–70.
- Ruetten H., Badorff C., Ihling C., et al. Inhibition of Caspase-3 Improves Contractile Recovery of Stunned Myocardium, Independent of Apoptosis – Inhibitory Effects. Journal of the American College of Cardiology, 2001; 38: 0735–1097.
- Takkenberg J., Roos-Hesselink J., Rao S. Congenital Heart Defects – A Review. Congenital Heart Disease – Selected Aspects, 2012; 10; 5772–27002.
- Tsujimoto Y. Role of Bcl-2 family proteins in apoptosis: apoptosomes or mitochondria. Genes to Cells, 1998; 3 (11): 697–707.
- Vijlbrief D. C., Benders M. J., Kemperman H. Use of cardiac biomarkers in neonatology. Pediatric Research, 2012; 72: 337–343.