Jaunas metodes izveide un aprobācija ar asinsreces traucējumiem saistītu reprodukcijai nozīmīgu ģenētisko variāciju noteikšanai
Jaunas metodes izveide un aprobācija ar asinsreces traucējumiem saistītu reprodukcijai nozīmīgu ģenētisko variāciju noteikšanai
Kopsavilkums
Ievads. Iedzimta trombofilija ir riska faktors dažādām ar reprodukciju saistītām slimībām, arī neauglību un priekšlaicīgu grūtniecības pārtraukšanos. Kā biežākās ģenētiskās variācijas, kas ietekmē trombofiliju, literatūrā tiek minētas R506Q (F5 gēnā), G20210A (F2 gēnā), C677R (MTHFR gēnā), G786A (SERPINC1 gēnā) un A1730G (ESR2 gēnā).
Darba mērķis. Izstrādāt jaunu daudzpakāpju polimerāzes ķēdes reakciju, kas ļautu vienlaikus noteikt C677T, G20210A, R506Q, G786A un A1730G ģenētiskās variācijas, un piemērot to noteikšanu, izmantojot fluorescentu fragmentu garuma analīzi, lietojot kapilāra elektroforēzes iekārtu. Izstrādāto metodi aprobēt, nosakot šo ģenētisko variāciju retākās alēles biežumu jeb minorās alēles frekvenci (MAF) Latvijas vispārējā populācijā.
Rezultāti. Izstrādāta piecpakāpju ARMS-PCR reakcija, ar kuru, izmantojot fluorescentu fragmentu garuma analīzi, ir iespējams vienlaikus noteikt piecas ģenētiskās variācijas, kas ir saistītas ar iedzimtu trombofiliju. Vispārējā Latvijas populācijā noteikts šo ģenētisko variāciju retākās alēles biežums: C677T – 0,243, G20210A – 0,013, R506Q – 0,004, G786A – 0,087, A1730G – 0,379.
Secinājumi. Izstrādāta jauna metode, kas ļauj noteikt ar asinsreces traucējumiem saistītas reprodukcijai nozīmīgas ģenētiskās variācijas.
Ievads
Ļoti daudzas ģenētiskās variācijas ir iesaistītas vairāk nekā tikai vienas slimības attīstībā, tāpēc ir ļoti svarīgi atklāt to saistību ar dažādām fenotipiskām pazīmēm, tādējādi, iespējams, uzlabojot konkrētu slimību ārstēšanas vai profilakses izvēles veidu. Atklājot saistību ar dažādām slimībām, fenotipiskām pazīmēm, rodas nepieciešamība pēc jaunu ģenētisko testu izveides, kas ļauj noteikt vienlaikus vairākas ģenētiskās variācijas, kas var ietekmēt vienu fenotipu. Asinsrecē jeb koagulācijā ir iesaistīti daudzi faktori, un izmaiņas to aktivitātē vai daudzumā var izraisīt pastiprinātu asinsreci un trombozi. Trombozi var ietekmēt daudzi gan ārējās vides, gan arī ģenētiskie faktori.
Koagulācijas faktorus kodē daudzi gēni, kuros ir atklātas dažādas ģenētiskās variācijas, kas ietekmē fenotipus, tomēr dažādās metaanalīzēs un klīniskajās vadlīnijās ir iekļautas tikai trīs no tām – MTHRF gēna C677T ģenētiskā variācija, F5 jeb Leidena faktora kodējošā gēna R506Q un F2 jeb protrombīna kodējošā gēna G20210A ģenētiskā variācija (LFB vadlīnijas, 2012; Segal et al., 2009). Aptuveni 40 % trombofilijas gadījumu ir iedzimti, t. i., pārmantoti (Hiller et al., 1998). Tiek uzskatīts, ka iedzimta trombofilija ir riska faktors dažādām ar reprodukciju saistītām slimībām, tostarp neauglību (Grandone et al., 2001) un priekšlaicīgu atkārtotu grūtniecības pārtraukšanos (recurrent pregnancy loss) (Davenport et al., 2014; Kutteh et al., 2006).
Ģenētiskā variācija R506Q, kas atrodas F5 jeb Leidena faktora kodējošā gēnā, iedzimst pēc autosomāli dominanta iedzimšanas tipa, un Eiropas izcelsmes indivīdiem šīs ģenētiskās variācijas biežums ir 2–5 % (pēc šīs ģenētiskās variācijas homozigotiski indivīdi ir 1 : 1000) (Rees et al., 1995). Heterozigotiem indivīdiem ir septiņas reizes paaugstināts risks attīstīties venozām trombozēm, savukārt indivīdiem, kuri ir homozigotiski pēc šīs ģenētiskās variācijas, – 50–100 reižu. 20–50 % venozo trombožu slimnieku tiek atklāta šī ģenētiskā variācija. Sievietēm ar R506Q ģenētisko variāciju heterozigotiskā formā vai ar iegūtu aktivētā proteīna C rezistenci ir divas reizes paaugstināts grūtniecības priekšlaicīgas pārtraukšanās risks, kā arī pieaug risks piedzimt nedzīvi dzimušam bērnam.
MTHFR gēnā tiek aprakstīta galvenokārt C677T ģenētiskā variācija. C677T ģenētiskā variācija sastopama 10–20 % Eiropiešu izcelsmes indivīdu. Pēc literatūras datiem šī ģenētiskā variācija homozigotiskā formā saistās ar ievērojami paaugstinātu homocisteīna līmeni, savukārt paaugstināts homocisteīns ir saistīts ar sarežģījumiem grūtniecības laikā – nervu caurulītes defektiem, placentas infarktiem, intrauterīnas augšanas aizturi, placentas atslāņošanos (Varga et al., 2005).
F2 gēnā, kas kodē faktoru II / protrombīnu, netranslējamā reģionā ģenētiskā variācija G20210A stabilizē mRNS, kas ir saistīta ar augstāku protrombīna koncentrāciju, un līdz ar to tiek pastiprināta trombīna veidošanās, tādējādi paaugstinot risku veidoties venozai vai arteriālai trombozei (Kyrle et al., 1998). G20210A heterozigotiskā formā atrodama 1–6 % Eiropas izcelsmes indivīdu (Tosetto et al., 1999)). Sešiem līdz astoņpadsmit procentiem pacientu, kam ir dziļā vēnu tromboze, tiek atklāta šī ģenētiskā variācija.
Literatūrā rodama informācija arī par citām ģenētiskajām variācijām saistībā ar asinsreces traucējumiem, piemēram, SERPINC1 un ESR2 gēnos. SERPINC1 gēns kodē antitrombīnu, kas ir iesaistīts asinsreces procesā, nomācot visus koagulācijas faktorus. Līdzsvars starp antitrombīnu un koagulācijas faktoriem nodrošina asinsreces procesu. Ģenētiskā variācija G786A ir saistīta ar pazeminātu antitrombīna līmeni, kas savukārt ir riska faktors venozai trombozei, kā arī var būt saistīts ar priekšlaicīgu grūtniecības pārtraukšanos (Cao et al., 2013). ESR2 gēns kodē estrogēna receptora 2 beta subvienību, kas nodrošina estrogēna iedarbību uz organismu. Ir atklāts, ka estrogēna koncentrācijas izmaiņas ietekmē arī koagulāciju, it īpaši periodos, kad mainās tā līmenis organismā, piemēram, grūtniecības laikā vai lietojot hormonālo orālo kontracepciju. Ģenētiskā variācija A1730G, kas atrodas ESR2 gēnā, tiek saistīta ar paaugstinātu trombožu risku sievietēm (Boudjenah et al., 2012), kā arī ietekmē grūtniecības iznākumu, veicot in vitro apaugļošanu (Alessio et al., 2007; Boudjenah et al., 2012).
Darba mērķis
Izstrādāt jaunu daudzpakāpju polimerāzes ķēdes reakciju (PĶR), kas ļautu vienlaikus noteikt C677T, G20210A, R506Q, G786A un A1730G ģenētiskās variācijas attiecīgi gēnos MTHFR, F2, F5, SERPINC1 un ESR2, un piemērot to noteikšanu, izmantojot fluorescentu fragmentu garuma analīzi, lietojot kapilāra elektroforēzes iekārtu. Izstrādāto metodi aprobēt, nosakot šo ģenētisko variāciju retākās alēles biežumu jeb minorās alēles frekvenci (MAF) Latvijas vispārējā populācijā.
Materiāls un metodes
Metodes izvēle
Lai izstrādātu metodi, kas būtu lietojama ar asinsreces traucējumiem saistītu reprodukcijai nozīmīgu ģenētisko variāciju vienlaicīgai noteikšanai, tika analizēti literatūras dati par metodēm, kura būtu vispiemērotākā un lietojama, izmantojot standarta molekulārās bioloģijas laboratorijas iekārtas.
Kā vispiemērotākā tika izvēlēta amplifikācijas refraktorā mutāciju sistēmas polimerāzes ķēdes reakcija (amplification refractory mutation system polymerase chain reaction (ARMS-PCR)), kuras pamatā ir divi ārējie sintētiskie oligonukleotīdi fragmenta sintēzei, kurā ir analizējamā ģenētiskā variācija, un divi iekšējie sintētiskie oligonukleotīdi, kuri ir alēļu specifiski, papildus izmainot trešo nukleotīdu sintētiskā oligonukleotīda 3’ galā, tādējādi nodrošinot iekšējo sintētisko oligonukleotīdu specifisku piesaisti (Newton et al., 1989).
Ģenētisko marķieru atlase
Daudzpakāpju polimerāzes ķēdes reakcijas izveidei tika atlasītas piecas ģenētiskās variācijas, kas pēc literatūras datiem ir saistītas ar asinsreces traucējumiem un ir iesaistītas reprodukcijā – 1 ģenētiskā variācija MTHFR gēnā, 1 – F2 gēnā, 1 – F5 gēnā, 1 – SERPINC1 gēnā un 1 – ESR2 gēnā (Alessio et al., 2007; Cao et al., 2013; Kutteh et al., 2006).
Sintētisko oligonukleotīdu secību izveide
Lai veiktu sintētisko oligonukleotīdu sintēzi, kas piemēroti ARMS-PCR, literatūrā visbiežāk tiek aprakstītas divas brīvpieejas programmas – Primer1 (http://cedar.genetics.soton.ac.uk/public_ html/primer1.html) (Ye et al., 2001) un Batch Primer 3 (You et al., 2008) (http://probes.pw.usda.gov/ batchprimer3/). Veidojot sintētisko oligonukleotīdu secības, kā viens no vadmotīviem bija 5–20 bp atšķirība starp veidotajiem alēļu specifiskajiem divpavedienu DNS PĶR produktiem. Sākotnēji tika pārbaudīta arī iespēja izmantot universālos sintētiskos oligonukleotīdus – atrastajiem sintētiskajiem oligonukleotīdiem 5’ galā pievienojot universālu nukleotīdu secību, jo pēc informācijas literatūrā šāda sintētisko oligonukleotīdu modifikācija ļauj metodi optimizēt (Shuber et al., 1995). Atrastās sintētisko oligonukleotīdu secības tika pārbaudītas ar Autodimer (http://pubapps.nist.gov:8444/dnaAnalysis/) brīvpieejas programmu (Vallone et al., 2004), tāpēc tika atlasītas tikai tādas sintētisko oligonukleotīdu secības, kuras veidoja vismazāk savstarpēji komplementārās secības, kas varētu ietekmēt PĶR specifiskumu un norisi.
PĶR optimizācija
Izmantojot temperatūras gradienta PĶR, sintētiskie oligonukleotīdi vispirms tika pārbaudīti 12 dažādās praimeru piesaistes (angļu val. – annealing) temperatūrās (no 50 līdz 72° C). Sākotnēji tika pārbaudīti atsevišķi gan praimeri ar universālajām iezīmēm, gan bez tām, bet, pamatojoties uz to, ka praimeri ar iezīmēm veidoja nespecifiskus produktus 100 bp garumā, to turpmāka optimizācija netika veikta. Pēc tam sintētiskie oligonukleotīdi tika pārbaudīti šādās kombinācijās: atsevišķi tikai ārējie sintētiskie oligonukleotīdi, alēļu specifiskie jeb “iekšējie” sintētiskie oligonukleotīdi ar atbilstošo ārējo sintētisko oligonukleotīdu un visi četri sintētiskie oligonukleotīdi kopā. Tika pārbaudīts, vai produkti sintezējas alēļu specifiski, izmantojot dažādus DNS paraugus ar zināmu genotipu.
Sintētisko oligonukleotīdu fluorescentā iezīmēšana
Lai varētu atšķirt ģenētisko variāciju alēles, papildu fragmentu garumu atšķirībai to specifiskās sintētisko oligonukleotīdu secības 5’ galā tika iezīmētas ar fluorescentajām krāsām, tādējādi identificējot, kura ir mutantā alēle un kura ir normas alēle. Ar 6-FAM fluorescento krāsu tika iezīmētas tās sintētisko oligonukleotīdu secības, kas atbilst alēļu normas variantam, bet ar Yakima Yellow fluorescento krāsu – tās sintētisko oligonukleotīdu secības, kas atbilst mutantai alēlei, izņemot SERPINC1 gēna ģenētiskās variācijas mutanto alēli, kas tika iezīmēta ar Tamra fluorescento krāsu.
Izstrādātās metodes aprobācija
Izstrādātās metodes aprobācijai tika izmantoti 100 DNS paraugi no vispārējās Latvijas populācijas, kuriem tika veikta piecpakāpju PĶR reakcija. Visi indivīdi, kuru DNS paraugi tika izmantoti, ir parakstījuši informētu piekrišanas formu. Pēc nejaušības principa no RSU Molekulārās ģenētikas zinātniskās laboratorijas datubāzes tika atlasīti indivīdi, kuriem nebija atzīmētas kādas hroniskas slimības un informētās piekrišanas formā nebija atzīmēti ierobežojumi molekulārajiem izmeklējumiem.
DNS tika izolēta no perifērajām asinīm, kas apstrādātas ar EDTA konservantu, izmantojot standarta hlorofoma-fenola metodi (Sambrook et al., 2006). Izolētie DNS paraugi tika šķīdināti sterilā ūdenī. Pirms PĶR veikšanas izolētie DNS paraugi tika atšķaidīti 50 ng/μl darba koncentrācijā (tīrība – A260/280, attiecība – 1,8–1,9). Citas DNS koncentrācijas, tīrības pakāpes un atšķaidījumi netika pārbaudīti. Paraugi tika analizēti, izmantojot kapilāra elektroforēzes iekārtu ABI Prism 310 (Applied Biosystems, ASV), polimēru POP6 (Thermo Scientific, ASV) un garuma standartu LIZ500 (Thermo Scientific, ASV). Alēļu garumi tika analizēti, izmantojot Gene Mapper programmatūru (Applied Biosystems, ASV).
Pētījums tika veikts ar Latvijas Centrālās medicīnas ētikas komitejas izsniegtu atļauju.
Izstrādātās metodes validācija
Lai pārbaudītu noteikto genotipu pareizību, nejauši atlasītiem 10 paraugiem ar citu metodi tika pārbaudīti atsevišķi visu ģenētisko variāciju genotipi. Ģenētiskās variācijas G20210A (F2 gēnā) un R506Q (F5 gēnā) tika noteiktas ar restrikcijas fragmentu garuma polimorfisma analīzi, izmantojot MnlI restrikcijas endonukleāzi (Thermo Scientific, ASV) pēc Koksal un kolēģu aprakstīta protokola (Koksal et al., 2007), ģenētiskā variācija C677T (MTHFR gēnā) tika noteikta ar restrikcijas fragmentu garuma polimorfisma analīzi, izmantojot HinfI restrikcijas endonukleāzi (Thermo Scientific, ASV) pēc Safarinejad un kolēģu aprakstīta protokola (Safarinejad et al., 2011).
Fragmenti, kas saturēja G786A (SERPINC1 gēnā) un A1730G (ESR2 gēnā) ģenētiskās variācijas, tika sekvenēti, izmantojot BigDye Terminator Kit v.3.1. (Thermo Scientific, ASV) un sagatavojot paraugus sekvenēšanai pēc ražotāja rekomendētā protokola.
Rezultāti
Lai sasniegtu izvirzīto mērķi, kā vispiemērotākā metode atlasīto ģenētisko variāciju vienlaicīgai noteikšanai tika izvēlēta ARMS-PCR.
Tika atlasītas piecas ģenētiskās variācijas (C677T, G20210A, R506Q, G786A un A1730G attiecīgi gēnos MTHFR, F2, F5, SERPINC1 un ESR2)), kas ir saistītas ar asinsreces traucējumiem un kurām ir atklāta nozīmīga saistība ar reprodukciju. Informācija par atlasītajām ģenētiskajām variācijām ir attēlota 1. tabulā.
Tika izveidotas maksimāli specifiskas sintētisko oligonukleotīdu secības atbilstoši aprakstītajiem atlases kritērijiem. Pēc tam tika pārbaudīta sintētisko oligonukleotīdu secību darbība un optimizēti PĶR apstākļi, lai vizualizētu iegūtos PĶR rezultātus 12 % poliakrilamīda gelā (sk. 1. att.).
1. tabula. Daudzpakāpju polimerāzes ķēdes reakcijā iekļauto ģenētisko variāciju raksturojums / Characterisation of genetic variations included in multiplex PCR
| Gēns | rs # (dbSNP) | Tradicionālais nosaukums | Mutāciju nosaukumi pēc HGVS* nomenklatūras | MAF** | |
|---|---|---|---|---|---|
| Nukleotīdu izmaiņa gēnā | Nukleotīda pozīcija kodējošā secībā | ||||
| MTHFR | rs1801133 | C677T | NG_013351.1: g.14783C > T | NM_005957.4: c.665C > T | 0,365 |
| F2 | rs1799963 | G20210A | NG_008953.1: g.25313G > A | NM_000506.3: c.*97G > A | 0,008 |
| F5 | rs6025 | R506Q | NG_011806.1: g.41721G > A | NM_000130.4: c.1601G > A | 0,012 |
| SERPINC1 | rs2227589 | G786A | NG_012462.1: g.5301G > A | NM_000488.3: c.41 + 141G > A | 0,095 |
| ESR2 | rs4986938 | A1730G | NG_011535.1: g.110453G > A | NM_001040275.1: c.1406 + 1872G > A | 0,377 |
* HGVS – Cilvēka genoma variāciju asociācija (Human Genome Variation Society)
** Retākās alēles biežums (MAF – minor allele frequency) Eiropas izcelsmes indivīdiem pēc 1000 genoma
projekta datiem (http://browser.1000genomes.org/)
1. attēls. Piecpakāpju ARMS-PCR rezultātu vizualizācija 12% poliakrilamīda gelā (PAGE) / Visualisation of pentaplex ARMS-PCR results in 12% polyacrylamide gel electrophoresis (PAGE)
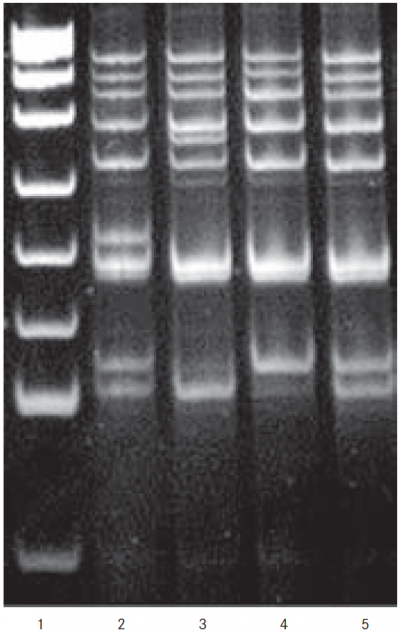
Paraugi:
1 – DNS fragmentu garuma marķieris pUC19 DNA/Msp (HpaII) (Thermo Scientific, ASV) ar fragmentu joslām, kas atbilst 501/489, 404, 331, 242, 190, 147, 111/110, 67 bp garumam,
2 – indivīds ar R506Q (F5 gēns), C677T (MTHFR gēns) un A1730G (ESR2 gēns) ģenētiskajām variācijām (fragmentu joslas attiecīgi 112, 123, 168, 181, 210, 265, 298, 365, 394, 491 bp garas (ārējo praimeru produktu 765, 700 bp garumi nav redzami 12 % PAGE)) heterozigotā formā,
3 – indivīds ar G20210A (F2 gēns), C677T (MTHFR gēns) ģenētiskajām variācijām (fragmentu joslas attiecīgi 112, 168, 181, 265, 279, 298, 365, 394, 491 bp garas (ārējo praimeru produktu 765, 700 bp garumi nav redzami 12% PAGE)) heterozigotā formā,
4 – indivīds ar G786A (SERPINC1 gēns) ģenētisko variāciju heterozigotā formā un A1730G (ESR2 gēns) ģenētisko variāciju (fragmentu joslas attiecīgi 123, 168, 181, 265, 279, 298, 365, 394, 491 bp garas (ārējo praimeru produktu 765, 700 bp garumi nav redzami 12 % PAGE)) homozigotā formā,
5 – indivīds ar A1730G (ESR2 gēns) ģenētisko variāciju (fragmentu joslas attiecīgi 112, 123, 168, 181, 265, 279, 298, 365, 394, 491 bp garas (ārējo praimeru produktu 765, 700 bp garumi nav redzami 12 % PAGE)) heterozigotā formā
Samples:
1 – DNA ladder pUC19 DNA/Msp (HpaII) (Thermo Scientific, USA) with fragments that represents fragments of following sizes 501/489, 404, 331, 242, 190, 147, 111/110, 67 bp,
2 – individual with R506Q (F5 gene), C677T (MTHFR gene) and A1730G (ESR2 gene) variations in heterozygous state (bands in the gel are 112, 123, 168, 181, 210, 265, 298, 365, 394, 491 bp long (outer primer formed products of size 765, 700 bp are not visible in the 12 % PAGE)),
3 – individual with G20210A (F2 gene) and C677T (MTHFR gene) variations in heterozygous state (bands in the gel are 112, 168, 181, 265, 279, 298, 365, 394, 491 bp long (outer primer formed products of size 765, 700 bp are not visible in the 12 % PAGE)),
4 – individual with G786A SEPINC1 gene) in heterozygous state and A1730 (ESR2 gene) in homozygous state (bands in the gel are 123, 168, 181, 265, 279, 298, 365, 394, 491 bp long (outer primer formed products of size 765, 700 bp are not visible in the 12 % PAGE)),
5 – individual with A1730G (ESR2 gene) in heterozygous state (bands in the gel are 112, 123, 168, 181, 265, 279, 298, 365, 394, 491 bp long (outer primer formed products of size 765, 700 bp are not visible in the 12 % PAGE))
Rezultātā tika izstrādāts konkrēts polimerāzes ķēdes reakcijas komponentu un speciālu ķīmisko vielu sastāvs, piemērots piecpakāpju PĶR veikšanai un rezultāta iegūšanai, izmantojot kapilāra elektroforēzes iekārtu. 2. attēlā ir sniegts shematisks fragmentu analīzes attēls, pieņemot, ka viens indivīds ir heterozigotisks pēc visām analizētajām ģenētiskajām variācijām. Sintētisko oligonukleotīdu secības un PĶR komponentu sastāvs netiek norādīts, aizsargājot vēl nepublicētus rezultātus ERAF līdzfinansētā projekta “Jaunas metodes izstrāde reprodukcijai nozīmīgu ģenētisko variāciju noteikšanai” darbības gaitā.
Veicot izstrādātās metodes aprobāciju, tika analizēti 100 DNS paraugi un noteikts retākās alēles biežums Latvijas populācijā. Iegūtie rezultāti ir attēloti 2. tabulā. Salīdzinājumam norādīti MAF dati Eiropas izcelsmes indivīdiem.
2. attēls. Shematisks fragmentu analīzes attēls, pieņemot, ka indivīds ir heterozigotisks pēc visām atlasītajām ģenētiskajām variācijām / Schematic figure of fragment analysis for theoretycal individual, who is heterozygous for all selected genetic variations
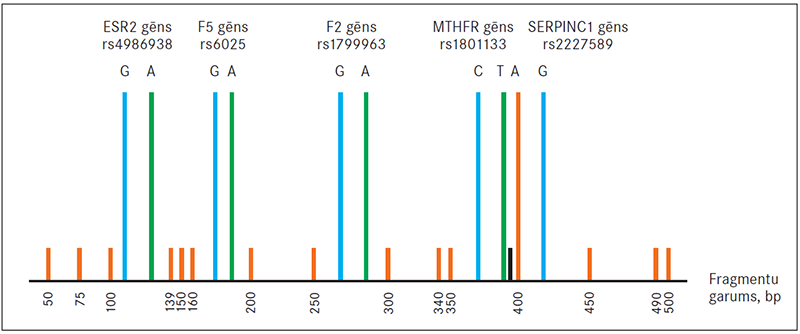
Retākās alēles (saistītas ar izmainītu gēna ekspresiju) ir iezīmētas ar Yakima Yellow fluorescento krāsu (zaļš signāls), izņemot SERPINC1 gēna G786A variācijas retāko alēli, kas ir iekrāsota ar Tamra fluorescento krāsu (melns signāls), biežākās alēles ir iezīmētas ar 6-FAM fluorescento krāsu (zils signāls). Fragmentu analīzei lietots LIZ 500 garuma standarts (oranžs signāls)
Minor alleles (assotiated with changed gene expression) is tagged with Yakima Yellow fluorescent dye (green signal), except minor allele of the G786A variantion in the SERPINC1 gene, that is tagged with Tamra fluorescent dye (black signal), all major alleles are tagged with 6-FAM fluorescent dye (blue signal). For fragment analysis is used LIZ 500 size marker (orange signal)
2. tabula. Izstrādātās metodes aprobācijas rezultāti – noteikts iekļauto ģenētisko variāciju biežums vispārējā Latvijas populācijā / Results of aprobation of the developed method – detected frequencies of selected genetic variation in the general population of Latvia
| Gēns | rs # (dbSNP) | Ģenētiskās variācijas tradicionālais nosaukums | MAF* Eiropas izcelsmes indivīdiem | MAF Latvijas populācijā |
|---|---|---|---|---|
| MTHFR | rs1801133 | C677T | 0,365 | 0,243 |
| F2 | rs1799963 | G20210A | 0,008 | 0,013 |
| F5 | rs6025 | R506Q | 0,012 | 0,004 |
| SERPINC1 | rs2227589 | G786A | 0,095 | 0,087 |
| ESR2 | rs4986938 | A1730G | 0,377 | 0,379 |
* Retākās alēles biežums (MAF – minor allele frequency) Eiropas izcelsmes indivīdiem pēc 1000 genoma
projekta datiem (http://browser.1000genomes.org/)
Izveidotās metodes aprobācijas gaitā tika analizēti 10 nejauši atlasīti DNS paraugi, lai atkārtoti noteiktu genotipu, izmantojot RSU Molekulārās ģenētikas zinātniskās laboratorijas aprīkojumu (testu veica viena un tā pati persona) un iegūstot 100 % rezultātu atkārtojamību (angļu val. – repeatability).
Ar piecpakāpju PĶR un fluorescento fragmentu garuma analīzi iegūtie genotipi 10 nejauši atlasītu DNS paraugiem tika apstiprināti, izmantojot papildu izvēlētās metodes atbilstoši ģenētiskajai variācijai. Visos gadījumos iegūtie genotipi saskanēja. Ar izstrādāto metodi Molekulārās ģenētikas zinātniskā laboratorija piedalījās arī ārējās kvalitātes kontroles shēmās (organizē Rfb-DGKL referenzinstitut für Bioanalytik – Deutsche Vereinte Gesellschaft für Klinische Chemie und Laboratoriumsmedizin (Rfb-DGKL).
Pēc ārējās kvalitātes kontroles shēmas DNS paraugi tika izdalīti no venozajām asinīm un atšķaidīti līdz 50 ng/μl koncentrācijai (tīrība – A260/280, attiecība – 1,8–1,9). Ar iegūtajiem DNS paraugiem tika veikta piecpakāpju multipleksa PĶR, kā rezultātā F2 un F5 gēnā ģenētiskajām variācijām noteiktie genotipi bija atbilstoši (citu variāciju genotipi netika iesniegti).
Diskusija
Strauji augošās jauno tehnoloģiju attīstības dēļ tirgū tiek piedāvāti daudzi jauni ģenētiskie testi dažādu fenotipisko pazīmju noteikšanai un iespējamā riska dažādu pazīmju attīstības kalkulācijai, tāpēc ir pieaugusi nepieciešamība pēc ekonomiski izdevīgiem diagnostiskiem testiem, ar kuru palīdzību var noteikt vairākas ģenētiskās variācijas vienlaikus, tādējādi iegūstot rezultātu maksimāli īsā laikā. Īpaši būtiski tas ir ierobežota laika gadījumā, kad ir nepieciešams ģenētiskās testēšanas rezultātu iegūt 1–2 dienu laikā.
Ļoti būtisks faktors ģenētisko testu izstrādes procesā ir radīt tādu ģenētisko testu, kas ir maksimāli piemērots konkrētajai populācijai. Tas nozīmē, ka ļoti daudzu ģenētisko pazīmju noteikšanā ir nelietderīgi universāli ģenētiskie testi, jo ir pierādīta ģenētisko variāciju atšķirība starp reģioniem, rasēm un pat starp ģeogrāfiski tuvām populācijām (Bauduer et al., 2005; Lucotte et al., 2001). Turklāt testiem ir jāiekļauj variācijas, kuras visvairāk ietekmē analizējamo fenotipisko pazīmi, tādējādi atvieglojot klīniskās atbildes sniegšanu pacientiem. Tā, piemēram, labas laboratoriskās prakses vadlīnijās ir aprakstīts, ka ir nevēlama pārlieka ģenētisko marķieru iekļaušana komerciāli pieejamos diagnostiskajos testos, jo šādu ģenētisko variāciju identificēšana un rezultāta sniegšana pacientam ir diskutabls ētikas jautājums (Claustres et al., 2014; Krausz et al., 2014).
Latvijas Republikas likumdošana paredz, ka diennakts tumšajā laikā ārpus apdzīvotām vietām, kā arī apdzīvotās vietās gājējiem, kas pārvietojas pa brauktuvi vai tās nomali, jālieto gaismas atstarotājs [3]. Tomēr pētījuma rezultāti rāda, ka Latvijā gandrīz vienmēr atstarotājus lieto mazāk nekā puse respondentu. Literatūrā tiek norādīts uz kājāmgājēju vecuma grupām un to saistību ar satiksmes negadījumiem un to smaguma pakāpi [6, 78]. Šajā pētījumā kājāmgājēju atstarotāju lietošanai tika atrasta saistība ar vecumu – palielinoties vecumam, lielāks respondentu īpatsvars lieto atstarotājus. Novērotās atšķirības norāda uz nepieciešamību turpmāk, veidojot informatīvās sabiedrības informēšanas kampaņas, tās veidot atbilstoši noteiktām iedzīvotāju vecumgrupām.
Sievietēm ar atkārtotu grūtniecības pārtraukšanos, kā arī pirms mākslīgās apaugļošanas procedūras izvēles ir būtiski noteikt ar asinsreces traucējumiem saistītas ģenētiskas variācijas. Tādējādi tiktu identificētas sievietes, kas ir atkārtotu grūtniecības pārtraukšanās riska grupā, un varētu uzlabot mākslīgās (in vitro) apaugļošanas, tostarp ārpusdzemdes apaugļošanas, procedūras iznākumu (Bauduer et al., 2005).
Izveidotais tests ir piemērots DNS paraugiem, kas ir izdalīti no bioloģiskā materiāla ar koncentrāciju 50 ng/μl (tīrība – A260/280, attiecība – 1,8–1,9). Citas tīrības vai atšķaidījuma DNS paraugi netika pārbaudīti.
Metodes izstrādes gaitā desmit paraugiem tika pārbaudītas visas piecas noteiktās ģenētiskās variācijas, lietojot molekulārās ģenētikas metodi (PCR-RFLP vai tiešo sekvenēšanu). Tika konstatēts, ka genotipi 100 % saskan. Desmit paraugu analīze, izmantojot piecpakāpju multipleksa PĶR reakciju, tika atkārtota (veica tas pats personāls tādos pašos apstākļos kā iepriekš), un tika iegūti tādi paši rezultāti.
Divas no iekļautajām ģenētiskajām variācijām (R506Q F5 gēnā un G20210A F2 gēnā) tika pārbaudītas arī pēc ārējās kvalitātes kontroles shēmas – no citas laboratorijas tiek atsūtīti trīs perifēro asiņu paraugi indivīdiem ar nezināmu genotipu un genotipēti ar izveidoto metodi. Iegūtie genotipi tika apstiprināti ar organizētāju izsniegtu kvalitātes sertifikātu.
Secinājumi
Pētījuma laikā ir izstrādāta metode, kas ir lietojama, lai vienlaikus noteiktu ar asinsreces traucējumiem saistītas reprodukcijai nozīmīgas ģenētiskās variācijas. Tādējādi ir radīts jauns ģenētiskais tests, ko Latvijas tirgū ir iespējams piedāvāt kā diagnostisku pakalpojumu, kuru var veikt īsā laikā un ar zemām izmaksām.
Pateicība
Pētījums tapis ERAF līdzfinansētā projekta “Jaunas metodes izstrāde reprodukcijai nozīmīgu ģenētisko variāciju noteikšanai” (2014/0048/2DP/2.1.1.1.0/14/APIA/ VIAA/074) īstenošanas laikā.
Abstract
Development and Approbation of New Method for Detection of Important Genetic Variations that Influence Reproduction by Causing Coagulation Defects
Inherited thrombophilia is one of the risk factors for several complications associated with reproduction, including infertility and recurrent pregnancy loss. As most common genetic variations associated with inherited thrombophilia are described R506Q, G20210A, C677R, G786A and A1730G.
The aim of the study was to develop new multiplex PCR that would allow detecting simultaneously R506Q, G20210A, C677R, G786A and A1730G genetic variations. By modifying synthetic oligonucleotides to adjust it for using with capillary electrophoresis for fluorescent fragment analysis. To approbate the new method on general population of Latvia, detecting minor allele frequency (MAF) for included genetic variations.
There is developed pentaplex ARMS-PCR that allows simultaneously to detect five genetic variants associated with inherited thrombophilia by using fluorescent fragment analysis. Detected minor allele frequency for included genetic variations in the general population of Latvia are: C677T – 0.243, G20210A – 0.013, R506Q – 0.004, G786A – 0.087, A1730G – 0.379.
There has been developed a new method for simultaneous detection of genetic variations associated with coagulation and reproduction disorders.
Literatūra
- LFB vadlīnijas. Dziļo vēnu tromboze diagnostika, profilakse un ārstēšana. http://www.lfb.lv/vadlinijas/DTV.pdf%20galiga.pdf (sk. 1.06.2015.).
- Alessio A. M., Hoehr N. F., Siqueira L. H., et al. Association between estrogen receptor alpha and beta gene polymorphisms and deep vein thrombosis. Thromb Res, 2007; 120 (5): 639–645.
- Bauduer F. and Lacombe D. Factor V Leiden, prothrombin 20210A, methylenetetrahydrofolate reductase 677T, and population genetics. Mol Genet Metab, 2005; 86 (1–2): 91–99.
- Boudjenah R., Molina-Gomes D., Torre A., et al. Genetic polymorphisms influence the ovarian response to rFSH stimulation in patients undergoing in vitro fertilization programs with ICSI. PLoS One, 2012; 7 (6): e38700.
- Cao Y., Zhang Z., Xu J., et al. The association of idiopathic recurrent pregnancy loss with polymorphisms in hemostasis-related genes. Gene, 2013; 530 (2): 248–252.
- Claustres M., Kozich V., Dequeker E., et al. Recommendations for reporting results of diagnostic genetic testing (biochemical, cytogenetic and molecular genetic). Eur J Hum Genet, 2014; 22 (2): 160–170.
- Davenport W. B. and Kutteh W. H. Inherited thrombophilias and adverse pregnancy outcomes: a review of screening patterns and recommendations. Obstet Gynecol Clin North Am, 2014; 41 (1): 133–144.
- Grandone E., Colaizzo D., Lo Bue A., et al. Inherited thrombophilia and in vitro fertilization implantation failure. Fertil Steril, 2001; 76: 201–202.
- Hiller E. and Pihusch R. Thrombophilia caused by congenital disorders of blood coagulation. Fortschr Med, 1998; 116 (29): 26–28, 30, 32 passim.
- Koksal V., Baris I. and Etlik O. Primer-engineered multiplex PCR-RFLP for detection of MTHFR C677T, prothrombin G20210A and factor V Leiden mutations. Exp Mol Pathol, 2007; 83 (1): 1–3.
- Krausz C., Hoefsloot L., Simoni M. and Tuttelmann F. EAA/EMQN best practice guidelines for molecular diagnosis of Y-chromosomal microdeletions: state-of-the-art 2013. Andrology, 2014; 2 (1): 5–19.
- Kutteh W. H. and Triplett D. A. Thrombophilias and recurrent pregnancy loss. Semin Reprod Med, 2006; 24 (1): 54–66.
- Kyrle P. A., Mannhalter C., Beguin S., et al. Clinical studies and thrombin generation in patients homozygous or heterozygous for the G20210A mutation in the prothrombin gene. Arterioscler Thromb Vasc Biol, 1998; 18 (8): 1287–1291.
- Lucotte G. and Mercier G. Population genetics of factor V Leiden in Europe. Blood Cells Mol Dis, 2001; 27 (2): 362–367.
- Newton C. R., Graham A., Heptinstall L. E., et al. Analysis of any point mutation in DNA. The amplification refractory mutation system (ARMS). Nucleic Acids Res, 1989; 17 (7): 2503–2516.
- Rees D. C., Cox M. and Clegg J. B. World distribution of factor V Leiden. Lancet, 1995; 346 (8983): 1133–1134.
- Safarinejad M. R., Shafiei N. and Safarinejad S. Relationship between genetic polymorphisms of methylenetetrahydrofolate reductase (C677T, A1298C, and G1793A) as risk factors for idiopathic male infertility. Reprod Sci, 2011; 18 (3): 304–315.
- Sambrook J., Russell D. W. Purification of nucleic acids by extraction with phenol:chloroform. CSH Protoc, 2006.
- Segal J. B., Brotman D. J., Necochea A. J., et al. Predictive value of factor V Leiden and prothrombin G20210A in adults with venous thromboembolism and in family members of those with a mutation: a systematic review. Jama, 2009; 301 (23): 2472–2485.
- Shuber A. P., Grondin V. J. and Klinger K. W. A simplified procedure for developing multiplex PCRs. Genome Res, 1995; 5 (5): 488–493.
- Tosetto A., Missiaglia E., Frezzato M. and Rodeghiero F. The VITA project: prothrombin G20210A mutation and venous thromboembolism in the general population. Thromb Haemost, 1999; 82 (5): 1395–1398.
- Vallone P. M. and Butler J. M. AutoDimer: a screening tool for primer-dimer and hairpin structures. Biotechniques, 2004; 37 (2): 226–231.
- Varga E. A., Sturm A. C., Misita C. P. and Moll S. Cardiology patient pages. Homocysteine and MTHFR mutations: relation to thrombosis and coronary artery disease. Circulation, 2005; 111 (19): e289–293.
- Ye S., Dhillon S., Ke X., et al. An efficient procedure for genotyping single nucleotide polymorphisms. Nucleic Acids Res, 2001; 29 (17): E88–88.
- You F. M., Huo N., Gu Y. Q., et al. BatchPrimer3: a high throughput web application for PCR and sequencing primer design. BMC Bioinformatics, 2008; 9: 253.



