Osteoartrīta slimnieku sinoviālās membrānas morfoloģiskās analīzes korelācija ar klīniskajiem un laboratoriskajiem rādītājiem
Osteoartrīta slimnieku sinoviālās membrānas morfoloģiskās analīzes korelācija ar klīniskajiem un laboratoriskajiem rādītājiem
Kopsavilkums
Ievads. Osteoartrīts ir biežākā multifaktoriālā locītavu slimība. Viena no būtiskākajām problēmām ir osteoartrīta saistība ar citām balstaparāta slimībām, kas var ietekmēt osteoartrīta klīniskās izpausmes un sinovialās membrānas morfoloģiskās izmaiņas. Aktuāls ir jautājums par osteoartrīta slimnieku grupām, kam varētu izmantot sinoviālo apvalku biopsiju diagnozes precizēšanai un ārstēšanas taktikas izvēlei.
Darba mērķis. Ar morfoloģiskām metodēm analizēt sinoviālajā membrānā notiekošos procesus audu līmenī un salīdzināt tos ar klīniskajiem un laboratoriskajiem rādītājiem.
Materiāls un metodes. Darbā tika analizēti endoprotezēšanas laikā iegūtie 48 pacientu sinoviālās membrānas audi un šo pacientu pirmsoperācijas klīniskie un laboratoriskie rādītāji. Audu paraugu griezumi tika krāsoti ar hematoksilīnu un eozīnu un analizēti gaismas mikroskopā, lai noteiktu sinoviālās membrānas morfoloģiskās pārmaiņas, kas tika gradētas pēc adaptētas Krena un līdzautoru (2006) skalas. Vienlaicīgi tika analizētas izmaiņas pilnā asinsainā, eritrocītu grimšanas ātrumā, C-reaktīvā proteīna (CRP) līmenī, urīna un aknu bioķīmiskajās analīzēs.
Rezultāti. Statistiski ticamas korelācijas tika noteiktas starp daudzkodolaino gigantisko šūnu un sinoviālās membrānas virsējā slāņa šūnu daudzumu, gigantisko šūnu un asinsvadu daudzumu, kā arī korelācija starp gigantisko šūnu daudzumu un sinovīta smaguma pakāpi. Asinsvadu blīvums korelē ar sinovīta izteiktības pakāpi. Pacienti tika iedalīti divās grupās – ar zemu vai vidēji aktīvu sinovītu un izteiktu sinovītu. CRP līmeņa mediānās vērtības abām grupām bija vienādas, savukārt grupā ar izteiktu sinovītu datu izkliede bija lielāka, kā arī tika novērots paaugstināts CRP līmenis.
Secinājumi. Laboratoriskās analīzes un Vizuālās analogu skalas rādītājus nevar izmantot kā vienīgos sinovīta smaguma pakāpes novērtēšanas kritērijus. Daudzkodolaino gigantisko šūnu un asinsvadu daudzuma izvērtējumu stromā var izmantot kā papildu kritēriju, lai noteiktu sinovīta smaguma pakāpi.
Ievads
Osteoartrīts ir biežākā multifaktoriālā, deģeneratīvā locītavu slimība, ko raksturo locītavas skrimšļa destrukcija, subhondrāla kaula skleroze, kā arī osteofītu veidošanās un sinoviālās membrānas izmaiņas [32, 34, 35]. Osteoartrīta klīniskā aina ir līdzīga citu locītavu slimību klīniskajām izpausmēm, tāpēc osteoartrīta diferenciālā diagnostika bieži ir sarežģīta. Nesen veiktajos pētījumos ar radioloģijas metodēm asimptomātiskais osteoartrīts tika apstiprināts 19,6 %, bet simptomātiskais gūžas locītavas osteoartrīts – 4,2 % no ASV pilsētu populācijas [21]. Savukārt Turkevica un līdzautoru kohortas pētījumā ceļa locītavu radioloģiskais un simptomātiskais osteoartrīts tika konstatēts attiecīgi 25,4 un 15,4 % gadījumu [39]. Lai gan slimību veicinoši faktori, tādi kā svars, ēšanas paradumi un vitamīnu trūkums organismā, ir daudz pētīti [28], osteoartrīta patoģenēze joprojām ir neskaidra [27].
Dažreiz osteoartrīta gaita var strauji progresēt, manifestējoties izteiktam sāpju sindromam. Šāda paasinājuma rezultātā ātrāk attīstās locītavu bojājums un skrimšļa destrukcija, pacientam klīniski pastiprinās sāpes, paaugstinās iekaisīgie rādītāji. Šādas klīniskās ainas izmaiņas var būt saistītas gan ar paša osteoartrīta patoģenēzi, gan parādīties citu paralēli notiekošo slimību, piemēram, reaktīvā, psoriātiskā vai reimatoīdā artrīta gadījumos. Nereti šādos gadījumos nepieciešama endoprotezēšanas operācija [1]. Vēl viens no svarīgiem slimības gaitu pastiprinošiem faktoriem var būt vīrusu infekcija, tai skaitā cilvēka parvovīrusa B19 infekcija [20, 6].
Līdz šim veiktajos pētījumos noskaidrots, ka locītavu iekaisīgās slimības var pētīt, analizējot izmaiņas locītavas kapsulas iekšējā apvalkā – sinoviālajā membrānā [14, 22, 24]. Tā sastāv no diviem slāņiem – virsējā jeb intīmas slāņa (angļu val. lining) un sinoviālās membrānas stromas (angļu val. sublining), kas tiek skarti, slimībai attīstoties. Iekaisīgu locītavu slimību gadījumos sinoviālajā membrānā notiek audu pārbūve, šūnu proliferācija un migrācija, tiek sekretēti iekaisuma citokīni un augšanas faktori [23]. Ir zināms, ka reimatoīdā artrīta gadījumā mezenhimālās izcelsmes šūnas sinoviālajā apvalkā vīrusu infekcijas ietekmē var fenotipiski mainīties un iesaistīties agresīvā locītavas skrimšļa destrukcijā [36, 5]. Tomēr pētījumu par sinoviālajā membrānā notiekošajiem procesiem audu un šūnu līmenī ir maz – gan tos vērtējot morfoloģisko metožu jutīguma un specifiskuma aspektā, gan analizējot korelācijas ar klīniskajiem un laboratoriskajiem rādītājiem. Krena un kolēģu (2006) metode tiek izmantota hroniska sinovīta pakāpes noteikšanai [22]. Tomēr līdz šim nav noteikti patomorfoloģiskie kritēriji, ko, izmantojot audu biopsijas, varētu izmantot precīzai diagnozei un pacientu savlaicīgai ārstēšanai.
Darba mērķis
Ar morfoloģiskām metodēm analizēt sinoviālajā membrānā notiekošos procesus audu līmenī, tos korelējot ar pirmsoperācijas periodā iegūtajiem pacienta subjektīvajiem rādītājiem (sāpju vērtējumu pēc Vizuālās analogu skalas), kā arī klīniskajiem un laboratoriskajiem rādītājiem.
Materiāls un metodes
Pētījumā tika iesaistīti 48 pacienti (27 sievietes, 28 vīrieši), kas no 2015. gada februāra līdz 2016. gada maijam bija stacionēti ORTO klīnikā ar diagnozi “gūžas vai ceļa locītavas osteoartrīts” plānveida locītavu endoprotezēšanas veikšanai. Pacientu vidējais vecums – 60,3 gadi (35–87 gadi). Pirms operācijas gan glikokortikoīdi, gan nesteroīdie pretiekaisuma līdzekļi, gan arī fizioterapija tika lietoti 45 pacientiem. Pētījuma gaitā tika apkopoti anamnēzes dati no pacientu medicīniskajām kartēm un Vizuālās analogu skalas (VAS) rādītāji (0–10 punkti), tika analizētas izmaiņas pacientu pilnā asinsainā, eritrocītu grimšanas ātrumā (EGĀ), C reaktīvā proteīna (CRP) līmenī, kā arī urīna un aknu bioķīmiskajos (AlAT; AsAT) rādītājos.
Sinoviālās membrānas audu paraugi tika iegūti gūžas un ceļa locītavu endoprotezēšanas laikā. Materiāls tika fiksēts 10 % formalīnā ar turpmāku apstrādi un ieliešanu parafīna blokos. No parafīna blokos ielietā sinoviālās membrānas audu materiāla ar mikrotomu tika pagatavoti 4–6 mkm biezi histoloģiskie griezumi. Vispārēja pārskata iegūšanai, mikroskopiskai analīzei un diagnozes noteikšanai audu griezumi tika krāsoti ar hematoksilīnu un eozīnu (H & E). Analizējot sinoviālās membrānas morfoloģisko ainu, tika izmantota adaptēta Krena un līdzautoru (2006) izveidotā parametru skala sinovīta pakāpes (angļu val. synovitis score) noteikšanai (sk. 1. tab.). Šajā skalā tika izmantoti šādi parametri: 1) virsējā slāņa izmaiņas, 2) stromas šūnu blīvums, 3) iekaisuma šūnu infiltrācija un 4) sinovīta pakāpe; izmaiņas katrā no šiem rādītājiem raksturojot ar 0–3 punktiem. Pēc primārās audu apskates tika ieviesti divi papildu parametri – daudzkodolaino gigantisko šūnu esamība un asinsvadu daudzums sinoviālajā membrānā. Sinoviālo membrānu audu histopatoloģiskās analīzes rezultāti tika izvērtēti gaišā redzes laukā, izmantojot Leitz DMRB gaismas mikroskopu, fotodokumentācija tika veikta ar digitālo kameru DC 300F. Audu analīzei tika izmantota puskvantitatīvās analīzes metode.
Pēc audu mikroskopiskās analīzes pacienti tika iedalīti divās grupās: pirmā grupa (n = 33) – pacienti ar zemu vai vidēji aktīvu sinovītu un otrā grupa – pacienti (n = 15) ar izteiktām morfoloģiskām izmaiņām sinoviālās membrānas audos, izteiktu sinovītu. Datu apstrāde tika veikta IBM SPSS Statistics programmā, izmantojot neparametriskos testus un Spīrmena (Spearman’s rank) korelācijas koeficientu datu saistības izvērtēšanai. Būtiskuma līmenis (p) ar vērtību, kas mazāka par 0,05, vērtēts kā statistiski ticams.
1. tabula. Sinoviālās membrānas morfoloģisko izmaiņu raksturojums / Morphological evaluation and synovial membrane score
| Parametri | Punkti | Morfoloģiskās izmaiņas |
|---|---|---|
| Virsējā slāņa šūnu daudzums | 0 | Šūnas veido tikai vienu slāni |
| 1 | Šūnas veido 2–3 slāņus | |
| 2 | Šūnas veido 4–5 slāņus, var būt dažas daudzkodolainās šūnas | |
| 3 | > 5 šūnu slāņiem, virsējā slāņa izčūlojums, var būt daudzkodolainās šūnas | |
| Saistaudu šūnu daudzums sinoviālās membrānas stromā | 0 | Šūnu daudzums atbilst normai |
| 1 | Nedaudz palielināts šūnu daudzums | |
| 2 | Vidēji palielināts šūnu daudzums | |
| 3 | Izteikti palielināts šūnu daudzums | |
| Iekaisuma infiltrāti | 0 | Nav iekaisuma infiltrātu |
| 1 | Daži, galvenokārt perivaskulāri izvietoti limfocīti un plazmocīti | |
| 2 | Daudz limfocītu un plazmocītu, dažkārt tie veido limfocītu agregātus – folikulus | |
| 3 | Blīvi difūzi infiltrāti vai vairāki limfoīdie folikuli | |
| Sinovīta pakāpe | 0–1 | Nav sinovīta |
| 2–4 | Neizteikts sinovīts | |
| 5–9 | Izteikts sinovīts | |
| Daudzkodolainās gigantiskās šūnas | 0 | Nav |
| 1 | Atsevišķas daudzkodolainās šūnas | |
| 2 | Daudz daudzkodolaino šūnu | |
| Asinsvadu daudzums | 1 | Asinsvadu daudzums atbilst normai |
| 2 | Daudz, atsevišķi asinsvadi pilnasinīgi | |
| 3 | Izteikti daudz, ir pilnasinīgi asinsvadi, hemorāģijas |
Modificēts pēc V. Krenn et al., 2006.
Rezultāti
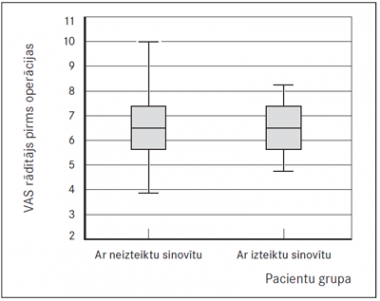
Grupā ar zemu vai vidēji aktīvu sinovītu pirms operācijas VAS skalas rādītāji no 7 punktiem un augstāk (no ļoti stiprām līdz neciešamām sāpēm) bija deviņiem pacientiem (31 % ), no tiem viens pacients novērtēja sāpju līmeni ar gradāciju 10 un viens – ar deviņi. Grupā ar augstu sinovīta aktivitāti VAS skalas rādītāji no 7 punktiem un augstāk bija četriem pacientiem (33,3 %). VAS skalas rādītāju sadalījums bija līdzīgs abām grupām (sk. 1. att.). Grupā ar neiekaisušiem sinoviālajiem audiem urīnceļu infekcija (UCI) bija 12 pacientiem (44 %), savukārt grupā ar izteiktu sinovītu UCI bija pieciem pacientiem (38,5 %). Aknu bioķīmisko rādītāju (AlAT; AsAT) paaugstinājums virs normas kopumā bija 11 pacientiem (40,7 %), savukārt grupā ar izteiktu sinovītu tika reģistrēts tikai viens pacients ar izmainītiem aknu rādītājiem. Vidējais sāpju ilgums grupā bez vai ar neizteiktu sinovītu bija 21 mēnesis. Izteikta sinovīta gadījumā vidējais sāpju ilgums bija 17,7 mēneši.
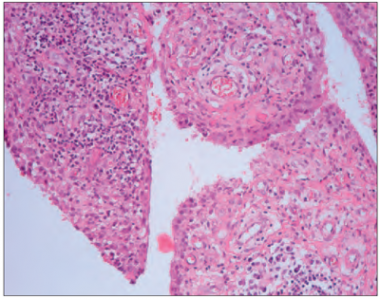
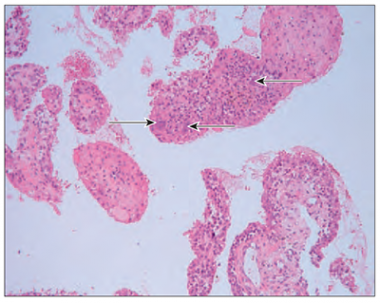
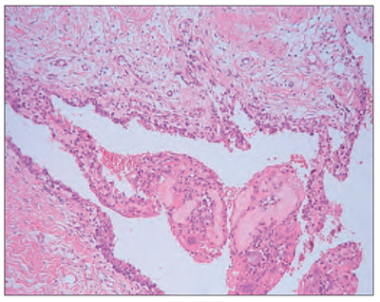
Vidējais vecums un datu sadale abām grupām bija līdzīga. Leikocitoze grupā ar izteiktu sinovītu bija tikai trīs pacientiem (20,0 %), savukārt grupā ar neizteiktu sinovītu – četriem pacientiem (12,9 %). Statistiski ticamas korelācijas starp VAS skalas un laboratoriskajiem rādītājiem netika pierādītas. Grupā ar izmainītu, iekaisušu sinoviālo membrānu tika novērotas šādas morfoloģiskās pārmaiņas: sinoviālās membrānas hipertrofija un hiperplāzija, kā arī virsējā slāņa izčūlojumi (sk. 2. att.), limfocītu infiltrācija un limfoīdo folikulu veidošanās (sk. 3. att). Tika novērotas arī daudzkodolainas gigantiskās šūnas gan sinoviālās membrānas virsējā slānī, gan arī sinoviālās membrānas stromā (sk. 4. att.). Daudzkodolainas gigantiskās šūnas tika novērotas galvenokārt sinoviālajā membrānā ar izteiktu iekaisumu. Dažreiz tika novērota pastiprināta fibrīna izgulsnēšanās (sk. 5. att.).
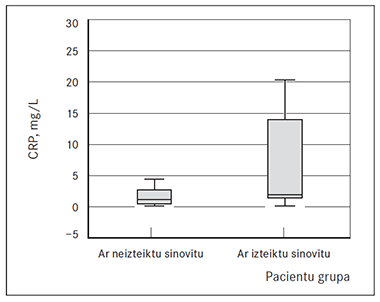
Statistiskās analīzes rezultātā vidēji stipras korelācijas tika noteiktas starp daudzkodolaino gigantisko šūnu daudzumu un sinoviālās membrānas virsējā slāņa izmaiņām (p < 0,002), gigantisko šūnu daudzumu un asinsvadu daudzumu (p < 0,005), kā arī vidēji stipras korelācijas starp gigantisko šūnu daudzumu un sinovīta smaguma pakāpi. Asinsvadu blīvumam novērota vidēji stipra korelācija ar sinovīta izteiktības pakāpi (p < 0,001). CRP līmeņa mediānās vērtības abām grupām bija vienādas, taču grupā ar izteiktu sinovītu datu izkliede bija lielāka, kā arī šajā grupā tika novērots paaugstināts CRP līmenis (sk. 6. att.).
1. attēls. Vizuālās analogu skalas rādītāju sadalījums pacientu grupās / Distribution of Visual Analogue Scale data in patients’ groups | 2. attēls. Sinoviālās membrānas virsējā slāņa hiperplāzija un erozijas. Difūza limfocītu infiltrācija, × 100 / Synovial membrane intimal layer hyperplasia and erosion, diffuse lymphocyte infiltration, × 100 |
|
|
3. attēls. Sinoviālās membrānas hiperplāzija, limfoīdais folikuls, × 100 / Synovial membrane hyperplasia, lymphoid follicle, × 100 | 4. attēls. Daudzkodolainas gigantiskās šūnas (↑), × 100 / Synovial multinucleated giant cells (↑), × 100 |
|
|
5. attēls. Virsējā slāņa hiperplāzija, fibrīna depozīti, hronisks iekaisums, sinoviālās membrānas stromas fibroze, × 100 / Hyperplasia of synovial lining, fibrin deposition, chronic inflammation, sublining fibrosis, × 100 | 6. attēls. CRP analīžu rezultātu sadalījums pacientu grupās / Distribution of CRP data in patients’ groups |
|
|
Diskusija
Līdz šim nav izveidota klasifikācija, kas atspoguļotu visas osteoartrīta variācijas [12, 17, 31]. Tradicionāli ar terminu “osteoartrīts” definē deģeneratīvu jeb neiekaisīgu locītavu slimību. Tomēr jaunāko pētījumu rezultāti liecina, ka gadījumos, kad sinoviālajā membrānā pastiprinās iekaisuma process, osteoartrītam piemīt iekaisīgam artrītam raksturīgas pazīmes ar sinovīta attīstību. Osteoartrīta gadījumā tas izpaužas kā iekaisuma sindroms [3, 7, 16 ]. Šāda osteoartrīta gadījumā pacientam parādās izteiktas sāpes, nakts sāpes un rīta stīvums, kas ilgst vismaz 30 minūtes [16]. Izteiktas sāpes tiek asociētas ar iekaisīgām pārmaiņām, tās bieži konstatē ātri progresējoša destruktīva osteoartrīta gadījumā [11]. Konstatējot iekaisumu, ir jāatceras, ka pacientiem ar diagnosticētu osteoartrītu vai rentgenogrammā redzamām osteoartrītam atbilstošām locītavu izmaiņām iespējama arī citu iekaisīgu locītavu slimību attīstība. Šādos gadījumos slimības diagnostika ir apgrūtināta, īpaši tās sākuma fāzē, kad neizpaužas visi simptomi.
Lai precizētu no jauna radušos sinovītu, izmanto vairākas metodes – laboratoriskās analīzes, radioloģiskās izmeklēšanas metodi un sinoviālā šķidruma analīzi. Tomēr dažreiz, tikai slimībai manifestējoties, var precizēt diagnozi un atšķirt, vai tas ir osteoartrīts paasinājuma fāzē vai arī kāda cita saslimšana, piemēram, vēlīni sācies reimatoīds artrīts, ko grūti diferencēt slimības sākumfāzē [36]. Agrīnā sinovīta diferencēšanas grūtību dēļ pieaug nesteroīdo pretiekaisuma līdzekļu lietošana pacientiem ar sāpēm locītavās, kas rada papildu apdraudējumus pacientu veselībai.
Tā kā sinoviālā membrāna tiek uzskatīta par vairāku iekaisīgu artropātiju galveno mērķorgānu, neskaidru locītavu saslimšanu diagnostikai un ārstēšanai var izmantot sinoviālās membrānas biopsijas [4, 10, 15, 33]. Mūsdienās sinoviālo audu biopsiju novērtēšanu izmanto audzēju diagnostikai, diagnozes precizēšanai granulomu gadījumos, kristālu un infekciozo artropātiju diferencēšanai, kā arī slimības ārstēšanas rezultātu novērtēšanai [19]. Savukārt iekaisīgo artropātiju gadījumā sinoviālo audu biopsiju izmanto retāk, jo šīs grupas slimības morfoloģiski var izpausties dažādi – vienas un tās pašas slimības dažādiem cilvēkiem var izpausties atšķirīgi [2, 9]. Diagnozi ietekmē arī analizējamā audu materiāla morfoloģiskā heterogenitāte, kas var būt novērojama viena preparāta ietvaros [26].
Morfoloģiskās izmaiņas sinoviālajā membrānā, kurā aktīvi notiek iekaisuma procesi, ietver sinoviālās membrānas hipertrofiju un hiperplāziju, virsējā slāņa izčūlojumus, asinsvadu ieaugšanu, to daudzuma un blīvuma palielināšanos, imūno šūnu infiltrāciju, daudzkodolaino gigantisko šūnu parādīšanos un fibrīna izgulsnēšanos [36, 10]. Visas šīs izmaiņas var novērot pacientiem ar sinovītu. Tomēr līdzšinējos pētījumos tika ietvertas morfoloģiskās pazīmes un salīdzinātas slimības, izmantojot tikai vienu vai dažus kritērijus, t. i., asinsvadu daudzumu un endotēlija šūnu proliferācijas indeksu, imūno šūnu izvietojumu un daudzumu, kā arī gigantisko šūnu esamību ar norādi uz izteiktu iekaisumu un šūnu disfunkciju gan reimatoīdā artrīta, gan osteoartrīta gadījumā [8, 22, 29, 40].
Nozīmīgu informāciju sniedz iekaisuma šūnu daudzuma analīze, to izvietojums audos, folikulu veidošanās un imūnkompetento šūnu attiecības. Taka un līdzautoru pētījumā ir parādīts, ka iekaisīgu artrītu, galvenokārt reimatoīda artrīta, gadījumā ir izteiktāka limfocītu un plazmocītu infiltrācija sinoviālās membrānas rajonā [38], turklāt dažādiem indivīdiem tā var atšķirties [19]. Atsevišķi jāanalizē arī asinsvadu izvietojums un blīvums. Pētījumā, ko bija veikusi Rīsa un kolēģi, izmantojot artroskopijas metodi, ir salīdzināti asinsvadi reimatoīdā, reaktīvā un psoriātiskā osteoartrīta gadījumā, demonstrējot asinsvadu atšķirības šo grupu starpā [29]. Tomēr līdz šim vēl nav noteikti morfoloģiskie kritēriji sinoviālās membrānas asinsvadu analīzei.
Ir bijuši vairāki mēģinājumi apvienot iegūtās zināšanas par sinoviālās membrānas morfoloģiskām izmaiņām. Viens no tiem ir Krena un līdzautoru (2006) izveidotā sinovīta smaguma pakāpes novērtēšanas skala (angļu val. synovitis score), kuru izmanto, lai noteiktu locītavas iekaisuma izteiktības pakāpi [22]. Šī analītiskā instrumenta skala palīdz novērtēt, cik izteikts ir sinovīts, tādējādi iespējams precizēt slimības diagnozi un slimības agresivitāti. Diemžēl tas ir maz noderīgs neprecizētas artropātijas diagnosticēšanai. Pēc Krena un kolēģu datiem izteiktāks iekaisums vērojams RA gadījumā, taču ReA un PsA gadījumos arī var novērot izteiktu iekaisumu [22].
Noslēgumā jāatzīmē, ka neskaidru artropātiju diagnosticēšana ir izaicinājums jebkuram ārstam. Lai precīzāk noteiktu un ārstētu slimību, jābūt izveidotai ārstu komandai, kas kopīgi un interdisciplināri, izmantojot vairākas metodes, strādātu pie šī problēmjautājuma risināšanas. Lai arī sinoviālo audu morfoloģiskā analīze nav galvenais kritērijs neskaidru artropātiju noteikšanā, tai ir svarīga nozīme diagnostikā. Turpmākos pētījumos būtu jārisina divas ar to saistītas problēmas, proti, morfoloģisko kritēriju izveide katram artropātijas veidam, kā arī specifisku / nozīmīgu marķieru atklāšana un to pacientu grupas identificēšana, kam noteikti indicēta sinoviālo audu biopsija diagnozes noteikšanai un slimības ārstēšanas uzlabošanai.
Secinājumi
- Laboratoriskās analīzes un Vizuālās analogu skalas rādītājus nevar izmantot kā vienīgos sinovīta smaguma pakāpes noteikšanas rādītājus.
- Papildu kritērijs, kas nosaka sinovīta pakāpi, ir daudzkodolaino gigantisko šūnu un asinsvadu daudzuma analīze stromā.
- Dažos osteoartrīta gadījumos sinoviālās membrānas biopsija ir nozīmīgs solis, kas palīdz precīzi diagnosticēt locītavu slimību un prognozēt tās attīstības gaitu, kā arī pieņemt lēmumu par konservatīvās vai ķirurģiskās terapijas lietošanu.
Pateicība
Darbs veikts ar Valsts pētījumu programmas “Biomedicīna sabiedrības veselībai (BIOMEDICINE)” projekta “Inovatīvu infekcijas procesa regulācijas un modulācijas stratēģiju izveide” apakšprojekta Nr. 5.7.2. atbalstu.
Abstract
Histopathological Analysis of Synovial Membrane in Osteoarthritis Patients and Its Correlation with Clinical and Laboratory Indices
Chronic degenerative disease, osteoarthritis, can mask inflammatory arthropathies such as rheumatoid arthritis, reactive and psoriatic arthritis. Detection of such conditions can help to designate patient group, to whom synovial tissue biopsy is recommended for elucidation of histopathological changes. All this can help to establish correct diagnosis and following conservative treatment, perhaps, lower number of endoprosthetical operations.
The aim of the research – by using morphological methods analyse synovial membrane and morphological changes found in osteoarthritis patients correlating these with clinical and laboratory indices.
Forty eight patients’ synovial membrane samples obtained during replacement surgeries were used in this study. Patients’ clinical data and laboratory indices obtained from medical records were analysed. Histological slides were stained routinely with haematoxylin and eosin. Synovial membrane morphological changes were studied as well as the lining layer hypertrophy or hyperplasia and sublining connective tissue morphology.
Moderate correlation was demonstrated between a number of giant multinucleated cells and lining layer cellularity; a number of giant multinucleated cells and a number of blood vessels in synovial stroma. A moderate correlation was found between the number of giant cells and synovitis. There was correlation between blood vessels’ density in synovial stroma and synovial inflammation. CRP levels median values were equal in both groups (with low or moderate active synovitis and intense synovitis), whereas the range was higher, and elevated CRP levels were found in greater numbers in a group with intense synovitis.
Suggestions based on laboratory test or VAS only cannot be conclusive making decisions preoperatively. Multinucleated giant cells, vascular pattern and blood vessel quantity in synovial membrane stroma can be used as additional criteria for determination of severity of synovitis.
Literatūra
- Aslan, B., Serin, M. S., Theis, K. A., et al. Prevalence and correlates of arthritis-attributable work limitation in the US population among persons ages 18–64: 2002 National Health Interview Survey Data. Arthritis Care & Research. 2007, 57(3), 355–363.
- Baarsen, L. G., van, Wijbrandts, C. A., Timmer, T. C., et al. Synovial tissue heterogeneity in rheumatoid arthritis in relation to disease activity and biomarkers in peripheral blood. Arthritis & Rheumatism. 2010, 62(6), 1602–1607.
- Baeten, D., Demetter, P., and Cuvelier, C. Comparative study of the synovial histology in rheumatoid arthritis, spondyloarthropathy, and osteoarthritis: influence of disease duration and activity. Annals of the Rheumatic Diseases. 2000, 59(12), 945–953.
- Baeten, D., Kruithof, E., Rycke, L., de, et al. Infiltration of the synovial membrane with macrophage subsets and polymorphonuclear cells reflects global disease activity in spondyloarthropathy. Arthritis Res Ther. 2005, 7(2), R359–R369.
- Bari, C., de, Dell’Accio, F., Tylzanowski, P., et al. Multipotent mesenchymal stem cells from adult human synovial membrane. Arthritis & Rheumatism. 2001, 44(8), 1928–1942.
- Bendiksen, S., Martinez-Zubiavrra, I., Tümmler, C., et al. Human endogenous retrovirus W activity in cartilage of osteoarthritis patients. BioMed Research International. 2014, 2014, 698609.
- Benito, M. J., Veale, D. J., FitzGerald, O., et al. Synovial tissue inflammation in early and late osteoarthritis. Annals of the Rheumatic Diseases. 2005, 64(9), 1263–1267.
- Braun, J., Kingsley, G., Heijde, D., van der, et al. On the difficulties of establishing a consensus on the definition of and diagnostic investigations for reactive arthritis. Results and discussion of a questionnaire prepared for the 4th International Workshop on Reactive Arthritis. Berlin, Germany, July 3–6, 1999. The Journal of Rheumatology. 2000, 27(9), 2185–2192
- Castañeda, S., Roman-Blas, J. A., Largo, R., et al. Osteoarthritis: a progressive disease with changing phenotypes. Rheumatology. 2014, 53(1), 1–3.
- Ceponis, A., Konttinen, Y. T., Imai, S., et al Synovial lining, endothelial and inflammatory mononuclear cell proliferation in synovial membranes in psoriatic and reactive arthritis: a comparative quantitative morphometric study. Rheumatology. 1998, 37(2), 170–178.
- Chen, Y., Sun, Y., Pan, X., et al. Joint distraction attenuates osteoarthritis by reducing secondary inflammation, cartilage degeneration and subchondral bone aberrant change. Osteoarthritis and Cartilage. 2015, 23(10), 1728–1735.
- Dougados, M. Clinical assessment of osteoarthritis in clinical trials. Current Opinion in Rheumatology. 1995, 7(2), 87–91.
- Fickert, S., Fiedler, J., and Brenner, R. E. Identification, quantification and isolation of mesenchymal progenitor cells from osteoarthritic synovium by fluorescence automated cell sorting. Osteoarthritis and Cartilage. 2003, 11(11), 790–800.
- Filippou, G., Tacchini, D., Adinolfi, A., et al. Histology of the synovial membrane of patients affected by osteoarthritis and calcium pyrophosphate dihydrate crystal deposition disease vs. osteoarthritis alone: a pilot study. Scandinavian Journal of Rheumatology. 2016, 19, 1–2.
- Firestein, G. S. Starving the synovium: angiogenesis and inflammation in rheumatoid arthritis. The Journal of Clinical Investigation. 1999, 103(1), 3–4.
- Goldring, M. B. and Otero, M. Inflammation in osteoarthritis. Current Opinion in Rheumatology. 2011, 23(5), 471–478.
- Hughes, D. Osteoarthritis and inflammatory arthritis. Surgery (Oxford). 2009, 27(2), 75–79.
- Johnson, J. S. and Freemont, A. J. A 10 year retrospective comparison of the diagnostic usefulness of synovial fluid and synovial biopsy examination. J Clin Pathol. 2001, 54, 605–607.
- Kalaci, A., Yanat, A. N., Tezcan, S., et al. Detection of parvovirus B19 in synovial fluids of patients with osteoarthritis. Diagnostic Microbiology and Infectious Disease. 2008, 60(4), 381–385.
- Kim, C., Linsenmeyer, K. D., Vlad, S. C., et al. Prevalence of radiographic and symptomatic hip osteoarthritis in an urban United States community: the Framingham Osteoarthritis Study. Arthritis & Rheumatology. 2014, 66(11), 3013–3017.
- Krenn, V., Morawietz, L., Burmester, G. R., et al. Synovitis score: discrimination between chronic low-grade and highgrade synovitis. Histopathology. 2006, 49(4), 358–364.
- Lange-Brokaar, B. J. E., de, Ioan-Facsinay, A., Yusuf, E., et al. Degree of synovitis on MRI by comprehensive whole knee semi-quantitative scoring method correlates with histologic and macroscopic features of synovial tissue inflammation in knee osteoarthritis. Osteoarthritis and Cartilage. 2014, 22(10), 1606–1613.
- Lange-Brokaar, B. J. E., de, Kloppenburg, M., Andersen, S. N., et al. Characterization of synovial mast cells in knee osteoarthritis: association with clinical parameters. Osteoarthritis and Cartilage. 2016, 24(4), 664–671.
- Lange-Brokaar, B., de, Ioan-Facsinay, A., Osch, G., van, et al. Synovial inflammation, immune cells and their cytokines in osteoarthritis: a review. Osteoarthritis and Cartilage. 2012, 20(12), 1484–1499.
- Lindblad, S. and Hedfors, E. Intraarticular variation in synovitis. Local macroscopic and microscopic signs of inflammatory activity are significantly correlated. Arthritis & Rheumatism. 1985, 28(9), 977–986.
- Loeser, R. F. Osteoarthritis year in review 2015: biology. Osteoarthritis and Cartilage. 2013, 21(10), 1436–1442.
- Menz, H. B., Roddy, E., Marshall, M., et al. Demographic and clinical factors associated with radiographic severity of first metatarsophalangeal joint osteoarthritis: cross-sectional findings from the Clinical Assessment Study of the Foot. Osteoarthritis and Cartilage. 2015. 23(1), 77–82.
- Prieto-Potin, I., Largo, R., Roman-Blas, J. A., et al. Characterization of multinucleated giant cells in synovium and subchondral bone in knee osteoarthritis and rheumatoid arthritis. BMC Musculoskeletal Disorders. 2015, 16, 226.
- Reece, R. J., Canete, J. D., Parsons, W. J., et al. Distinct vascular patterns of early synovitis in psoriatic, reactive, and rheumatoid arthritis. Arthritis & Rheumatism. 1999, 42(7), 1481–1484.
- Roos, E. M. and Arden, N. K. Strategies for the prevention of knee osteoarthritis. Nature Reviews Rheumatology. 2016, 12(2), 92–101.
- Samuels, J., Krasnokutsky, S., and Abramson, S. B. Osteoarthritis: a tale of three tissues. Bull NYU Hosp JT Dis. 2008, 66(3), 244–250.
- Sandoo, A., Zanten, J. J. V., van, Metsios, G. S., et al. Vascular function and morphology in rheumatoid arthritis: a systematic review. Rheumatology. 2011, 50(11), 2125–2139.
- Sellam, J. and Berenbaum, F. The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis. Nature Reviews Rheumatology. 2010, 6(11), 625–635.
- Sellam, J., Herrero-Beaumont, G., and Berenbaum, F. Osteoarthritis: pathogenesis, clinical aspects and diagnosis. EULAR Compendium on Rheumatic Diseases. 2009, 444–463.
- Smith, M. D. The normal synovium. The Open Rheumatology Journal. 2011, 5, 100–106.
- Smith, M. D., Triantafillou, S., Parker, A., et al. Synovial membrane inflammation and cytokine production in patients with early osteoarthritis. The Journal of Rheumatology. 1997, 24(2), 365–371.
- Tak, P. P., Smeets, T. J., Daha, M. R., et al. Analysis of the synovial cell infiltrate in early rheumatoid synovial tissue in relation to local disease activity. Arthritis & Rheumatism. 1997, 40(2), 217–225.
- Turkiewicz, A., de Verdier, M. G., Engström, G., et al. Prevalence of knee pain and knee OA in southern Sweden and the proportion that seeks medical care. Rheumatology. 2015, 54(5), 827–835.
- Vijay, P. M. and Doddikoppad, M. M. Clinicopathological study of inflammatory synovial lesions. Int J Biol Med Res. 2011, 2(4), 882–888.
- Wilkinson, L. S., Pitsillides, A. A., and Edwards, J. C. Giant cells in arthritic synovium. Annals of the Rheumatic Diseases. 1993, 52(3), 182–184.