Iekaisuma procesu regulējošo citokīnu sastopamība intraabdominālu saaugumu audos bērniem līdz gada vecumam
Iekaisuma procesu regulējošo citokīnu sastopamība intraabdominālu saaugumu audos bērniem līdz gada vecumam
Kopsavilkums
Citokīnu regulatorā loma saaugumu veidošanā līdz šim nav skaidra. Šī pētījuma mērķis bija izpētīt interleikīnu 1, 4, 6, 7, 8 un 10 (IL-1, IL-4, IL-6, IL-7, IL-8 un IL-10) relatīvo sadalījumu iedzimtu intraabdominālu saaugumu audos, salīdzinot ar relatīvi normāliem audiem. Pētījuma grupas materiāls tika iegūts no pacientiem, kuriem veikta abdomināla ķirurģiska operācija pilnīgas vai daļējas zarnu necaurejamības dēļ. Savukārt kontrolgrupas audi tika iegūti no pacientiem, kuriem veikta cirkšņa trūces plastika. Imūnhistoķīmiski tika noteikti IL-1, IL-4, IL-6, IL-7, IL-8 un IL-10, relatīvais sadalījums tika novērtēts ar puskvantitatīvo skaitīšanas metodi.
Pētījuma grupas audos tika konstatēts maz līdz mēreni daudz IL-1, IL-4 un IL-8 pozitīvo fibroblastu, pozitīvo iekaisuma šūnu, mezoteliocītu un endoteliocītu. Savukārt kontrolgrupas audos šo struktūru bija statistiski ticami vairāk gan IL-1 (U = 95,5; p = 0,015), gan IL-4 (U = 60,5; p = 0,002), gan arī IL-8 (U = 40,0; p < 0,001) gadījumā. Tika atrastas mēreni daudzas IL-6 pozitīvās iekaisuma šūnas, mezoteliocīti, fibroblasti un endoteliocīti, bet netika konstatēta statistiski ticama atšķirība, salīdzinot ar kontrolgrupu (U = 146,5; p = 0,243). Vidēji daudz līdz daudz pozitīvo struktūru saturēja IL-7 un IL-10, bet arī šo faktoru gadījumā statistiski ticama atšķirība ar kontrolgrupu netika konstatēta (IL-7 gadījumā U = 144,5, p = 0,19; IL-10 gadījumā U = 184,0, p = 0,769).
Salīdzinot ar kontrolgrupas audiem, mazākā IL-1 atrade intraabdominālu saaugumu audos un izteiktā IL-10 atrade norāda uz dominējošu audu lokālo aizsardzības reakciju saaugumu gadījumā. IL-6 un IL-7 nav specifiski faktori saaugumu patoģenēzē, bet, visticamāk, veicina iekaisuma procesa uzturēšanu audos ilgstošā laikposmā. Salīdzinoši mazā IL-4 un IL-8 atrade liecina par izmaiņām humorālajā imunitātē un neitrofilo leikocītu hemotaksē saaugumu gadījumā.
Ievads
Intraabdomināli saaugumi var būt iegūti vai iedzimti. Lielākā daļa saaugumu veidojas pēc ķirurģiskām manipulācijām un ir pieskaitāmi iegūto saaugumu grupai. Iedzimti intraabdomināli saaugumi ir vēdera dobuma embrionālās attīstības traucējumu sekas (Butureanu and Butureanu, 2014).
Iegūti intraabdomināli saaugumi veidojas kā atbildes reakcija uz abdominālas ķirurģiskas operācijas laikā iegūtu audu traumu (Maciver et al., 2011). Saaugumi var veidoties arī iekaisuma vai intraperitoneālas infekcijas rezultātā (Attart and MacLean, 2007). Intraabdominālo audu traumas rezultātā veidojas ar iekaisuma citokīniem un dažādiem šūnu tipiem bagāts eksudāts. Tiek aktivēta koagulācijas kaskāde un veidojas fibrīna tīkls, kas veicina virsmu salipšanu (Maciver et al., 2011).
Iekaisuma citokīni galvenokārt ir atbildīgi par efektīvu aizsargreakciju uzsākšanu pret eksogēnajiem patogēniem. Savukārt pretiekaisuma citokīni mazina iekaisuma procesu (Ng et al., 2003).
Ir pētīta atsevišķu citokīnu potenciālā loma saaugumu veidošanās procesā, taču regulatorā loma līdz šim nav definēta. Šī pētījuma dizains veidots tā, lai izpētītu saistību starp iekaisuma un pretiekaisuma citokīniem iedzimtu intraabdominālu saaugumu gadījumā.
Interleikīns-1 (IL-1) ir galvenais iekaisuma citokīns un patoģenētiskais mediators autoimūnu, iekaisuma, infekcijas un deģeneratīvu slimību gadījumos (Garlanda et al., 2013). IL-1 tieši paātrina šūnu dalīšanos un mieloīdo šūnu diferenciāciju no hemopoētiskām cilmes šūnām (Pietras et al., 2016). Tas pagarina makrofāgu un neitrofilo leikocītu dzīves ilgumu un stimulē to darbību (Garlanda et al., 2013). IL-1α sintezē epiteliālās šūnas (Miller et al., 2007), tas mediē neitrofilo leikocītu virzību uz ievainojuma vietu, inducē tur esošās šūnas sintezēt IL-1β un citus citokīnus (Rifer et al., 2013). IL-1β visvairāk producē aktivētās imūnsistēmas šūnas, piemēram, monocīti un makrofāgi (Miller et al., 2007).
Interleikīns-4 (IL-4) ir aprakstīts kā galvenais citokīns otrā tipa T līdzētājšūnu (Th2) diferenciācijā. Th2 šūnas regulē audu atjaunošanu caur “alternatīvo” makrofāgu aktivācijas ceļu (Paul and Zhu, 2010). “Klasiskā” iekaisuma aktivācija ir atkarīga no aktivētiem Th1 limfocītiem vai dabīgajām galētājšūnām. IL-4 ir arī regulētājfaktors slāpekļa oksīda metabolismā makrofāgos, kas nodrošina makrofāgu citotoksisko aktivāciju (Wang and Joyce, 2010). IL-4 darbojas arī kā tiešs citotoksiskās aktivitātes stimulators caur CD8+ T šūnām (Oliver et al., 2012).
Interleikīns-6 (IL-6) ir multifunkcionāls citokīns, kas regulē T limfocītu aktivāciju un proliferāciju un var inducēt B šūnu diferenciāciju par antivielas producējošām šūnām. Tas regulē arī akūtās fāzes atbildes reakciju un šūnu apoptozi (Wanqiu et al., 2014). Šo proteīnu sintezē gandrīz visas stromas un imūnšūnas, ieskaitot T limfocītus, B limfocītus un makrofāgus. Iekaisuma gadījumā monocīti un makrofāgi ir pirmās šūnas, kas producē IL-6. IL-1 un audzēju nekrozes faktors (TNFα) ir galvenie IL-6 ekspresijas aktivatori (Schmidt-Arras and Rose-John, 2016). Galvenā IL-6 funkcija ir regulēt balansu starp T šūnām – IL-6 sekmē Th1 un Th17 diferenciāciju, bet inhibē regulatoro T šūnu produkciju. Lai arī IL-6 funkcija ir iekaisuma veicināšana, tas ir nepieciešams arī iekaisuma uzsūkšanās procesā (Fernando et al., 2014).
Interleikīnu-7 (IL-7) producē stromas šūnas kaulu smadzenēs, aizkrūtes dziedzerī, limfmezglos un mīkstajos audos, epiteliālās šūnas kuņģī un aknās, endotēlija šūnas, gludie miocīti un keratinocīti (Malabendu et al., 2014). Iekaisuma skartos audos dažādi šūnu tipi, ieskaitot makrofāgus un fibroblastus, sintezē IL-7 (Bikker et al., 2012). IL-7 ir pleiotropisks citokīns, kas nepieciešams B šūnu un T šūnu attīstības regulācijā un T limfocītu homeostāzes nodrošināšanai (Ouyang et al., 2013). IL-7 ir nozīmīga loma B limfocītu priekšteču nobriešanā, proliferācijā un izdzīvošanā (Corfe and Paige, 2012). Tas ir nepieciešams arī T šūnu subtipu izdzīvošanā (Malabendu et al., 2014) un palielina T limfocītu migrāciju uz infekcijas vietu (Shindo et al., 2015). IL-7 nodrošina no T šūnām atkarīgo makrofāgu un fibroblastu aktivāciju, tas ir iesaistīts audu destrukcijas procesos hronisku iekaisuma slimību gadījumos (Bikker et al., 2012).
Interleikīns-8 (IL-8) ir viens no spēcīgākajiem neitrofilo leikocītu hemoatraktantiem akūta iekaisuma gadījumā (Oliveira et al., 2013; Harada et al., 1994). Neitrofilie leikocīti ir zināmi kā pirmās šūnas, kas tiek papildinātas iekaisuma apvidū (Oliveira et al., 2013). IL-8 ir iesaistīts leikocītu hemotaksē, iekaisuma atbildes reakcijās, kā arī ietekmē endoteliocītus, nodrošinot angioģenēzi (Ning et al., 2011). Šo interleikīnu producē fibroblasti, monocīti un makrofāgi, endoteliālās un epiteliālās šūnas iekaisuma vietās (Harada et al., 2014). IL-8 sintezē arī plašs audzēju šūnu spektrs melanomas, prostatas, olnīcu, krūts vai resnās zarnas audzēju gadījumos (Ning et al., 2011).
Interleikīns-10 (IL-10) ir galvenais pretiekaisuma un imūnsupresīvais citokīns (Shimin et al., 2016). Tas nomāc iekaisuma reakcijas un limitē iekaisuma izraisītu audu bojājumu (Ouyang et al., 2011), galvenokārt bloķējot iekaisuma ceļu aktivāciju un inhibējot iekaisuma mediatoru, piemēram, IL-1, IL-6, IL-8, interferona γ (IFN-γ) un TNF-α, sekrēciju (Shimin et al., 2016). IL-10 spēj producēt gandrīz visas imūnsistēmas šūnas, ieskaitot T šūnas, B šūnas, monocītus un makrofāgus, tuklās šūnas, eozinofilos leikocītus, neitrofilos leikocītus un dendrītiskās šūnas (Shimin et al., 2016). Atsevišķi endogēnie imūnsistēmas mediatori var ierosināt IL-10 ietekmētu B šūnu nobriešanu (Mion et al., 2014).
Darba mērķis
Izpētīt interleikīnu 1, 4, 6, 7, 8 un 10 (IL-1, IL-4, IL-6, IL-7, IL-8 un IL-10) relatīvo sadalījumu iedzimtu intraabdominālu saaugumu audos, salīdzinot ar relatīvi normāliem audiem.
Materiāls un metodes
Pētījuma grupas (sk. 1. tab.) materiāls tika iegūts no 50 pacientiem – 23 zēniem un 27 meitenēm vecumā līdz vienam gadam. Pacientiem tika veikta abdomināla ķirurģiska operācija pilnīgas vai daļējas zarnu necaurejamības dēļ. Visbiežāk saaugumi lokalizējās starp tievo zarnu cilpām (21 gadījums), divpadsmitpirkstu zarnas reģionā (10 gadījumi), distālajā līkumainās zarnas daļā (4 gadījumi). Trīspadsmit gadījumos saaugumi izveidoja Leda (Ladd) saiti, bet vēl divos gadījumos saaugumu veidošanā bija iesaistīta vēdera priekšējā siena.
Savukārt kontrolgrupas (sk. 2. tab.) audi tika iegūti no astoņiem pacientiem vecumā līdz vienam gadam, kuriem veikta cirkšņa trūces plastika.
1. tabula. Pētījuma grupas pacientu raksturojums
Characteristics of experimental group
| Nr. p. k. | Vecums (dienas) / dzimums | Lokalizācija |
|---|---|---|
| 1. | 0 / Z | TZ |
| 2. | 0 / M | D |
| 3. | 0 / M | LS |
| 4. | 1 / Z | TZ |
| 5. | 1 / M | LS |
| 6. | 1 / Z | TZ |
| 7. | 1 / M | LS |
| 8. | 1 / M | D |
| 9. | 1 / Z | VPS |
| 10. | 2 / Z | TZ |
| 11. | 2 / Z | TZ |
| 12. | 2 / Z | D |
| 13. | 2 / Z | LS |
| 14. | 2 / Z | TZ |
| 15. | 3 / Z | LS |
| 16. | 4 / Z | D |
| 17. | 4 / M | LS |
| Nr. p. k. | Vecums (dienas) / dzimums | Lokalizācija |
|---|---|---|
| 18. | 4 / M | TZ |
| 19. | 9 / M | D |
| 20. | 9 / M | D |
| 21. | 9 / M | VPS |
| 22. | 9 / Z | LS |
| 23. | 14 / Z | TZ |
| 24. | 15 / Z | LS |
| 25. | 15 / M | LS |
| 26. | 19 / M | TZ |
| 27. | 26 / M | LS |
| 28. | 28 / Z | ID |
| 29. | 30 / M | TZ |
| 30. | 36 / M | TZ |
| 31. | 39 / Z | D |
| 32. | 41 / M | LS |
| 33. | 48 / Z | LS |
| 34. | 51 / M | LS |
| Nr. p. k. | Vecums (dienas) / dzimums | Lokalizācija |
|---|---|---|
| 35. | 56 / Z | TZ |
| 36. | 56 / M | TZ |
| 37. | 62 / M | D |
| 38. | 67 / Z | TZ |
| 39. | 71 / M | TZ |
| 40. | 94 / M | TZ |
| 41. | 100 / M | TZ |
| 42. | 103 / Z | D |
| 43. | 108 / Z | TZ |
| 44. | 129 / Z | TZ |
| 45. | 130 / M | D |
| 46. | 134 / M | TZ |
| 47. | 151 / M | TZ |
| 48. | 185 / M | TZ |
| 49. | 210 / Z | ID |
| 50. | 292 / M | TZ |
Z – zēns, M – meitene, TZ – tievā zarna, ID – līkumainās zarnas distālā daļa, D – divpadsmitpirkstu zarna, LS – Leda saite, VPS – vēdera priekšējā siena.
2. tabula. Kontrolgrupas pacientu raksturojums
Characteristics of control group
| Nr. p. k. | Vecums (dienas) / dzimums |
|---|---|
| 1. | 46 / M |
| 2. | 53 / Z |
| 3. | 56 / Z |
| 4. | 60 / M |
| Nr. p. k. | Vecums (dienas) / dzimums |
|---|---|
| 5. | 73 / Z |
| 6. | 76 / Z |
| 7. | 92 / Z |
| 8. | 145 / Z |
Z – zēns, M – meitene.
Iegūtie audu paraugi bija Rīgas Stradiņa universitātes Anatomijas un antropoloģijas institūta arhīva materiāls. Pētījums tika veikts saskaņā ar Helsinku deklarācijas principiem, un pētījuma veikšanai tika saņemta Rīgas Stradiņa universitātes Ētikas komitejas atļauja.
Audu fragmentu fiksācija tika veikta 24 stundas Stefanini šķīdumā, kas pagatavots no 2 % formaldehīda un 0,2 % pikrīnskābes 0,1 M fosfātu buferšķīdumā (pH 7,2). Tika sagatavoti parafīna audu bloki, no kuriem tika iegūti 3–4 mikrometrus plāni audu griezumi ar pusautomātiskā rotācijas mikrotoma (Leica RM2245, Leica Biosystems Richmond Inc., ASV) palīdzību.
Lai iegūtu pārskata morfoloģisko ainu, sagatavotie paraugi tika krāsoti ar hematoksilīnu un eozīnu un analizēti ar gaismas mikroskopu (Leica DM500RB, Leica Biosystems Richmond Inc., ASV).
Imūnhistoķīmiski tika noteikts IL-1α (sc-9983; pele, monoklonāla antiviela, darba atšķaidījums 1 : 50, Santa Cruz, ASV), IL-4 (orb10908; trusis, poliklonāla antiviela, darba atšķaidījums 1 : 100, Biorbyt, Lielbritānija), IL-6 (LD-B1582; pele, monoklonāla antiviela, darba atšķaidījums 1 : 50, Nordic BioSite, Zviedrija), IL-7 (orb48420; trusis, poliklonāla antiviela, darba atšķaidījums 1 : 100, Biorbyt, Lielbritānija), IL-8 (orb39299; trusis, poliklonāla antiviela, darba atšķaidījums 1 : 100, Biorbyt, Lielbritānija) un IL-10 (ab34843; trusis, poliklonāla antiviela, darba atšķaidījums 1 : 400, Abcam, Lielbritānija).
Audu paraugi tika deparafinizēti ksilolā un hidratēti spirtu saturošos šķīdumos ar dilstošu koncentrāciju, tad 10 minūtes skaloti Tris buferšķīdumā (15-M106; Bio-Optica, Itālija) un piecas minūtes vārīti EDTA buferī (T0103; Diapath, Itālija) mikroviļņu krāsnī. Kad paraugi bija atdzesēti, tie tika skaloti ar Tris buferšķīdumu divas reizes pa piecām minūtēm. Pēc tam tika bloķēta endogēnās peroksidāzes aktivitāte ar 3 % peroksīdu 10 minūtes un veikta atkārtota skalošana ar Tris buferšķīdumu divas reizes pa piecām minūtēm. Lai mazinātu fona krāsojumu, 20 minūtes tika lietots bloķējošais serums.
Visiem audu paraugiem primārās antivielas inkubācijas ilgums bija viena stunda, un tika izmantota HiDef DetectionTMHRP polimēra sistēma. Desmit minūtes istabas temperatūrā tika izmantots HiDef DetectionTM amplifikators (954D-31; Cell Marque, ASV). Pēc šīs apstrādes preparāti 5 minūtes atkārtoti skaloti Tris buferšķīdumā. Tālāk tika veikta 10 minūtes ilga inkubācija istabas temperatūrā ar HiDef DetectionTMHRP polimēru iezīmētāju (954D-32; Cell Marque, ASV), atkārtota piecas minūtes ilga skalošana ar Tris buferšķīdumu un 10 minūtes ilga DAB Substrate Kit hromogēna (957D-61; Cell Marque, ASV) izmantošana pozitīvo struktūru iezīmēšanai brūnā krāsā. Tad paraugi tika skaloti zem tekoša ūdens un krāsoti ar hematoksilīnu (ab143166; Abcam, ASV).
Imūnhistoķīmiski pozitīvo struktūru klātbūtne tika izvērtēta atbilstoši puskvantitatīvajai skaitīšanas metodei (Pilmane et al., 2011):
0 – nevienas pozitīvās struktūras redzes laukā;
0/+ – retas pozitīvās struktūras redzes laukā;
+ – maz pozitīvo struktūru redzes laukā;
+/++ – maz līdz vidēji daudz pozitīvo struktūru redzes laukā;
++ – vidēji daudz pozitīvo struktūru redzes laukā;
++/+++ – vidēji daudz līdz daudz pozitīvo struktūru redzes laukā;
+++ – daudz pozitīvo struktūru redzes laukā;
+++/++++ – daudz līdz ļoti daudz pozitīvo struktūru redzes laukā;
++++ – ļoti daudz pozitīvo struktūru redzes laukā.
Pozitīvās struktūras tika analizētas 10 nejauši izvēlētos redzes laukos katrā audu paraugā.
Datu analīzei tika izmantotas aprakstošās statistikas metodes un neparametriskie testi. Pēc rangu lielumiem tika aprēķināts Spīrmena (Spearman) korelācijas koeficients (rs), kur 0–0,3 tika vērtēta kā vāja korelācija, 0,31–0,69 – vidēji cieša, 0,7–1 – cieša. Atšķirības starp pētījuma un kontrolgrupas datiem tika analizētas, izmantojot Manna–Vitnija (Mann–Whitney) U testu. Rezultātus uzskatīja par statistiski ticamiem, ja p < 0,05. Statistiskā analīze veikta ar IBM SPSS Statistics datorprogrammu.
Rezultāti
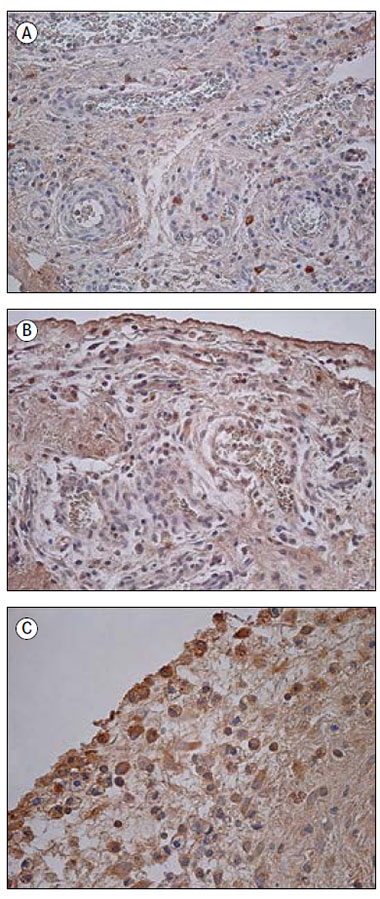
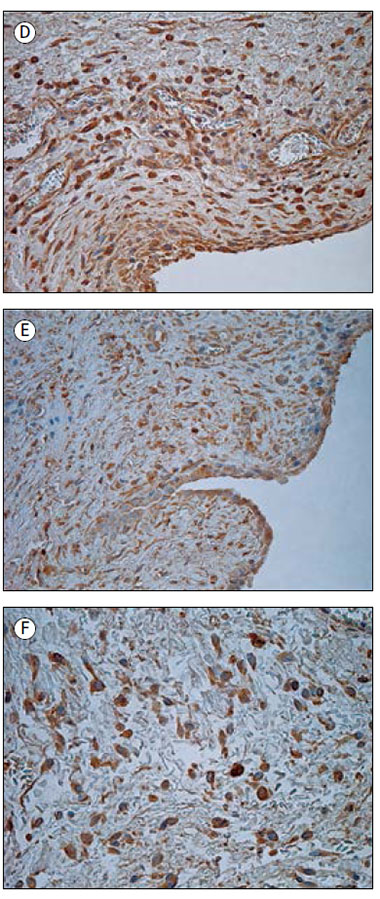
Pētījuma grupas audos tika novēroti IL-1 pozitīvi makrofāgi un fibroblasti, ieskaitot strukturāli izmainītus fibroblastus (sk. 1. A att.). Saaugumu audos vidēji daudz līdz daudz (++/+++) pozitīvo struktūru tika konstatēts četros gadījumos, vidēji daudz (++) – 13 gadījumos, bet maz līdz vidēji daudz (+/++) – 10 gadījumos. Astoņos audu paraugos bija maz (+) un 14 – retas (0/+) IL-1 pozitīvās šūnas. Vienā gadījumā IL-1 pozitīvās struktūras netika novērotas. Savukārt kontrolgrupas audos šo struktūru bija statistiski ticami vairāk (U = 95,5; p = 0,015), tika novēroti arī IL-1 pozitīvi mezoteliocīti (sk. 2. A att.). Relatīvi veselajos audos IL-1 pozitīvo struktūru visbiežāk bija vidēji daudz (++).
Daudzas (+++) IL-4 pozitīvās struktūras tika novērotas vienā gadījumā, vidēji daudz līdz daudz (++/+++) – piecos gadījumos, vidēji daudz (++) – astoņos gadījumos (sk. 1. B att.). Citos 11 gadījumos tika konstatēts maz līdz vidēji daudz (+/++) un 14 gadījumos – maz (+) fibroblastu un makrofāgu. Retas (0/+) IL-4 pozitīvās struktūras bija vērojamas piecos gadījumos, savukārt atlikušajos piecos pētījuma audu paraugos neiezīmējās neviena pozitīva struktūra. Kontrolgrupas audos IL-4 pozitīvo struktūru bija ievērojami vairāk (U = 60,5; p = 0,002), piecos paraugos bija vidēji daudz (++) (sk. 2. B att.) un trīs paraugos – vidēji daudz līdz daudz (++/+++) pozitīvo struktūru.
Astoņos pētījuma paraugos novēroja daudz (+++) IL-6 pozitīvo struktūru (sk. 1. C att.), 12 gadījumos – vidēji daudz līdz daudz (++/+++). Vidēji daudz (++) IL-6 pozitīvo struktūru tika konstatēts 11 gadījumos, maz līdz vidēji daudz (+/++) IL-6 pozitīvo iekaisuma šūnu (neitrofilo leikocītu, makrofāgu) un fibroblastu (ieskaitot izmainītos fibroblastus) konstatēja deviņos paraugos. Maz (+) pozitīvo struktūru bija vēl deviņos gadījumos. Vājas pozitīvas korelācijas iezīmējās starp IL-6 un IL-1 (rs = 0,325; p = 0,023), IL-6 un IL-10 (rs = 0,361; p = 0,011) pozitīvajām struktūrām. Kontrolgrupā visbiežāk (piecos gadījumos) pozitīvo struktūru bija vidēji daudz līdz daudz (++/+++), atlikušajos trijos gadījumos bija vidēji daudz pozitīvu mezoteliocītu (sk. 2. C att.). Šī faktora gadījumā netika konstatēta statistiski ticama atšķirība starp pētījuma un kontroles grupu (U = 146,5; p = 0,243).
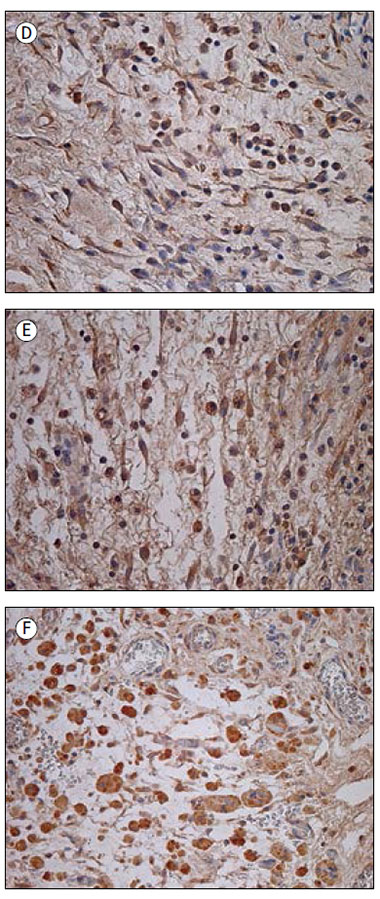
Visbiežāk tika novērots daudz (+++), vidēji daudz līdz daudz (++/+++) vai vidēji daudz (++) IL-7 pozitīvo struktūru. Pozitīvi iezīmējās fibroblasti, makrofāgi (sk. 1. D att.), endoteliocīti, epitelioīdās šūnas. Tikai sešos gadījumos bija maz (+) vai maz līdz vidēji daudz (+/++) pozitīvo IL-7 struktūru. Izmantojot Spīrmena korelāciju testu, pozitīva korelācija tika novērota starp IL-7 un IL-1 (rs = 0,471; p = 0,001), IL-7 un IL-4 (rs = 0,491; p < 0,001), IL-7 un IL-8 (rs = 0,440; p = 0,001), IL-7 un IL-10 (rs = 0,433; p = 0,002) pozitīvajām struktūrām. Ar kontrolgrupu statistiski ticama atšķirība netika konstatēta (U = 144,5; p = 0,19). Kontrolgrupā bija vidēji daudz līdz daudz (++/+++) vai daudz (+++) pozitīvu fibroblastu un makrofāgu (sk. 2. D att.).
IL-8 pozitīvi bija fibroblasti un makrofāgi (sk. 1. E att.). Divos gadījumos bija daudz (+++) iezīmēto šūnu, sešos gadījumos – vidēji daudz līdz daudz (++/+++), desmit gadījumos – vidēji daudz (++), bet septiņos – maz līdz vidēji daudz (+/++). Četrpadsmit audu paraugos bija maz (+) IL-8 pozitīvo struktūru, astoņos gadījumos – retas (0/+) pozitīvās šūnas. Savukārt trīs paraugos IL-8 pozitīvās struktūras netika novērotas. Kontrolgrupā IL-8 pozitīvo struktūru bija statistiski ticami vairāk (U = 40,0; p < 0,001). Vidēji daudz līdz daudz (++/+++) mezoteliocītu un fibroblastu bija astoņos gadījumos (sk. 2. E att.).
IL-10 tika konstatēts makrofāgos, epitelioīdajās šūnās (sk. 1. F att.), neitrofilajos leikocītos, fibroblastos un citās saistaudu šūnās. Daudz (+++) IL-10 pozitīvo šūnu tika novērots deviņos gadījumos, 22 gadījumos bija vidēji daudz līdz daudz (++/+++) pozitīvo struktūru, 10 gadījumos – vidēji daudz (++), četros gadījumos – maz līdz vidēji daudz (+/++), divos – maz (+). Atlikušajos divos paraugos tika konstatētas retas IL-10 pozitīvās struktūras. Statistiski ticamas korelācijas tika novērotas starp IL-10 un IL-1 (rs = 0,438; p = 0,002), IL-10 un IL-8 (rs = 0,550; p < 0,001) pozitīvajām struktūrām. Kontrolgrupas audos novēroja vidēji daudz (++) vai vidēji daudz līdz daudz (++/+++) pozitīvo šūnu, visbiežāk makrofāgus un fibroblastus (sk. 2. F att.). Statistiski ticama atšķirība starp grupām netika konstatēta (U = 184,0; p = 0,769).
Visi puskvantitatīvās skaitīšanas rezultāti ir apkopoti 3. tabulā.
3. tabula. Interleikīnu sadalījuma novērtējums ar puskvantitatīvo skaitīšanas metodi
Semi-quantitative evaluation of immunoreactive structures
| Citokīns | Datu kopas sadalījums | Pētījuma grupa | Kontrolgrupa | Manna–Vitnija U kritērijs | p vērtība |
|---|---|---|---|---|---|
| IL-1 | Mediāna | +/++ | ++ | 95,5 | 0,015 |
| IQR | +/++ | 0 | |||
| IL-4 | Mediāna | +/++ | ++ | 60,5 | 0,002 |
| IQR | + | 0/+ | |||
| IL-6 | Mediāna | ++ | ++/+++ | 146,5 | 0,243 |
| IQR | + | 0/+ | |||
| IL-7 | Mediāna | ++/+++ | ++/+++ | 144,5 | 0,19 |
| IQR | + | 0/+ | |||
| IL-8 | Mediāna | + līdz +/++ | ++/+++ | 40,0 | < 0,001 |
| IQR | + | 0 | |||
| IL-10 | Mediāna | ++/+++ | ++/+++ | 184,0 | 0,769 |
| IQR | 0/+ | 0/+ |
IL-1 – interleikīns-1, IL-4 – interleikīns-4, IL-6 – interleikīns-6,
IL-7 – interleikīns-7, IL-8 – interleikīns-8, IL-10 – interleikīns-10,
IQR – starpkvartiļu izkliede.
Pozitīvo struktūru kvantifikācija:
0/+ – retas pozitīvās struktūras redzes laukā;
+ – maz pozitīvo struktūru redzes laukā;
+/++ – maz līdz vidēji daudz pozitīvo struktūru redzes laukā;
++ – vidēji daudz pozitīvo struktūru redzes laukā;
++/+++ – vidēji daudz līdz daudz pozitīvo struktūru redzes laukā;
+++ – daudz pozitīvo struktūru redzes laukā.
1. attēls. Imūnreaktīvās struktūras iedzimtu saaugumu audos
Immunoreactive structures in congenital adhesion
|
|
A – maz IL-1 pozitīvo saistaudu šūnu iedzimtu saaugumu gadījumā 14 dienas vecam pacientam (IHĶ, × 250); | D – daudz IL-7 pozitīvo fibroblastu un makrofāgu iedzimtu saaugumu gadījumā 56 dienas vecam pacientam (IHĶ, × 400); |
2. attēls. Imūnreaktīvās struktūras kontrolgrupas audos
Immunoreactive structures in control group
|
|
A – vidēji daudz IL-1 pozitīvo mezoteliocītu un fibroblastu 53 dienas vecam pacientam (IHĶ, × 200); | D – daudz IL-7 pozitīvo fibroblastu un makrofāgu 76 dienas vecam pacientam (IHĶ, × 250); |
Diskusija
Līdz šim nav veikti pētījumi, kuros būtu aplūkoti interleikīni iedzimtu intraabdominālu saaugumu gadījumos. Atsevišķi citokīni aprakstīti iegūtu saaugumu gadījumos. Pēcoperācijas saaugumi ir aprakstīti kā atbildes reakcija uz audu ievainojuma rezultātā radušos iekaisuma procesu (Arung et al., 2011). Citokīniem varētu būt nozīme saaugumu izveidē un pārveidē, jo tie plaši mijiedarbojas ar fibrinolītiskajiem ceļiem un sekmē tiešu vai netiešu ekstracelulārās matrices remodelāciju. Traucēta ekstracelulārās matrices remodelācijas kontrole var būt atbildīga par saaugumu veidošanos pēc peritoneāla bojājuma (Cheong et al., 2002). Literatūrā ir aprakstīts, ka autopsijas laikā 28 % gadījumu saaugumi konstatēti arī tām personām, kurām dzīves laikā nav veiktas ķirurģiskas manipulācijas (Brüggmann et al., 2010). Tādēļ jādomā, ka iekaisuma atbildes reakcija var būt nozīmīga saaugumu patoģenēzē.
IL-1 ir galvenais iekaisuma citokīns, kas tiek primāri atbrīvots, lai cīnītos pret ārēji radītām izmaiņām organismā; tas pagarina makrofāgu un neitrofilo leikocītu dzīves ilgumu un stimulē to efektoro funkciju (Garlanda et al., 2013). Ir aprakstīts, ka agrīna IL-1 pozitīvo struktūru skaita palielināšanās un līmeņa paaugstināšanās plazmā ir būtisks marķieris pēcoperācijas saaugumu veidošanās procesā (Saba et al., 1998). Iedzimtu intraabdominālu saaugumu gadījumā IL-1 atrade audos, salīdzinot ar kontrolgrupas audiem, bija izteikti mazāka, līdz ar to jādomā par neefektīvi noritošu sistēmisko iekaisumu.
Salīdzinoši izteiktā IL-10 atrade liek domāt par dominējošu lokālās aizsardzības procesu iedzimtu intraabdominālu saaugumu patoģenēzē. Salīdzinot peritoneālos fibroblastus ar saaugumu fibroblastiem, vērojama izteiktāka IL-10 parādīšanās (Saed et al., 2001). IL-10 var nomākt iekaisuma reakciju un ierobežot iekaisuma radītu audu bojājumu (Ouyang et al., 2011). IL-10 galvenokārt nomāc iekaisuma procesu, bloķējot iekaisuma ceļu aktivāciju un inhibējot iekaisuma procesa mediatoru, ieskaitot IL-1, IL-6, IL-8, IFN-γ, TNF-α, sintēzi (Mion et al., 2014). Šis apgalvojums ir saskaņā ar mūsu iegūtajiem rezultātiem attiecībā uz IL-10 un šī faktora attiecību ar citiem iekaisuma mediatoriem.
IL-6 sintezē gandrīz visas stromas un imūnšūnas, ieskaitot T šūnas, B šūnas un makrofāgus (Schmidt-Arras and Rose-John, 2016). Pacientiem pēc abdominālas ķirurģiskas operācijas peritoneālajā šķidrumā IL-6 ir atrasts palielinātā daudzumā (Jin et al., 2016). Saaugumu fibroblastiem ir ievērojami augstāks IL-6 līmenis, salīdzinot ar normāliem vēderplēves fibroblastiem (Ambler et al., 2012). IL-1 un TNF-α ir galvenie IL-6 ekspresijas aktivatori (Schmidt-Arras and Rose-John, 2016). Tādējādi šajā pētījumā var izskaidrot pozitīvo korelāciju starp IL-1 un IL-6 imūnreaktīvajām struktūrām. Kaut arī visbiežāk tika novērots vidēji daudz IL-6 pozitīvo struktūru, netika konstatēta statistiski ticama atšķirība starp pētījuma grupu un kontrolgrupu. Līdz ar to, domājams, šis faktors var uzturēt iekaisuma procesu audos, bet tas nav specifisks iedzimtu saaugumu patoģenēzē.
IL-7 nodrošina makrofāgu un fibroblastu aktivāciju, regulē audu destrukcijas procesus hroniska iekaisuma gadījumā (Bikker et al., 2012). Šis interleikīns stimulē limfocītus, kas sekmē citu iekaisuma citokīnu, IFN-γ, TNF-α, kā arī IL-10 izdali (Li H. et al., 2015). Paaugstināts IL-7 līmenis plazmā sekmē monocītu un makrofāgu migrāciju cauri endotēlijam (Li R. et al., 2011). Šajā pētījumā konstatēts vidēji daudz līdz daudz IL-7 pozitīvo struktūru, kas būtiski neatšķīrās no kontrolgrupas, taču saistība starp IL-7 un citiem iekaisuma / pretiekaisuma citokīniem rosina domāt, ka šis faktors ir nozīmīgs iekaisuma mediators iedzimtu intraabdominālu saaugumu gadījumā.
IL-4 ir galvenais makrofāgu “alternatīvās” (pretiekaisuma) aktivācijas stimulators, kas inducē brūču dzīšanu un audu remodelācijas procesus (Wang and Joyce, 2010). Līdzšinējie pētījumi liecina, ka IL-4 izraisa radikālas izmaiņas makrofāgu morfoloģijā – tie saplūst kopā un veido gigantiskas multinukleāras šūnas jeb makrofāgu agregātus. Izmaiņas varētu būt mēģinājums palielināt makrofāgu darbības kapacitāti (Binder et al., 2013). Šajā pētījumā gigantiskas multinukleāras šūnas konstatētas atsevišķos gadījumos, bet kopumā tika novērots maz IL-4 pozitīvo struktūru. Ņemot vērā, ka kontrolgrupas audos IL-4 bija statistiski ticami vairāk, tad var domāt, ka saaugumu slimības gadījumā šī faktora trūkums liecina par izmaiņām humorālajā imunitātē.
Savukārt IL-8 ir iesaistīts dažādos nespecifiskos iekaisuma procesos (Yu et al., 2013); akūta iekaisuma gadījumā tas ir viens no spēcīgākajiem neitrofilo leikocītu hemoatraktantiem (Oliveria et al., 2013; Harada et al., 1994). IL-8 galvenais mērķis ir inducēt neitrofilo leikocītu migrāciju uz iekaisuma vietu un nodrošināt to aktivāciju (Henkels et al., 2011). Literatūrā ir dati, ka IL-8 var aktivēt vaskulārās šūnas un palielināt endotēlija permeabilitāti. Endotēlijam ir nozīmīga loma vaskulārās homeostāzes uzturēšanā (Hongchi et al., 2013). Salīdzinoši mazā IL-8 atrade iedzimtu saaugumu audos norāda uz izmaiņām neitrofilo leikocītu hemotaksē.
Secinājumi
Mazā IL-1 atrade intraabdominālu saaugumu audos un izteiktā IL-10 atrade, salīdzinot ar kontrolgrupas audiem, norāda uz dominējošu audu lokālo aizsardzības reakciju saaugumu gadījumā.
IL-6 un IL-7 nav specifiski faktori saaugumu patoģenēzē, bet, visticamāk, veicina iekaisuma procesa uzturēšanu audos ilgstošā laika posmā.
Salīdzinoši mazā IL-4 un IL-8 atrade liecina par izmaiņām humorālajā imunitātē un neitrofilo leikocītu hemotaksē saaugumu gadījumā.
Abstract
Occurrence of Inflammation Regulating Cytokines in Congenital Intraabdominal Adhesions in Children under One Year of Age
Regulatory role between cytokine pathways in adhesion formation is yet to be defined. This study was designed to explore the relative distribution of interleukin 1, 4, 6, 7, 8 and 10 (IL-1, IL-4, IL-6, IL-7, IL-8 and IL-10) in congenital intraabdominal adhesions compared with relatively healthy tissue controls. The experimental group material was obtained from patients who underwent abdominal surgery due to complete or partial bowel obstruction. The control group was obtained from patients with surgical repair of inguinal hernia. IL-1, IL-4, IL-6, IL-7, IL-8 and IL-10 were detected using immunohistochemistry methods and their relative distribution evaluated by means of a semi-quantitative counting method.
The experimental group tissues showed few to moderate counts of IL-1, IL-4 and IL-8 positive fibroblasts, positive inflammatory cells, mesotheliocytes and endotheliocytes. In control group, tissues of positive structures were in significantly higher counts for IL-1 (U = 95.5, p = 0.015), IL-4 (U = 60.5, p = 0.002) and IL-8 (U = 40.0, p < 0.001). Moderate counts of IL-6 positive inflammatory cells, mesotheliocytes, fibroblasts and endotheliocytes were observed, there was no statistically significant difference between the groups (U = 146.5, p = 0.243). Moderate to numerous counts of IL-7 and IL-10 positive structures were seen, but again no statistically significant difference between the groups was detected – IL-7 (U = 144.5, p = 0.19), IL-10 (U = 184.0, p = 0.769).
The markedly lower IL-1 finding in intraabdominal adhesions tissues compared with healthy controls and essential IL-10 finding points to a local defense response in case of adhesions. IL-6 and IL-7 seem to be unspecific factors in pathogenesis of adhesions, but do assist an ongoing inflammatory tissue response. The comparably low findings for IL-4 and IL-8 indicate that humoral immunity and neutrophil chemotaxis could be impaired in case of adhesions.
Literatūra
- Ambler, D. R., Fletcher, N. M., Diamond, M. P. et al. 2012. Effects of hypoxia on the expression of inflammatory markers IL-6 and TNF-a in human normal peritoneal and adhesion fibroblasts. Syst Biol Reprod Med. 58(6), 324–329.
- Arung, W., Meurisse, M. and Detry, O. 2011. Pathophysiology and prevention of postoperative peritoneal adhesions. World J Gastroenterol. 17(41), 4545–4553.
- Attart, P. J. and MacLean, R. A. 2007. Adhesive small bowel obstruction: epidemiology, biology and prevention. Can J Surg. 50(4), 291–300.
- Bikker, A., Hack, C. E., Lafeber, F. P. et al. 2012. Interleukin-7: a key mediator in T cell-driven autoimmunity, inflammation, and tissue destruction. Curr Pharm Des. 18(16), 2347–2356.
- Binder, F., Hayakawa, M., Choo, M. K. et al. 2013. Interleukin-4-induced β-catenin regulates the conversion of macrophages to multinucleated giant cells. Mol Immunol. 54(2), 157–163.
- Brüggmann, D., Tchartchian, G., Wallwiener, M. et al. 2010. Intra-abdominal Adhesions. Dtsch Arztebl Int. 107(44), 769–775.
- Butureanu, S. A. and Butureanu, T. A. 2014. Pathophysiology of adhesions. Chirurgia (Bucur). 109(3), 293–298.
- Cheong, Y. C., Laird, S. M., Shelton, J. B. et al. 2002. The correlation of adhesions and peritoneal fluid cytokine concentrations: a pilot study. Hum Reprod. 17(4), 1039–1045.
- Corfe, S. A. and Paige, C. J. 2012. The many roles of IL-7 in B cell development; mediator of survival, proliferation and differentiation. Semin Immunol. 24(3), 198–208.
- Fernando, R. M., Reyes, L. J., Iannuzzi, J. et al. 2014. The pro-inflammatory cytokine, interleukin-6, enhances the polarization of alternatively activated macrophages. PLoS One. 9(4), e94188.
- Garlanda, C., Dinarello, C. A. and Mantovani, A. 2013. The interleukin-1 family: back to the future. Immunity. 39(6), 1003–1018.
- Harada, A., Sekido, N., Akahoshi, T. et al. 1994. Essential involvement of interleukin-8 (IL-8) in acute inflammation. J Leukoc Biol. 56(5), 559–564.
- Henkels, M. K., Frondorf, K., Gonzalez-Meija, E. M. et al. 2011. Il-8-induces neutrophil chemotaxis is mediated by Janus kinase 3 (JAK3). FEBS Lett. 585(1), 159–166.
- Hongchi, Y., Xianliang, H., Yunlong, M. et al. 2013. Interleukin-8 regulates endothelial permeability by down-regulation of tight junction but not dependent on integrins induced focal adhesions. Int J Biol Sci. 9(9), 966–979.
- Jin, X., Ren, S., Macarak, E. et al. 2016. Pathobiological mechanisms of peritoneal adhesions: The mesenchymal transition of rat peritoneal mesothelial cells induced by TGF-β1 and IL-6 requires activation of Erk1/2 and Smad2 linker region phosphorylation. Matrix Biol. 51, 55–64.
- Li, H. Y., Zhang, D. L., Zhang, X. et al. 2015. Interleukin-7 is decreased and maybe plays a pro-inflammatory function in primary immune thrombocytopenia. Platelets. 26(3), 243–249.
- Li, R., Paul, A., Ko, K. W. S. et al. 2011. Interleukin-7 induces recruitment of monocytes / macrophages to endothelium. Eur Heart J. 33(24), 3114–3123.
- Maciver, A. H., McCall, M., Shapiro, A. M. 2011. Intra-abdominal adhesions: cellular mechanisms and strategies for prevention. Int J Surg. 9(8), 589–594.
- Malabendu, J., Susanta, M., Arundhati, J. et al. 2014. Interleukin-12 (IL-12), but not IL-23, induces the expression of IL-7 in microglia and macrophages: implications for multiple sclerosis. Immunology. 141(4), 549–563.
- Miller, L. S., Pietras, E. M., Uricchio, L. H. et al. 2007. Inflammasome-mediated production of IL-1beta is required for neutrophil recruitment against Staphylococcus aureus in vivo. J Immunol. 179(10), 6933–6942.
- Mion, F., Tonon, S., Toffoletto, B. et al. 2014. IL-10 production by B cells is differentially regulated by immune-mediated and infectious stimuli and requires p38 activation. Mol Immunol. 62(2), 266–276.
- Ng, P., Li, K., Wong, R. et al. 2003. Proinflammatory and anti-inflammatory cytokine responses in preterm infants with systemic infections. Arch Dis Child Fetal Neonatal Ed. 88(3), 209–213.
- Ning, Y., Manegold, C. P., Hong, K. Y. et al. 2011. Interleukin-8 is associated with proliferation, migration, angiogenesis and chemosensitivity in vitro and in vivo in colon cancer cell line models. Int J Cancer. 128(9), 2038–2049.
- Oliveira, S., Reyes-Aldasoro, C. C., Candel, S. et al. 2013. Cxcl8 (Interleukin-8) mediates neutrophil recruitment and behavior in the zebrafish inflammatory response. J Immunol. 190(8), 4349–4359.
- Oliver, J. A., Stolberg, R. V., Chensue, W. S. et al. 2012. IL-4 acts as a potent stimulator of IFN-γ expression in CD8+ T cells through STAT6-dependent and independent induction of Eomesodermin and T-bet. Cytokine. 57(1), 191–199.
- Ouyang, W., Oh, A. S., Ma, Q. et al. 2013. TGF-β cytokine signaling promotes CD8+ T cell development and low-affinity CD4+ T cell homeostasis by regulation of interleukin-7 receptor-α expression. Immunity. 39(2), 335–346.
- Ouyang, W., Rutz, S., Crellin, N. K. et al. 2011. Regulation and functions of the IL-10 family of cytokines in inflammation and disease. Annu Rev Immunol. 29, 71–109.
- Paul, E. W. and Zhu, J. 2010. How are TH2-type immune responses initiated and amplified? Nat Rev Immunol. 10(4), 225–235.
- Pietras, E. M., Mirantes-Barbeito, C., Fong, S. et al. 2016. Chronic interleukin-1 exposure drives haematopoietic stem cells towards precocious myeloid differentiation at the expense of self-renewal. Nat Cell Biol. 18(6), 607–618.
- Pilmane, M., Ozoliņa, L., Ābola, Z. et al. 2011. Growth factors, their receptors, neuropeptide-containing innervation, and matrix metalloproteinases in the proximal and distal ends of the esophagus in children with esophageal atresia. Medicina (Kaunas). 47(8), 453–460.
- Rifer, P., Carmi, Y., Voronov, E. et al. 2013. Interleukin-1α. Semin Immunol. 25(6), 430–438.
- Saba, A. A., Godziachvili, V., Mavani, A. K. et al. 1998. Serum levels of interleukin 1 and tumor necrosis factor alpha correlate with peritoneal adhesion grades in humans after major abdominal surgery. Am Surg. 64(8), 734–736.
- Saed, G. M., Zhang, W., Diamond, M. P. 2001. Molecular characterization of fibroblasts isolated from human peritoneum and adhesions. Fertil Steril. 75(4), 763–768.
- Schmidt-Arras, D. and Rose-John, S. 2016. IL-6 pathway in the liver: From physiopathology to therapy. J Hepatol. 64(6), 1403–1415.
- Shimin, W., Xiang, G., Guobo, S. et al. 2016. Interleukin-10 deficiency impairs regulatory T cell-derived neuropilin-1 functions and promotes Th1 and Th17 immunity. Sci Rep. 6, 24249.
- Shindo, Y., Unsinger, J., Burnham, C. A. et al. 2015. Interleukin 7 and anti-programmed cell death 1 antibody have differing effects to reverse sepsis-induced immunosuppression. Shock. 43(4), 334–343.
- Wang, H. W. and Joyce, J. A. 2010. Alternative activation of tumor-associated macrophages by IL-4. Cell Cycle. 9(24), 4824–4835.
- Wanqiu, H., Young-Hee, J., Hyun, S. K. et al. 2014. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibiting cellular apoptosis and cytotoxic T cell function. J Virol. 88(15), 8479–8489.
- Yu, H., Huang, X., Ma, Y. et al. 2013. Interleukin-8 regulates endothelial permeability by down-regulation of tight junction but not dependent on integrins induced focal adhesions. Int J Biol Sci. 9(9), 966–979.