Ātriju fibrilācija un faktori, kas ietekmē atkārtotus paroksismu recidīvus pēc elektriskās kardioversijas
Kopsavilkums
Ātriju fibrilācijas (ĀF) gadījumā ir palielināts embolisko notikumu un sirds mazspējas attīstības risks, tāpēc nepieciešams atjaunot sinusa ritmu pēc iespējas ātrāk un drošāk. Šīm prasībām atbilst elektriskā kardioversija (EKV), taču tā nenovērš augsto mirdzaritmijas recidīvu iespēju, ko nosaka dažādi riska faktori.
Darba mērķis. Izvērtēt antiaritmiskās terapijas efektivitāti un identificēt recidivējošas ĀF riska faktorus pēc EKV.
Materiāls un metodes. Pētījums ietver informāciju par 256 prospektīviem un 229 retrospektīviem ĀF pacientiem, kam 2013. gada laikā Paula Stradiņa Klīniskajā universitātes slimnīcā, Latvijas Kardioloģijas centra 11. nodaļā, veikta EKV. Pētījuma gaitā tika veikta stacionārā anketēšana un kontroles anketēšana pa tālruni pēc viena, trim un sešiem mēnešiem, apkopoti anamnestiskie dati par 227 prospektīviem pacientiem.
Rezultāti. ĀF recidīvu biežums pēc EKV bija 32,6 % pacientu. Hroniskas nieru slimības gadījumā bija statistiski ticami augstāks recidīvu un hospitalizāciju biežums viena, trīs un sešu mēnešu laikā. Vecuma grupā no 45 līdz 55 gadiem trīs mēnešu laikā statistiski ticami biežāki bija recidīvi un hospitalizācijas to dēļ, salīdzinot ar citām vecuma grupām. Sinusa ritma uzturēšanai Ic vai III klases antiaritmiskie līdzekļi tika lietoti 83,1 % pacientu, visbiežāk amiodarons (62,1 %), kura lietotāju grupā statistiski ticami retāk novēroja recidīvus (33,3 %), salīdzinot ar propafenona (63,6 %), etacizīna (83,3 %) un sotalola lietotāju grupu. Retāki recidīvi ir statīnu, aldosterona antagonistu un diurētisko medikamentu lietotāju grupās.
Secinājumi. ĀF recidīvi pēc EKV ir katram trešajam pacientam. Statīnu, aldosterona antagonistu grupas medikamenti un diurētiskie līdzekļi samazina ĀF recidīvu biežumu pēc EKV. Amiodarons statistiski ticami efektīvāk novērš ĀF recidīvus nekā etacizīns, propafenons un sotalols. Statistiski ticami augstāks ĀF recidīvu un hospitalizācijas risks sešu mēnešu laikā ir pacientiem ar hronisku nieru slimību un trīs mēnešu laikā – pacientiem vecuma grupā no 45 līdz 55 gadiem.
Izmantotie saīsinājumi
AAL – antiaritmiskie līdzekļi
ĀF – ātriju fibrilācija
AH – arteriāla hipertensija
ARB – aldosterona receptoru blokatori
BAB – beta adrenoblokatori
BNP – nātrijurētiskais smadzeņu peptīds (brain natriuretic peptide)
CD – cukura diabēts
CRO – C reaktīvais olbaltums
DT – datortomogrāfija
EDD – kreisā kambara beigu diastoliskais diametrs
EF – kreisā kambara izsviedes frakcija
EKG – elektrokardiogramma / elektrokardiogrāfija
ESD – kreisā kambara beigu sistoliskais diametrs
HKMP – hipertrofijas kardiomiopātija
HNS – hroniska nieru slimība
HSM – hroniska sirds mazspēja
HOPS – hroniska obstruktīva plaušu slimība
KAS – koronāro artēriju slimība
KK – kreisais kambaris
KKB – kalcija kanālu blokatori
KKH – kreisā kambara hipertrofija
KSS – koronāra sirds slimība
ĶMI – ķermeņa masas indekss
LA – labais ātrijs
LAVI – kreisā ātrija tilpuma indekss
J – džouls
N-T proBNP – N-terminālais pro-nātrijurētiskais smadzeņu peptīds
PV RFKA – pulmonālo vēnu radiofrekvences katetrablācija
OR – izredžu attiecība (odds ratio)
RFKA – radiofrekvences katetrablācija
RR – relatīvais risks
SDF – sirdsdarbības frekvence
SD – standartdeviācija
SM – sirds mazspēja
SR – sinusa ritms
TI – ticamības intervāls
TIL – transitīva išēmiska lēkme
Ievads
Mirdzaritmija jeb ātriju fibrilācija ir supraventrikulāra tahiaritmija, kam raksturīga nekoordinēta, ātra priekškambaru aktivācija (240–320 reižu minūtē) ektopisku impulsu rašanās dēļ ārpus sinusa mezgla, kas rada konsekventu kambaru mehāniskās funkcijas pasliktināšanos [Camm, 2010; Camm, 2012]. Ātriju fibrilācijas prevalence palielinās no 0,1 % cilvēkiem, kas jaunāki par 55 gadiem, līdz 9 % personām, kas vecākas par 80 gadiem [Lafuente-Lafuente, 2006]. Tā sastopama 2,3 miljoniem Amerikas Savienoto Valstu iedzīvotāju, un tiek prognozēts, ka līdz 2050. gadam šis skaits var palielināties pat līdz 5,6 miljoniem [Lafuente-Lafuente, 2006; Camm, 2012].
Problēmas, kas saistītas ar ĀF un kam būtu jāpievērš uzmanība, ir palielināts cerebrālo insultu risks, demences attīstība, pakāpeniska sirds remodelācijas un mazspējas progresēšana, finansiālo līdzekļu izlietošana medicīnisko problēmu un recidīvu dēļ, pēkšņas nāves risks, kā arī simptomātiska ĀF. Minētās problēmas var ievērojami pasliktināt dzīves kvalitāti [Rienstra, 2012].
ĀF terapijas pamatā ir ritma vai frekvences kontrole un antitrombotiskā terapija, tāpēc parasti tiek lietoti antikoagulanti vai antiagreganti atkarībā no riska līmeņa (CHA2DS2-VASc skala) [Camm, 2012; Lip, 2013; Ērglis, 2013]. Kā viena no ritma konversijas metodēm tiek izmantota elektrisko impulsu terapija jeb elektriskā kardioversija, kas tiek īstenota, izmantojot noteiktas līdzstrāvas jaudas lādiņu īslaicīgā vispārējā anestēzijā. EKV ir efektīva gandrīz 100 % gadījumu. Pēc tam tiek veikta ritma kontroles terapija – sinusa ritma uzturēšanas pasākumi: jāmaina dzīvesveids, jālieto beta adrenoblokatori, renīna angiotensīna sistēmas bloķējošie medikamenti vai statīnu un citu grupu medikamenti atkarībā no iespējamiem recidīva riska faktoriem un blakusslimībām [Roy, 2000; Camm, 2010; Jirgensons, Kalējs, 2010].
Ir pierādīts, ka cīņa ar recidīviem izmaksā lētāk nekā cīņa ar mirdzaritmijas komplikācijām, tāpēc pielāgot un izvērtēt AAL lietošanas nepieciešamību pēc EKV ir svarīga terapijas stratēģija, kas veiksmīgas izvēles gadījumā, ņemot vērā recidivējošas ĀF riska faktorus, nodrošina sinusa ritma persistenci ilgākā laikposmā [Jirgensons, Kalējs, 2010; Camm, 2010; Chiang, 2013].
Kā statistiski ticami ātriju fibrilācijas recidīva riska faktori pēc sinusa ritma konversijas pasaules literatūrā ir minēta neparoksismāla ātriju fibrilācijas forma, lielāks kreisā ātrija diametrs, palielināts ķermeņa masas indekss, lielāka sirdsdarbības frekvence, sievietes dzimums, lielāks vecums, koronārā sirds slimība, sirds vārstuļu slimības [Jirgensons, Kalējs, 2010; Camm, 2010; Pisters, 2013]. Pētnieciskā darba mērķis ir identificēt recidivējošas mirdzaritmijas riska faktorus un novērtēt antiaritmiskās terapijas efektivitāti vienu, trīs un sešus mēnešus pēc elektriskās kardioversijas.
Darba mērķis un uzdevumi
Ņemot vērā hipotēzi, ka atkārtotas mirdzaritmijas epizodes pēc elektriskās kardioversijas biežāk ir sievietēm un vecākiem pacientiem, kam ir lielāks ķermeņa masas indekss, kreisā ātrija diametrs un tilpuma indekss, augstāks lipīdu līmenis, arteriālā hipertensija, cukura diabēts, metabolais sindroms, hroniska nieru slimība un ilgstošāka aritmijas anamnēze pirms elektriskās kardioversijas, kā arī pacientiem bez antiaritmisko līdzekļu terapijas, ir jāsalīdzina pacientu grupas ar ĀF, kas slimo ar minētajām patoloģijām.
Darba mērķis. Izvērtēt antiaritmiskās terapijas efektivitāti un identificēt recidivējošas ātriju fibrilācijas riska faktorus pēc elektriskās kardioversijas.
Darba uzdevumi.
- Noskaidrot ātriju fibrilācijas recidīvu biežumu pēc elektriskās kardioversijas.
- Izpētīt dažādu medikamentu grupu parakstīšanas biežumu sinusa ritma uzturēšanai un to efektivitāti pēc elektriskās kardioversijas, novērtēt ātriju fibrilācijas recidīvu skaitu dažādu antiaritmisko līdzekļu lietošanas pacientu grupās.
- Noteikt, vai pēc elektriskās kardioversijas ir statistiski ticamas atšķirības starp pacientiem ar ātriju fibrilāciju un bez recidīviem dažādās vecuma un dzimuma grupās, vai atšķiras ātriju fibrilācijas ilgums, kreisā ātrija diametrs un tilpuma indekss, ķermeņa masas indekss un lipīdu līmenis.
- Izpētīt, vai arteriālās hipertensijas, hroniskas nieru slimības, cukura diabēta un metabolā sindroma gadījumā ir biežāki recidīvi.
- Veikt daudzfaktoru loģistiskās regresijas analīzi un atrast neatkarīgos mainīgos, kas ar statistiski ticamu nozīmīgumu prognozē ātriju fibrilācijas recidīvu attīstību pēc elektriskās kardioversijas.
Literatūras apskats
Ātriju fibrilācijas raksturojums. ĀF ir klīniskajā praksē visbiežāk sastopamā aritmija, kas skar vienu trešdaļu pacientu, kuri stacionēti sirds ritma traucējumu dēļ. Ir aprēķināts, ka 25 % cilvēku, kas ir vecāki par 40 gadiem, ir risks turpmākās dzīves laikā piedzīvot ātriju fibrilāciju [Camm, 2010; Pisters, 2013]. Šīs aritmijas patofizioloģiskā procesa pamatā ir multiplu, ektopisku, reentrantu elektriskās aktivitātes vilnīšu veidošanās ārpus sinusa mezgla, visbiežāk ap pulmonālajām vēnām, kas tālāk virzās pa loku ātrijā. Impulsu frekvence var būt pat līdz 300–600 reizēm, kas tādējādi palielina kambaru frekvenci līdz 60–130 reizēm minūtē, negatīvi ietekmējot kambaru uzpildīšanos, izsviedi un vispārējo asinsapgādi. Tomēr lielākajā daļā (pat līdz 90 %) gadījumu šī aritmija pacientiem ir asimptomātiska [Cannon, 2008].
Visnopietnākā komplikācija, kas rodas fibrilējošo ātriju strukturālo pārmaiņu dēļ, ir cerebrāls insults, kad no kreisās sirds puses asins stāzes un hiperkoagulācijas dēļ atraujas trombs, kas nonāk cerebrālajos asinsvados. Ārzemju zinātnieku (Renfrew / Paisly) pētījumā 25 kontroles gadu laikā pierādīts, ka pacientiem ar ĀF ir 2,5 līdz 3,2 reizes augstāks insulta risks un 1,5 reizes augstāks nāves risks nekā pacientiem bez ĀF.
Aprēķināts, ka izmaksas dzīves laikā ĀF pacientiem ar insultu ir robežās no 41 257 līdz pat 104 629 ASV dolāriem [Cannon, 2008]. ĀF gadījumā tiešās izmaksas pieaug ne vien insulta, bet arī recidīvu, atkārtotu ārsta vizīšu, progresējošas sirds mazspējas un medikamentu iegādes dēļ, savukārt netiešās izmaksas – kavēto darba dienu dēļ.
Jāņem vērā, ka ne vien ĀF komplikācijas ietekmē dzīves kvalitāti, bet arī, piemēram, tahisistoliskas vai bradisistoliskas ĀF dēļ var būt traucēta vispārējā asinsapgāde, kas rada reiboņus, nogurumu, elpas trūkumu, īpaši pacientiem, kam ir plaušu un sirds slimības, tā samazinot darba spējas un dzīves kvalitāti [Cannon, 2008; Jirgensons, Kalējs, 2010].
ĀF persistēšanu veicina kreisā ātrija dilatācija, ko var radīt strukturālas sirds izmaiņas, vārstuļu slimības, arteriāla hipertensija, sirds mazspēja un citi iemesli. Ātriju palielināšanās aktivē daudzus molekulāros ceļus, tostarp renīna-aldosterona-angiotensīna sistēmu. Angiotensīns II paaugstina matriksa metālproteināzes un dizintegrīna līmeni, kas veicina miokarda remodelāciju, fibrozes attīstību un muskuļu masas zudumu, refraktārā perioda saīsināšanos, kad nenotiek normāla refraktivitātes adaptācija sirds ritma izmaiņām, kas sekmē ĀF atkārtošanos un sirds mazspējas attīstību [Cannon, 2008].
ĀF tiek iedalīta pirmreizējā un recidivējošā formā, ja ir dokumentētas vismaz divas tās epizodes. Ja recidivējoša ātriju fibrilācija tiek pārtraukta spontāni 48 stundu laikā, tā ir paroksismāla forma. Ja persistenta ĀF ilgst vismaz septiņas dienas, tad ir nepieciešama medikamentoza vai elektriska kardioversija sinusa ritma atjaunošanai. Permanentas ĀF gadījumā ārstējošais ārsts izlemj un pacients piekrīt neatjaunot sinusa ritmu, bet realizēt tikai frekvences kontroli [Camm, 2010]. Reti sastopama ir idiopātiska ĀF forma (lone atrial fibrillation), kuras gadījumā netiek atklātas strukturālas sirds izmaiņas. Visbiežāk ĀF ir saistīta ar KSS, CD, AH, aptaukošanos, plaušu slimībām un sirds mazspēju [Camm, 2010].
Ātriju fibrilācijas riska faktori. Kohortas pētījumā The Framingham Heart Study tika iekļauti 2090 vīrieši un 2641 sieviete vecuma grupā no 55 līdz 94 gadiem, kuriem pētīja dzimumam specifiskus, neatkarīgus iespējamos ĀF riska faktorus. Trīsdesmit astoņu gadu ilgā kontroles laikā tika pierādīti vairāki fakti.
Vīriešiem ir 1,5 reizes augstāks ĀF risks nekā sievietēm, un katru gadu tas pieaug 2,1 reizi vīriešiem un 2,2 reizes sievietēm (p < 0,001).
Cukura diabēts (OR = 1,4 vīriešiem, OR = 1,6 sievietēm), sastrēguma sirds mazspēja (OR = 4,5 vīriešiem, OR = 5,9 sievietēm), vārstuļu slimība (OR = 1,8 vīriešiem, OR = 3,4 sievietēm) un arteriāla hipertensija (OR = 1,5 vīriešiem, OR = 1,4 sievietēm) ir slimības, kas ir saistītas ar paaugstinātu ĀF risku abu dzimumu pārstāvjiem.
Miokarda infarkts vīriešiem (OR = 1,4) ir cieši saistīts ar ātriju fibrilācijas attīstību, savukārt sievietēm biežāk nekā vīriešiem vārstuļu slimības ir ĀF attīstības riska faktors [Benjamin, 1994].
Atklāts arī, ka lielāka prevalence un lielāks ĀF risks pēc 50 gadu vecuma ir baltās rases pārstāvjiem, salīdzinot ar afroamerikāņiem (2,2 % vs. 1,5 %; p < 0,001) [Cannon, 2008].
Kā citi riska faktori, kas veicina strukturālas sirds izmaiņas un ĀF attīstību, pasaules literatūrā minēta aptaukošanās un diastoliska sirds kreisā kambara mazspēja, kas izraisa spiediena paaugstināšanos un tilpuma pārslodzi kreisajā ātrijā. Galvenā problēma, kas saistīta ar aptaukošanos, ir palielināts perikardiālo metaboli aktīvo tauku slānis, kam ir kopīga mikrocirkulācija ar sirdi. Kaut gan ĶMI tiek koriģēts, perikardiālie tauki joprojām ir saistīti ar augstu ĀF attīstību [Rienstra, 2012].
Arī koronāro artēriju subklīnisks bojājums ir ĀF riska faktors. To pētījusi zinātnieku grupa (Nucifora, et al.), izmantojot daudzslāņu datortomogrāfiju, 150 ĀF pacientiem bez zināmas KAS un 148 pacientiem bez dokumentētas ĀF. Tika konstatēta statistiski ticama atšķirība abās grupās: 18 % ĀF pacientu nebija klīniskas KAS, 41 % bija neobstruktīva KAS un 41 % – obstruktīva KAS (p = 0,001) [Rienstra, 2012].
HNS izteikti paaugstina KSS un SM attīstības risku un tiek saistīta arī ar AH, KKH un sistēmisku iekaisuma stāvokli. Alonso ar kolēģiem (Alonso, et al.), analizējot 10 328 vīriešus un sievietes, kas piedalījās pētījumā Atherosclerosis Risk in Communities, atklāja, ka samazināta nieru funkcija un albuminūrija ir cieši saistīta ar ĀF incidenci 10 kontroles gadu laikā [Sarnak, 2003; Rienstra, 2012].
Citos pētījumos kā iespējamie ĀF riska biomarķieri tiek minēti: paaugstināts BNP un N-T proBNP, homocisteīna, renīna un aldosterona līmenis serumā, fibrinogēna un CRO, D-dimēru līmenis un plazminogēna aktivatora inhibitora tips, albuminūrija urīnā [Cannon, 2008; Rienstra, 2012].
Pētījumā Cardiovascular Health Study, kas balstīts uz sabiedrības izpēti, tika analizēti 5445 pacienti un iegūts statistiski ticams apstiprinājums tam, ka proBNP ir nozīmīgs ĀF incidences prognozes rādītājs (OR = 4,0; 95 % TI 3,2–5,0; p < 0,001) [Patton, 2009].
Paaugstināts CRO ir pierādīts kā nozīmīgs ĀF riska faktors. Sekojot līdzi 5806 pacientu veselības stāvoklim 6,9 ± 1,6 gadu garumā (Cardiovascular Health Study), ir pierādīts, ka pēdējās (ceturtās) kvartīles pacientiem (CRO > 3,41 mg/l), salīdzinot ar pirmās kvartīles pacientiem (CRO < 0,97 mg/l), biežāk konstatēja ĀF (7,4 % vs. 3,7 %; OR = 1,8; 95 % TI 1,2–2,5; p = 0,002) [Avilas, 2003].
Elektriskā kardioversija un sinusa ritma uzturēšana. ĀF gadījumā sinusa ritma atjaunošana, uzturēšana un aritmijas recidīvu novēršana var samazināt aritmijas radītos simptomus un uzlabot sirds funkciju. Sinusa ritma atjaunošana ir saistīta ar fiziskās slodzes tolerances un hemodinamisko parametru uzlabošanos un ātriju izmēra samazināšanos [Van Gelder, 2002; Chiang, 2013]. Frekvences kontroles gadījumā mortalitāte un kardiovaskulāra morbiditāte neatšķiras, salīdzinot ar ritma kontroli, tādēļ tai tiek dota priekšroka kā sākotnējai ĀF terapijai. Tomēr ir pacienti, kas ikdienā paliek simptomātiski, tāpēc ir jāmēģina pāriet uz ritma kontroli [Van Gelder, 2002; Nieuwlaat, 2005].
Ritma kontrole tiek iedalīta divos posmos: SR atjaunošana un uzturēšana. Pēc SR atjaunošanas svarīgi ir novērst iespējamos ĀF recidīvus, jo cīņa ar tiem ir lētāka nekā ar aritmijas komplikācijām [Roy, 2000; Camm, 2010]. Sinusa ritma uzturēšanas pamatā ir riska faktoru korekcija, AAL, BAB, renīna angiotensīna sistēmas aktivitāti samazinošo, statīnu vai citu grupas medikamentu lietošana. Svarīgas SR atjaunošanas stratēģijas metodes ir farmakoloģiska un elektriska kardioversija, kā arī mūsdienās ilgstošai ritma kontrolei ir pieejama RFKA, kas var būt kā pirmās rindas terapija noteiktai pacientu grupai [Cannon, 2008].
EKV gadījumā tiek izmantota līdzstrāvas enerģija, ar kuru var efektīvi atjaunot sinusa ritmu gan akūtos, gan arī plānveida gadījumos. Tā ir viegli veicama procedūra ar pozitīvu iznākumu biežumu (gandrīz 100 %) un zemu embolisko notikumu risku, ja ĀF ilgums ir mazāks par 48 stundām vai arī tiek lietota adekvāta antikoagulantu terapija [Jirgensons, Kalējs, 2010; Camm, 2012; Ērglis, 2013]. EKV efektivitāte ĀF gadījumā, kas nav ilgāka par trīsdesmit dienām, atšķiras atkarībā no lietotās līdzstrāvas stipruma: < 200 J gadījumā – 5,5 %, 200 J gadījumā – 35 % un 360 J gadījumā – 55 %. Pētījumos pierādīts, ka pacientiem, kam ĀF ilgst mazāk par 30 dienām, SR var tikt atjaunots ar 100 J stipru strāvu, bet ilgstošākas ĀF gadījumā SR atjaunošanās varbūtība, ja strāvas stiprums ir < 200 J, ir maz ticama. Pacientiem, kam ĀF ilgst vairāk nekā 180 dienu, sākotnēji izmantots par 300 J lielāks lādiņš, kas ir drošs un var būt piemērots arī, ja ĀF ilgst 30–180 dienu [Gallagher, 2001].
Ir pētīta arī augstāka līdzstrāvas stipruma izmantošana EKV laikā pacientiem ar lielāku ķermeņa svaru (ĶMI 48 ± 4,1 kg/m2) un rezistenci pret standarta EKV elektrisko impulsu lielumu. Tika pierādīts, ka 720 J liela impulsu terapija var būt droša un efektīva ĀF gadījumā, jo tā stabilizē sirds ritmu 84 % gadījumu [Roy, 2000; Camm, 2010].
Neatliekama EKV tiek rekomendēta ĀF gadījumā, kad saglabājas ātra kambaru frekvence, kas nereaģē uz farmakoloģisko terapiju, un parādās miokarda išēmijas pazīmes, simptomātiska hipotensija, stenokardija vai sirds mazspēja. Tāpat EKV jāveic paroksismālas ĀF gadījumā, kas ilgst ne mazāk kā 48 stundas. Ja tomēr šis laiks ir pārsniegts un pacientam nav bijis regulāras un adekvātas antikoagulantu terapijas, pirms EKV nepieciešama vismaz trīs nedēļu ilga terapija ar antikoagulantiem. EKV tiek definēta kā veiksmīga, ja EKG dokumentē vismaz divus P viļņus pēc elektriskā lādiņa [Lombardi, 2001].
Lai arī EKV ir efektīva ritma konversijas iespēja, pēc tās pacients nav pasargāts no ĀF recidīviem, kas tiek iedalīti trīs grupās: tūlītēji recidīvi pirmajās minūtēs pēc EKV, agrīni recidīvi pirmo piecu dienu laikā un vēlīni recidīvi, kas rodas pēc piecām dienām [Lombardi, 2001; Camm, 2010]. Ilgstošai sirds ritma uzturēšanai tiek lietoti AAL, lai atvieglotu ĀF simptomus un novērstu recidīvus. Tie nepieciešami, ja ir bieži (> 4 reizes gadā) recidīvi vai novēro sākotnēji klīnisko nestabilitāti, ir jāizvērtē proantiaritmiskais risks, blaknes un kontrindikācijas [Lafuente-Lafuente, 2006; Lip, 2013].
Četrdesmit četros randomizētos pētījumos ir pierādīts, ka ĀF recidīvu biežumu, salīdzinot ar kontroles grupu, ievērojami samazina nātriju kanālu ātrie blokatori (dizopiramīds, kvinidīns), lēnie blokatori (flekainīds, propafenons), dotefilīns, kālija kanālu blokatori (sotalols) vai miksētie jonu kanālu blokatori ar antisimpātisko efektu [Camm, 2010].
BAB lietošana pēc SR atjaunošanas mēreni novērš ĀF recidīvus, tos lieto pat līdz 71,2 % paroksismālas ĀF gadījumu, labāk – tireotoksikozes un fiziskas slodzes izraisītas ĀF gadījumā [Lip, 2013]. Plašā randomizētā pētījumā 394 pacientiem, kas lietoja metoprololu, recidīvus konstatēja 47,7 % gadījumu, salīdzinot ar 59,9 % gadījumu kontroles grupā (p = 0,005) [Camm, 2010; Rienstra, 2012]. Persistējošas ĀF recidīvu gadījumos tika savstarpēji salīdzināta arī bisoprolola un karvedilola efektivitāte. Tika iegūti dati, ka karvedilola grupā ir par 14 % mazāks recidīvu risks viena gada laikā (n = 17; 32 %) nekā bisoprolola grupā (bez statistiskas ticamības: n = 23; 46 %, p = 0,468) [Reimold, 1993]. KKB salīdzinoši tiek lietoti retāk – aptuveni 1,1 % gadījumu pēc EKV [Chiang, 2013].
Propafenons samazina ĀF biežumu, un tam piemīt vājš BAB efekts. To nedrīkst lietot pacienti ar KSS vai samazinātu EF. Sinusa ritma kontrolei to izmanto 0,3–7,3 % gadījumu [Camm, 2010]. Pētījumos ar propafenonu (n = 50) 3, 6 un 12 mēnešu laikā pēc kardioversijas SR bez recidīviem uztur attiecīgi 46 ± 8 %, 41 ± 8 % un 30 ± 8 % pacientu [Reimold, 1998].
Amiodarons ĀF recidīvu skaitu samazina efektīvāk nekā sotalols vai propafenons. Tas ir izvēles medikaments, un to lieto 4 % gadījumu, ja ir permanenta ĀF, līdz pat 23,4 % gadījumu, ja ir paroksismāla ĀF, pārsvarā izvēloties ritma kontrolei biežas, simptomātiskas ĀF gadījumā, neņemot vērā citu AAL lietošanas fonu [Lip, 2013]. To var lietot strukturālas sirds slimības gadījumā, kaut gan ir dati, ka gandrīz 50 % gadījumu to nepareizi paraksta kā pirmās izvēles AAL cilvēkiem bez sirds mazspējas vai hipertensijas un ievērojamas kreisā kambara hipertrofijas [Jirgensons, Kalējs, 2010; Camm, 2010].
Ir konstatēts, ka, lietojot amiodaronu (200 mg 3 reizes dienā) un papildus tam arī enalaprilu (10 mg 2 reizes dienā) četras nedēļas pirms EKV līdz tam laikam, kad pirmo reizi novēro ĀF recidīvu pēc EKV, tūlītēju un agrīnu recidīvu biežums ir retāks (4,3 % (n = 70) vs. 14,7 % (n = 75), p = 0,067)), bet Kaplana–Meijera analīzē parādās iespējamā SR noturība četru nedēļu laikā (84,3 % vs. 61,3 %, p = 0,002) [Ueng, 2003; Chiang, 2013].
Sotalols, salīdzinot ar amiodaronu, mazāk efektīvi novērš ĀF recidīvus, tomēr rezultāti ir labāki nekā pacientiem, kas nelieto AAL (p < 0,010). Sotalols veicina proaritmijas stāvokļa rašanos, jo tas pagarina QT intervālu [McNamara, 2003; Singh, 2005]. Pētījumos pierādīts, ka, salīdzinot ar propafenonu, sotalola efektivitāte ir līdzīga (n = 50) – 49 ± 7 %, 46 ± 8 % un 37 ± 8 % pacientu 3, 6 un 12 mēnešu laikā nav konstatēti recidīvi [Van Gelder, 2002].
Plašā pētījumā, kur tika iesaistīti 403 pacienti, tika analizēts ĀF recidīvu biežums 201 cilvēka lielā grupā, kas lietoja amiodaronu mazās devās, un 202 cilvēku lielā grupā, kas lietoja vai nu sotalolu (n = 101), vai propafenonu (n = 101). Pēc 16 mēnešu ilgas kontroles 71 pacientam (35 %) amiodarona lietošanas grupā un 127 pacientiem (63 %) grupā, kas lietoja vai nu propafenonu, vai sotalolu, tika dokumentēti ĀF recidīvi [Roy, 2000; Connolly, 1999].
Ir pētīta arī atorvastatīna iespējamā ietekme uz ĀF recidīvu trīs mēnešu ilgā kontroles laikā pēc EKV: 48 pacienti ar 48 stundu ilgu ĀF tika iedalīti divās grupās – viena pēc EKV saņēma atorvastatīnu, bet otra to nesaņēma. Iznākumā ĀF recidīvi tika dokumentēti 18 pacientiem pirmajā grupā (12,5 %) un 11 pacientiem otrajā grupā (45,8 %) (p = 0,01). Tika konstatēts, ka atorvastatīns nozīmīgi samazina ĀF attīstību pēc EKV [Ozaydin, 2006].
Kaut gan riska faktoru korekcijai ir nozīmīga proaritmiska loma AH vai HSM gadījumā un tiek veikta adekvāta AAL terapija, ĀF recidīvi tomēr var būt un tos nav iespējams paredzēt vai pilnīgi novērst [Lombardi, 2001].
Faktori, kas ietekmē sinusa ritmu pēc elektriskās kardioversijas. ĀF recidīvi pēc elektriskās kardioversijas notiek bieži, un AAL terapija to iespaido tikai daļēji. Ir dokumentēts, ka ĀF recidīvi 40–60 % SR atjaunošanas gadījumu notiek arī tad, ja turpmāk tiek veikta adekvāta AAL terapija. Vidējais recidīvu biežums hroniskas un persistējošas ĀF gadījumā ir 30–60 %, kas var būt ap 27 % divu nedēļu laikā un līdz pat 38 % sešu mēnešu laikā [Lombardi, 2001].
Nozīmīga problēma, kas saistīta ar ĀF iespējamo vēlīno recidīvu dokumentāciju, nosakot sinusa ritma uzturēšanas efektivitāti, ir ĀF asimptomātiskā daba. Ir pierādīta nozīmīgi ticama ĀF recidīvu biežuma atšķirība starp pacientiem, kam ir implantētas monitorēšanas ierīces, un pacientiem, kam ĀF dokumentēta ar ārējām EKG ierīcēm un kas saņem optimizētu antiaritmisko līdzekļu terapiju. Pētījumā, kurā tika iesaistīti 210 pacienti, 19 ± 11 mēnešu laikā tika veiktas 678 kontroles vizītes, kurās 51 pacientam (46 %) EKG pierakstā un 97 pacientiem (88 %) ar implantētām ierīcēm EKG atmiņā tika dokumentēta ĀF (p < 0,001), no kurām 19 (38 %) bija pilnīgi asimptomātiskas. Tas ļāva secināt, ka ĀF recidīvu incidence ir augsta arī tad, ja tiek optimizēta antiaritmisko līdzekļu terapija [Camm, 2012].
Pēc pasaules literatūras izpētes jāsecina, ka lielākā daļa ĀF riska faktoru ir pierādīti arī kā ĀF recidīvu riska faktori pēc ritma atjaunošanas. Nozīmīgi neatkarīgie faktori, kas veicina ĀF recidīvus pēc EKV, ir pacienta vecums, ilgstoša ĀF epizode un bieži ĀF recidīvi pirms EKV, palielināts kreisā ātrija lielums vai samazināta kreisā kambara funkcija, KSS, kā arī mitrālā vārstuļa vai plaušu slimības, ātrāka SDF, ātriju vadītspējas izmaiņas un ektopiski ātriju ritmi [Cannon, 2008; Camm, 2010; Jirgensons, Kalējs, 2010]. Dažādi ir pētījumu rezultāti, kuros analizēta SR stabilitāte pēc tā atjaunošanas.
Pēc jebkura veida ritma kardioversijas gada laikā kā neatkarīgi SR prognozes faktori paroksismālas ĀF gadījumā ir īsāks kopējais ĀF ilgums, Ic klases AAL vai amiodarona turpmāka lietošana, ja nav HOPS (p = 0,003), mazāks vecums (p = 0,004) un mazāks kreisais ātrijs (p = 0,005) [De Vos, 2010; Pisters, 2012].
Pacientiem ar palielinātu kreiso ātriju (> 45 mm) un hronisku, simptomātisku ĀF Ia un Ic klases AAL vai amiodarona lietošana sešu mēnešu laikā SR stabilitāti pierādīja 81 % gadījumu, 12 mēnešu laikā – 79 % gadījumu un 24 mēnešu laikā – 60 % gadījumu. Retāki recidīvi bijuši, ja hroniska ĀF ilgusi mazāk par 1 gadu, LA diametrs bijis ≤ 60 mm (p < 0,05), kā arī tad, ja nav bijušas mitrālā vārstuļa slimības. Vecums, kreisā kambara funkcija un KSS esamība nebija saistīta ar iznākumu [Brodsky, 2013].
Paroksismālas ĀF gadījumā bez kreisā kambara disfunkcijas kā nozīmīgi ĀF recidīva riska faktori 124 pacientu lielā grupā tika pierādīti arī KSS (RR 1,9; 95 % TI 0,9–3,9), neparoksismāla ĀF (RR 2,3; 95 % TI 1,1–5,0), sieviešu dzimums (RR 2,3; 95 % TI 1,1–4,6), plaušu slimības (RR 3,9; 95 % TI 1,9–7,6) un valvulāra sirds slimība (RR 4,1; 95 % TI 2,2–8,8). Kā neatkarīgi ĀF recidīvu prognozējošie faktori tika pierādīti KSS (OR 2,5; 95 % TI 1,1–8,2) un sieviešu dzimums (RR 3,4; 95 % TI 1,3–8,9) [Suttorp, 1993].
Lielāks ĀF recidīvu risks ir pacientiem ar ĶMI 25–30 kg/m2 (RR 0,07; 95 % TI 0,008–0,59), ĶMI > 30 kg/m2 (RR 0,24; 95 % TI 0,08–0,72), cukura diabētu (RR 0,34; 95 % TI 0,12–0,98), ja ĀF ilgst vairāk nekā 3 mēnešus (RR 0,28; 95 % TI 0,09–0,83) un kreisā ātrija diametrs ir lielāks par 45 mm (RR 0,23; 95 % TI 0,07–0,74) [Ozaydin, 2006].
Pētot agrīnu recidīvu (12–15 dienu laikā pēc EKV) riska faktorus, kā neatkarīgi riska faktori netika pierādīti: LA diametrs, vecums, dzimums, AH, CD, ĀF ilgums, EF, iepriekš veikta EKV (p > 0,05). Kā neatkarīgs riska faktors agrīniem recidīviem tika pierādīta sirds frekvences variabilitāte (ja zema frekvence pret augstu frekvenci ir vairāk nekā divās situācijās, rekurentas ĀF risks ir 97 % (OR 1,97; 95 % TI 1,33–2,94) [Lombardi, 2001].
Augsti jutīgā CRO līmenis pētīts arī nevalvulāras persistējošas ĀF gadījumā pirms EKV un vienu gadu pēc tās, lai noteiktu tā korelāciju ar ĀF recidīviem. Tika konstatēts, ka pacientiem, kuriem CRO < 1,9 mg/l, bija ievērojamāki retāki ĀF recidīvi (4 % vs. 33 % pēc trim mēnešiem, salīdzinot ar augstāku CRO līmeni (p = 0,007), un 28 % pret 60 % pēc viena gada (p = 0,010)) [Loricchio, 2007].
Citos literatūras avotos kā iespējamais ĀF recidīva riska faktors minēts arī obstruktīvas miega apnojas sindroms, kura gadījumā ir intermitējoša organisma hipoksija un paaugstināta simpātiskās nervu sistēmas aktivitāte. Pierādīts, ka gada laikā 27 pacientiem bez miega apnojas adekvātas terapijas ĀF recidīvu biežums bija 82 % vs. 42 % pacientu grupā, kas saņēma miega apnojas sindromam adekvātu terapiju (p = 0,0013) [Kanagala, 2003].
Randomizētā pētījumā Radiofrequency Ablation vs Antiarrhythmic Drugs as First-line Treatment of Symptomatic Atrial Fibrillation viena gada kontroles laikā tika salīdzināti terapijas rezultāti 35 pacientiem, kas saņēma antiaritmiskos līdzekļus, un 32 pacientiem pēc RFKA. ĀF recidīvi bija biežāki medikamentozas kardioversijas gadījumā, salīdzinot ar RFKA grupu (63 % (n = 22) vs. 19 % (n = 4); p < 0,001). Arī biežāka hospitalizācija bija dokumentēta medikamentozas kardioversijas pacientu grupā (54 % (n = 19) vs. 9 % (n = 3), p < 0,001) [Wann, 2011]. Recidīvu riska faktori jāvērtē arī pēc RFKA, lai spriestu par AAL nepieciešamību un izmaiņām terapijā. Kā viens no atkārtotas ĀF riska faktoriem pēc RFKA ir palielināts kreisā kambara miokarda ekstracelulārais tilpums, kas stingri korelē ar miokarda fibrozi un kas, palielinoties par 10 %, palielina rekurentas ĀF risku par 29 % [Pisters, 2012].
Pēc PV RFKA par recidīvu iespējamību var prognostiski spriest arī pēc HATCH skalas: arteriālā hipertensija (1 punkts), par 75 gadiem lielāks vecums (1 punkts), insults / TIL (2 punkti), HOPS (1 punkts), sirds mazspēja (2 punkti). Izpētīts, ka pacientiem, kuriem pēc HATCH skalas ir vairāk nekā 2 punkti, bija izteikti lielāks kreisā ātrija izmērs, ESD, EDD un mazāka kreisā kambara izsviedes frakcija, salīdzinot ar pārējām HATCH kategorijām. Pēc kontroles laikposma (474 ± 330 dienas) rekurentas ĀF biežums bija attiecīgi 36,4 %, 38,7 % un 34,3 % HATCH 0, 1, > 2 grupā (p = 0,707).
Datu analīze pierādīja, ka neparoksismāla (persistējoša) ĀF, kreisā ātrija izmērs un ĶMI ir nozīmīgi ĀF recidīva riska faktori. Kā vienīgais neatkarīgais ĀF recidīva riska faktors tika pierādīta iepriekš neparoksismāla ĀF (HR = 1,4; 95 % TI 1,0–1,99; p = 0,031) [De Vos, 2010].
Materiāls un metodes
Pētījums ir klasificēts kā gadījumu-kontroles retrospektīvs, prospektīvs pētījums. Tajā apkopoti Paula Stradiņa Klīniskās universitātes slimnīcas Latvijas Kardioloģijas centra 11. – aritmoloģijas – nodaļā ārstēto pacientu, kam ātriju fibrilācijas gadījumā sinusa ritms atjaunots ar elektrisko impulsu terapiju, medicīnisko karšu dati un kontroles tālruņa zvanu (pēc viena, trim un sešiem mēnešiem) laikā iegūtā informācija.
Pētījumā iekļauti abu dzimumu jebkura vecuma 485 pacienti ar ātriju fibrilāciju, kuriem veiktas elektriskās kardioversijas un kuri izrakstīti no slimnīcas 2013. gada laikā. Apkopota un analizēta pacientu slimības un dzīves anamnēze, asinsaina, bioķīmisko analīžu, ehokardiogrāfisko parametru, elektrokardiogrāfisko datu, ārstēšanas taktikas, elektriskās kardioversijas norise un iznākums stacionārā, kā arī pa tālruni veikto aptauju laikā iegūtā informācija.
Dati statistiski apstrādāti, izmantojot IBM SPSS Statistics 17.0 programmu. Ticamības intervāli relatīvajiem biežumiem aprēķināti ar Confidence Interval Calculator for proportions. Par statistiski ticamu uzskatāms rezultāts, ja p vērtība < 0,05. Parametri atainoti kā vidējās vērtības, to standartnovirze, mediāna, absolūtais biežums un relatīvais biežums – procentos.
Kvantitatīvo datu atbilstība normālam iedalījumam abās grupās pārbaudīta ar Kolmogorova– Smirnova testu, savukārt izlašu dispersijas pārbaudītas ar Lēvena testu. Attiecīgi dati analizēti, izmantojot Stjūdenta testu normāla iedalījuma gadījumā un Manna–Vitnija testu asimetriska iedalījuma gadījumā (kaut vienā no grupām). Kvalitatīvo datu atšķirības grupā bez recidīviem un grupā ar recidīviem meklētas, izmantojot hī kvadrāta (χ2) testu un Fišera precīzo testu (ja sagaidāmo gadījumu skaits n < 5 kādā no ailītēm tabulā).
Parametriem, kas pierādīti kā statistiski ticami atšķirīgi abās grupās, pētīta savstarpējā saistība korelācijas analīzē – Pīrsona korelācija un loģistiskās regresijas analīzē.
Pētnieciskā darba veikšana iepriekš tika saskaņota ar Rīgas Stradiņa universitātes Ētikas komiteju un saņemta atļauja veikt pētījumu.
Rezultāti
Pētījumā tika apkopota informācija par 485 ar ātriju fibrilāciju sirgstošiem pacientiem, kam SR atjaunošanai lietota elektrisko impulsu terapija Paula Stradiņa Klīniskās universitātes slimnīcas Latvijas Kardioloģijas centra 11. nodaļā. No tiem 256 pacienti ir prospektīvi, bet 229 – retrospektīvi.
Kopumā kontroles zvani veikti 227 pacientiem – 44,1 % (n = 100) sieviešu un 55,9 % (n = 127) vīriešu. Pēc trīs mēnešiem kontroles zvanu saņēma 84 % (n = 192) pacientu, bet pēc sešiem mēnešiem – 65,6 % (n = 149) pacientu, ar kuriem sazinājās viena mēneša laikā. Ar 29 slimniekiem, kas parakstījuši piekrišanu kontrolei pa tālruni, sazināties neizdevās, zvanot trīs dažādās dienās vismaz divas reizes, kā arī nepareizu vai slēgtu tālruņa numuru dēļ. Sešu mēnešu kontroles periodā konstatēts viens nāves un divi cerebrāla insulta gadījumi. Kopējais recidīvu skaits, neizšķirot kontroles laiku (1 / 3 / 6 mēneši), bija 32,6 % (n = 74) (sk. 1. tab.).
1. tabula. Kontroles tālruņa zvanu laikā no pacientiem gūtā informācija par ātriju fibrilācijas (ĀF) recidīviem / Data from telephone control and questionary from pacients about atrial fibrillation relapses
| Pēc viena mēneša | Pēc trīs mēnešiem | Pēc sešiem mēnešiem | |||||
|---|---|---|---|---|---|---|---|
| n = 227 | 95 % TI | n = 192 | 95 % TI | n = 149 | 95 % TI | ||
| Sinusa ritms kontroles dienā, n (%) | Ir | 207 (91,2) | 86,5–94,4 | 172 (89,6) | 84,1–93,4 | 108 (83,7) | 76,0–89,4 |
| Nav | 20 (8,8) | 5,6–13,5 | 20 (10,4) | 6,6–15,8 | 21 (16,3) | 10,6–24,0 | |
| ĀF recidīvi (kopā 32,6 %), n (%) | Ir | 48 (21,1) | 16,1–27,2 | 48 (25,0) | 19,2–31,9 | 55 (36,9) | 29,3–45,2 |
| Nav | 178 (78,8) | 72,4–83,5 | 144 (63,4) | 68,2–80,8 | 94 (63,1) | 54,8–70,7 | |
| Hospitalizēto pacientu skaits (recidīvu dēļ), n (%) | 30 (62,5 %) | 33 (68 %) | 35 (63,6 %) | ||||
| Recidīvu skaits vienam pacientam, n (%) | 0 | 178 (78,8) | 72,4–83,5 | 144 (74,6) | 68,2–80,8 | 94 (63,1) | 54,8–70,7 |
| 1 | 44 (19,5) | 14,6–25,2 | 37 (19,27) | 14,1–25,7 | 30 (20,1) | 14,2–27,6 | |
| 2–3 | 2 (0,9) | 0,2–3,5 | 10 (5,20) | 2,7–9,6 | 14 (9,4) | 5,4–15,5 | |
| ≥ 4 | 1 (0,4) | 0,02–2,8 | 1 (0,52) | 0,03–3,3 | 3 (2,32) | 0,5–6,2 | |
| Pastāvīga ĀF | 1 (0,4) | 0,02–2,8 | 1 (0,5) | 0,03–3,3 | 8 (5,4) | 2,5–10,7 | |
n = pacientu skaits.
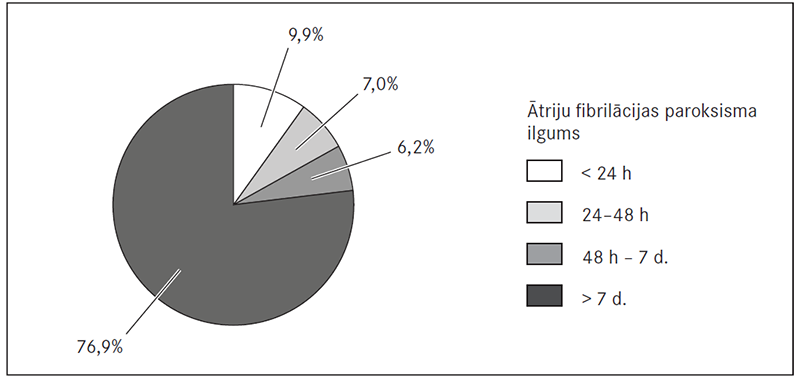
Nonākot slimnīcā, ĀF epizodes ilgums bija: mazāk nekā 24 h – 9,9 % (n = 48) pacientu, 24–48 h – 7,0 % (n = 34), ilgāk par 48 h līdz 7 dienām – 6,2 % (n = 30), bet vairāk kā 7 dienas ilga – 76,9 % (n = 373) pacientu (sk. 1. att.). Slimnīcā ar Neatliekamās medicīniskās palīdzības dienestu nokļuvuši 14,8 % (n = 72) pacientu, ar ārsta nosūtījumu – 84,1 % (n = 408), bet tikai 1,0 % (n = 5) pacientu aritmijas dēļ ieradušies paši.
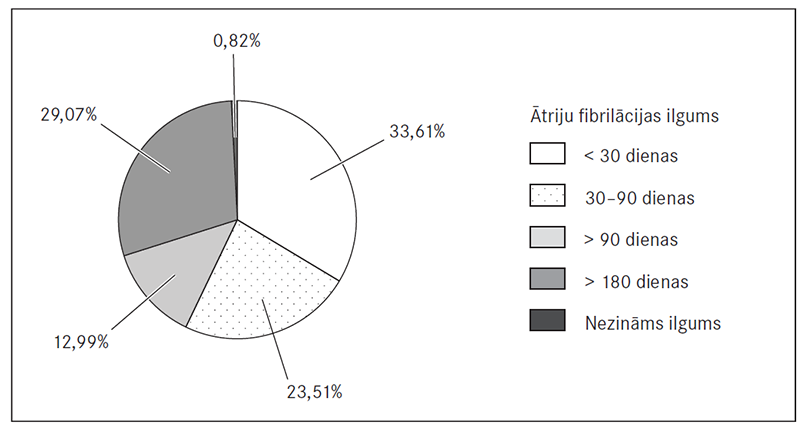
ĀF ilgums līdz 30 dienām bijis 33,61 % (n = 163) pacientu, 30–90 dienas – 23,51 % (n = 114), vairāk par 90 dienām – 12,99 % (n = 63), bet vairāk par 180 dienām – 29,7 % (n = 141) pacientu (sk. 2. att.).
Slimnīcā ĀF kā galvenā iemesla dēļ nonākuši 452 (93,2 %) pacienti, bet 33 (6,8 %) pacienti – citu iemeslu dēļ; 447 (97,7 %) pacienti nokļuvuši slimnīcā darba dienās, bet tikai 11 (2,3 %) – brīvdienās.
1. attēls. Ātriju fibrilācijas paroksisma ilgums pirms elektriskās kardioversijas / Duration of paroxism of atrial fibrillation before electrical cardioversion
2. attēls. Ātriju fibrilācijas ilgums pirms elektriskās kardioversijas / Duration of atrial fibrillation before electrical cardioversion
Apkopotie anamnēzes dati liecina: 62,3 % (n = 302) pacientu iepriekš veikta vismaz viena farmakoloģiska kardioversija, bet 13,0 % (n = 63) to noliedz, par 0,6 % (n = 3) pacientu nav datu. Agrāk EKV veikta 42,3 % (n = 205) pacientu. Kopumā 24,1 % (n = 117) pacientu dokumentētu iepriekšējo epizožu nav bijis. Sinusa ritms iepriekš atjaunots ar EKV 43,2 % (n = 98) prospektīvo pacientu, no kuriem kontroles laikā 32,6 % (n = 32) pacientu dokumentēti ĀF recidīvi (p = 0,550).
Pirms EKV stacionārā lietoto medikamentu biežums: BAB – 90,1 % (n = 437), amiodarons – 69,5 % (n = 337); ACE vai ARB – 67,4 % (n = 327); Ic grupas AAL – 4,7 % (n = 23). Pēc EKV lietotie medikamenti: BAB – 92,0 % (n = 446), amiodarons – 68,7 % (n = 333), ACE vai ARB – 70,5 % (n = 342); Ic grupas AAL – 5,2 % (n = 25).
Pētījumā iekļauto pacientu pieejamo ehokardiogrāfijas datu vidējās vērtības: EDD (n = 145) 53,4 ± 6,5 mm (SD); ESD (n = 134) 37,5 ± 7,4 mm; EF (n = 247) 55,31 ± 9,9 %; LA (n = 197) 45,0 ± 7,0 mm; LAVI (n = 134) 38,1 ± 10,4 ml/m2; KK starpsiena (n = 128) 11,4 ± 2,2 mm; KK mugurējā siena (n = 117) 11,0 ± 1,8 mm; LKSS (n = 38) 65,0 ± 37,0 mm Hg.
Apkopotie dati par slimnieku blakusslimībām un anamnēzi: arteriālā hipertensija – 403 pacientiem (83,1 %); 44 smēķētāji (9,1 %); cukura diabēts – 61 pacientam (12,6 %); HSM – 323 pacientiem (66,6 %); sirds operācijas iepriekš veiktas 18 pacientiem (3,7 %); metabolā sindroma diagnozei vismaz trīs kritēriji atbilst 78 pacientiem (16,1 %); miokarda infarkts anamnēzē – 59 pacientiem (12,2 %); perkutāna koronāra intervence iepriekš veikta 74 pacientiem (15,3 %); anamnēzē insults bijis 27 pacientiem (5,6 %); elektrokardiostimulatori – 39 pacientiem (8,0 %); HNS bijusi 58 pacientiem (12,0 %), no kuriem 33 pacientiem (6,8 %) nav datu par HNS; HKMP diagnoze – 10 pacientiem (2,1 %); RFKA iepriekš veikta 19 pacientiem (3,9 %).
Lai atjaunotu SR, elektriskās kardioversijas laikā lietota 199,57 ± 52,04 J liela līdzstrāvas enerģija (minim. 70 J; maks. 360 J); izlāžu skaits 1,2 ± 0,6 reizes EKV laikā. SR atjaunots: 404 (83,3 %) gadījumos – ar vienu izlādi, 47 (9,7 %) gadījumos – ar divām izlādēm, 22 (4,5 %) gadījumos – ar 3 izlādēm, 4 gadījumos – ar 6 (1,2 %) izlādēm. Iznākumā 472 (97,8 %) pacientiem EKV beidz ar SR; 407 (83,9 %) gadījumos efektu iegūst ar pirmo, bet 72 (14,8 %) gadījumos ir nepieciešama atkārtota izlāde.
Medikamentu rekomendācijas pēc EKV: ACEI – 304 (62,7 %), statīni – 255 (52,6 %), aldosterona antagonisti – 52 (10,7 %), metabolie medikamenti – 7 (1,4 %), etacizīns – 43 (8,9 %), propafenons – 37 (7,6 %), amiodarons – 301 (62,1 %), omega-3 taukskābes – 4 (0,8 %), apiksabāns – 7 (1,4 %), varfarīns – 252 (52,0 %), dabigatrāns – 161 (33,2 %), rivaroksabāns – 24 (4,9 %), BAB – 440 (90,7 %), ARB – 45 (9,3 %), sotalols – 22 (4,5 %), KKB – 90 (18,6 %) pacientiem.
Prospektīvo pacientu grupā (n = 227) viena mēneša kontroles laikā amiodaronu lietojuši 58,1 % (n = 132), ACEI – 58,1 % (n = 132), ARB – 9,7 % (n = 19), BAB – 86,8 % (n = 197), KKB – 19,8 % (n = 45) pacientu. Attiecīgi trīs mēnešu kontroles laikposmā (n = 192) amiodaronu lietojuši 24,5 % (n = 47), ACEI – 57,3 % (n = 110), ARB – 8,9 % (n = 17), BAB – 84,4 % (n = 162), KKB – 20,8 % (n = 40). Sešu mēnešu kontroles laikā (n = 149) amiodaronu lietojuši 22,15 % (n = 33), ACEI – 55,0 % (n = 82), ARB – 7,4 % (n = 12), BAB – 81,9 % (n = 122), KKB – 16,9 % (n = 31) pacientu. Lietoto medikamentu biežums pacientu grupā bez recidīviem un grupā ar recidīviem ir atainots 2. un 3. tabulā.
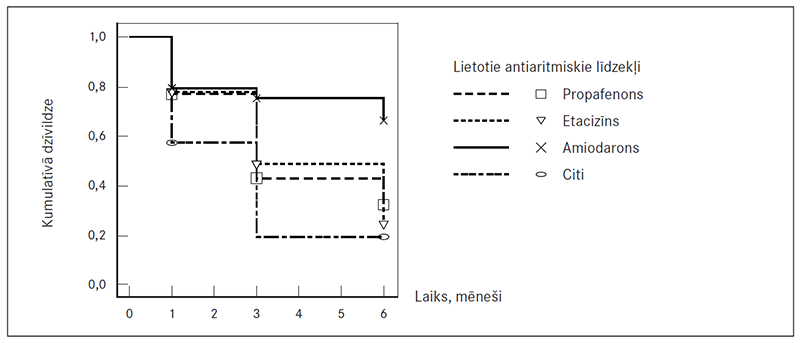
Iedalot pacientus grupā ar recidīviem un grupā bez recidīviem atkarībā no lietotajiem AAL, statistiski ticami retāk recidīvu bija amiodarona lietotāju grupā, tā apliecinot amiodarona pārākumu pār etacizīnu un propafenonu (p = 0,002) (2. tab.). Sešu mēnešu laikā propafenona lietošanas gadījumā recidīvus novēroja 63,6 % pacientu (95 % TI 31,62–87,6); lietojot etacizīnu, – 83,3 % (95 % TI 36,5–99,1); savukārt amiodarona grupā tos novēroja visretāk, t. i., 33,3 % (95 % TI 18,5–51,8) (sk. 3. tab.), kā arī kopumā, neizšķirot kontroles laiku, amiodarona grupā recidīvi bija 29,9 % (95 % TI 22,9–38,9) pacientu.
Kaplana–Meiera SR saglabāšanas analīzē statistiski ticami labāki rezultāti konstatēti amiodarona lietošanas grupās viena mēneša laikā (95 % TI, p = 0,027), vēlākā laikposmā statistiski ticamas AAL efektivitātes atšķirības netika novērotas, jo šajā analīzē netika iekļauti pacienti, kas nebija lietojuši nevienu AAL. Beigu punkta atzīme ir ĀF recidīvs vai medikamenta lietošanas pārtraukšana ar attiecīgo notikumu – ir / nav recidīvs. BAB un KKB netika uzskatīti par AAL.
Sotalola grupā statistiski ticamas atšķirības recidīvu biežumā netika pierādītas: AAL lietotājiem atkārtotas ĀF epizodes kontroles laikā bijušas relatīvi vairāk (33,3 %; n = 3; 95 % TI 9,0–69,1), salīdzinot ar grupu, kurā lietoja citu AAL vai nelietoja nevienu AAL (32,3 %; n = 68; 95 % TI 26,1–39,1) (p = 0,600).
2. tabula. Antiaritmisko līdzekļu efektivitātes izvērtējums, salīdzinot grupas, kurās pacienti lieto dažādus antiaritmiskos līdzekļus vai tos nelieto vispār / Effectiveness of antiarrhythmic drugs and comparison between groups with and without antiarrhythmics
| Antiaritmiskais līdzeklis | Recidīvi viena mēneša laikā | Recidīvi trīs mēnešu laikā | Recidīvi sešu mēnešu laikā | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ir | Nav | R % | p | Ir | Nav | R % | p | Ir | Nav | R % | p | |
| Nelieto AAL | 8 | 52 | 13,3 | ― | 18 | 97 | 15,6 | ― | 29 | 66 | 38,6 | ― |
| Propafenons | 4 | 7 | 36,3 | 0,128 | 4 | 8 | 33,3 | 0,001 | 7 | 4 | 63,6 | 0,041 |
| Cits AAL | 36 | 119 | 23,2 | 26 | 39 | 25,0 | 19 | 24 | 44,1 | |||
| Etacizīns | 4 | 12 | 25,0 | 0,216 | 6 | 5 | 54,5 | < 0,001 | 5 | 1 | 83,3 | 0,017 |
| Cits AAL | 36 | 114 | 24,0 | 24 | 42 | 36,4 | 21 | 27 | 43,7 | |||
| Amiodarons | 28 | 104 | 21,2 | 0,044 | 15 | 32 | 31,9 | 0,001 | 11 | 22 | 33,3 | 0,002 |
| Cits AAL | 12 | 22 | 33,3 | 15 | 15 | 50,0 | 15 | 6 | 71,4 | |||
AAL – antiaritmiskais līdzeklis; R % – recidīvu relatīvais biežums antiaritmiskā līdzekļa lietošanas grupā attiecīgajā kontroles laikposmā; p – statistiski ticama atšķirība, ja < 0,05.
Pacientu grupā, kas lietoja BAB līdzekļus, ĀF recidīvi bija retāki, neprecizējot kontroles laiku bez statistiskas ticamības: lietotāju grupā (n = 66) recidīvi bija 32,2 % (95 % TI 25,9–39,1) pacientu, salīdzinot ar grupu, kur BAB netika lietoti (n = 139), – 34,3 % (95 % TI 13,0–61,3) pacientu (p = 1,000). Visretāk ĀF recidīvi tika konstatēti grupā, kas lietoja nebivololu (n = 44), – 6,8 % lietotāju, un šis rādītājs nesasniedza statistisko ticamību (p = 0,640), sk. 3. att.
3. tabula. Dažādu medikamentu lietošanas biežums grupā ar recidīviem un grupā bez recidīviem viena, trīs un sešu mēnešu kontroles laikposmā / Different medication in groups with and without relapses of atrial fibrillation in one, three and six month period
| Lietotie medikamenti | Viena mēneša laikā | Trīs mēnešu laikā | Sešu mēnešu laikā | ||||
|---|---|---|---|---|---|---|---|
| Grupa ar recidīviem, n (%) | Grupa bez recidīviem, n (%) | Grupa ar recidīviem, n (%) | Grupa bez recidīviem, n (%) | Grupa ar recidīviem, n (%) | Grupa bez recidīviem, n (%) | ||
| AAL | Nelieto | 52 (29,2) | 8 (16,7) | 97 (67,4) | 18 (37,5) | 66 (70,2) | 29 (52,7) |
| Propafenons | 7 (3,9) | 4 (8,3) | 8 (5,6) | 4 (8,3) | 4 (4,3) | 7 (12,7) | |
| Etacizīns | 12 (6,7) | 4 (8,3) | 5 (3,5) | 6 (12,5) | 1 (1,1) | 5 (9,1) | |
| Amiodarons | 104 (58,4) | 28 (58,3) | 32 (22,2) | 15 (31,3) | 22 (23,4) | 11 (20,0) | |
| Cits | 3 (1,7) | 4 (8,3) | 2 (1,4) | 5 (10,4) | 1 (1,1) | 3 (5,5) | |
| ACE vai ARB | ACE | 109 (61,2) | 23 (47,9) | 86 (59,7) | 24 (50) | 53 (56,4) | 29 (52,7) |
| ARB | 15 (8,4) | 4 (8,3) | 13 (9,0) | 4 (8,3) | 9 (9,6) | 3 (5,5) | |
| Nelieto | 54 (30,3) | 21 (43,8) | 45 (31,3) | 20 (41,7) | 32 (34,0) | 23 (41,8) | |
| BAB | Nelieto | 26 (14,6) | 4 (8,3) | 25 (17,4) | 5 (10,4) | 19 (20,2) | 8 (14,5) |
| Metoprolols | 77 (43,3) | 26 (54,2) | 64 (44,4) | 26 (54,2) | 43 (45,7) | 25 (45,5) | |
| Bisoprolols | 68 (38,3) | 13 (27,1) | 50 (34,7) | 13 (27,1) | 28 (29,8) | 18 (32,7) | |
| Nebivolols | 7 (3,9) | 3 (6,3) | 5 (34,7) | 3 (6,3) | 4 (4,3) | 3 (5,5) | |
| Cits | 0 | 2 (4,2) | 0 | 1 (2,1) | 0 | 1 (1,8) | |
| Lipīdus koriģējošie medikamenti | Nelieto | 98 (55,1) | 24 (50) | 75 (52,1) | 24 (51,1) | 53 (56,4) | 28 (50,1) |
| Statīni | 77 (43,3) | 24 (50) | 66 (45,8) | 21 (44,7) | 39 (41,5) | 27 (49,1) | |
| Fibrāti | 2 (1,1) | 0 | 2 (1,4) | 2 (4,3) | 1 (1,1) | 0 | |
| Ezetrols | 1 (0,6) | 0 | 1 (0,7) | 0 | 1 (1,1) | 0 | |
| KKB | Nelieto | 147 (82,6) | 35 (72,9) | 116 (80,6) | 36 (75) | 71 (76,6) | 47 (85,5) |
| Verapamils | 2 (1,1) | 0 | 3 (2,1) | 3 (6,3) | 2 (2,1) | 0 | |
| Amlodipīns | 25 (14) | 12 (25) | 20 (13,9) | 8 (16,7) | 15 (16) | 8 (14,5) | |
| Lacidipīns | 2 (1,1) | 1 (2,1) | 2 (1,4) | 1 (2,1) | 2 (2,1) | 0 | |
| Cits | 2 (1,1) | 0 | 3 (2,1) | 0 | 3 (3,2) | 0 | |
| Aldosterona antagonisti | Lieto | 17 (9,6) | 7 (8,3) | 10 (6,9) | 6 (12,5) | 6 (6,4) | 6 (10,9) |
| Nelieto | 161 (90,4) | 41 (85,4) | 134 (93,1) | 42 (87,5) | 88 (93,6) | 49 (89,1) | |
| Metabolie medikamenti | Lieto | 13 (7,3) | 4 (8,3) | 13 (9,0) | 4 (8,3) | 4 (4,3) | 8 (14,5) |
| Nelieto | 165 (92,7) | 44 (91,7) | 131 (91,0) | 44 (91,7) | 90 (95,7) | 47 (85,5) | |
| CD korekcijas medikamenti | Lieto | 18 (10,1) | 8 (16,7) | 14 (9,7) | 6 (12,5) | 13 (13,8) | 5 (9,1) |
| Nelieto | 160 (89,9) | 40 (83,3) | 130 (90,3) | 42 (87,5) | 81 (86,2) | 50 (90,9) | |
AAL – antiaritmiskais līdzeklis, ACE – angiotensīnu konvertējošie medikamenti, ARB – aldosterona receptoru antagonisti, BAB – beta adrenoblokatori, KKB – kalcija kanālu blokatori, CD – cukura diabēts.
3. attēls. Kaplana–Meiera salīdzinošā sinusa ritma saglabāšanas analīze – izdzīvošanas laiks bez recidīviem – lietoto antiaritmisko līdzekļu grupās / Maintenance of sinus rhythm and different antiarrhythmic drugs
Tika pierādītas statistiski ticamas recidīvu biežuma atšķirības: lietojot statīnus (n = 119), recidīvi bija 26,9 % pacientu (n = 32; 95 % TI 19,4–35,9), bet grupā, kur nelietoja statīnus (n = 101), recidīvi bija 38,6 % pacientu (n = 39; 95 % TI 29,2–48,4) (p = 0,044).
Bez statistiskas ticamības KKB lietotāju grupā recidīvi bija retāk – 26,2 % pacientu (n = 11; 95 % TI 14,4–42,3), salīdzinot ar KKB nelietotāju grupu, kur tie bija 33,7 % (n = 60; 95 % TI 26,9–41,2) (p = 0,463). Amlodipīna lietotāju grupā (n = 23) sešu mēnešu laikā recidīvi bija 34,8 % (n = 8) pacientu, salīdzinoši retāk lietots verapamils (n = 2) un lacidipīns (n = 2).
Angiotensīna aktivitāti samazinošo medikamentu lietotāju grupā statistiski ticama atšķirība netika pierādīta (p = 0,245), tomēr recidīvi retāk bija ACEI lietotājiem – 17,2 % pacientu (n = 23; 95 % TI 11,9–24,8), salīdzinot ar ARB lietotāju grupu – 21 % pacientu (n = 4; 95 % TI 8,5–43,3) – un grupu, kas nelieto nevienu no šiem medikamentiem, – 28,77 % pacientu (n = 21; 95 % TI 19,6–40,0) .
Statistiski ticami retāk recidīvi novēroti aldosterona antagonistu lietotāju grupā – 12,5 % pacientu (n = 3; 95 % TI 3,3–33,5), salīdzinot ar grupu, kur tos nelieto, – 34,7 % pacientu (n = 68; 95 % TI 28,1–41,8) (p = 0,036). Līdzīga situācija ir vērojama arī pacientiem, kas sešu mēnešu laikā lietoja diurētiskos līdzekļus, – recidīvu biežums bija 15,4 % pacientu (n = 4; 95 % TI 5,0–35,7), salīdzinot ar grupu, kur tie netika lietoti, – 41,5 % pacientu (n = 51; 95 % TI 32,8–50,7) (p = 0,014).
Veicot Manna–Vitnija testu, tika pētītas iespējamās kvantitatīvās datu vērtības, kas neatbilst normālam iedalījumam, un atšķirības pacientu grupās, kam ir vai nav bijis ĀF recidīvs viena, trīs vai sešu mēnešu laikā. Pacientu grupā, kam bijis recidīvs viena mēneša laikā, tika noteikts lielāks LA diametrs – 45,2 mm [41,0; 48,0], salīdzinot ar grupu bez recidīviem – 45,0 mm [40,0; 48,0] (n = 112; p = 0,985); LAVI 40,0 [32,0; 45,0] vs. 36,0 [32,0; 42,0] (n = 82; p = 0,318); ķermeņa masas indekss – 29,3 [25,9; 32,9] vs. 29,2 [26,5; 29,4] (n = 170; p = 0,609) un triglicerīdu līmenis – 1,1 [0,85; 1,4] vs. 1,0 [0,7; 1,7] (n = 203; p = 0,997), tomēr statistisku ticamību nesasniedz.
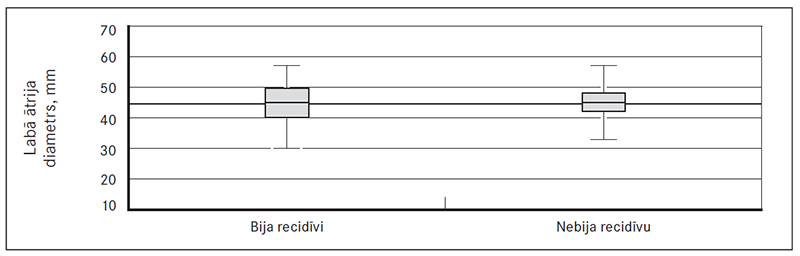
Vēlāku recidīvu grupā trīs un sešu mēnešu laikā atšķirības saglabājas, bet statistiskā ticamība netiek sasniegta. Nozīmīgas statistiskas atšķirības arī netika pierādītas, salīdzinot vērtības starp grupām, kam nav bijis recidīvu un kam ir bijis viens vai divi, trīs vai četri un vairāk recidīvu. Iedalot pacientus grupās pēc LA diametra, biežāki recidīvi konstatēti lielāka LA diametra gadījumā: grupā ar LA diametru, kas lielāks par 50 mm, recidīvi sastopami 47,6 % (n = 10) gadījumu, bet, ja LA diametrs ir mazāks par 50 mm, recidīvi konstatēti 40,6 % (n = 37) gadījumu, tomēr statistiskā ticamība netika sasniegta (p = 0,672) (sk. 4. att.).
Līdzīgi arī Stjūdenta t-testa gadījumā, salīdzinot kvantitatīvos datus, kas atbilst normālam iedalījumam, statistiskā ticamība abās grupās netika pierādīta. Pacientiem, kam kontroles laikā bijuši recidīvi, novēro augstāku holesterīna (p = 0,518) un zema blīvuma lipoproteīnu (p = 0,215) līmeni, kā arī mazāku glomerulu filtrācijas ātrumu (p = 0,095).
Pacienti tika iedalīti grupā ar recidīviem vai grupā bez recidīviem atkarībā arī no ĀF ilguma pirms EKV. Biežāki recidīvi bez statistiskas ticamības viena un trīs mēnešu laikā bijuši grupā, kur ĀF ilgusi vairāk par 180 dienām. Mēneša laikā recidīvi ĀF gadījumā, kas ilgusi mazāk nekā 30 dienas, bija 12,0 % pacientu, 30–90 dienas (n = 63) – 22,0 %, vairāk nekā 90 dienas (n = 23) – 17,0 %, bet vairāk par 180 dienām (n = 77) – 27,0 % pacientu (p = 0,311).
Trīs mēnešu laikā recidīvus novēroja: ja ĀF pirms EKV ilgusi mazāk par 30 dienām (n = 48), – 27,0 % pacientu, 30–90 dienas (n = 58), – 19,0 % pacientu, vairāk par 90 dienām (n = 28), – 14,0 % pacientu, bet vairāk par 180 dienām (n = 68), – 29,0 % pacientu (p = 0,569).
Sešu mēnešu laikā recidīvu skaits neproporcionāli palielinājās: ja ĀF ilgusi mazāk par 30 dienām (n = 40), recidīvus novēroja 42,5 % pacientu, ja 30–90 dienas (n = 45), – 35,6 % pacientu, ja vairāk par 90 dienām (n = 13), – 30,8 % pacientu, un, ja ĀF ilgusi vairāk nekā 180 dienas, – 35,3 % pacientu (p = 0,840) (sk. 5. att.).
4. attēls. Labā ātrija diametra lielums grupā ar recidīviem un grupā bez recidīviem / Diameter of left atrium in patients with and without relapses of atrial fibrillation
5. attēls. Recidīvu absolūtais biežums atkarībā no ātriju fibrilācijas ilguma pirms elektriskās kardioversijas / Rate of relapses and atrial fibrillation duration before cardioversion
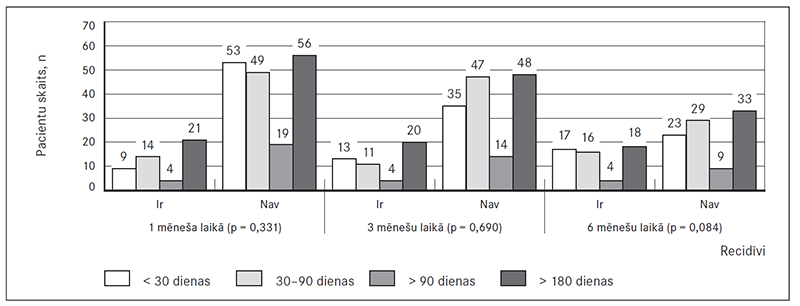
Atsevišķu slimību grupās novēro lielāku recidīvu skaitu, tomēr statistiska ticamība netiek sasniegta: rezultāti atspoguļo tendenci, ka biežāki recidīvi ir vīriešiem (33,1 % vs. 32,0 %, p = 0,887) 45–55 gadu vecumā (40,9 %, p = 0,848), kuriem anamnēzē ir HSM (34,7 % vs. 28,9 %, p = 0,706), hipertrofiskā KMP (50,0 % vs. 32,3 %, p = 0,598), smēķēšana (50,0 % vs. 54,3 %, p = 1,102), miokarda infarkts (33,3 % vs. 32,8 %, p = 1,000), ja ĀF ilgusi 30–90 dienas (36,5 %, p = 0,390). Statistiski ticami biežāki recidīvi ir RFKA pacientu grupā (80,0 % vs. 30,8 %, p = 0,040).
Biežāk ĀF recidīvus novēro, pieaugot vecumam. Statistiski ticama recidīvu biežuma atšķirība grupā bez recidīviem un grupā ar recidīviem novērota trīs mēnešu laikā: 24,7 % (n = 2) > 65 gadu vecumā, 17,6 % (n = 10) > 55–65 gadu vecumā, 55,5 % (n = 13) 45–55 gadu vecumā, 15 % (n = 23) < 45 gadu vecumā (OR 0,648; p = 0,011). Kopumā, taču bez statistiskas ticamības, recidīvi biežāki (40,9 %), neizšķirot kontroles laiku, ir 45–55 gadu vecumā (p = 0,848). Pētot arī hospitalizāciju biežumu recidīvu dēļ vienam pacientam, biežākas hospitalizācijas viena un trīs mēnešu laikā bija 45–55 gadu vecuma grupā (31,8 % šīs grupas pacientu hospitalizēti viena mēneša laikā (p = 0,010), bet 44,4 % – trīs mēnešu laikā (p = 0,033)). Statistiska ticamība recidīvu biežumam sešu mēnešu laikā netika pierādīta (sk. 3. tab.).
Statistiski ticama atšķirība ir recidīvu biežumam hroniskas nieru slimības (HNS) gadījumā (53,2 % (n = 25) pacientiem ar HNS, salīdzinot ar grupu, kurā ir pacienti bez HNS (27 % (n = 48); OR 0,324; p = 0,020)). Tika secināts, ka pacientiem ar HNS ir biežāki recidīvi sešu mēnešu laikā. HNS gadījumā ir statistiski ticama atšķirība arī hospitalizāciju biežumā vienam pacientam recidīvu dēļ viena, trīs un sešu mēnešu laikā. HNS gadījumā 19,1 % (n = 9) pacientu viena mēneša laikā ir stacionēti recidīvu dēļ vienu reizi, bet pacienti bez HNS ir hospitalizēti tikai 11,5 % (n = 18) gadījumu; attiecīgi 9,8 % (n = 17) ir bijusi viena hospitalizācija recidīva dēļ, bet 1,7 % (n = 3) pacientu – divas hospitalizācijas viena mēneša laikā (p = 0,028).
Hospitalizāciju skaits recidīvu dēļ dažādās vecuma grupās. Trīs mēnešu laikā biežāki recidīvi arī bijuši pacientiem HNS gadījumā (23,2 % (n = 10)): 13,9 % (n = 6) HNS slimnieku stacionēti recidīva dēļ vienu reizi un 9,3 % (n = 4) pacientu stacionēti divas reizes, bet bez HNS (16,9 % pacientu) vienu reizi stacionēti 13,4 % (n = 19) pacientu, savukārt divas reizes – 2,8 % (n = 4) pacientu, un trīs reizes – 0,7 % (n = 1) pacientu (p = 0,010). Sešu mēnešu laikā hospitalizāciju skaits recidīvu dēļ HNS gadījumā relatīvi pieaudzis: HNS grupā 41,9 % (n = 13) hospitalizācijas gadījumu ir bijuši recidīvu dēļ: 2,6 % (n = 7) hospitalizēti vienu reizi, 12,9 % (n = 4) – divas reizes, 3,2 % (n = 1) – trīs reizes un 3,2 % (n = 1) – četras reizes; bet bez HNS hospitalizēti 22,2 % (n = 25) pacientu: vienu reizi hospitalizēti 15,1 % (n = 17) pacientu, bet divas reizes – 7,1 % (n = 8) pacientu (p = 0,050).
Izmantojot Pīrsona korelācijas testu, tika meklēta statistiski ticama pazīmju savstarpējā saistība. Rezultātā statistiski ticama, bet vāja saistība recidīviem jebkurā laikā pēc EKV tika pierādīta HNS gadījumā (R = 0,226; p = 0,001).
Loģistiskās regresijas analīzei trūka statistiski ticamu neatkarīgo parametru saistības, tāpēc tika iekļauti parametri, kuri nebija statistiski ticami (p > 0,05), līdz ar to izveidot spēcīgu un statistiski ticamu vairāku neatkarīgo faktoru ĀF recidīvu attīstības riska modeli neizdevās.
Diskusija
Pētījuma rezultātus ietekmēja vairāki faktori: objektīvo datu (EhoKG, GFĀ) trūkums, pacientu, kas saņēma tālruņa kontroles zvanu, skaita iedalījuma nevienmērīgums un zemais recidīvu pierādījuma (simptomātiski vai hospitalizācijas) līmenis. Analizējot datus, pacienti tika iedalīti grupās pēc kontroles laika atkarībā no tā, ir vai nav bijuši recidīvi. Grūtības sagādāja laika iedalījums – visiem pacientiem datu analīzes brīdī nebija pagājis sešu mēnešu kontroles laikposms, tāpēc bija mazāks pacientu skaits trīs un sešu mēnešu kontroles laika grupās. Tika konstatēts, ka recidīvi bijuši 21,1 % pacientu viena mēneša, 25,0 % – trīs mēnešu un 36,9 % pacientu – sešu mēnešu laikā. Apvienojot datus, tika iegūts kopējais pacientu skaits, kam bijuši recidīvi, neizšķirot kontroles laiku, t. i., 32,6 % (n = 74), kas arī atbilst pasaules literatūrā dažādos pētījumos aprakstītajiem datiem (21–40 % sešu mēnešu laikā) [Cannon, 2008; Pisters, 2012]. Tomēr recidīvus apstiprinoša informācija iegūta aptaujās pa tālruni, kas netika apstiprināta ar Holtera monitorēšanas pierakstu vai vienkāršu EKG.
Kontroles tālruņa zvanu laikā anamnēze tika ievākta iespējami precīzāk, par recidīviem uzskatīti aritmijas subjektīvie simptomi, tās apstiprinājums ārsta apmeklējuma laikā vai SR atjaunošana stacionārā. Tomēr sūdzības ir nespecifiskas, un tas, neiekļaujot asimptomātiskas epizodes, varēja ietekmēt šī pētījuma rezultātus. Pasaules literatūrā pieejamos pētījumos recidīvi kontroles laikā tika apstiprināti gan anamnestiski, gan EKG vai Holtera monitorēšanas pierakstā. Šā pētījuma laikā nebija pieejami objektīvie ĀF recidīvu pierādījumi, tāpēc īstenais to biežums var būt atšķirīgs, kas izmainītu arī anamnestisko un objektīvo laboratorisko datu vērtības, relatīvos biežumus un statistisko ticamību grupā bez recidīviem un grupā ar recidīviem.
Ir pierādītas arī recidivējošas ĀF biežuma atšķirības pacientu grupās, kam recidīvi fiksēti standarta EKG pieraksta laikā, kā arī izmantojot implantētas EKG ierīces pacientiem ar EKS, kas ļauj pierādīt, ka ĀF recidīvu biežums ir stipri augstāks asimptomātiskās norises dēļ [Patton, 2009]. Tādēļ var apšaubīt arī analizēto riska faktoru rezultātus, kas nebija statistiski ticami šajā pētījumā, bet ir pierādīti kā ĀF riska faktori pasaules literatūrā: pacienta vecums, ilgstoša ĀF epizode, palielināts ĀF ilgums, KSS, sieviešu dzimums, palielināts ĶMI, CD, HOPS [Jirgensons, Kalējs, 2010; Camm, 2010, De Vos, 2010]. Tomēr literatūrā ir arī dati, kas neapstiprina statistiski ticamas atšķirības KSS biežumā, LA diametrā, vecumā, dzimuma grupās, AH un CD gadījumu biežumos, ĀF ilgumā, EF un iepriekš veiktu EKV biežumā grupā bez recidīviem un grupā ar recidīviem [Cannon, 2008; Pisters, 2012; Lip, 2013].
Šajā pētījumā iegūtie rezultāti atspoguļo tendenci biežākiem recidīviem būt HSM (p = 0,706), hipertrofas KMP (p = 0,598), smēķēšanas (p = 1,102) gadījumā, ja anamnēzē ir miokarda infarkts (p = 1,000), vīriešiem (p = 0,887), pacientiem 45–55 gadu vecumā (p = 0,848), ja ĀF ilgusi 30–90 dienas (p = 0,390), tomēr statistiskā ticamība netika sasniegta. Metabolā sindroma, CD, AH gadījumā biežāki recidīvi netika pierādīti, iespējams, tādēļ, ka pacientu skaits ar šīm slimībām bija relatīvi zems.
Kreisā ātrija diametra palielināšanās, ko izraisa fibrotisko audu hiperplāzija, saistību ar ĀF recidīviem noliegt nevar, tomēr šajā pētījumā statistiska ticamība recidīvu biežumā dažādu LA diametru grupās netika sasniegta, kas liek kritiski skatīties uz šī riska faktora analīzes rezultātiem. Problēmas radīja prospektīvo pacientu EhoKG datu trūkums (LA (n = 112), LAVI (n = 82)), kas, iespējams, izjauca attiecību starp grupu bez recidīviem un grupu ar recidīviem. Tā kā kreisā ātrija dilatācija ilgākā laikposmā veidojas miokarda masas zuduma un fibrozes attīstības dēļ, veicinot ektopisko impulsu atkārtotu veidošanos, iespējams, objektīvāk būtu izmeklēt tieši saistaudu plašumu ātrija sieniņā kā iespējamo recidīvu riska faktoru, kas izraisa sirds dobumu palielināšanos. Tas būtu sirds strukturālo izmaiņu un ĀF substrāta pierādījums magnētiskajā rezonansē. Šajā gadījumā dati par fibrozes izplatību ātriju sieniņā nav pieejami, tomēr tas nevar izslēgt tās nozīmīgumu ĀF recidīvu veidošanās procesā.
Salīdzinot hospitalizēto pacientu grupu un grupu pacientu ar mājās medikamentozas vai spontānas kardioversijas recidīviem relatīvo biežumu, ir atšķirības – viena mēneša laikā hospitalizēti 62,5 % pacientu ar recidīviem, trīs mēnešu laikā – 68,0 %, bet sešu mēnešu laikā – 63,6 % pacientu. Ņemot vērā, ka kontroles tālruņa zvanu laikā sūdzības un pacientu taktika recidīvu gadījumā tika sīki iztirzāta, var secināt: lai arī pacienti ir labi apmācīti un māk lietot AAL recidīvu gadījumos, tos bieži vien mājās kupēt neizdodas, jo stacionēto recidīvu relatīvais biežums ir augsts.
Statistiski ticami biežāki recidīvi vērojami arī pacientiem, kam veikta RFKA (80,0 %, salīdzinot ar grupu, kam nav veikta RFKA, – 30,8 %; p = 0,040), ko varētu skaidrot ar agrīniem recidīviem trīs mēnešu laikā pēc procedūras, tiem neatkārtojoties ilgākā laikposmā. To šajā gadījumā nevar precizēt anamnestisko datu vākšanas laikā neprecizēto jautājumu dēļ.
Trīs mēnešu laikā statistiski ticami biežāki recidīvi (40,5 %) bijuši pacientiem 45–55 gadu vecumā (OR 0,648; p = 0,011). Būtu jāveic kontroles tālruņa zvani visiem pacientiem sešu mēnešu laikā, lai rūpīgāk izpētītu recidīvu biežumu pētījumā iekļauto pacientu grupās, jo par viena un sešu mēnešu laiku statistiskā ticamība netika sasniegta.
Kā ĀF riska faktors pasaules literatūrā ir minēta HNS [Levey, 2003; Rienstra, 2012], un šajā pētījumā tā tika pierādīta arī kā recidivējošas ĀF riska faktors (recidīvi 53,2 % vs. grupā bez HNS 27,7 %, OR 0,324; p = 0,020) pēc EKV. Tās gadījumā bijušas biežākas arī ĀF recidīvu hospitalizācijas viena, trīs un sešu mēnešu laikā (p = 0,010). Tomēr ar šo secinājumu ir jābūt uzmanīgiem, jo datu vākšanas laikā grūtības sagādāja tas, ka daudzu pacientu vēstures datos trūka datu par HNS diagnozi un kreatinīna līmeni. Glomerulu filtrācijas ātrums tika noteikts, izmantojot Kokrofta–Golta formulu (GFĀ (ml/min) = (140 – vecums) × masa (kg) / SCr × 0,81 [× 0,85 sievietēm]). Ja iepriekš nebija pieejamu datu par HNS, šī diagnoze tika noteikta, ņemot vērā GFĀ un kreatinīna lielumu vecākos izrakstos, esošo GFĀ, vecumu un blakusslimības esamību un ilgumu, kas varētu liecināt, ka nieru bojājums ir vismaz trīs mēnešus. HNS diagnoze prospektīvo pacientu grupā bija 47 pacientiem, 32 (14,1 %) no viņiem tā tika pierādīta, ņemot vērā iepriekš nosauktos kritērijus.
Izvērtējot medikamentu parakstīšanas biežumu pēc EKV, jāsecina, ka medikamentozā terapija SR uzturēšanai vismaz mēneša laikā tiek noteikta diezgan bieži: amiodarons tiek rekomendēts 62,1 % gadījumu (pasaules literatūrā tikai 24,1 %), propafenons – 7,6 % gadījumu (pasaules literatūrā tikai 2,9 %), etacizīns – 8,9 %, BAB – 90,7 %, sotalols – 4,5 % gadījumu (pasaulē 5,5 % gadījumu) [Pisters, 2012]. Kopumā Ic un III klases AAL tika ieteikti 403 pacientiem (83,1 %), kas ir salīdzinoši augsts rādītājs.
Izpētot recidīvu biežumu dažādu lietoto medikamentu grupās, atklājās pasaules literatūras datiem līdzīgi rezultāti: amiodarona lietošanas grupā novēro viszemāko recidīvu biežumu (29,87–33,33 %), salīdzinot ar propafenonu (63,6 %) un etacizīnu (83,3 %) (p = 0,002). Tomēr pasaules pētījumos recidīvu biežums propafenona un etacizīna lietotāju grupās ir zemāks. Augstos recidīvu biežuma rādītājus varēja ietekmēt relatīvi zemais propafenona un etacizīna lietotāju skaits šajā pētījumā – tikai 12 prospektīvo pacientu lietoja propafenonu, bet 16 – etacizīnu, kas ir izteikti mazāk nekā aplūkotajos pētījumos (attiecīgi – 202 amiodarona un 101 propafenona lietotājs; trūkst datu par etacizīna efektivitāti un lietošanas biežumu [Pisters, 2012; Lip, 2013]).
Viena mēneša laikā AAL nelietoja 60 pacientu, bet sešu mēnešu laikā – 75 pacienti ar statistiski ticamu atšķirību, ka recidīvi, nelietojot AAL, ir retāki, salīdzinot ar ALL lietotāju grupām, kas var liecināt, ka nepieciešams izvērtēt SR uzturēšanas terapiju un to, vai ārsts efektīvi tos paraksta (p = 0,001). Pacientu grupai bez AAL terapijas būtu nepieciešams ilgāks kontroles periods, lai atklātu vēlākus recidīvus viena divu gadu laikā un izvērtētu tendenci tiem atkārtoties. Sotalola gadījumā statistiski ticamas atšķirības recidīvu biežumā netika pierādītas, tos novēroja 33,3 % (n = 3) pacientu (pasaules literatūrā 46 ± 8 % sešu mēnešu laikā) [Lip, 2013], bet sotalola lietotāju grupa (n = 6) bija neliela, salīdzinot ar citos pētījumos norādītajiem vidēji 50 lietotājiem [Pisters, 2012].
Apstiprinājās arī statistiski ticama atšķirība recidīvu biežumā statīnu lietotāju grupā (recidīvi 26,9 %), salīdzinot ar nelietotāju grupu (38,6 %) (p = 0,044). Pasaules literatūrā ir pētījumi ar līdzīgu iznākumu atorvastatīna ietekmē uz ĀF recidīvu biežumu pēc EKV, attiecīgi 12,5 % lietotāju un 45,8 % nelietotāju grupā (p = 0,010) [Ozaydin, 2006]. Šajā aspektā jāizšķir statīnu labvēlīgā ietekme uz endotēlijšūnu, asinsvadu, sirds funkciju un lipīdu līmeņa stabilizāciju. Izpētot kvantitatīvo datu vidējo vērtību atšķirības, pacientiem recidīvu grupās bija augstāks kopējā holesterīna (p = 0,518), zema blīvuma lipoproteīnu (p = 0,215) līmenis, kas neļāva sasniegt statistisko ticamību.
Darba hipotēze pierādīta daļēji – bez statistiski ticamas atšķirības – recidīvu biežumā lielāka LA diametra, LAVI, esošas KSS, ĶMI, metabolā sindroma, sieviešu dzimuma un ilgstošākas ĀF epizodes gadījumā. Kā statistiski ticams recidivējošas ĀF un hospitalizācijas riska faktors sešu mēnešu laikā pēc EKV tika pierādīta HNS (p = 0,020), bet recidīvu riska faktors trīs mēnešu laikā – pacientu vecums 45–55 gadi (p = 0,011).
Pētījuma mērķi ir sasniegti, jo ir pierādīti vai noraidīti iepriekš nosauktie ĀF recidīvu riska faktori un izvērtēts recidīvu biežums dažādu medikamentu grupu lietošanas gadījumos. Uzdevumi ir izpildīti, jo ir apstrādāti dati un izpētītas recidīvu biežuma atšķirības un izvērtēts parakstītās medikamentozās terapijas biežums un efektivitāte. Mēģinājums izveidot ĀF recidīvu neatkarīgo riska faktoru modeli ar loģistiskās regresijas metodi neizdevās, jo trūka statistiski ticamu saistību, un šis uzdevums netika izpildīts pilnīgi, tāpēc turpmākā datu analīzē metode netika izmantota.
Sīkāk un precīzāk izpētīt ĀF riska faktorus un terapijas efektivitāti būtu iespējams, papildinot šī pētījuma rezultātus. Vajadzētu turpināt pētījumu, lai iegūtu pilnīgu informāciju 227 pacientu lielā grupā. Jāmaina pētījuma struktūra, veicot kontroles vizīti, jāpieaicina pacienti klātienē, lai izvērtētu kontroles laikā citos stacionāros veikto EKG, Holtera monitorēšanas vai EKS pieraksta izpēti vai veiktu EKG pierakstu iespējamiem asimptomātiskiem ĀF pacientiem vizītes laikā.
Lai turpmāk precīzāk izvērtētu HNS ietekmi uz ĀF recidīvu biežumu, stacionārā rūpīgāk jāveic nieru funkcijas laboratoriskā un urīna analīžu izpēte, vienlaikus izslēdzot akūta nieru bojājuma iespējamību; jāsalīdzina dati, kas pieejami pacientam klātienē, vismaz trīs mēnešu vecos izrakstos, lai apstiprinātu vai noliegtu HNS diagnozi.
Lai precīzāk izpētītu ĀF recidīvu biežumu pacientiem ar dažādu LA diametru un LAVI lielumu, rūpīgāk jāveic EhoKG rezultātu pieraksts stacionāra medicīniskajā dokumentācijā, jo šo datu trūka. Datu trūkums, iespējams, izjauca attiecību starp grupu bez recidīviem un grupu ar recidīviem.
Jāizpēta arī citi pasaules literatūrā pieejamie ĀF recidīvu biežuma riska faktori: obstruktīvā miega apnoja un CRO līmenis, kas šajā gadījumā netika iekļauts, jo diemžēl mūsu izmantotajā medicīniskajā dokumentācijā nebija pieejami šie dati. Tomēr nākotnē būtu vērts veikt papildu pētījumu par šiem riska faktoriem.
Lai būtu vieglāk pētīt iespējamos riska faktorus, terapijas efektivitāti un nepieciešamību tos ņemt vērā, pielāgojot SR uzturēšanas terapiju, jāveido ātriju fibrilācijas slimnieku reģistrs, kurā jāiekļauj pacienti gan pēc SR medikamentozas, gan elektriskās kardioversijas.
Secinājumi
- Ātriju fibrilācijas recidīvu biežums sešu mēnešu laikā pēc elektriskās kardioversijas ir 21,1–55 %.
- Sinusa ritma uzturēšanai pēc elektriskās kardioversijas bieži tiek lietoti antiaritmiskie līdzekļi, beta adrenoblokatori un angiotensīnu konvertējošā enzīma inhibitori.
- Statīnu, aldosterona antagonistu un diurētisko līdzekļu grupas līdzekļu lietošana samazina ātriju fibrilācijas recidīvu biežumu pēc elektriskās kardioversijas.
- Amiodarons statistiski ticami efektīvāk novērš ātriju fibrilācijas recidīvus pēc elektriskās kardioversijas nekā etacizīns, propafenons un sotalols.
- Statistiski ticami augstāks ātriju fibrilācijas recidīvu un hospitalizācijas risks trīs mēnešu laikā ir pacientiem vecuma grupā no 45 līdz 55 gadiem, bet sešu mēnešu laikā – pacientiem ar hronisku nieru slimību.
- Pacientu grupās bez recidīviem un ar recidīviem nav statistiski ticamas vecuma, dzimuma, ātriju fibrilācijas ilguma, labā ātrija diametra, kreisā ātrija tilpuma indeksa, ķermeņa masas indeksa, lipīdu līmeņa atšķirības. Recidīvi nav statistiski ticami biežāki arteriālās hipertensijas, cukura diabēta un metabolā sindroma gadījumā.
Abstract
Atrial Fibrillation and Risk Factors of Recurrent Paroxysms after Electrical Cardioversion
There is an increased risk of embolic events and development of heart failure in case of atrial fibrillation (AF). That is the reason why it is so necessary to restore sinus rhythm (SR) in a much safer, faster and more effective way; these requirements are met by electrical cardioversion (ECV). It restores SR in most cases, but cannot prevent high possibility of recurrent AF, which depends on various risk factors that should be considered, prescribing SR maintenance therapy.
The aim of the study was to evaluate the effectiveness of antiarrhythmic drug therapy and identify risk factors of recurrent AF after ECV.
Review of medical records and information from control phone calls one, three and six months after ECV of 256 prospective and medical records of 229 retrospective patients who were undergoing ECV in case of AF during the year of 2013 at Latvian Cardiology Centre.
32.6 % patients were with recurrent AF. There was a statistically significant higher rate of recurrences and hospitalisations in case of chronic kidney disease during one, three and six months after ECV. Patients in the age group 45–55 (40.5 %) had AF recurrences more frequently during three months. In class Ic and class III antiarrhythmic drugs were prescribed in 83.1 % cases, more often Amiodarone (62.1 %), as recurrences were less frequent (33.3 %), comparing with Propaphenone (63.6 %), Ethacizine (83.3 %) and Sotalol (33.3 %). 81.9‒86.8 % of patients received beta-blockers, but 55.5‒58.1 % of patients – ACEI. There were more uncommon episodes of recurrent AF in groups, where statins (26.9 % vs. 38.6 %), aldosterone antagonists (12.5 % vs. 34.7 %), and diuretics (15.4 % vs. 41.5 %) were used.
Recurrent AF occurs in every third patient with AF after ECV. The use of beta-blockers and ACEI after ECV is frequent. Use of statins, diuretics and aldosterone antagonists decreases the number of AF recurrences. Amiodarone statistically significantly more effectively decreases the risk of AF than Propaphenone, Ethacizine and Sotalol.
Literatūra
- Jirgensons J., Kalējs O. Sirds un asinsrites sistēmas saslimšanas // Klīniskā medicīna: Pirmā grāmata / A. Lejnieka red. – Rīga: Medicīnas apgāds, 2010. – 143., 145. lpp.
- Ērglis A., Kalvelis A., Kalējs O. u. c. Latvijas Kardiologu biedrības 2010. gada pavasara konsensus dokuments ātriju mirgošanas ārstēšanā. – Rīga: LKB, 2010. – 3.–7. lpp.
- Ērglis A., Latkovskis G., Kalējs O. u. c. Antikoagulantu lietošana pacientiem ar ātriju fibrilāciju kardioemboliskā insulta novēršanai. – Rīga, 2013. – 5., 7.–9., 15., 18. lpp.
- Aviles R. J., Martin A. O., Van Wagoner D. R., et al. Inflammation as a risk factor for atrial fibrillation // Circulation, 2003; 108: 3006–3010.
- Benjamin E. J., Levy D., Vaziri S. M., et al. Independent risk factors for atrial fibrillation in a population-based Cohort // The Framingham Heart Study, 1994.
- Brodsky M. A., Allen J. G., Capparelli E. V., et al. Factors determining maintenance of sinus rhythm after chronic atrial fibrillation with left atrial dilatation // The American Journal of Cardiology, 2013; 15(63): 1065–1068.
- Camm A. J., Kirchhof P., Lip G. Y. H., et al. Guidelines for the management of atrial fibrillation. The task force for the management of atrial fibrillation of the European Society of Cardiology (ESC) // European Heart Journal, 2010; 31: 2369–2429.
- Camm A. J., Lip G. Y. H., De Caterina R., et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation. An update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association // Europace, 2012; 10(14): 1385–1413.
- Cannon C. P., Armani A. M. Atrial fibrillation – from bench to bedside. – Humana Press, 2008. – Pp. 37–69.
- Chiang C. E., Goethals M., O’Neill J. M., et al. Inappropriate use of antiarrhythmic drugs in paroxysmal and persistent atrial fibrillation in a large contemporary international survey: insights from RealiseAF // Europace, 2013; 15: 1733–1740.
- Connolly S. J. Evidence-based analysis of amiodarone efficacy and safety // Circulation, 1999; 100: 2025–2034.
- Co A. S., Hylek E. M., Aphillips K., et al. Prevalence of diagnosed atrial fibrillation in adults // JAMA, May 9, 2001; 18(l): 285.
- De Vos C. B., Pisters R., Nieuwlatt R., et al. Progression from paroxysmal to persistent atrial fibrillation: Title and subTitle Break clinical correlates and prognosis // J Am Coll Cardiol, 2010; 8(55): 725–731.
- Kanagala M., Murali N. S., Friedman P. A., et al. Obstructive sleep apnea and the recurrence of atrial fibrillation // Circulation, May 12, 2003; 107: 2589–2594.
- Lafuente-Lafuente C., Mouly S., Tejero M. A. L., et al. Antiarrhythmic drugs for maintaining sinus rhythm after cardioversion of atrial fibrillation: A systematic review of randomized controlled trial // Arch Intern Med, 2006; 166: 719–728.
- Lip G. Y. H., Laroche C., Dan G. A prospective survey in European Society of Cardiology member countries of atrial fibrillation management: Baseline results of Euro Observational Research Programme Atrial Fbrillation (EORP-AF): Pilot General Registry // Europace, 2013; 5(14): 666–674.
- Lombardi F., Colombo A., Basilico B., et al. Heart rate variability and early recurrence of atrial fibrillation after electrical cardioversion // JACC, January 2001, 1(37): 157–162.
- Loricchio M. L., Cianfrocca C., Pasceri V., et al. Relation of c-reactive protein to long-term risk of recurrence of atrial fibrillation after electrical cardioversion // The American Journal of Cardiology, May 2007, 10(99): 1421–1424.
- Nieuwlaat R., Capucci A., Camm A. J., et al. For the European heart survey investigators. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on atrial fibrillation // Eur Heart J, October 4, 2005; 26: 2422–2434.
- Ozaydin M., Varol E., Aslan S. M., et al. Effect of atorvastatin on the recurrence rates of atrial fibrillation after electrical cardioversion // American Journal of Cardiology, May 2006; 10(97): 1490–1493.
- Patton K. K., Ellinor P. T., Heckbert S. R., et al. N-terminal pro-b-type natriuretic peptide is a major predictor of the development of atrial fibrillation: The cardiovascular health study // Circulation, 2009; 120: 1768–1774.
- Pisters R., Nieuwlaat, R., Prins M. H., et al. Clinical correlates of immediate success and outcome at 1-year follow-up of real-world cardioversion of atrial fibrillation: the Euro Heart Survey // Europace, 2012; 5(14): 666–674.
- Reimold S. C., Cantillon C. O., Friedman P. E., Antman E. M. Propafenone versus sotalol for suppression of recurrent symptomatic atrial fibrillation // The American Journal of Cardiology, March 1, 1993; 7(71): 558–563.
- Rienstra M., McManus D. D., Benjamin E. J., et al. Novel risk factors for atrial fibrillation. Useful for risk prediction and clinical decision making? // Circulation, 2012; 125: 941–946.
- Roy D., Talajic M., Dorian P., et al. For the Canadian trial of atrial fibrillation investigators. Amiodarone to prevent recurrence of atrial fibrillation // N Engl J Med, March 30, 2000; 342: 913–920.
- Sarnak M. J., Levey A. S., Schoolwerth A. C., et al. Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on kidney in cardiovascular disease, high blood pressure research, clinical cardiology, and epidemiology and prevention // Circulation, 2003; 108: 2154–2169.
- Singh B. N., Singh S. N., Reda D. J., et al. Amiodarone versus sotalol for atrial fibrillation // N Engl J Med, May 5, 2005; 352: 1861–1872.
- Suttorp M. A., Kingma J. H., Koomen E. A., et al. Recurrence of paroxysmal atrial fibrillation or flutter after successful cardioversion in patients with normal left ventricular function // The American Journal of Cardiology, March 15, 1993; 8(71): 710–713.
- Ueng K. C., Tsai T. P., Yu W. C., et al. Use of enalapril to facilitate sinus rhythm maintenance after external cardioversion of long-standing persistent atrial fibrillation. Results of a prospective and controlled study // European Heart Journal, 2003, 24: 2090–2098.
- Van Gelder I. C., Hagens V. E., Bosker H. A., et al. Rate control versus electrical cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation // N Engl J Med, 2002; 347: 1834–1840.


