Iekaisuma un imunoloģisko rādītāju prognostiskā nozīme pacientiem ar nieršūnu karcinomu
Kopsavilkums
Ievads. Hroniskam audzēja perifokālam iekaisumam un ar to saistītām izmaiņām imūnsistēmā ir būtiska nozīme nieršūnu karcinomas (NŠK) attīstībā. Visuzskatāmāk tās var vērot audzēja audos, taču perifērajās asinīs tās ir gan vieglāk analizējamas, gan arī mērāmas dinamikā.
Darba mērķis. Darba mērķis bija noteikt ikdienas praksē viegli nosakāmu iekaisuma un imunoloģisko rādītāju korelāciju ar NŠK stadiju un to mainību, slimībai progresējot, lai spriestu par to potenciālo nozīmi diagnostikā un NŠK gaitas prognozēšanā.
Materiāls un metodes. Pētījuma laikā apkopoti dati par 158 RAKUS pacientiem ar morfoloģiski pierādītiem nieru audzējiem, kuriem pirms terapijas tika noteikti šādi laboratoriskie rādītāji: C reaktīvais olbaltums (CRO), eritrocītu grimšanas ātrums (EGĀ), laktātdehidrogenāze (LDH), absolūtais leikocītu (Leu), neitrofilo leikocītu (Ne), monocītu (Mo), limfocītu (Ly), trombocītu (Tr) skaits, kuru analizēšanai izmantoja klīnikas standarta metodes, un šādas limfocītu subpopulācijas: CD3+, CD3+CD4+, CD3+CD8+, CD38+, CD16+CD56+, CD19+, CD95+, CD4/CD8 ar plūsmas citometrijas metodi, kā arī aprēķinātas vairākas šūnu attiecības.
Rezultāti. Visbūtiskākā mainība atkarībā no audzēja un tā stadijas tika novērota Tr un Mo absolūtajam skaitam, CRO un EGĀ, kā arī CD19+ šūnu skaitam (B limfocītiem). Mo/Ly attiecība ir vienīgais rādītājs, kuru varētu piemērot labdabīgu veidojumu diferenciācijai no lokalizētas NŠK. Savukārt Tr/Ly attiecība nozīmīgi atšķiras starp lokalizētu un metastātisku NŠK. Pacientiem ar III stadijas un metastātisku NŠK visbūtiskāko saistību ar audzējspecifiskās dzīvildzes prognozi uzrāda Tr absolūtais skaits, CRO un EGĀ, kā arī Tr/Ly attiecība un CD8+/CD19+ šūnu attiecība.
Ievads
Mūsdienās ir skaidri pierādīts, ka ar audzēju saistītam hroniskam iekaisumam un izmaiņām imūnsistēmā ir būtiska nozīme vairāku lokalizāciju, tai skaitā NŠK, patoģenēzē un attīstībā, angioģenēzes, proliferācijas un metastazēšanās veicināšanā (Manola et al., 2011). Novērots, ka starp audzēju un dažādām imūnkompetentajām šūnām pastāv sarežģīta mijiedarbība, kura līdz galam vēl nav izprasta. Tomēr ir zināms, ka slimības progresija ir atkarīga ne tikai no audzēja spējas “izvairīties” no organisma dabīgās un adaptīvās imūnatbildes, bet arī “mainīt” par to atbildīgo šūnu raksturu (Brandau, Dumitru and Lang, 2013). Turklāt zināms, ka audzēja mikrovidē imūnās šūnas var gan veicināt, gan kavēt tā augšanu un izplatību (Senovilla, 2012). Audzējam piemīt spēja izraisīt imūnkompetento šūnu un ar tām saistīto mediatoru līdzsvara nobīdi, kas visuzskatāmāk vērojama audzēja audos, bet var būt manāma arī asins cirkulācijā, sniedzot zināmas priekšrocības, jo izmaiņas perifērajās asinīs ir gan vieglāk analizējamas, gan arī mērāmas dinamikā.
Lai gan interese par audzēja imūnās regulācijas mehānismiem pieaug, literatūrā joprojām pietrūkst datu par vienkārši nosakāmu asins imūnbioloģisko rādītāju un to savstarpējo korelāciju nozīmīgumu vēža progresijā. Lai spriestu par marķieru mainību audzēja attīstības gaitā, var veikt retrospektīvu kohortu analīzi, piemēram, izmantojot kontrolētas zāļu klīniskās izpētes laikā iegūto informāciju. Tomēr tādā gadījumā jāņem vērā, ka dati būs pieejami tikai par pētījuma kritērijiem atbilstošiem pacientiem ar stingri limitētu mērījumu skaitu. Savukārt, lai prospektīvi analizētu dažādu raksturlielumu korelāciju ar izdzīvotību, ir nepieciešami vairāki gadi, it īpaši audzēja sākumstadijās vai lēni progresējošiem audzējiem. Kaut gan šāds izpētes modelis ir informatīvāks un precīzāks, to ierobežo gan pacientu atlase, gan novērošanas laiks. Cits veids, kā spriest par analizējamo marķieru izmaiņām slimības gaitā, ir nosakot to svārstības dažādos posmos, piemēram, secīgās audzēja stadijās, kas ir šajā pētnieciskajā darbā izmantotā pieeja.
Darba mērķis
Noteikt būtiskākos iekaisuma un imunoloģiskos rādītājus perifērajās asinīs, kuri korelē ar nieršūnu karcinomas stadiju un statistiski ticami mainās slimības progresijas gaitā, lai spriestu par to potenciālo nozīmi diagnostikā un prognozē.
Materiāls un metodes
Pētījums ir prospektīvs un veikts RAKUS Uroloģijas klīnikā. Microsoft Excel tika izveidota datu tabula, lai kodētā veidā ievadītu šādus datus par katru pacientu ar vizuāldiagnostiski (DT – datortomogrāfiski vai USG – ultrasonogrāfiski) konstatētu nieru audzēju: vecums, dzimums, blakusslimības; anatomiskie faktori: slimības stadija: T, N, M kategorija, audzēja morfoloģiskās izmeklēšanas laikā noteiktais izmērs, metastāžu lokalizācijas vietas; histoloģiskie faktori: apakštips, malignitātes pakāpe un laboratorisko rādītāju absolūtās un relatīvās vērtības: C reaktīvais olbaltums (CRO), eritrocītu grimšanas ātrums (EGĀ), laktātdehidrogenāze (LDH), absolūtais leikocītu (Leu), neitrofilo leikocītu (Ne), monocītu (Mo), limfocītu (Ly), trombocītu (Tr) skaits un limfocītu subpopulācijas: CD3+, CD3+CD4+, CD3+CD8+, CD38+, CD16+CD56+, CD19+ CD95+, kā arī noteikts imūnregulatorais indekss CD4+/CD8+ un aprēķināta šūnu attiecība: Mo/Ly, Ne/Ly, Tr/Ly un CD3+CD8+/CD19+.
Pacienti ar klīniski nozīmīgām infekcijas, citām ļaundabīgām un autoimūnām slimībām pētījumā netika iekļauti. Pētījumā tika analizēti pacienti ar primāru NŠK vai tās recidīvu. Pirms iekļaušanas pacienti nebija saņēmuši specifisku pretvēža terapiju, izņemot recidīva gadījumā – nefrektomiju anamnēzē. NŠK stadija noteikta atbilstoši TNM kritērijiem saskaņā ar Amerikas Apvienotās vēža komitejas (American Joint Committee on Cancer, AJCC) septīto redakciju.
Asins paraugi tika savākti standarta K2 EDTA stobriņos, veicot perifērās vēnas punkciju, pirms tam no katra pētījumā iekļautā pacienta iegūstot informētu piekrišanu dalībai pētījumā. Hematoloģiskie rādītāji tika analizēti ar klīniskajā praksē lietotām standarta metodēm. Pilna asins aina tika noteikta ar Sapphire Cell-Dyn 5-diff autoanalizatoru (Abbott Diagnostics) vai MultiAngle Polarized Scatter Separation (MAPSS) tehnoloģiju. CRO tika noteikts ar bioķīmisko analizatoru (Cobas 6000, Roche), izmantojot imūnturbodimetrisko metodi, un oriģinālajiem reaģentiem. EGĀ analizēšanai tika izmantots Analyser Test 1 (Alifax), lietojot kapilārās fotometrijas metodi.
Limfocītu subpopulācijas tika analizētas ar plūsmas citometrijas metodi. Visi paraugi tika krāsoti ar divu krāsu monoklonālām antivielām BD Simulset IMK-Lymphocyte, lai noteiktu CD3+, CD3+CD4+, CD3+CD8+, CD16+CD56+, CD19+ limfocītus. Vienas krāsas monoklonālās antivielas tika izmantotas CD38+ un CD95+ limfocītu noteikšanai. Paraugi tika analizēti ar plūsmas citometru FACS Calibur, kas aprīkots ar 488 nm argona lāzeru, lietojot SimulSET un Cell Quest programmatūru un Becton Dickinson (ASV) ražotos reaģentus.
Datu statistiskā apstrāde tika veikta, izmantojot Microsoft Excel un IBM SPSS Statistics programmu. Pacientu datu raksturošanai tika lietotas vispārpieņemtās aprakstošās statistikas metodes – kopsavilkuma tabulas, histogrammas vai diagrammas. Tika vērtēti centrālās tendences rādītāji (vidējais aritmētiskais (M) vai mediāna (Mdn)) un izkliedes rādītāji – standartnovirze (SN) un 95 % ticamības intervāls (TI). Gadījumos, kad datu izkliede nebija simetriska, nepārtraukto mainīgo raksturošanai tika izmantota Mdn ar starpkvartiļu izkliedi (IQR), bet normālsadalījumam atbilstošie dati tika atspoguļoti ar M un SN.
Kvantitatīvo atšķirību analīzei starp grupām tika izmantota dispersiju analīze (ANOVA), pirms tam veicot datu pārbaudi šādām parametriskās metodes prasībām:
- ekstremālo vērtību esamība, izmantojot diagrammu;
- datu atbilstība normālsadalījumam pēc Šapiro–Vilka (Shapiro–Wilk) testa;
- grupu dispersiju dažādība pēc Lēvena (Levene) testa.
Atšķirību būtiskuma izvērtēšanai starp grupām lietots post hoc Tukey HSD tests.
Nosakot izlases lielumu, kurš būtu pietiekams one way ANOVA testa izmantošanai trim neatkarīgām izlasēm, pieņemot par statistiskās nejaušības līmeni p vērtību – 0,05 (α kļūda), statistiskā pierādījuma spēku (statistical power) – 95 % (β kļūda 5 %) un par sagaidāmo efekta lielumu (effect size) atšķirībai starp analizējamām grupām – 0,5, tad pētījuma dalībnieku skaitam būtu jābūt vismaz 66 (Allgemeine Psychologie und Arbeitspsychologie, 2015). Līdz ar to pētījumā iekļauto pacientu skaits vērtējams kā atbilstošs.
Normālsadalījumam neatbilstošu datu gadījumā tika lietotas neparametriskās metodes, piemēram, veikta vidējo rangu salīdzināšana ar Kruskala–Vollisa (Kruskall–Wallis) testu. Korelāciju analīzei tika izmantota Spīrmena (Spearman) metode, uzskatot, ka korelācija ir vāja, ja rs < 0,3, vidēji cieša – 0,3 < rs < 0,69 un cieša – rs > 0,7. Viena mainīgā analīzē pacientu dzīvildze tika salīdzināta, izmantojot Kaplana–Meijera (Kaplan–Meier) metodi.
Rezultāti
Pētījuma laikā tika apkopoti dati par 158 pacientiem ar vizuāldiagnostiski atrastiem nieru audzējiem un sekojošu morfoloģisku verifikāciju no rezekcijas vai biopsijas materiāla. Analizētajā pacientu kopā bija 80 vīrieši un 78 sievietes, vidējais pacientu vecums – 62,8 gadi (SN = 10,3). Pacienti, kuriem pētījuma sākumā tika konstatētas metastāzes, tika klasificēti kā diseminēti un analizēti vienā grupā ar ceturto stadiju. Visiem pacientiem laboratoriskie rādītāji tika noteikti pirms radikālas operācijas – lokalizētas slimības gadījumā vai pirms medikamentozās terapijas sākšanas – pacientiem ar metastātisku NŠK. Par novērojuma sākumpunktu izvēlēts asins analīžu noteikšanas datums, sākot ar 2013. gada 25. novembri, un tika turpināts līdz 2015. gada 1. novembrim. Pētījuma beigās dzīvi bija 140 (88,6 %) un miruši – 18 (11,4 %) pacienti. Pacientus raksturojošie dati pēc to iedalījuma stadijās atspoguļoti 1. tabulā.
Veicot analizēto asins rādītāju atbilstības pārbaudi parametrisko metožu prasībām, pēc diagrammas katrā grupā (t. i., labdabīgi veidojumi, I, II, III stadija un metastātiski audzēji) bija vērojams nozīmīgs ekstremālo vērtību skaits un datu neatbilstība normālsadalījumam. Tāpēc, lai gūtu vispārēju priekšstatu par statistiski nozīmīgajām atšķirībām analizētajos parametros, sākumā tika veikta vidējo rangu salīdzināšana, izmantojot neparametrisko Kruskall–Wallis testu.
1. tabula. Pētījumā iesaistīto pacientu vispārējais raksturojums atbilstoši nieršūnu karcinomas stadijām / Characteristics of study patients by stage of the renal cell carcinoma
| Rādītājs | Labdabīgi veidojumi (n = 19) | Nieršūnu karcinoma (N = 139) | |||
|---|---|---|---|---|---|
| I stadija (n = 85) | II stadija (n = 9) | III stadija (n = 12) | Primāri metastātiska vai IV stadija (n = 33) | ||
| Dzimums | |||||
| Vīrieši, n | 7 | 39 | 4 | 8 | 22 |
| Sievietes, n | 12 | 46 | 5 | 4 | 11 |
| Vidējais vecums, gadi | 65,6 | 63,4 | 57,3 | 58,4 | 60,3 |
| Morfoloģiskais variants, n | |||||
| Onkocitoma | 10 | — | — | — | — |
| Angiomiolipoma | 7 | — | — | — | — |
| Gaiššūnu vēzis | — | 74 | 8 | 10 | 28 |
| Papillāra karcinoma | — | 4 | 0 | 0 | 1 |
| Hromofoba karcinoma | — | 7 | 1 | 1 | 0 |
| Malignitātes pakāpe, n | |||||
| G1 | — | 35 | 0 | 1 | 2 |
| G2 | — | 41 | 4 | 4 | 6 |
| G3 | — | 6 | 3 | 3 | 11 |
| G4 | — | 1 | 1 | 3 | 7 |
| Lielākais audzēja šķērsizmērs, cm (M ± SN) | 3,9 ± 2,8 | 4,0 ± 1,9 | 8,3 ± 1,17 | 7,9 ± 3,1 | 12,3 ± 13,5 |
| Miruši | 0 | 2 (2,4) | 0 | 4 (33,3) | 12 (36,4) |
| Vidējā dzīvildze mirušajiem, dienas (M ± SN) | — | 434 ± 331 | — | 307 ± 194 | 210 ± 88 |
| Vidējais novērošanas ilgums dzīvajiem, dienas (M ± SN) | 568 ± 96 | 581 ± 99 | 607 ± 105 | 616 ± 89 | 337 ± 246 |
* N – skaits; M – vidējais aritmētiskais; SN – standartnovirze; G – ļaundabīgā audzēja pakāpe.
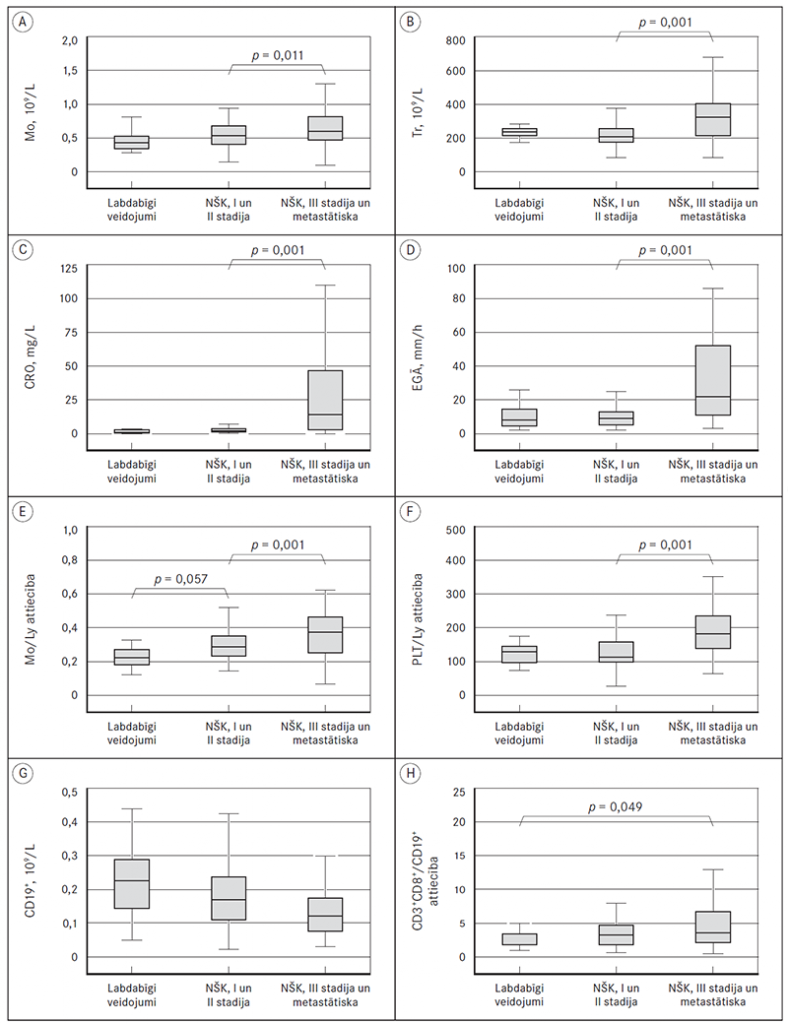
Statistiski ticama atšķirība starp labdabīgajiem veidojumiem, I, II, III stadijas un metastātiskiem nieru audzējiem tika novērota šādiem rādītājiem: Mo un Tr absolūtajam skaitam, kā arī EGĀ, CRO, Ne/Ly un Mo/Ly attiecībai, bet nevienai no limfocītu subpopulāciju absolūtajām vērtībām, izņemot CD19+ (sk. 2. tab.).
Ņemot vērā izlases heterogenitāti pacientu skaita ziņā, kā arī neparametrisko metožu zemo precizitāti, turpmāk tika izmantota one way ANOVA metode ar starpgrupu post hoc Tukey HSD testu rādītāju vidējo vērtību salīdzināšanai, pacientus klasificējot trīs apakšgrupās: ar labdabīgiem veidojumiem, lokalizētu NŠK (I un II stadija) un izplatītu NŠK (III stadija un metastātiski). Atsevišķi pacienti ar ekstremālām vērtībām (trīs gadījumi) no analizētās kopas tika izslēgti, jo pēc rezultātu pārbaudes – ar vai bez tām – netika konstatēta nozīmīga ietekme. Rezultāti liecināja par statistiski ticamām atšķirībām starp lokalizētiem un izplatītiem nieru audzējiem pēc šādiem rādītājiem: absolūtais leikocītu skaits (p = 0,020), Tr (p = 0,001), Mo (p = 0,011), CRO (p = 0,001), EGĀ (p = 0,001), LDH (p = 0,008), kā arī pēc šādām šūnu attiecībām: Tr/Ly (p = 0,001), Mo/Ly (p = 0,019). Bez iepriekš minētajām starpgrupu atšķirībām statistiskās ticamības līmeni sasniedza arī CD3+CD8+/CD19+ šūnu attiecība, bet tikai salīdzinājumā starp labdabīgiem nieru veidojumiem un progresējošu NŠK (p = 0,049). Savukārt vienīgais rādītājs, kurš nozīmīgi, bet ne statistiski ticami atšķīrās starp labdabīgiem veidojumiem un lokalizētu NŠK, bija Mo/Ly attiecība (p = 0,057). Uzskatāmības nolūkam būtiskākie rādītāji attēloti diagrammu veidā 1. attēlā, akcentējot statistiski nozīmīgās atšķirības starp grupām.
2. tabula. Asins iekaisuma un imunoloģisko parametru vidējo rangu salīdzinājums pacientiem ar labdabīgiem nieru veidojumiem un dažādu stadiju nieršūnu karcinomu, izmantojot Kruskall–Wallis testu (Mdn ± IQR) / The comparison of mean ranks of blood inflammatory and immunological parameters in patients with benign renal lesions and different stages of renal cell carcinoma by Kruskall-Wallis test (Mdn ± IQR)
| Rādītājs | Labdabīgi veidojumi (n = 19) | Nieršūnu karcinoma (n = 139) | p | |||
|---|---|---|---|---|---|---|
| I stadija (n = 85) | II stadija (n = 9) | III stadija (n = 12) | Metastāzes (n = 33) | |||
| Leu, 109/L | 5,18 ± 2,18 | 6,35 ± 2,36 | 6,24 ± 1,01 | 5,94 ± 3,96 | 6,67 ± 2,77 | 0,150 |
| Ne, 109/L | 2,89 ± 1,96 | 3,64 ± 1,71 | 3,09 ± 0,91 | 3,81 ± 2,66 | 3,64 ± 1,92 | 0,097 |
| Tr, 109/L | 236 ± 47 | 208 ± 79 | 203 ± 105 | 230 ± 203 | 338 ± 225 | 0,001 |
| Ly, 109/L | 2,01 ± 0,90 | 1,81 ± 0,78 | 1,80 ± 1,16 | 1,52 ± 0,64 | 1,43 ± 1,16 | 0,566 |
| Mo, 109/L | 0,43 ± 0,20 | 0,54 ± 0,27 | 0,58 ± 0,40 | 0,59 ± 0,50 | 0,61 ± 0,30 | 0,011 |
| CRO, mg/L | 0,9 ± 2,5 | 2,2 ± 3,33 | 3,4 ± 30,2 | 2,7 ± 24,4 | 14,2 ± 56,2 | 0,001 |
| EGĀ, mm/h | 8,0 ± 11,0 | 9,0 ± 10,7 | 13,0 ± 28,0 | 13,0 ± 47,0 | 29,0 ± 41,0 | 0,001 |
| LDH, U/L | 179 ± 36 | 167 ± 45 | 152 ± 44 | 160 ± 31 | 166 ± 88 | 0,239 |
| Ne / Ly | 1,79 ± 0,73 | 2,03 ± 1,31 | 1,75 ± 1,37 | 2,42 ± 0,61 | 2,52 ± 1,65 | 0,063 |
| Mo / Ly | 0,22 ± 0,11 | 0,29 ± 0,11 | 0,23 ± 0,17 | 0,31 ± 0,11 | 0,40 ± 0,26 | 0,002 |
| CD3+, 109/L | 1,30 ± 0,81 | 1,31 ± 0,57 | 1,42 ± 0,78 | 1,09 ± 0,55 | 1,12 ± 0,99 | 0,898 |
| CD3+, % | 73 ± 8 | 74 ± 11 | 78 ± 14 | 70 ± 14 | 75 ± 12 | 0,603 |
| CD3+CD4+, 109/L | 0,73 ± 0,62 | 0,77 ± 0,36 | 0,79 ± 0,36 | 0,61 ± 0,19 | 0,68 ± 0,45 | 0,408 |
| CD3+CD4+, % | 44 ± 13 | 45 ± 13 | 44 ± 12 | 41 ± 12 | 46 ± 16 | 0,215 |
| CD3+CD8+, 109/L | 0,58 ± 0,44 | 0,52 ± 0,36 | 0,64 ± 0,45 | 0,46 ± 0,43 | 0,39 ± 0,54 | 0,733 |
| CD3+CD8+, % | 27 ± 9 | 29 ± 13 | 30 ± 9 | 27 ± 15 | 29 ± 21 | 0,713 |
| CD38+, 109/L | 0,40 ± 0,26 | 0,37 ± 0,21 | 0,39 ± 0,26 | 0,36 ± 0,16 | 0,32 ± 0,18 | 0,865 |
| CD38+, % | 23 ± 7 | 21 ± 10 | 22 ± 14 | 23 ± 8 | 24 ± 9 | 0,587 |
| CD16+CD56+, 109/L | 0,31 ± 0,14 | 0,23 ± 0,20 | 0,19 ± 0,43 | 0,24 ± 0,20 | 0,22 ± 0,51 | 0,449 |
| CD16+CD56+, % | 16 ± 8 | 15 ± 10 | 11 ± 19 | 17 ± 16 | 13 ± 11 | 0,708 |
| CD19+, 109/L | 0,23 ± 0,17 | 0,16 ± 0,14 | 0,19 ± 0,62 | 0,16 ± 0,13 | 0,14 ± 0,74 | 0,028 |
| CD19+, % | 12 ± 6 | 9 ± 6 | 9 ± 3 | 11 ± 8 | 10 ± 8 | 0,123 |
| CD95+, 109/L | 0,96 ± 0,54 | 0,89 ± 0,48 | 0,94 ± 0,47 | 0,81 ± 0,10 | 0,73 ± 0,32 | 0,463 |
| CD95+, % | 50 ± 16 | 53 ± 14 | 57 ± 13 | 53 ± 13 | 48 ± 16 | 0,558 |
| CD4+ / CD8+ | 1,67 ± 0,83 | 1,58 ± 1,01 | 1,33 ± 0,43 | 1,63 ± 1,05 | 1,63 ± 1,44 | 0,634 |
Mdn – mediāna, IQR (interquartile range) – starpkvartiļu izkliede.
Leu – leikocīti, Ne – neitrofilie leikocīti, Tr – trombocīti, Ly – limfocīti, Mo – monocīti, Ne/Ly – neitrofilo leikocītu un limfocītu attiecība, Mo/Ly – monocītu un limfocītu attiecība, CRO – C reaktīvais olbaltums, EGĀ – eritrocītu grimšanas ātrums, LDH – laktātdehidrogenāze.
1. attēls. Atšķirības asins iekaisuma un imunoloģiskajos rādītājos pacientiem ar labdabīgiem nieru veidojumiem un lokalizētu un izplatītu nieršūnu karcinomu / Comparative values of blood inflammatory and immunological markers in patients with benign and localised and advanced renal cell carcinoma
Savstarpējo korelāciju analīzei starp dažādiem asins parametriem tika izmantots Spīrmena (Spearman) tests un pierādīta statistiski ticama sakarība starp vairākiem rādītājiem (sk. 3. tab.). Būtiskākās no tām turpmāk analizētas diskusijas sadaļā.
Lai noteiktu analizēto asins rādītāju ietekmi uz pacientu dzīvildzi, tika izmantotas divas metodes. Pirmkārt, tika izvērtēta rādītāju absolūto vērtību korelācija ar dienu skaitu no asins analīzes veikšanas brīža līdz nāves iestāšanās dienai vai novērojuma beigu datumam 01.11.2015., lietojot Spīrmena (Spearman) testu, un tika konstatētas statistiski ticamas korelācijas šādiem rādītājiem: Ne, Tr absolūto skaitu, CRO, EGĀ un LDH (sk. 4. tab.).
3. tabula. Savstarpējā korelācija pēc Spīrmena testa starp dažādiem pirmsterapijas asins iekaisuma un imunoloģiskajiem rādītājiem pacientiem ar nieru audzējiem / Reciprocal correlations between different blood inflammatory and immunological markers by Spearman test in patients with renal tumours
| Ne | Tr | Mo | CRO | EGĀ | CD3+ | CD3+ | CD38+ | CD16+ C56+ | CD19+ | CD95+ | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ne | rs | 1 | 0,43** | 0,49** | 0,36** | 0,13 | 0,18* | 0,11 | 0,11 | 0,11 | 0,06 | 0,06 |
| p | 0,001 | 0,001 | 0,001 | 0,105 | 0,029 | 0,177 | 0,206 | 0,163 | 0,502 | 0,442 | ||
| Tr | rs | — | 1 | 0,36** | 0,34** | 0,39** | 0,07 | 0,08 | 0,14 | 0,19* | −0,06 | 0,07 |
| p | 0,001 | 0,001 | 0,001 | 0,410 | 0,349 | 0,081 | 0,017 | 0,489 | 0,398 | |||
| Mo | rs | — | — | 1 | 0,38** | 0,10 | 0,32** | 0,28** | 0,20** | 0,18* | 0,11 | 0,23** |
| p | 0,001 | 0,235 | 0,001 | 0,001 | 0,012 | 0,025 | 0,163 | 0,004 | ||||
| CRO | rs | — | — | — | 1 | 0,51** | 0,02 | 0,07 | −0,05 | −0,04 | −0,08 | 0,10 |
| p | 0,001 | 0,787 | 0,406 | 0,573 | 0,677 | 0,344 | 0,210 | |||||
| EGĀ | rs | — | — | — | — | 1 | −0,09 | −0,09 | −0,03 | −0,06 | −0,11 | −0,04 |
| p | 0,274 | 0,260 | 0,704 | 0,483 | 0,165 | 0,605 | ||||||
| CD4+ | rs | — | — | — | — | — | 1 | 0,40** | 0,40** | 0,23** | 0,41** | 0,57** |
| p | 0,001 | 0,001 | 0,004 | 0,001 | 0,001 | |||||||
| CD8+ | rs | — | — | — | — | — | — | 1 | 0,27** | 0,21** | 0,12 | 0,67** |
| p | 0,001 | 0,009 | 0,151 | 0,001 | ||||||||
| CD38+ | rs | — | — | — | — | — | — | — | 1 | 0,63** | 0,37** | 0,41** |
| p | 0,001 | 0,001 | 0,001 | |||||||||
| CD16+ C56+ | rs | — | — | — | — | — | — | — | — | 1 | 0,31** | 0,28** |
| p | 0,001 | 0,001 | ||||||||||
| CD19+ | rs | — | — | — | — | — | — | — | — | — | 1 | 0,38** |
| p | 0,001 | |||||||||||
| CD95+ | rs | — | — | — | — | — | — | — | — | — | — | 1 |
| p | ||||||||||||
rs – Spīrmena korelācijas koeficients.
* – vāja korelācija.
** – vidēji stipra korelācija.
4. tabula. Statistiski nozīmīgās korelācijas pēc Spīrmena testa starp dažādu asins iekaisuma un imunoloģisko rādītāju absolūto skaitu un nieru audzēju dabu un stadiju (labdabīgs, I II, III stadija un metastātiska nieršūnu karcinoma) un dzīvildzi no laboratoriskā izmeklējuma veikšanas brīža līdz novērojuma beigām / Statistically significant correlations between blood inflammatory and immunological parameters (absolute figures) and type of renal tumour (benign, stage I, II, III and metastatic renal cell carcinoma) and survival time from the laboratory test up to the end of the study by Spearman test
| Rādītājs | Korelācija ar audzēja slogu atkarībā no ļaundabīguma un izplatības | Korelācija ar dienu skaitu no asins analīzes līdz nāves iestāšanās dienai vai novērojuma beigām (01.11.2015.) | ||||
|---|---|---|---|---|---|---|
| N | rs | p | N | rs | p | |
| Leu, 109/L | 154 | 0,18* | 0,024 | 154 | −0,152 | 0,060 |
| Ne, 109/L | 154 | 0,22** | 0,005 | 154 | −0,183* | 0,023 |
| Tr, 109/L | 154 | 0,27** | 0,001 | 154 | −0,301** | 0,001 |
| Ly, 109/L | 155 | −0,13 | 0,096 | 155 | 0,049 | 0,544 |
| Mo, 109/L | 154 | 0,25* | 0,002 | 154 | −0,87 | 0,281 |
| CRO, mg/L | 148 | 0,49** | 0,001 | 148 | −0,289** | 0,001 |
| EGĀ, mm/h | 149 | 0,39** | 0,001 | 149 | −0,300** | 0,001 |
| LDH, U/L | 151 | −0,01 | 0,924 | 151 | −0,160* | 0,050 |
| CD3+, 109/L | 155 | −0,05 | 0,537 | 155 | 0,005 | 0,954 |
| CD3+CD4+, 109/L | 155 | −0,045 | 0,576 | 155 | −0,117 | 0,145 |
| CD3+CD8+, 109/L | 155 | 0,010 | 0,903 | 155 | 0,068 | 0,400 |
| CD38+, 109/L | 155 | −0,070 | 0,390 | 155 | −0,043 | 0,594 |
| CD16+CD56+, 109/L | 155 | −0,150 | 0,062 | 155 | 0,086 | 0,287 |
| CD19+, 109/L | 155 | −0,247** | 0,002 | 155 | 0,086 | 0,285 |
| CD95+, 109/L | 155 | −0,132 | 0,102 | 155 | −0,004 | 0,965 |
| CD4+ / CD8+ | 155 | −0,033 | 0,684 | 155 | −0,146 | 0,069 |
N – pacientu skaits, rs – Spīrmena korelācijas koeficients.
* – vāja korelācija.
** – vidēji stipra korelācija.
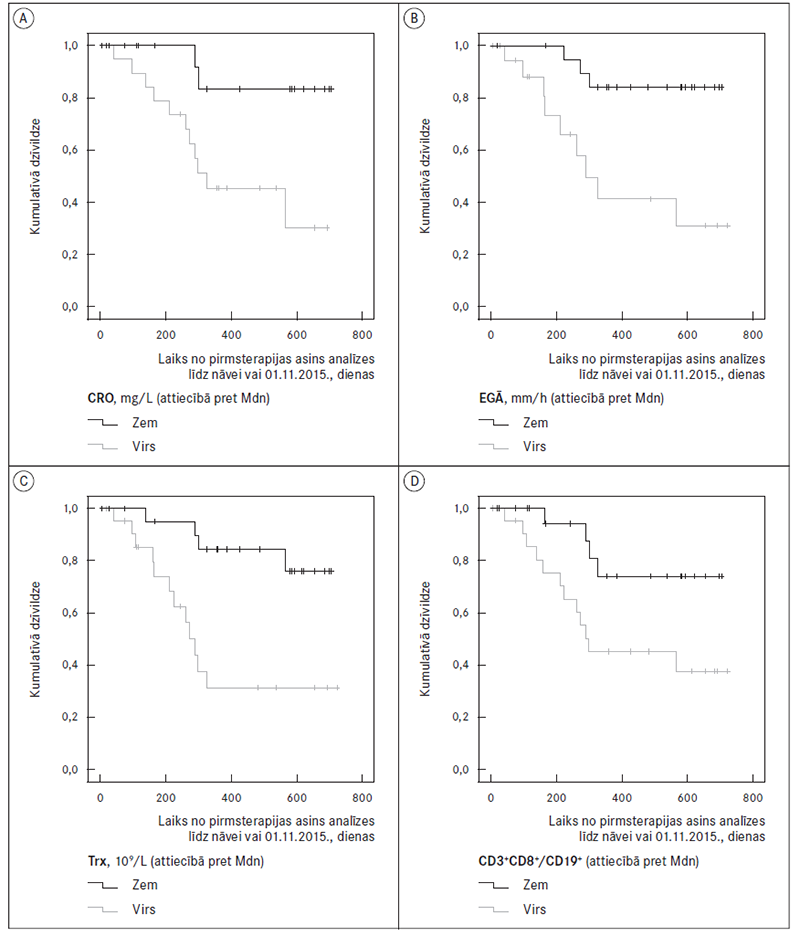
Otrkārt, tika veikta dzīvildzes analīze pacientiem ar primāri izplatītu (III stadija) un metastātisku NŠK, jo lokalizēta nieru vēža gadījumu kopā (I un II stadija) pētījuma laikā tika konstatēti tikai divi nāves gadījumi. Ņemot vērā pacientu mazo skaitu, dzīvildzes salīdzināšana tika veikta nevis atbilstoši laboratorijas referentām vērtībām (zem normas, norma vai virs normas), bet pacientus iedalot divās grupās – ar augstu vai zemu rādītāju, par robežvērtību izvēloties mediānu. Tas nozīmē, ka asins parametru ietekme uz izdzīvotību pacientiem ar progresējošu NŠK tika analizēta, nosakot dzīvildzes līkņu izkliedi starp pacientu grupām ar rādītāja esamību zem vai virs mediānās vērtības. Dzīvildzes analīzei pēc Kaplan–Meier metodes, lietojot Log rank, Breslow, Tarone Ware testus, tika konstatēta statistiski ticama ietekme uz izdzīvotību šādiem faktoriem: Tr (p = 0,002), CRO (p = 0,011), EGĀ (p = 0,002) un CD3+CD8+/CD19+ attiecībai (p = 0,023) (sk. 2. att.).
2. attēls. Kaplan–Meier dzīvildzes līknes pacientiem ar III stadijas un metastātisku nieršūnu karcinomu atkarībā no asins iekaisuma un imunoloģisko rādītāju esamības zem vai virs mediānās (Mdn) vērtības / Kaplan–Meier survival curves according to blood inflammatory and immunological parameters in patients with locally advanced and metastatic renal cell carcinoma
Diskusija
C reaktīvā olbaltuma līmeņa pieaugums, audzējam progresējot, ir pārliecinošs, sasniedzot statistiskās ticamības līmeni, neatkarīgi no izmantotās metodes. Pētījumā novērojām būtisku CRO vidējo vērtību atšķirību gan starp pacientiem ar labdabīgiem nieru jaunveidojumiem un NŠK, gan starp pacientiem ar dažādām NŠK stadijām (sk. 2. tab.). No visiem analizētajiem rādītājiem CRO piemita visciešākā korelācija ar audzēja raksturu un izplatību, pieņemot, ka labdabīgu veidojumu gadījumā tas ir 0, lokalizētas NŠK gadījumā atbilstoši tās stadijai, bet metastātiska vēža gadījumā – 4 (sk. 4. tab.). Turklāt vienfaktora dzīvildzes analīze pierādīja statistiski nozīmīgu līkņu izkliedi starp grupām ar CRO virs vai zem mediānās vērtības, III stadijas un metastātiskiem NŠK pacientiem, liecinot par sliktāku slimības prognozi grupā ar augstu CRO (sk. 2. att.).
Minētie rezultāti vēlreiz apliecina, ka CRO paaugstināšanās ir vērojama jau agrīnās audzēja attīstības stadijās (Allin and Nordestgaard, 2011). Lai gan šī rādītāja jutība un specifiskums ir zems, to, iespējams, varētu izmantot kā palīglīdzekli ļaundabīgu veidojumu diferencēšanai no labdabīgiem. Ar ticamu varbūtību var pieņemt, ka tieši CRO ir viens no būtiskākajiem parametriem, ar kuru varētu papildināt kādu no jau esošajām prognozes skalām, paaugstinot to precizitāti, piemēram, Leiboviča (Leibovich) nomogrammu lokālas NŠK gadījumā recidīva prognozei (Leibovich et al., 2003) vai Henga (Heng) piedāvāto algoritmu metastātisku NŠK pacientu stratifikācijai riska grupās, nozīmējot sistēmisku medikamentozo terapiju (Heng et al., 2013).
Turklāt, ņemot vērā CRO īso pussabrukšanas periodu, vēža pacientiem, kam nav datu par citas etioloģijas iekaisumu dažu iepriekšējo dienu laikā pirms marķiera noteikšanas (infekcija, sistēmiska saistaudu slimība, būtisks audu bojājums, piemēram, miokarda infarkts vai trauma), audzējs diezgan ticami ir uzskatāms par vienīgo iemeslu CRO kāpumam (Hu et al., 2014).
CRO paaugstināšanās audzēja gadījumā varētu būt skaidrojama ar pieaugošo fosfoholīna ekspresiju sakarā ar pastiprinātu šūnu bojāeju vēža gadījumā. Tas varētu norādīt, piemēram, uz nekrozi hipoksisku audzēju gadījumā. Savukārt īslaicīga CRO paaugstināšanās varētu liecināt par citotoksiskās vēža terapijas efektu, norādot uz audzēja šūnu destrukciju. Tā kā audzēja izraisīta paaugstināta IL-6 un TNFα sintēze veicina CRO produkciju hepatocītos, tas netieši norāda uz augstu šo iekaisuma mediatoru koncentrāciju asinīs.
Līdzīgi kā CRO, arī EGĀ (pēc kapilārās fotometrijas metodes) kāpums pacientiem ar NŠK bija saistīts gan ar audzēja progresiju, gan sliktāku prognozi. Iegūtie rezultāti maz atšķiras no CRO. Lai gan starp CRO un EGĀ vērtībām pastāv vidēji cieša pozitīva korelācija (rs = 0,51; p < 0,001), tomēr tā nav absolūta. Ņemot vērā, ka šos rādītājus ietekmējošie faktori ir gan kopīgi, gan atšķirīgi, ir pamats uzskatīt, ka tie liecina par nieru vēža progresiju un prognozi arī neatkarīgi viens no otra, jo tikai daļai pacientu ir vērojams vienlaicīgs abu parametru pieaugums. Atšķirībā no CRO, kas ir labi zināms akūtās fāzes proteīns, EGĀ paaugstināšanās vairāk liecina par hroniska iekaisuma persistenci, un šajā ziņā tas varētu būt lietderīgs rādītājs vēža izraisītam audu bojājumam, pat neskatoties uz pēdējā laikā zaudēto nozīmīgumu. EGĀ paaugstināšanās NŠK pacientiem var liecināt gan par asins viskozitātes pieaugumu, gan fibrinogēna koncentrācijas paaugstināšanos, kas arī ir viens no akūtās iekaisuma fāzes proteīniem, kuru sintezē hepatocīti, bet atšķirībā no CRO tā pussabrukšanas laiks ir ievērojami garāks (Coico and Sunshine, 2015). EGĀ kāpumu varētu skaidrot arī ar imūnglobulīnu paaugstinātu sintēzi plazmocītos B limfocītu aktivācijas rezultātā.
Pretēji gaidītajam no literatūras apkopojuma (Donskov, 2013) par neitrofilijas negatīvo nozīmi attiecībā uz dzīvildzes prognozi pacientiem ar dažādiem audzējiem, tai skaitā NŠK, savā pētījumā nenovērojām statistiski ticamu cirkulējošo Ne leikocītu skaita atšķirību pacientiem ar dažādām NŠK stadijām, izņemot starp labdabīgiem veidojumiem un metastātisku NŠK. Tāpat netika konstatēta Ne leikocītu skaita virs mediānās vērtības statistiski ticama ietekme uz III stadijas un metastātisku NŠK pacientu dzīvildzi. Mūsu pētījuma rezultāti liek domāt, ka intratumorālo Ne leikocītu skaitam ir lielāka nozīme NŠK prognozē nekā to skaitam perifēriskajās asinīs. Viens no skaidrojumiem tam varētu būt, ka, salīdzinot ar audzēja vidi, kur šo šūnu ir relatīvi maz, asinīs tās veido lielāko balto asinsķermenīšu pūlu, līdz ar to svārstības ir mazāk pamanāmas. Turklāt ļoti iespējams, ka vēzi infiltrējošiem Ne leikocītiem piemīt neatkarīga imūnsupresīva darbība, kas izpaužas tikai paša audzēja mikrovidē. Turklāt, audzējam progresējot, tas ne tik daudz izraisa Ne absolūtā skaita izmaiņas, cik maina to raksturu un funkcijas, pieaugot jauno, nenobriedušo šūnu skaitam, piemēram, uz granulocītu rindas – mieloīdās izcelsmes supresoro šūnu (Gr-MDSC; Granulocytic Myeloid-derived Suppressor Cells) rēķina, kuras rutīnas asins ainā nav diferencējamas (Dumitru et al., 2012).
Pēc CRO un EGĀ nākamais informatīvākais rādītājs, kas liecina par pieaugošu audzēja slogu (slimības plašāku izplatību) organismā, ir Tr skaita paaugstināšanās. Šajā ziņā analizētie dati saskan ar literatūrā minēto. Atsaucoties uz metaanalīzi, kurā apkopoti rezultāti par 47 pētījumiem, var secināt, ka augsts CRO, EGĀ un trombocitoze ir sliktas prognozes rādītāji pacientiem ar NŠK attiecībā uz kopējo, audzējspecifisko un bezrecidīva dzīvildzi (Wu et al., 2011). Atšķirībā no CRO un EGĀ trombocitoze ir viens no faktoriem, kuru šobrīd izmanto pacientu stratifikācijai riska grupās, lai nozīmētu medikamentozo terapiju (Ljundberg et al., 2014). Jāpiebilst, ka starp trombocītu skaitu un CRO, kā arī EGĀ ir vērojama vidēji stipra pozitīva korelācija (attiecīgi: rs = 0,34, p < 0,001; rs = 0,39; p < 0,001), tādējādi norādot uz to, ka daļai pacientu ir vērojams visu trīs rādītāju kāpums. Skaidrojums tam varētu būt tāds, ka vai nu minētie rādītāji līdzīgi raksturo hroniska iekaisuma klātbūtni, vai arī to patoģenēzes mehānismi ir savstarpēji vienoti. Viens no iemesliem Tr skaita pieaugumam pacientiem ar NŠK varētu būt saistībā ar IL-6 trombopoēzi stimulējošo darbību, kas tādā gadījumā izskaidro ciešo korelāciju starp Tr skaitu un CRO. Analizējot Tr skaita vērtību mediānu atšķirības pacientiem ar labdabīgiem nieru veidojumiem un dažādu stadiju NŠK (sk. 2 tab.), var secināt, ka visbūtiskāko kāpumu vēro pacientiem ar metastātiskiem audzējiem. I un II stadijā Tr skaits pat pazeminās, salīdzinot ar labdabīgo veidojumu grupu. Tādēļ jādomā, ka Tr pieaugums visvairāk saistīts ar NŠK plašāku izplatību un, iespējams, varētu būt netiešs audzēja metastazēšanās vai izplatības raksturlielums.
Mo skaits arī ir viens no rādītājiem, kuram pierādījām statistiski ticamu korelāciju ar audzēja progresiju. Apskatot šī rādītāja vērtību mediānas pacientiem ar labdabīgiem nieru audzējiem un dažādas izplatības pakāpes NŠK (sk. 2. tab.), vērojams Mo skaita pieaugums jau agrīnā vēža attīstības posmā – no 0,43 ± 0,20 (Mdn ± IQR) labdabīgiem veidojumiem līdz 0,54 ± 0,27 I stadijas NŠK. Atšķirībā no Tr, kuru skaita pieaugums korelē gan ar vēža stadiju, gan sliktāku dzīvildzi, izmaiņas Mo skaitā neliecina par izdzīvotības prognozi (p = 0,126). Izvērtējot šūnu savstarpējās korelācijas, redzams, ka no visiem hematoloģiskiem parametriem Mo skaits ir vienīgais, kurš statistiski ticami korelē ar gandrīz visām no analizētajām Ly subpopulācijām, izņemot CD19+ šūnas (sk. 3. tab.). Tāpat vērojama vidēji cieša korelācija ar CRO, bet tādas nav ar EGĀ. Minētais norāda uz to, ka Mo skaita izmaiņas, visticamāk, saistītas ne tikai ar audzēja izraisīto nespecifiskā iekaisuma reakciju, bet arī ar vēža ietekmēto imūnās sistēmas atbildi.
Turpmāk minēti daži iespējamie skaidrojumi Mo skaita pieaugumam perifērajās asinīs, audzējam progresējot:
- Pēc nokļūšanas cirkulācijā no kaulu smadzenēm, monocīti migrē uz audiem, kur tie kļūst par infiltrējošiem makrofāgiem (Chanmee et al., 2014). NŠK gadījumā audzēja mikrovidē esošo makrofāgu skaits ir ievērojami lielāks nekā normālos nieru audos un liecina par sliktāku prognozi (Santoni et al., 2013). Ļoti iespējams, ka labdabīgu veidojumu gadījumā makrofāgu infiltrācija nav tik izteikta un mononukleāro fagocītu sistēma tiek aktivēta līdz ar ļaundabīgo šūnu attīstības sākumu. Tādēļ Mo skaita pieaugams vērojams jau agrīnās NŠK stadijās.
- Tā kā Mo skaita kāpums nav saistīts ar sliktāku dzīvildzi, tas, visticamāk, skaidrojams ar normālu organisma imūnās sistēmas reakciju uz audzēju bez būtiskas ietekmes uz prognozi. Par to daļēji liecina arī pozitīvā korelācija ar CD3+CD4+ un CD3+CD8+ šūnu skaitu (attiecīgi: rs = 0,32, p < 0,001; rs = 0,28; p < 0,001). Būtu interesanti noskaidrot, kurš no Th apakštipiem (Th1, Th2, Treg vai kāds cits) nosaka CD3+CD4+ šūnu skaita pieaugumu.
Lietojot plūsmas citometrijas metodi, B limfocītu diferencēšanai kā standarta marķieris tiek izmantota antiviela pret CD19+. Jāatzīmē, ka šis limfocītu virsmas antigēns raksturīgs visām B šūnu attīstības stadijām, izņemot antivielas (AV) sintezējošiem plazmocītiem. Savā pētījumā konstatējām, ka CD19+ šūnu skaits statistiski ticami atšķiras pacientiem ar labdabīgiem nieru veidojumiem un metastātisku NŠK, turklāt ir vērojama šo šūnu vērtību mediānu samazināšanās tendence līdz ar vēža stadiju, tomēr nesasniedzot statistiskās ticamības līmeni (sk. 2. tab.). B šūnu skaitam ir vērojama samērā cieša pozitīva korelācija ar CD3+CD8+, t. i., citotoksiskiem T limfocītiem (rs = 0,67; p < 0,001) un līdzīgi arī ar CD3+CD4+ – T līdzētājšūnām (rs = 0,57; p < 0,001).
Pilnai B šūnu aktivācijai un to transformācijai plazmocītos, kuri sintezē imūnglobulīnus, ir nepieciešami vismaz divi signāli. Pirmo nodrošina uz B šūnas virsmas esošais specifiskā antigēna receptors, otru – kostimulējošais signāls, kuru B šūna saņem no T līdzētājšūnas (T-helper; Th) ar CD40 un tā liganda starpniecību. CD19+ šūnu samazināšanās, audzējam progresējot, varētu būt skaidrojama ar vairākiem iemesliem:
- T līdzētājšūnas diferencējas Th2 virzienā, kuras aktīvi piedalās humorālās imunitātes stimulācijā, veicinot B šūnu nobriešanu par AV (īpaši IgE un IgG1) sekretējošām šūnām (Elasser-Beile, 1999). Savukārt IgE, kā zināms, reaģējot ar īpašiem antivielu saistošiem Fc (fragment crystallizable) receptoriem uz bazofilo (Ba) un eozinofilo (Eo) leikocītu virsmas, ierosina to aktivāciju un skaita pieaugumu. Līdz ar to par T līdzētājšūnu diferenciāciju Th2 virzienā netieši varētu spriest arī pēc Eo un Ba šūnu skaita pieauguma.
- Par paaugstinātu plazmas šūnu sintēzi, vienlaikus samazinoties CD19+ šūnām, netieši varētu liecināt arī CD38+ šūnu skaita pieaugums. Lai gan CD38 ir virsmas antigēns, kas tiek ekspresēts uz dažādu imūnkompetento šūnu virsmas, tomēr B limfocītiem tas ir raksturīgs tikai kaulu smadzeņu priekšteču šūnām un plazmocītiem, bet ne nobriedušām AV nesintezējošām B šūnām (Malavasi et al., 2008). Šādu korelāciju savā darbā nenovērojām (sk. 3. tab.).
- CD19+ šūnu samazināšanās var liecināt arī par B limfocītu priekšteču sintēzes nomākumu. Tādā gadījumā, samazinoties CD19+ šūnu skaitam, vajadzētu pazemināties arī CD38+ šūnu daudzumam, jo CD38 ir virsmas marķieris, kuru ekspresē arī kopējā limfocitārās rindas cilmes šūna. Tā kā starp abiem rādītājiem pastāv pozitīva, vidēji cieša korelācija (rs = 0,37; p < 0,001), tas varētu būt ticams iemesls. Vēl jo vairāk tāpēc, ka CD38+ šūnu skaits diezgan cieši korelē ar gandrīz visām Ly subpopulācijām (sk. 3. tab.).
- Audzējam progresējot, pieaug B šūnu infiltrācija tā audos, it īpaši vēlīnās stadijās. Par to var spriest pēc divu pētījumu rezultātiem ar atšķirīgu atradi. Pirmajā no tiem tika analizēts vairāku limfocītu subpopulāciju relatīvais daudzums audzēja audos, nieru vēnā un perifērajās asinīs galvenokārt pacientiem ar lokalizētiem audzējiem, secinot, ka perifērajās asinīs B šūnas (CD19+) bija 9,7 %, bet NŠK audos tikai 0,9 % no visiem limfocītiem (Kopecky et al., 2007). Savukārt otra pētījuma atrade pacientiem ar vēlīno stadiju NŠK, gluži pretēji, norādīja, ka audzēju infiltrējošo B limfocītu attiecība pret to skaitu perifērajās asinīs bija 2,4 (Shabtai et al., 2002). Šī pretrunīgā atrade, visticamāk, skaidrojama ar cirkulējošo B šūnu pastiprinātu migrāciju audzējā, tam attīstoties un progresējot. Tas varētu būt viens no vienkāršākajiem skaidrojumiem cirkulējošo CD19+ šūnu skaita samazinājumam, pieaugot audzēja stadijai.
Apskatot šūnu skaita vērtību mediānas labdabīgiem veidojumiem un NŠK dažādās stadijās, skaidri iezīmējas tendence Ly skaitam samazināties un Ne, Tr, Mo skaitam augt (sk. 2. tab.). Tādēļ, šķiet, ka minēto šūnu attiecības pret Ly skaitu varētu būt efektīvāks prognozes marķieris nekā katrs no šiem rādītājiem atsevišķi. Tomēr, veicot vienfaktora dzīvildzes analīzi pēc Kaplan–Meier metodes pacientiem ar III stadijas un metastātisku NŠK, vienīgā no attiecībām, kurai izdevās pierādīt statistiski ticamu ietekmi uz dzīvildzi, par robežvērtību pieņemot rādītāja mediānu, bija Tr/Ly, tomēr arī ar zemāku pierādījuma līmeni nekā Tr skaitam atsevišķi.
Meklējot skaidrojumu šai pretrunīgajai atradei, tika analizētas Ne, Ly, Mo un Tr savstarpējās korelācijas pēc Spīrmana (Spearman) metodes (sk. 3. tab.), konstatējot, ka Ly skaits pieaug līdz ar Ne un Mo skaitu (attiecīgi: rs = 0,21, p = 0,011; rs = 0,37; p < 0,001). Savukārt Tr skaitam netika konstatēta statistiski ticama korelācija ar Ly skaitu. Tātad, neskatoties uz Ly samazināšanās tendenci, pieaugot NŠK stadijai, starp cirkulējošo Ne, Mo un Ly skaitu vērojama pozitīva, nevis negatīva korelācija, tādēļ šo šūnu attiecības būtiski neuzlabo to prognozes vērtību. Savukārt Ly skaita izmaiņas diezgan ticami notiek tieši uz CD19+ šūnu rēķina, kas ir no citiem parametriem neatkarīgs rādītājs.
CD3+CD8+ attiecībai pret CD19+ šūnām, t. i., citotoksisko / supresoro / atmiņas T limfocītu pret AV nesekretējošām B šūnām, veicot Kaplan–Meier analīzi, tika pierādīta statistiski nozīmīga ietekme u z dzīvildzi pacientiem ar III stadijas un metastātisku NŠK (p = 0,023), par robežvērtību izvēloties 3,54, kas bija analizētās pacientu grupas rādītāju mediāna (sk. 2. att.). Katram atsevišķi no minētajā attiecībā iekļautajiem rādītājiem nebija statistiski ticamas ietekmes uz dzīvildzi pēc Log Rank testa. CD3+CD8+ šūnu skaita pieaugums, NŠK progresējot, visticamāk, notiek uz atmiņas šūnu rēķina, bet, vienlaicīgi samazinoties CD19+ šūnu skaitam, attiecība ir informatīvāka nekā katrs rādītājs atsevišķi.
Secinājumi
- Visbūtiskākā mainība atkarībā no nieru audzēju dabas (ļaundabīgs vai nē) un nieršūnu karcinomas stadijas tika novērota Tr un Mo absolūtajam skaitam, CRO un EGĀ, kā arī CD19+ šūnām (B limfocītiem).
- Mo/Ly attiecība ir vienīgais rādītājs, kurš statistiski ticami atšķir labdabīgus veidojumus no lokalizētas nieršūnu karcinomas.
- Ne/Ly attiecībai netika novērota statistiski ticama atšķirība starp labdabīgiem nieru jaunveidojumiem un nieršūnu karcinomu, kā arī starp lokalizētu un metastātisku nieršūnu karcinomu.
- Tr/Ly attiecība statistiski ticami atšķīrās starp lokalizētas un metastātiskas nieršūnu karcinomas grupām, bet ne starp labdabīgiem veidojumiem un lokalizētu nieršūnu karcinomu. Tr skaita pieaugums vispārliecinošāk liecināja par vēža disemināciju.
- Pētījuma laikā (no 25.11.2013. līdz 01.11.2015.) bija miruši 33,3 % III stadijas un 36,4 % metastātiskas nieršūnu karcinomas pacientu. Šajā pacientu grupā būtiskākā ietekme uz dzīvildzi tika novērota Tr absolūtajam skaitam, CRO un EGĀ, kā arī Tr/Ly attiecībai un CD3+CD8+/CD19+ šūnu attiecībai.
Abstract
Correlation between Inflammatory and Immunological Markers and Prognosis of Patients with Renal Cell Carcinoma
Chronic inflammation and immune alterations that are connected to it are essential in the development of renal cell carcinoma (RCC). They are mostly observed in the tumour environment, but their reflection in peripheral blood makes them easier available for analyses and dynamic measurements. The aim of the study is to define those easily identifiable inflammatory and immune markers in peripheral blood that correlate with the stage of RCC and demonstrate statistically significant changes during the progression of the disease, in order to evaluate their potential significance in diagnostics and prognosis.
Data from 158 patients with morphologically proved renal tumours were collected at REUS clinic. The following laboratory data were collected for all patients before the treatment: C reactive protein (CRP), erythrocyte sedimentation rate (ESR), lactatdehydrogenase (LDH), absolute leucocyte (L), neutrophil leucocyte (Ne), monocyte (Mo), lymphocyte (Ly), platelet (PLT) counts, which were analysed with routine methods, and following lymphocyte subpopulations (CD3+; CD3+CD4+; CD3+CD8+; CD38+; CD16+CD56+; CD19+; CD95+; CD4/CD8 by using flow cytometry. Most significant changes in regards to the presence of RCC and its stage were observed for PLT and Mo count, CRP and ESR, as well as CD19+ cells (B lymphocytes). Mo/Ly ratio was the only parameter that statistically significantly distinguished benign tumours from localised RCC. While PLT/Ly ratio was found to be significantly different between localised and metastatic RCC. For the patients in stage III and metastatic disease the most significant impact on cancer specific survival was observed for PLT absolute count, CRP and ESR, as well as PLT/Ly and CD8+/CD19+ ratios.
Literatūra
- Allgemeine Psychologie und Arbeitspsychologie. Heinrich Heine Universität Düsseldorf. 20.11.2015. Iegūts no: http://www.gpower.hhu.de/en.html.
- Allin, K. H. and Nordestgaard, B. G. Elevated C-reactive protein in the diagnosis, prognosis, and cause of cancer. Crit Rev Clin Lab Sci. 2011, 48(4), 155–170.
- Brandau, S., Dumitru, C., and Lang, S. Protumor and antitumor functions of neutrophil granulocytes. Semin Immunopathol. 2013, 35, 163–176.
- Chanmee, T., Ontong, P., Konno, K., and Itano, N. Tumor-associated macrophages as major players in the tumor microenvironment. Cancers (Basel). 2014, 6(3), 1670–1690.
- Coico, R. and Sunshine, G. Immunology: A Short Course. 7th ed. Oxford: John Wiley & Sons, 2015.
- Donskov, F. Immunomonitoring and prognostic relevance of neutrophils in clinical trials. Semin Cancer Biol. 2013, 23, 200–207.
- Dumitru, C., Moses, K., Trellakis, S., Lang, S., and Brandau, S. Neutrophils and granulocytic myeloid-derived suppressor cells: Immunophenotyping, cell biology and clinical relevance in human oncology. Cancer Immunol Immunother. 2012, 61, 1155–1167.
- Elsässer-Beile, U., Grussenmeyer, T., Gierschner, D., et al. Semiquantitative analysis of Th1 and Th2 cytokine expression in CD3+, CD4+, and CD8+ renal-cell-carcinoma-infiltrating lymphocytes. Cancer Immunol Immunother. 1999, 48(4), 204–208.
- Heng, D. Y. C., Xie, W., Regan, M. M., et al. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: A population-based study. Lancet Oncol. 2013, 14, 141–148.
- Kopecky, O., Lukesova, S., Vroblova, V., et al. Phenotype analysis of tumour-infiltrating lymphocytes and lymphocytes in peripheral blood in patients with renal carcinoma. Acta Medica Cordoba. 2007, 50, 207–212.
- Leibovich, B. C., Blute, M. L., Cheville, J. C., et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: A stratification tool for prospective clinical trials. Cancer. 2003, 97(7), 1663–1671.
- Ljungberg, B., Bensalah, K., Canfield, S., et al. EAU Guidelines on renal cell carcinoma: 2014 update. Eur Urol. 2015.
- Malavasi, F., Deaglio. S., Funaro, A., Ferrero, E., Horenstein, A. L., Ortolan, E., Vaisitti, T., Aydin, S. Evolution and function of the ADP ribosyl cyclase / CD38 gene family in physiology and pathology. Physiol Rev. 2008 Jul, 88(3), 841–886.
- Mantovani, A., Allavena, P., Sica, A., and Balkwill, F. Cancer-related inflammation. Nature. 2008, 454(7203), 436–444.
- Santoni, M., Massari, F., Amantini, C., et al. Emerging role of tumor-associated macrophages as therapeutic targets in patients with metastatic renal cell carcinoma. Cancer Immunol Immunother. 2013, 62(12), 1757–1768.
- Senovilla, L., Vacchelli, E., Galon, J., et al. Prognostic and predictive value of the immune infiltrate in cancer trial watch. Oncoimmunology. 2012, 1(November), 1323–1343.
- Shabtai, M., Ye, H., Frischer, Z., Martin, J., Waltzer, W. C., Malinowski, K. Increased expression of activation markers in renal cell carcinoma infiltrating lymphocytes. J Urol. 2002, 168(5), 2216–2219.
- Wu, Y., Fu, X., Zhu, X., et al. Prognostic role of systemic inflammatory response in renal cell carcinoma: A systematic review and meta-analysis. J Cancer Res Clin Oncol. 2011, 137, 887–896.


