Kalprotektīna līmeņa un to iespējamo ietekmējošo faktoru salīdzinājums pacientu grupās ar čūlaino kolītu un hronisku obstruktīvu plaušu slimību Paula Stradiņa Klīniskajā universitātes slimnīcā
Kopsavilkums
Ievads. Kalprotektīns ir samērā jauns iekaisuma biomarķieris, kas atrodams visos cilvēka sekrētos. Mums likās interesanti noskaidrot fēču kalprotektīna un to ietekmējošo faktoru izmaiņas starp čūlainā kolīta (ČK) slimniekiem un slimniekiem ar hronisku obstruktīvu plaušu slimību (HOPS).
Darba mērķis. Analizēt kalprotektīna līmeni un tā noteikšanas metodes, salīdzinot pacientu grupas ar čūlaino kolītu un hronisku obstruktīvu plaušu slimību.
Materiāls un metodes. Pilotpētījumā tika iesaistīti 45 pacienti ar vidēji smagu vai smagu čūlaino kolītu (n = 25) un HOPS (n = 20). Sākotnējā darba etapā par visiem pacientiem tika savākti, apkopoti un analizēti dati, salīdzinot abas pacientu grupas: I grupa – pacienti ar čūlaino kolītu, II grupa – pacienti ar HOPS. Darba gaitā tika salīdzinātas divas kalprotektīna noteikšanas metodes Paula Stradiņa Klīniskās universitātes slimnīcas (PSKUS) Imunoloģijas laboratorijā: imūnfermentatīvā automatizētā ELISA metode Alegria un imūnhromatogrāfijas metode CalFast.
Rezultāti. Divdesmit pieci (55,6 %) pacienti bija ar čūlainā kolīta diagnozi un 20 (44,4 %) pacienti – ar HOPS diagnozi. Vidējais vecums I grupā – 39 ± 11 gadi, II grupā – 66 ± 10 gadi. Abām grupām novērtējām pilnas asinsainas rādītājus un CRO. Salīdzinot kalprotektīna rādītājus starp abām grupām, tika konstatēta statistiski ticama atšķirība (p = 0,01). Kalprotektīna rādītājs bija pozitīvs 21 (84 %) pacientam ar čūlaino kolītu un sešiem (30 %) pacientiem ar HOPS.
Secinājumi. Augstāka kalprotektīna vērtība vairāk ir raksturīga pacientiem ar vidējas un smagas gaitas čūlaino kolītu nekā pacientiem ar vidējas un smagas gaitas HOPS. Daļai pacientu ar HOPS konstatē paaugstinātu kalprotektīna līmeni fēcēs, bet tas ir skaitliski zemāks, salīdzinot ar pacientiem, kuriem ir ČK, ko daudzos gadījumos var izskaidrot ar HOPS, bet daļai pacientu nepieciešams tālāks klīniskais izvērtējums. PSKUS lietotās kalprotektīna noteikšanas metodes fēcēs – ELISA Alegria un CalFast – ir salīdzināmas, tomēr ir nepieciešama sīkāka references intervālu izpēte.
Ievads
Kalprotektīns ir samērā jauns iekaisuma biomarķieris, ko pašreiz medicīnā izmanto kā diagnostisko rādītāju fēcēs pie iekaisīgām zarnu slimībām (IZS), t. i., čūlainā kolīta un Krona slimības. Fēču biomarķieris kalprotektīns tiek izmantots, lai monitorētu IZS aktivitāti un terapijas efektivitāti. Šo testu galvenokārt lieto, lai atklātu zarnu iekaisumu un novērtētu tā smagumu.
Kalprotektīna patofizioloģijas mehānismi nav skaidri zināmi, tiek novērotas jaunas un jaunas kalprotektīna īpašības.
Kalprotektīns ir divu kalcija saistošu proteīnu heterodimērs, kas atrodas neitrofilo leikocītu citoplazmā un ekspresējas uz monocītu membrānas. Pēc neitrofilo leikocītu aktivizēšanas vai monocītu endotēlija adhēzijas kalprotektīns tiek atbrīvots un to var noteikt serumā vai ikvienā ķermeņa šķidrumā kā klīniskā iekaisuma marķieri (Bhardwaj et al., 1992; Striz and Trebichavsky, 2004).
Pirmo reizi kalprotektīnu aprakstīja Fagerhol et al. 1980. gadā. Turpmāk to sāka aktīvi izpētīt daudzi zinātnieki.
Roseth un kolēģi 1997. gadā pirmo reizi ziņoja, ka paaugstināts kalprotektīna līmenis novērojams iekaisīgu zarnu slimību gadījumos (Roseth et al., 1997). 21. gadsimta sākumā veikti daudzi pētījumi, kuros tika konstatēta kalprotektīna nozīme iekaisīgu zarnu slimību diagnostikā. Pēc jaunākajiem datiem NICE vadlīnijās 2013. gadā tika paziņots par iespējamo kalprotektīna kā fēču biomarķiera izmantošanu klīniskajā praksē. Pirmkārt, kalprotektīns ir laba skrīninga metode iekaisīgu zarnu slimību primārajā aprūpē. Otrkārt, to var izmantot iekaisīgu zarnu slimību aktivitātes noteikšanai un terapijas efektivitātes monitoringā (Waugh et al., 2013).
Lai gan NICE vadlīnijās kalprotektīna līmeņa noteikšana ir rekomendēta iekaisīgu zarnu slimību diagnostikā, tas joprojām tiek plaši pētīts daudzās medicīnas jomās. Tas saistīts ar to, ka kalprotektīns atrodams visos cilvēka sekrētos – asinīs, siekalās, krēpās, urīnā, likvorā, žultī, ascītā. Ir aprakstīts, ka pie elpošanas orgānu infekcijām iespējamais cēlonis paaugstināta kalprotektīna koncentrācijai fēcēs ir norītās krēpas (Waugh et al., 2013).
Kalprotektīna līmenis var būt paaugstināts zarnu sieniņas bojājuma un asiņošanas gadījumos, ko dažkārt novēro, ja pacients lieto nesteroīdos pretiekaisuma līdzekļus (NSPL) un protonu sūkņu inhibitorus (PSI), tomēr tā koncentrācija ir ievērojami zemāka nekā pacientiem ar aktīvu čūlaino kolītu un Krona slimību (Tibble, 1999; Goldstein, 2007; Holland, 2014).
European Respiratory Journal 2014. gadā publicēts raksts, kurā secināts, ka iekaisīgu zarnu slimību biežums pacientiem ar HOPS un bronhiālo astmu ir statiski ticami palielinājies, salīdzinot ar vispārējo iedzīvotāju populāciju (Brassard, 2014).
Darba mērķis
Analizēt kalprotektīnu līmeni un to noteikšanas metodes, salīdzinot pacientu grupas ar čūlaino kolītu un hronisku obstruktīvu plaušu slimību.
Materiāls un metodes
Darbs veikts Paula Stradiņa Klīniskajā universitātes slimnīcā (PSKUS) no 2015. gada oktobra līdz 2016. gada aprīlim. Pilotpētījumā tika iesaistīti 45 pacienti vecumā no 18 līdz 80 gadiem.
Iekļaušanas kritēriji:
- pacienti ar vidēji smagas un smagas pakāpes čūlainā kolīta vai vidēji smagas un smagas pakāpes HOPS diagnozi;
- abu dzimumu pacienti, vecāki par 18 gadiem;
- pacients piekrīt dalībai pētījumā;
- pacients ir kontaktējams, adekvāts, spēj saprast un atbildēt uz jautājumiem.
Izslēgšanas kritēriji:
- nav pierādīta vidēji smagas un smagas pakāpes čūlainā kolīta vai vidēji smagas un smagas pakāpes HOPS diagnoze;
- pacients ir jaunāks par 18 gadiem;
- pacients nepiekrīt dalībai pētījumā;
- pacients nespēj kontaktēties, nav adekvāts, pacienti ar garīgās attīstības traucējumiem, psihiatrijas pacienti.
Darba pirmajā posmā par pacientiem tika savākti dati, tie tika analizēti un salīdzināti starp divām pacientu grupām: I grupa – pacienti ar čūlaino kolītu, II grupa – pacienti ar hronisku obstruktīvu plaušu slimību (HOPS).
Pētījumā iekļautie anamnēzes dati:
- pacientu demogrāfiskie dati: pacienta vecums, svars, augums, dzimums;
- slimības ilgums, recidīvu skaits pēdējā gada laikā;
- smēķēšana;
- lietotie medikamenti;
- blakusslimības un alerģijas;
- sūdzības (nespēks, vājums, sāpes vēderā, diareja > 3 reizes dienā, aizcietējumi, nedefinējama vēdera izeja, ķermeņa masas zudums, meteorisms, klepus, krēpas, elpas trūkums);
- slēptas asinis fēcēs;
- veiktie endoskopiskie izmeklējumi – augšējā endoskopija (EGDS), apakšējā endoskopija (ileokolonoskopija), un to atrades;
- Mayo skala pacientiem ar čūlaino kolītu (Rutgeerts et al., 2005).
No laboratoriskajiem rādītājiem tika analizēti dati asinsainā: eritrocīti (Er), hemoglobīns (Hb), leikocīti (Leu), trombocīti (Tr), eritrocītu grimšanas ātrums (EGĀ), asins bioķīmiskais rādītājs: C reaktīvais olbaltums (CRO).
Visiem pacientiem fēcēs tika noteikts kalprotektīns pēc CalFast metodes PSKUS Imunoloģijas laboratorijā. Rezultāts uzskatāms par pozitīvu, ja > 70 mg/kg.
Darba otrajā posmā tika salīdzinātas divas kalprotektīna noteikšanas metodes PSKUS Imunoloģijas laboratorijā: imūnfermentatīvā automatizētā ELISA metode Alegria un imūnhromatogrāfijas metode CalFast.
Ar ELISA Alegria metodi kalprotektīna rezultāts tika uzskatīts par pozitīvu, ja vērtība bija > 50 μg/g; ar CalFast metodi, ja > 70 mg/kg. Augstākais rezultāts, ko var iegūt ar ELISA Alegria metodi, ir > 1000 μg/g, ar CalFast metodi – > 300 mg/kg.
Datu statistiskajai analīzei tika izmantotas šādas programmas: Microsoft Excel, IBM SPSS Statistics un statistiskās datu apstrādes programma Kullback (Sipponen et al., 2008).
Izmantojot IBM SPSS Statistics programmu, iegūtajiem datiem tika pārbaudīta atbilstība normālsadalījumam, izmantojot Kolgomorova–Smirnova testu. Rādītāji tika analizēti starp grupām un salīdzināti, izmantojot divu neatkarīgu izlašu t testu, ja dati atbilda normālsadalījumam, un Manna–Vitnija testu, ja dati neatbilda normālsadalījumam. Korelāciju analīze tika veikta, izmantojot Pīrsona korelācijas testu. Par statistiski ticamiem tika uzskatīti dati ar būtiskuma līmeni p ≤ 0,05.
Izmantojot daudzvariantu statistikas programmu Kullback (Rīgas Medicīnas institūtā 1985. gadā izveidotā programma ātrai bioloģisko datu apstrādei, inž. M. Magids), visi dati raksturoti kā “pazīmes”, piemēram, dzimums, un “pazīmju gradācijas”, piemēram, sieviete vai vīrietis, izmantojot “Pacientu novērojumu karti” (Kullback, 1959). Kodētie dati tika ievadīti MS Excel formātā un apstrādāti ar daudzfaktoru analīzes programmu Kullback, tika izvērtēta datu ticamība (p) un datu informativitāte (Î). Iegūtie rezultāti šajā pētījumā tiek uzskatīti par informatīviem, ja Î > 1,0. Ja Î < 1,0, informativitāte pat statistiskas ticamības gadījumā daudzfaktoru analīzes sistēmā norāda uz relatīvi mazu pazīmju skaitu un līdz ar to rezultāti nav informatīvi.
Pētījums veikts saskaņā ar Helsinku deklarāciju, ir saņemta Rīgas Stradiņa universitātes Ētikas komitejas atļauja pētījuma veikšanai.
Rezultāti
Darba pirmais posms. Dati tika salīdzināti starp divām pacientu grupām: I grupa – 55,6 % (n = 25) pacienti ar čūlaino kolītu un II grupa – 44,4 % (n = 20) pacienti ar HOPS. Vidējais vecums I grupā – 39 ± 11 gadi, II grupā – 66 ± 10 gadi. Salīdzinot vecumu abās grupās, tika novērota statistiski ticama atšķirība (p < 0,05), proti, pacienti ar čūlaino kolītu bija jaunāki nekā pacienti ar HOPS. Vecuma grupa no 30 līdz 39 gadiem nozīmīgi un ticami atšķīrās I grupas pacientiem (p = 0,02). Vecuma grupa no 70 līdz 79 gadiem nozīmīgi un ticami atšķīrās II grupas pacientiem (p = 0,03). Līdzīgi statistiski ticama atšķirība novērojama starp vecuma grupām, kad pacientiem bija pirmreizēji noteikta diagnoze: pacientiem ar čūlaino kolītu tā ir 20–29 gadu vecuma grupa, bet pacientiem ar HOPS – 50–69 gadu vecuma grupa.
ĶMI, kā arī ķermeņa masas zudums pacientiem pēdējo divu mēnešu laikā starp abām grupām statistiski ticami neatšķīrās.
Medikamentus ikdienā regulāri lietoja: I grupā – 18 (72 %) pacienti (neregulāri – 7 (28 %)) un II grupā – 10 pacienti (neregulāri – 10 pacienti). Rezultāti starp abām grupām statistiski neatšķīrās (p > 0,05).
Izvērtējot medikamentu, piemēram, omeprazola (vai cita PSI), lietošanu pēdējo divu mēnešu laikā vai antibiotiku lietošanu vienreizēji vai atkārtoti pēdējo sešu mēnešu laikā, rezultāti starp abām grupām statistiski neatšķīrās (p > 0,05). Astoņi pacienti – četri čūlainā kolīta grupā un četri HOPS grupā – lietoja NSPL pēdējo divu mēnešu laikā.
Alerģiskās izpausmes uz medikamentiem atzīmēja deviņi (36 %) pacienti ar čūlaino kolītu, bet neviens no pacientiem ar HOPS. Medikamentoza alerģija statistiski ticami biežāk tika novērota čūlainā kolīta grupas pacientiem (p = 0,01).
Pētījumā tika meklēta saistība ar citām blakusslimībām (sk. 1. tab.). Artrīta izpausme bija četriem pacientiem no I grupas un vienam pacientam no II grupas. Primārs sklerozējošs holangīts (PSH) bija diviem pacientiem ar čūlaino kolītu, savukārt 2. tipa cukura diabēts – tikai pacientiem ar HOPS (20 % gadījumu). Statistiski ticama atšķirība tika novērota tikai arteriālajai hipertensijai – II grupas pacientiem tā bija 35 % gadījumu (p = 0,01).
Izvērtējot pacientu sūdzības, tika novērots, ka noguruma un vājuma sajūtu pacienti atzīmēja vienādi bieži abās grupās: I grupā n = 23 vs. II grupā n = 18. Bet bija atšķirīgs noguruma un vājuma sajūtas ilgums: I grupā 26 % pacientu atzīmēja to pēdējo dienu laikā, II grupā 80 % pacientu – pēdējo gadu laikā (p > 0,05).
1. tabula. Čūlainā kolīta (ČK) un HOPS slimnieku blakusslimības / Comorbidities of ulcerative colitis and chronic obstructive pulmonary disease
| Artrīts | Vairogdziedzera slimības | Uveīts | Primārs sklerozējošs holangīts | Cukura diabēts | Arteriāla hipertensija | |
|---|---|---|---|---|---|---|
| I grupa – ČK (n = 25) | 4 | 0 | 1 | 2 | 0 | 0 |
| II grupa – HOPS (n = 20) | 1 | 0 | 0 | 0 | 4 | 7 |
n – pacientu skaits.
Čūlainā kolīta grupas pacientiem diareja (> 3 reizes diennaktī) bija novērota statistiski biežāk nekā HOPS grupas pacientiem: I grupā 19 vs. II grupā 3 pacientiem (p < 0,05). Trim (16 %) I grupas pacientiem diareja bija pēdējo dienu laikā, deviņiem (47 %) – pēdējo nedēļu laikā, četriem (21 %) – pēdējo mēnešu laikā, trim pacientiem (16 %) – pēdējā gada laikā. II grupas diviem pacientiem diareja bija pēdējo mēnešu laikā, vienam pacientam – pēdējo dienu laikā.
Tādas sūdzības kā sāpes vēderā, aizcietējumi, neregulāra vēdera izeja, neizskaidrojams ķermeņa masas zudums, meteorisms un to ilgums starp abām grupām statistiski ticami neatšķīrās.
Klepus statistiski ticami biežāk tika novērots II grupas (HOPS) pacientiem (p = 0,01, Î = 9,21), turklāt II grupas pacientiem 80 % gadījumu tas ilga vairākus gadus. Krēpas novērotas 40 % gadījumu. Elpas trūkums statistiski biežāk bija pacientiem ar HOPS: I grupā 3 vs. II grupā 19 pacientiem (p = 0,01, Î = 8,98). Lielākam skaitam (n = 18 (90 %)) II grupas pacientu elpas trūkums ilga vairākus gadus.
I grupas pacienti smēķēja statistiski ticami biežāk nekā II grupas pacienti: I grupā n = 4 vs. II grupā n = 18 (p = 0,01).
Novērtējot pilnas asinsainas rādītājus I un II grupai, izvērtējām leikocītu, eritrocītu, hemoglobīna, trombocītu rādītājus un EGĀ. Statistiski ticama atšķirība starp abām grupām bija novērojama tikai trombocītu rādītājos – HOPS slimniekiem bija statistiski mazāks trombocītu skaits nekā čūlainā kolīta slimniekiem (p = 0,007): I grupā – 337 ± 156 (109/l), II grupā – 227 ± 87 (109/l) (sk. 2. tab.).
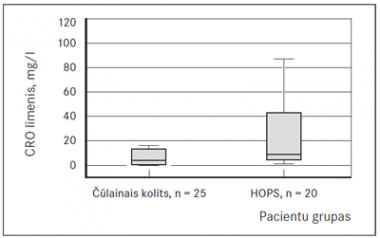
No asins bioķīmiskajiem rādītājiem tika salīdzināts CRO rādītājs. CRO vērtības starp abām grupām statistiski ticami neatšķīrās, tomēr HOPS slimniekiem bija novērojami augstāki CRO rādītāji, kas ir redzami 1. attēlā: I grupā – 12 ± 18 mg/l, II grupā – 24 ± 26 mg/l (p = 0,061).
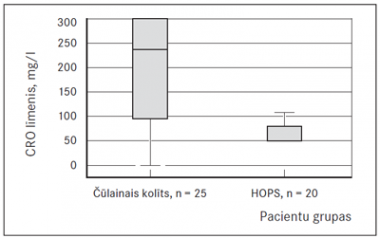
Salīdzinot kalprotektīna rādītājus starp abām grupām, tika konstatēta statistiski ticama atšķirība (p = 0,01). Kalprotektīns bija pozitīvs 21 (84 %) čūlainā kolīta slimniekam un 6 (30 %) HOPS slimniekiem. Čūlainā kolīta grupā 11 pacientiem rādītāji bija līdz 300 mg/kg un 10 pacientiem pārsniedza 300 mg/kg. No sešiem HOPS slimniekiem, kuriem bija paaugstināts kalprotektīna līmenis, tā vērtības nepārsniedza 140 mg/kg (2. attēlā shematiski atspoguļots kalprotektīna vērtību sadalījums starp abām grupām).
Slēptas asinis fēcēs I grupas pacientiem bija pozitīvas 48 %, negatīvas – 32 % gadījumu, un par 20 % pacientu nebija datu, II grupas pacientiem šis rādītājs attiecīgi bija 5 %, 60 %, 35 %. Rezultāti starp abām grupām statiski ticami atšķīrās (p = 0,02).
Augšējā endoskopija bija veikta deviņiem (64 %) pacientiem I grupā, trīs (15 %) pacientiem II grupā. Apakšējā endoskopija bija veikta visiem I grupas pacientiem, bet II grupā tikai vienam pacientam.
Būtiskas korelācijas starp laboratoriskajiem un kalprotektīna rādītājiem netika novērotas. Bet tika novērota korelācija čūlainā kolīta slimniekiem starp Mayo skalu un kalprotektīna rādītājiem: jo lielākas Mayo skalas vērtības, jo lielāki ir kalprotektīna rādītāji.
2. tabula. Laboratorisko rādītāju salīdzinājums starp čūlainā kolīta (ČK) un HOPS slimnieku grupām / The comparison of laboratory tests between groups
| Asinsaina | Pacientu grupa | Pacientu skaits, n | Vidējā vērtība | Standartdeviācija | p vērtība |
|---|---|---|---|---|---|
| Leikocīti, × 109/l | ČK | 25 | 8,99 | 2,93 | 0,654 |
| HOPS | 20 | 9,47 | 4,17 | ||
| Eritrocīti, × 1012/l | ČK | 25 | 4,24 | 0,79 | 0,587 |
| HOPS | 20 | 4,36 | 0,65 | ||
| Hemoglobīns, g/l | ČK | 25 | 122,40 | 28,10 | 0,345 |
| HOPS | 20 | 129,60 | 20,79 | ||
| Trombocīti, × 109/l | ČK | 25 | 336,84 | 156,12 | 0,007 |
| HOPS | 20 | 227,10 | 87,08 | ||
| CRO, mg/l | ČK | 25 | 11,68 | 17,78 | 0,061 |
| HOPS | 20 | 24,07 | 25,60 |
1. attēls. C reaktīvā olbaltuma salīdzinājums starp grupām / The comparison of CRP between groups | 2. attēls. Kalprotektīna salīdzinājums starp grupām / The comparison of calprotectin between groups |
|
|
Darba otrais posms. Abas kalprotektīna noteikšanas metodes – ELISA metode Alegria un imūnhromatogrāfijas metode CalFast – tika salīdzinātas 19 pacientiem. Iegūtie rezultāti atspoguļoti 3. tabulā.
3. tabula. Kalprotektīna noteikšanas metožu salīdzinājums / The comparison of calprotectin detection methods between groups
| Pacienti, nr. p. k. | ELISA Alegria (pozitīva vērtība > 50 μg/g) | ELISA Alegria + vai − | CalFast (pozitīva vērtība > 70 mg/kg) | CalFast, + vai − |
|---|---|---|---|---|
| 1. | 28,10 | − | < 50 | − |
| 2. | 31,70 | − | < 50 | − |
| 3. | 46,10 | − | 69,83 | − |
| 4. | > 1000 | + | > 300 | + |
| 5. | > 1000 | + | > 300 | + |
| 6. | 856,60 | + | 89,76 | + |
| 7. | 819,00 | + | > 300 | + |
| 8. | 17,00 | − | < 50 | − |
| 9. | > 1000 | + | 287,57 | + |
| 10. | 478,10 | + | 158,46 | + |
| 11. | 373,50 | + | 119,30 | + |
| 12. | 23,60 | − | < 50 | − |
| 13. | > 1000 | + | > 300 | + |
| 14. | > 1000 | + | 131,32 | + |
| 15. | 20,80 | − | < 50 | − |
| 16. | > 1000 | + | > 300 | + |
| 17. | 73,60 | + | 77,91 | + |
| 18. | 13,20 | − | < 50 | − |
| 19. | 845,30 | + | 88,05 | + |
(+) – pozitīva vērtība, (−) – negatīva vērtība.
Par pozitīvu kalprotektīna rezultātu ar ELISA metodi Alegria tiek uzskatīta vērtība > 50 μ g/g, bet ar CalFast metodi – > 70 m g/kg. Lielākie iegūstamie rezultāti ar ELISA ir > 1000 μg/g un ar CalFast – > 300 m g/kg. Analizējot datus, 12 pozitīvi kalprotektīna rādītāji ir vienādi abām noteikšanas metodēm. 3. tabulā izceltās ailītes parāda nesakritību intervālos starp vērtībām. Tā, piemēram, 9. pacientam ar ELISA metodi Alegria kalprotektīns ir > 1000 μg/g, bet ar CalFast – 287,57 mg/kg, savukārt 14. pacientam ar ELISA metodi Alegria rezultāts ir > 1000 μg/g, bet ar CalFast – 131,32 mg/kg; 6., 7., 19. pacientam ar ELISA metodi Alegria noteiktais kalprotektīna daudzums ir līdzīgs – 856,60 μg/g, 819 μg/g un 845 μg/g, bet ar CalFast metodi rezultāti ir stipri atšķirīgi – 89,76 mg/kg, > 300 mg/kg un 88,05 mg/kg.
Diskusija
Pētījums apstiprina uzskatus, ka kalprotektīna noteikšana fēcēs ir būtiska čūlainā kolīta diagnostikā. Salīdzinot kalprotektīna rādītājus starp divām pacientu grupām – pacientiem ar čūlaino kolītu un pacientiem ar HOPS – tika konstatēta statistiski ticama atšķirība. Ņemot vērā to, ka pacientu skaits bija neliels (n = 45), pētījumā iegūtie dati var atšķirties no citiem pētījumiem.
Vadoties pēc NICE (2013) vadlīnijām, kalprotektīns ir skrīninga metode IZS gadījumā primārajā aprūpē (Waugh et al., 2013). Kalprotektīnam ir būtiska nozīme IZS un kairinātu zarnu sindroma (KZS) atšķiršanā. Kalprotektīnu izmanto iekaisīgu zarnu slimību aktivitātes noteikšanai un terapijas efektivitātes monitoringā (Waugh et al., 2013). Iekaisīgu zarnu slimību aktivitāte ir izvērtējama pēc Mayo skalas, kas ietver pacienta sūdzības par vēdera izejas biežumu, asiņošanas raksturu no taisnās zarnas, kolonoskopisko atradi un pacienta vispārējā veselības stāvokļa novērtējumu (Rutgeerts et al., 2005). Mūsu pētījumā tika konstatēta saistība starp kalprotektīnu un Mayo skalu, kas parāda čūlainā kolīta aktivitāti. Jo augstāka Mayo skalas vērtība, jo lielāks kalprotektīna rādītājs. Arī citviet pasaulē veikto pētījumu, kuros noteiktas korelācijas starp endoskopisko novērtējumu un kalprotektīnu, histoloģisko atradi un kalprotektīnu, rezultāti ir līdzīgi mūsu pētījuma datiem (Limburg et al., 2000; Bunn and Bisset, 2001; Rutgeerts et al., 2005; Sipponen, et al., 2008; Peyrin-Biroulet, et al., 2011).
Izvērtējot abu grupu pacientu demogrāfiskos datus, tika konstatēta statistiski ticama atšķirība starp vecuma grupām. Pacienti ar čūlaino kolītu bija jaunāki nekā pacienti ar HOPS. Līdz ar to čūlainā kolīta diagnoze bija noteikta gados jaunākiem pacientiem – 20–29 gadu vecumā. Citu pētījumu dati ir līdzīgi – čūlainā kolīta slimība visbiežāk izpaužas no 15 līdz 30 gadu vecumam un pēc 50 gadu vecuma (Shanahan, 2012; Centers for Disease Control and Prevention, 2014).
Pēc literatūras datiem novērots, ka, iespējams, NSPL lietošana paaugstina kalprotektīna līmeni (Tibble, 1999; Goldstein, 2007; Holland, 2014). Mūsu pētījumā astoņi pacienti (četri pacienti ar čūlaino kolītu un četri pacienti ar HOPS) lietoja NSPL pēdējo divu mēnešu laikā.
Medikamentoza alerģija statistiski ticami biežāk tiek novērota čūlainā kolīta grupas pacientiem, ko varētu skaidrot ar to, ka čūlainais kolīts ir hroniska autoimūna slimība.
European Respiratory Journal 2014. g adā 19. novembrī tika publicēts raksts, kurā apgalvots, ka IZS incidence ir statistiski ticami palielinājusies pacientiem ar HOPS un bronhiālo astmu, salīdzinot ar vispārējo iedzīvotāju populāciju (Brassard, 2014). Mūsu pētījumā nebija neviena pacienta, kuram būtu diagnosticētas abas slimības – čūlainais kolīts un HOPS. Savukārt sešiem HOPS grupas pacientiem bija pozitīvs kalprotektīna rādītājs. Detalizētāk izvērtējot šos pacientus, tika konstatēts, ka trīs no šiem pacientiem lietoja NSPL un divi – PSI, kas varēja ietekmēt kalprotektīna rezultātu. Pieciem HOPS grupas pacientiem ar paaugstinātu kalprotektīna līmeni bija krēpas. Saskaņā literatūras datiem pacientiem ar HOPS kalprotektīns ir pētīts, tikai nosakot tā līmeni asinīs un krēpās. No mūsu pētījuma datiem izriet, ka kalprotektīna atrade fēcēs, iespējams, norāda uz izteikti augstu HOPS aktivitāti. Vienam HOPS grupas pacientam ar paaugstinātu kalprotektīna līmeni tika novērota diareja. Pacientiem ar HOPS, kuriem ir pozitīvs kalprotektīna rādītājs fēcēs, būtu nepieciešams atkārtot kalprotektīna noteikšanu pēc divām nedēļām. Ja tā ir pozitīva atkārtoti, ir nepieciešama pacienta tālāka izmeklēšana. Kalprotektīns fēcēs ir agrīns biomarķieris, kas parādās, ja ir iekaisuma aina kuņģa un zarnu traktā.
Mūsu pētījumā bija statistiski ticami augstāki kalprotektīna līmeņa rādītāji čūlainā kolīta grupas pacientiem nekā HOPS grupas pacientiem. No sešiem HOPS grupas pacientiem, kuriem bija augsts kalprotektīna līmenis, tā vērtības bija zemas un nepārsniedza 140 mg/kg. Savukārt čūlainā kolīta grupas pacientiem rādītāji bija līdz 300 mg/kg un 10 pacientiem – > 300 mg/kg. Arī pēc citu pētījumu datiem pacientiem ar pirmreizēji diagnosticētu IZS kalprotektīna rādītāji ir izteikti augsti. Savukārt zemi kalprotektīna rādītāji nozīmē, ka slimības pazīmes un simptomi, visticamāk, ir saistīti ar neiekaisīgiem zarnu traucējumiem (Lab Tests Online: Calprotectin).
Izvērtējot abas PSKUS izmantotās kalprotektīna noteikšanas metodes, varam secināt, ka gan ELISA metode Alegria, gan CalFast metode atspoguļo vienādus pozitīvus vai negatīvus rezultātus. Tomēr paliek neskaidrs jautājums par metožu references intervāliem. Pieciem pacientiem tika konstatētas atšķirības starp abu metožu references rezultātiem. Tā, piemēram, ja ar ELISA metodi Alegria kalprotektīna rezultāts bija ap 850 μg/g, tad tā paša pacienta kalprotektīna rezultāts ar CalFast metodi varēja būt gan 80 mg/kg, gan > 300 mg/kg, kas ir stipri atšķirīgi. Vai, piemēram, ar ELISA metodi Alegria kalprotektīna rezultāts ir > 1000 μg/g, kas liecina par izteiktu iekaisuma ainu kuņģa un zarnu traktā, un tā paša pacienta kalprotektīna rezultāts ar CalFast metodi ir tikai ap 131 un 287 mg/kg, kas nesasniedz maksimālo rezultātu – > 300 mg/kg, kas nenozīmē tik smagi izteiktu iekaisuma ainu kā HOPS gadījumā. Klīniskajā praksē ir būtisks ne tikai pozitīvs vai negatīvs rezultāts, bet arī slimības aktivitātes skaitliskā vērtība. Tādēļ ir nepieciešama vēl sīkāka šo metožu izpēte ar lielāku pacientu skaitu.
Secinājumi
- Augstāka kalprotektīna vērtība ir raksturīga vidējas un augstas aktivitātes čūlainā kolīta slimniekiem, salīdzinot ar slimniekiem, kuriem ir vidējas un smagas gaitas hroniska obstruktīva plaušu slimība.
- Daļai pacientu ar hronisku obstruktīvu plaušu slimību konstatē paaugstinātu kalprotektīna līmeni fēcēs, bet tas ir skaitliski zemāks, salīdzinot ar čūlainā kolīta slimniekiem, kas daudzos gadījumos var tikt izskaidrots ar hronisku obstruktīvu plaušu slimību, bet daļai pacientu nepieciešama tālāka klīniskā izvērtēšana.
- Paula Stradiņa Klīniskajā universitātes slimnīcā lietotās kalprotektīna noteikšanas metodes fēcēs – ELISA Alegria un CalFast – ir salīdzināmas, bet ir nepieciešama sīkāka references intervālu izpēte.
Abstract
Calprotectin Level and the Possible Factors Affecting the Comparison in Patients Groups of Ulcerative Colitis and Chronic Obstructive Pulmonary Disease at Pauls Stradiņš Clinical University Hospital
Calprotectin is a relatively new biomarker of inflammation, which can be found in all human secretions. It seemed interesting for us to find out faecal calprotectin and factors affecting changes between ulcerative colitis (UC) and chronic obstructive pulmonary disease (COPD) patients.
To analyse calprotectin values and its detection methods comparing two patients groups – ulcerative colitis and chronic obstructive pulmonary disease.
A pilot study included 45 patients with moderate / severe activity UC (n = 25) and COPD (n = 20). At the first study stage, all patients’ data were collected and analysed and compared between both patient groups: group I – UC patients, group II – COPD patients. At the second study stage, two calprotectin detection methods are compared used at Pauls Stradiņš Clinical University Hospital (PSCUH) Immunology laboratory. The first enzyme immunoassay automated ELISA method Alegria, the second – immunochromatography method CalFast.
25 (55.6 %) patients had a diagnosis of UC and 20 (44.4 %) patients were with a diagnosis of COPD. The average age in the group I – 39 ± 11 years, group II – 66 ± 10 years. The performance of complete blood counts were assessed in both groups, as well as CRP. Comparing calprotectin values between both groups, there was a statistically significant difference, p = 0.01. Calprotectin was positive in 21 (84 %) of ulcerative colitis patients and 6 (30 %) patients with COPD.
Higher calprotectin value is more characteristic of ulcerative colitis medium and high activity compared to patients with chronic obstructive pulmonary disease medium and high activity patients. A part of COPD patients were found elevated levels of faecal calprotectin, but comparing with UC values were lower, in most cases it can be explained by COPD, but a part require further clinical evaluation. PSCUH applied calprotectin methods ELISA Alegria and CalFast are comparable, but requires a more detailed study of the reference interval.
Literatūra
- Bhardwaj, R., Zotz, C., Zwadlo-Klarwasser G., et al. The calcium-binding proteins MRP8 and MRP14 form a membrane associated heterodimer in a subset of monocytes / macrophages present in acute but absent in chronic inflammatory lesions. Eur J Immunol. 1992, 22, 1891–1897.
- Brassard, P., Vutcovici M., Ernst P., et al. Increased incidence of inflammatory bowel disease in Quebec residents with airway diseases. European Respiratory Journal. 2014, 15, 14.
- Bunn, S., Bisset, W., and Main, M. Fecal calprotectin: validation as a non-invasive measure of bowel inflammation in childhood inflammatory bowel disease. J Pediatr Gastroenterol Nutrition. 2001, 33(1), 14–22.
- Goldstein, J. Small bowel mucosal injury is reduced in healthy subjects treated with celecoxib compared with ibuprofen plus omeprazole, as assessed by video capsule endoscopy. Aliment Pharmacol Ther. 2007, 25, 1211–1222.
- Holland, M. Does NSAID use affect the faecal calprotectin result? Alpha Laboratories Leading Edge Newsletter. 2014, 2–3.
- Inflammatory bowel disease (IBD) Centers for Disease Control and Prevention website. Iegūts no: www.cdc.gov/ibd [sk. 22.03.2016.].
- Lab Tests Online: Calprotectin, US. Iegūts no: https://labtestsonline.org/understanding/analytes/calprotectin [sk. 29.03.2016.].
- Kullback, S. Information Theory and Statistics. New York: Wiley, London: Chapman and Hall, 1959, 395.
- Limburg, P., Ahlquist, D., and Sandborn, W. Fecal calprotectin levels predict colorectal inflammation among patients with chronic diarrhoea referred for colonoscopy. Am J Gastroenterol. 2000, 95(10), 2831–2837.
- Peyrin-Biroulet, L., Ferrante, M., Magro, F., et al. Results from the 2nd Scientific Workshop of the ECCO (I): Impact of mucosal healing on the course of inflammatory bowel disease. Journal of Crohn’s and Colitis. 2011, 5, 477–483.
- Roseth, A., Aadland, E., Jahnsen, J., et al. Assessment of disease activity in ulcerative colitis by faecal calprotectin, a novel granulocyte marker protein. Digestion. 1997, 58, 176–180.
- Rutgeerts, P, Sandborn, W. J., Feagan, B. G., Reinisch, W., et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med. 2005, 353(23), 2462–2476.
- Shanahan, F. Ulcerative colitis. No: Textbook of Clinical Gastroenterology and Hepatology. C. J. Hawkey, J. Bosch, J. E. Richter, G. Garcia-Tsao, eds. Oxford: Wiley-Blackwell, 2012, 355–371.
- Sipponen, T., Savilahti, E., Kolho, K. L., et al. Crohn’s disease activity assessed by fecal calprotectin and lactoferrin: correlation with Crohn’s disease activity index and endoscopic findings. Inflammatory Bowel Diseases. 2008, 14, 40–46.
- Striz, I. and Trebichavsky, I. Calprotectin – a pleiotropic molecule in acute and chronic inflammation. Physiological research. Academia Scientiarum Bohemoslovaca. 2004, 53(3), 245–253.
- Tibble, J. High prevalence of NSAID enteropathy as shown by a simple faecal test. Gut. 1999, 45, 362–368.
- Waugh, N., Cummins, E., Royle P., et al. Protocol for assessment of faecal calprotectin. Faecal calprotectin diagnostic tests for inflammatory diseases of the bowel. NICE Diagnostics Guidance. UK, 2013, 1–14.