Osteoporotisku kaulaudu kvantitatīva imūnhistoķīmiska analīze eksperimenta dzīvniekiem jaunas bifāziskā kalcija fosfātu biokeramikas implantācijas zonā
Kopsavilkums
Ievads. Lai iegūtu detalizētu informāciju par osteoporotisku kaulu reģenerāciju un remodelāciju, kā modelis tiek izmantoti eksperimenta dzīvnieki ar inducētu osteoporozi, kas reprezentē līdzīgu morfoloģiju kā osteoporotisks kauls cilvēkam.
Darba mērķis. Eksperimenta dzīvnieku (trušu) kaulaudu augšanas faktoru, kaulu reģenerācijas marķieru, kaulu pamatvielas proteīnu un šūnu aktivitātes rādītāju analīze sintētiskas bifāziskas kalcija fosfātu biokeramikas implantācijas zonā 3 mēnešus pēc implantācijas.
Materiāls un metodes. Inducēta osteoporoze 7 trušu mātītēm vecumā no 2 līdz 2,8 gadiem, veicot ovariektomiju un ik dienu 8 nedēļas ievadot metilprednizolonu 1 mg/kg. Pēc tam eksperimenta grupā 4 dzīvniekiem ciskas kaulā izveidots defekts, kas aizpildīts ar ar bifāziskā kalcija fosfātu biokeramikas granulām ar izmēru 1 līdz 1,4 mm, kas satur hidroksiapatītu (HAp) un β-trikalcija fosfātu (β-TCP) attiecībā 90/10, kas izstrādāts Rīgas Tehniskās universitātes Rūdolfa Cimdiņa Rīgas Biomateriālu inovāciju un attīstības centrā. Kontroles grupā bija 3 trušu mātītes, kurām granulu implantācija netika veikta.
Pēc 3 mēnešiem veikta dzīvnieku eitanāzija un kaulaudu paraugu imunohistoķīmiska analīze šādiem marķieriem: osteokalcīns (OC), osteopontīns (OP), kaula morfoģenētiskais proteīns 2/4 (BMP2/4), transformējošais augšanas faktors beta (TGFβ). Kaulaudu aktivitātes marķieri izvērtēti, izmantojot puskvantitatīvo metodi.
Rezultāti un diskusija. Vismazākā atšķirība eksperimenta un kontroles grupās bija TGFβ ekspresijā. Aktīvāku BMP2/4 ekspresiju osteoporotiskā kaulā bez HAp/TCP ietekmes var skaidrot ar lēnāku osteoģenēzi. OC ekspresija izmeklētajos paraugos ir salīdzinoši vairāk izteikta, kas norāda uz biokeramikas spēju aktivizēt kaulšūnas un veicināt kaulu reģenerāciju. Izmeklētajos paraugos eksperimenta grupā OP pozitīvo šūnu daudzums pret OC pozitīvo šūnu skaitu ir ievērojami mazāks, kas var liecināt par iniciālu kaulaudu remodelāciju, kurā osteoblastu funkcija pārsniedz osteoklastu aktivitāti.
Mūsu pētījumā OPG ekspresija kaulaudos ap HAp/TCP implantācijas vietu osteoporotiskā kaulā ir divas reizes augstāka nekā kontroles grupā bez biokeramikas implantācijas, kas liecina par osteoģenēzes pārsvaru pār kaulaudu resorbciju.
Secinājumi. HAp/TCP biokeramikas implantācija osteoporotiskā kaulā pozitīvi ietekmē kaulaudu kvalitāti un veicina kaulaudu remodelāciju osteoģenēzes veicināšanas virzienā.
Ievads
Osteoporotisku kaulu lūzumu ārstēšana ārstiem sagādā izaicinājumu. Piemēram, osteoporotiski augšstilba kaula proksimālās daļas lūzumi ir visbiežāk ārstētie lūzumi stacionārā [12, 20] ar salīdzinoši vislielāko mirstību [14]. Mirstību un komplikāciju skaitu varētu mazināt stabila kaulu lūzumu fiksācija un ātra lūzumu sadzīšana, kas palīdz pacientiem ātrāk atgūt mobilitāti. Viens no mēģinājumiem uzlabot kaulaudu reģenerāciju un struktūru ir kalcija biokeramikas lietošana osteoporotiska lūzuma zonā, kas veicina kaulaudu reģenerāciju [7, 13]. Bifāziskā kalcija fosfāta biokeramika, kas satur kalcija fosfātu un hidroksiapatītu, jau tiek lietota gan sejas un žokļu ķirurģijā, gan traumatoloģijā lūzumu ārstēšanā, gan ortopēdijā kaulu defektu aizpildīšanai [9, 11].
Pierādīta bioefektivitāte ir Rīgas Tehniskās universitātes Rūdolfa Cimdiņa Rīgas Biomateriālu un inovācijas un attīstības centrā izstrādātajam materiālam, kas satur kalcija hidroksiapatītu un kalcija fosfātu attiecībā 90/10 [24]. Šī biokeramika ir veiksmīgi izmantota sejas un žokļu ķirurģijā Rīgas Stradiņa universitātes Stomatoloģijas intitūtā, kā arī ir pirmie klīniskie rezultāti izmantošanai traumatoloģijā un ortopēdijā Rīgas 2. slimnīcā [18, 21, 24, 26].
Lai varētu spriest par kaulaudu morfoloģiju un proteīnu aktivitāti pēc biokeramikas implantācijas, izmanto imūnhistoķīmijas metodes, kuru lietošanu klīniskajā praksē ierobežo grūtības iegūt standarta materiālu daudzveidīgai morfoloģiskai izmeklēšanai. Tāpēc, lai iegūtu detalizētu informāciju par osteoporotisku kaulu reģenerāciju un remodelāciju, kā modeļi tiek izmanti eksperimenta dzīvnieki ar inducētu osteoporozi, kas reprezentē līdzīgu morfoloģiju kā osteoporotisks kauls cilvēkam [19].
Darba mērķis
Eksperimenta dzīvnieku (trušu) kaulaudu augšanas faktoru, kaulu reģenerācijas marķieru, kaulu pamatvielas proteīnu un šūnu aktivitātes rādītāju analīze sintētiskas bifāziskas kalcija fosfātu biokeramikas implantācijas zonā 3 mēnešus pēc implantācijas.
Materiāls un metodes
Eksperimentam izmantoti dzīvnieki no Rīgas Stradiņa universitātes Eksperimenta dzīvnieku audzētavas. Dzīvnieku izmatošanai saņemta LR Pārtikas un veterinārā dienesta atļauja. Inducēta osteoporoze eksperimenta dzīvniekiem – septiņām trušu mātītēm vecumā no 2 līdz 2,8 gadiem, veicot ovariektomiju un ik dienu 8 nedēļas ievadot metilprednizolonu 1 mg/kg [3]. Pēc tam eksperimenta grupā četriem dzīvniekiem veikta atkārtota operācija, kuras laikā izveidots kaula defekts augšstilba kaula lielā grozītāja rajonā 3 mm diametrā, kas aizpildīts ar bifāziskā kalcija fosfātu biokeramikas granulām, kas satur hidroksiapatītu (HAp) un β-trikalcija fosfātu (β-TCP) attiecībā 90/10. Kontroles grupā palika trīs trušu mātītes, kurām granulu implantācija netika veikta.
Granulas tika sintezētas Rīgas Tehniskās universitātes Rūdolfa Cimdiņa Rīgas Biomateriālu inovāciju un attīstības centrā, izmantojot ūdens precipitācijas metodi, kur kalcija hidroksīds un fosforskābe tika izmantoti kā izejmateriāls šādai reakcijai:
Ca(OH)2 + H3PO4 → Ca10−x(HPO4)x(PO4)6-x(OH)2−x + H2O [23].
Iegūtie precipitāti tiek formēti par porozām granulām (porozitāte ap 40 %) 1150 °C temperatūrā 2 stundas. Granulas pēc tam tika frakcionētas, un eksperimentam izmantotas no 1 līdz 1,4 mm lielas granulas.
Trīs mēnešus pēc kalcija biokeramikas granulu implantācijas veikta dzīvnieku eitanāzija. Iegūts kaulaudu materiāls, veikta tā fiksācija Stefanini šķīdumā un materiāls nosūtīts imūnhistoķīmiskai izmeklēšanai. Histoloģisko paraugu sagatavošana un analīze veikta Rīgas Stradiņa universitātes Anatomijas un antropoloģijas institūtā. Veikta paraugu dekalcinācija, atūdeņošana, attaukošana un ieguldīšana parafīnā un sagatavoti kaulaudu preparāti ar mikrotomu 3–4 mikronu biezumā.
Pēc tam materiāls krāsots ar hematoksīnu un eozīnu un imūnhistoķīmiskajai analīzei veikta paraugu apstrāde ar šādiem reaģentiem: osteokalcīns FL-100 SC:30044, poliklonālas antivielas, iegūtas no truša, atšķaidījums 1 : 100 (ražotājs: Santa Cruz Biotechnology Inc., ASV), osteopontīns ab8448, poliklonālas antivielas, iegūtas no truša, atšķaidījums 1 : 100 (ražotājs: abcam, Lielbritānija), kaula morfoģenētiskais proteīns anti-BMP-2/4, iegūts no kazas, atšķaidījums 1 : 100 (ražotājs: R & D Systems, Vācija), osteoprotegerīns N-20, SC:8468, poliklonālas antivielas, iegūtas no kazas (ražotājs: Santa Cruz Biotechnology Inc., ASV), transformējošais augšanas faktors beta ab1279, monoklonālās antivielas, iegūtas no peles. Palielinājumam izmantots mikroskops Leica ar palielinājumu × 100, × 200 un × 400.
Kaulaudu aktivitātes marķieri izvērtēti, izmantojot puskvantitatīvo metodi. Paraugi, kuros konstatētas retas pozitīvās šūnas, tika apzīmēti ar 0/+, maz pozitīvo šūnu daudzums apzīmēts ar +, vidēji daudzas pozitīvās šūnas apzīmētas ar ++ un daudzas pozitīvās šūnas apzīmētas ar +++.
1. tabula. Kaulu reģenerācijas marķieru, augšanas faktoru, pamatvielas proteīnu un šūnu aktivitātes rādītāju relatīvā daudzuma kopsavilkums eksperimenta grupas dzīvniekiem ar inducētu osteoporozi trīs mēnešus pēc biokeramikas granulu implantācijas / Relative quantitative summary of bone regeneration markers, growth factors, raw protein and cell activity indicators in experimental group of animals with induced osteoporosis 3 months after bioceramics pellet implantation
| Dzīvnieka Nr. | BMP2/4 | TGFβ | OC | OP | OPG |
|---|---|---|---|---|---|
| 1. | ++ | ++ | +++ | ++ | ++ |
| 2. | + | 0/+ | ++ | + | ++ |
| 3. | + | + | +++ | + | ++ |
| 4. | + | 0/+ | + | + | + |
BMP2/4 – kaulu morfoģenētiskie proteīni / bone morphogenetic proteins; TGFβ – transformējošais augšanas faktors / transforming growth factor; OC – osteokalcīns / osteocalcin; OP – osteopontīns / osteopontin; OPG – osteoprotegerīns / osteoprotegerin.
0/+ – retas pozitīvās šūnas; + – maz pozitīvo šūnu; ++ – vidēji daudz pozitīvo šūnu; +++ – daudz pozitīvo šūnu.
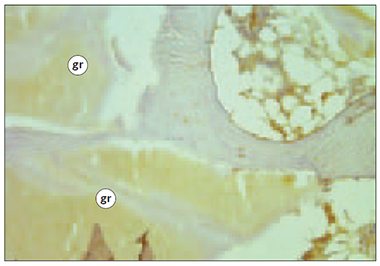
1. attēls. Eksperimenta grupas dzīvnieku kauls, kurā ap biokeramikas granulām ir vidēji daudz osteokalcīnu saturošo šūnu (OC IMH, × 200) / Bone around bioceramic pellets with average number of cells containing osteocalcin in experimental group of animals (OC IMH, × 200) | 2. attēls. Eksperimenta grupas dzīvnieku kauls, kurā ap biokeramikas granulām ir maz kaulu morfoģenētiskos proteīnus saturošo šūnu (BMP2/4 IMH, × 400) / Bone around bioceramic pellets with little number of cells containing bone morphogenetic proteins in experimental group of animals (BMP2/4 IMH, × 400) |
|
|
gr – biokeramikas granulas / bioceramic pellets.
Rezultāti
Rezultātu kopsavilkums eksperimenta grupas dzīvniekiem ar eksperimentālu osteoporozi un biokeramikas implantāciju redzams 1. tabulā. Osteokalcīna (OC) ekspresija kaulaudos bija vērojama visos gadījumos, divos atradām daudz tā saturošu šūnu, vienā vidēji daudz un vienā maz (sk. 1. att.). Savukārt osteopontīns (OP) tika atrasts 3 gadījumos maz šūnās, vienā vidēji daudz. Kaulu reģenerācijas proteīnu (BMP2/4) saturošo šūnu bija maz trīs gadījumos, vidēji daudz – vienā (sk. 2. att.). Transformējošais augšanas faktors beta (TGFβ) tika atrasts tikai retās kaulšūnās trīs gadījumos, nedaudz vairāk, bet arī maz vienā gadījumā, vidēji daudz šūnās vienā gadījumā. Osteoprotegerīnu (OPG) saturēja vidēji daudz šūnu trīs gadījumos, vienā šādu šūnu bija maz.
Rezultātu kopsavilkums kontroles grupas dzīvniekiem ar eksperimentālu osteoporozi bez biokeramikas implantācijas redzams 2. tabulā. Visos gadījumos BMP2/4 tika konstatēts vidēji daudz šūnās (sk. 3. att.). TGFβ bija atrodams divos gadījumos maz un vienā tikai retās šūnās. Līdzīgi rezultāti bija, analizējot OPG pozitīvās šūnas. Savukārt OC divos gadījumos tika atrasts retās šūnās un vienā gadījumā – maz šūnās (sk. 4. att.). Un, visbeidzot, OP konstatēja tikai vienā paraugā maz šūnās.
2. tabula. Kaulu reģenerācijas marķieru, augšanas faktoru, pamatvielas proteīnu un šūnu aktivitātes rādītāju relatīvā daudzuma kopsavilkums kontroles grupas dzīvniekiem ar inducētu osteoporozi bez biokeramikas granulu implantācijas / Relative quantitative summary of bone regeneration markers, growth factors, raw protein and cell activity indicators in experimental group of animals with induced osteoporosis without bioceramics pellet implantation
| Dzīvnieka Nr. | BMP2/4 | TGFβ | OC | OP | OPG |
|---|---|---|---|---|---|
| 10. | ++ | + | 0/+ | 0 | 0/+ |
| 12. | ++ | 0/+ | 0/+ | + | + |
| 15. | ++ | + | + | 0 | + |
BMP2/4 – kaulu morfoģenētiskie proteīni / bone morphogenetic proteins; TGFβ – transformējošais augšanas faktors / transforming growth factor; OC – osteokalcīns / osteocalcin; OP – osteopontīns / osteopontin; OPG – osteoprotegerīns / osteoprotegerin.
0/+ – retas pozitīvās šūnas; + – maz pozitīvo šūnu; ++ – vidēji daudz pozitīvo šūnu; +++ – daudz pozitīvo šūnu.
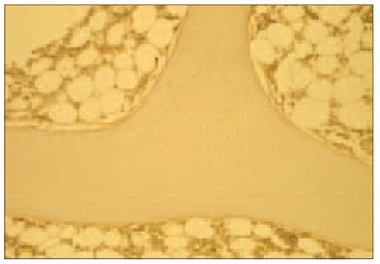
3. attēls. Osteoporotisks kontroles grupas dzīvnieku kauls bez granulu implantācijas, kurā ir vidēji daudz kaulu reģenerācijas proteīnu saturošo šūnu (BMP2/4 IMH, × 200) / Bone of control group of animals without biocemics pellets implantation with moderate amount of bone regeneration protein containing cells (BMP2/4 IMH, × 200) | 4. attēls. Kontroles grupas dzīvnieka kauls bez granulu implantācijas, kurā ir maz osteokalcīna pozitīvo šūnu (OC IMH, × 200) / Bone of control group of animals without biocemics pellets implantation with little amount of osteocalcin positive cells (OC IMH, × 200) |
|
|
Diskusija
Eksperimentālās osteoporozes modeļiem ir atzīta vieta šīs izplatītās patoloģijas pētījumos, un kā modeļi tiek izmantoti truši, žurkas, arī aitas un citi dzīvnieki. Šīs patoloģijas radīšanā vadošo vietu ieņem ovariektomija, kuras osteoporotiskā efekta veicināšanai pievieno zema kalcija satura diētu, glikokortikoīdos hormonus un citus faktorus. Klasiskās kaulaudu kvalitātes triādes rādītāji, t. i., kaula šūnu un starpšūnu vielas relatīvais apjoms kopējā kaula struktūrā, kaula kā materiāla biomehāniskās īpašības, galvenokārt minerālblīvums un kaulaudu arhitektonika, vairāk vai mazāk ir skarti visos eksperimentālās osteoporozes modeļos.
Mūsu pētījumā izvēlējāmies vairāku faktoru modeli, t. i., vecas trušu mātītes, kuru olnīcās, tās histoloģiski izmeklējot, bija cistiska deģenerācija un maz aktīvas parenhīmas, ovariektomiju kā radikālu estrogēno hormonu izslēgšanas metodi un metilprednizolona injekcijas maksimāli ilgā no ieteiktajiem laika periodā. Konvencionālā histoloģija ar hematoksilīna / eozīna krāsojumu apstiprināja kaula struktūru samazināšanos un intertrabekulāro telpu palielināšanos galvenokārt uz taukaudu rēķina. Šī raksta uzdevums bija izvērtēt imūnhistoķīmiskos rādītājus osteoporotiska ciskas kaula cilindriskā defektā un ap to trīs mēnešus pēc pildīšanas ar HAp/TCP 90/10 granulām un kontroles dzīvniekiem bez biokeramikas ievadīšanas.
Noteiktie kaulaudu reģenerāciju un remodelāciju raksturojošie funkcionālās morfoloģijas faktori kopumā uzrādīja paaugstinātu ekspresiju kaulaudos ap defektu, kurš bija pildīts ar HAp/TCP granulām, salīdzinot ar osteoporotisku kaulu bez defekta pildījuma.
Vismazākā atšķirība eksperimenta un kontroles grupās bija TGFβ ekspresijā. Ir zināms, ka šiem augšanas faktoriem ir izšķiroša loma mezenhimālo prekursoru šūnu stimulācijā diferenciācijai hondrocītu, osteoblastu un osteoklastu virzienā, t. i., primārajā osteoģenēzes un kaulaudu remodelācijas indukcijā normālos un osteoporotiskos kaulos [4, 5, 8, 16]. Lūzumu dzīšanas procesā morfoģenētiskie proteīni augstāko aktivitāti sasniedz primārā rumbējuma veidošanās posmā, kuram, pārejot no skrimšļaudiem trabekulārā un pēc tam plātnīšu kaulā, šo augšanas faktoru aktivitāte mazinās [5]. Mūsu materiālā trīs mēnešus pēc defekta radīšanas tā zonā pārsvarā vērojams plātnīšu kauls ar vidēji daudz BMP2/4 pozitīvu šūnu. Nedaudz aktīvāku BMP2/4 ekspresiju osteoporotiskā kaulā bez HAp/TCP ietekmes var skaidrot ar lēnāku osteoģenēzi.
OC ir osteoblastiski diferencētu šūnu produkts, kurš norāda, ka osteoblastiska diferenciācija ir notikusi. OC, kas tiek sekretēts osteoblastos, norāda uz to aktivitāti un tādējādi ir tieši saistīts ar kaula mineralizāciju un kaulu minerālā blīvuma pieaugumu [17]. OC ekspresija izmeklētajos paraugos ir salīdzinoši vairāk izteikta, kas norāda uz biokeramikas spēju aktivizēt kaulšūnas un veicināt kaulu reģenerāciju. Kontroles grupā, t. i., bez biokeramikas pildījuma, OC ekspresija bija minimāla.
OP ir pamatvielas proteīns, kura funkcija ir daudzveidīga un nav vēl pietiekami izpētīta. OP tiek sintezēts dažādās šūnās, t. sk. fibroblastos, osteoblastos, osteocītos, hondrocītos, mioblastos un citur, regulējot iekaisuma procesus [1, 27, 28]. Attiecībā uz kaulaudiem OP aktivizē osteoklastu funkciju, veicina kaulu remodelāciju [6, 10, 22]. Izmeklētajos paraugos eksperimenta grupā OP pozitīvo šūnu daudzums pret OC pozitīvo šūnu skaitu ir ievērojami mazāks, kas var liecināt par iniciālu kaulaudu remodelāciju, kurā osteoblastu funkcija pārsniedz osteoklastu aktivitāti.
OPG veido sakaru starp mezenhīmas / osteoblastu un hematopoētisko / osteoklastu šūnu līnijām un ir osteoklastu diferenciāciju un funkciju regulējošs faktors, kura trūkums aktivizē kaulaudu resorbciju, bet eksogēna ievadīšana var būt perspektīva osteoporozes ārstēšanā [2, 15]. Mūsu pētījumā OPG ekspresija kaulaudos ap HAp/TCP implantācijas vietu osteoporotiskā kaulā ir divas reizes augstāka nekā kontroles grupā bez biokeramikas implantācijas, kas liecina par osteoģenēzes pārsvaru pār kaulaudu resorbciju.
Šī pētījuma rezultāti var apstiprināt mūsu agrākos secinājumus [21], ka kaulaudu reģenerācijas un kalcija fosfātu biokeramikas implantācijas ietekme pēc funkcionālās morfoloģijas imūnhistoķīmiskajiem rādītājiem eksperimentālo operāciju zonā ir atšķirīga un dažādi traktējama dažādos laika periodos pēc biokeramikas granulu implantācijas, bet kopumā apstiprina citu autoru secinājumus par kalcija fosfātu biokeramikas materiālu osteoindukcijas spējām, aktivizējot endogēnos augšanas faktorus. Lietotā bifāziskā kompozīcija, t. i., ar lielu hidroksiapatīta pārsvaru pār trikalcijfosfātu, ir lēnas remineralizējošas darbības biokeramikas materiāls, kas domāts ilglaicīgai kaulaudus kvalitatīvi pastiprinošai darbībai līdztekus agrīnākā pēcimplantācijas periodā iegūtajai kaula kvantitatīvai palielināšanai un arī mehāniskajai pastiprināšanai osseointegrācijas ceļā.
Secinājumi
- Trīs mēnešus pēc sintētisku bifāzisku HAp/TCP granulu implantācijas eksperimentālas osteoporozes kaula defektā osteoģenēzi inducējošo augšanas faktoru ekspresija, salīdzinot ar osteoporotisku kaulu bez biokeramikas implantācijas, ir duāla: TGFβ ir bez izteiktas atšķirības, savukārt BMP2/4 samazinās.
- Kaulu pamatvielas proteīnu osteokalcīna un osteopontīna ekspresija osteoporotiskā kaulā ap HAp/TCP implantācijas vietu ir būtiski augstāka nekā ap osteoporotiska kaula defektu bez biomateriāla implantācijas, un tas norāda uz kaula kvalitātes uzlabošanos.
- Būtisks osteoprotegerīna ekspresijas pieaugums osteoporotiskā kaulā ap HAp/TCP implantācijas vietu apstiprina bifāziskās kalcija fosfātu biokeramikas labvēlīgo ietekmi uz kaulaudu remodelāciju osteoģenēzes veicināšanas virzienā.
Abstract
Quantitative Immunohistochemical Analysis of Osteoporotic Bone of Experimental Animals in New Biphasic Calcium Phosphate Bioceramic Implantation Area
To obtain detailed information on osteoporotic bone regeneration and remodelling as a model for the use of experimental animals with induced osteoporosis, a similar morphology as osteoporotic human bone was chosen.
Immunohistochemical analysis of experimental animal osteoporotic bone 3 months after implantation of calcium phosphate bioceramic granules was performed.
Experimental osteoporosis was induced in 7 female rabbits, aged 2 to 2.8 years, after ovariectomy followed by administration of 1 mg/kg of methylprednisolone daily for 8 weeks. In the experimental group of 4 animals, bone defect in hip bone was created and filled with a biphasic calcium phosphate bioceramic granules with a size of 1 to 1.4 mm, containing hydroxyapatite (HAp) and β-tricalcium phosphate (β-TCP) in proportion of 90/10 developed in RTU Rudolfs Cimdins Rīga Biomaterials Innovation and Development Centre. The control group had 3 rabbits without bioceramics implantation. After 3 months, all of the animals were euthanized and bone samples collected and prepared to analyse following immunohistochemistry markers: osteocalcin (OC), osteopontin (OP), bone morphogenetic protein 2/4 (BMP2/4), transforming growth factor beta (TGFβ). Semiquantitative method was used in result evaluation.
The smallest difference in experimental and control groups was in TGFβ expression. Osteocalcin expression in the investigated samples is relatively more pronounced, indicating the ability of bioceramics to improve bone quality. Investigated samples of the experimental group OP positive cells compared to OC positive cells is significantly lower, which may indicate bone remodelling, in which osteoblast function exceeds osteoclast activity. In our study, OPG expression in bone around the HAp/TCP implantation sites is twice as high as in the control group without bioceramic implantation, suggesting osteogenesis dominance over bone resorption.
HAp/TCP bioceramic implants in osteoporotic bone have a positive effect on bone quality and promotes bone remodelling towards new bone formation.
Literatūra
- Ashizawa N., et al., Osteopontin is produced by rat cardiac fibroblasts and mediates A(II)-induced DNA synthesis and collagen gel contraction // J Clin Invest, 1996 Nov 15; 98 (10): 2218–2227.
- Aubin J. E., Bonnelye E. Osteoprotegerin and its ligand: a new paradigm for regulation of osteoclastogenesis and bone resorbtion // Osteoporosis Int, 2000; 11: 905–913.
- Baofeng L., Zhi Y., Bei C., et al. Characterization of a rabbit osteoporosis model in duced by ovariectomy and glucocorticoid // Acta Orthop, 2010 Jun; 81 (3): 396–401.
- Beaudreuil J., Mbalaviele G., Cohen-Solai M., et al. Short-term local injections of transforming growth factor-beta 1 decrease ovariectomy-stimulated osteoclastic resorption in vivo in rats // J Bone Miner Res, 1995; 10: 971–977.
- Bostrom M. P., Asnis P. Transforming growth factor beta in fracture repair // Clin Orthop Relat Res, 1998; 355 Suppl.: 124–131.
- Choil S. T., et al., Osteopontin might be involved in bone remodelling rather than in inflammation in ankylosing spondylitis // Rheumatology, 2008, 47 (12): 1775–1779.
- Dorozhkin S. V. Biphasic, triphasic and multiphasic calcium orthophosphates // Acta Biomaterialia, 212, 8 (3): 963–977.
- Fujita T., Matsui T., Nakao Y., et al. Cytokines and osteoporosis // Ann NY Acad Sci, 1990; 587: 371–375.
- Garrido C. A., Lobo S. E., Turibio F. M., et al. Biphasic calcium phosphate bioceramics for orthopedic reconstructions: clinical outcomes // Int J Biomater, 2011; 9. doi:10.1155/2011/129727.
- Giachelli C. M., Steitz S. Osteopontin: a versatile regulator of inflammation and biomineralization // Matrix Biol, 2000 Dec; 19 (7): 615–622.
- Holmes R. E., Roser S. M. Porous hydroxyapatite as bone graft substitute in alveolar ridge augmentation: a histometric study // Int J Oral Maxillofac Surg, 1987; 16 (6): 718–728.
- Kannus P., Parkkari J., Sievänen H., et al. Epidemiology of hip fractures // Bone, 1996 Jan; 18 (1 Suppl), 57S–63S.
- Kolk A., Handschel J., Drescher W. Current trends and future perspectives of bone substitute materials – from space holders to innovative biomaterials // J Carnio Maxill Surg, 2012; 40 (8): 706–718.
- Lee N. K., et al. Endocrine regulation of energy metabolism by the skeleton // Cell, 2007 August 10; 130 (3): 456–469.
- Melton L. J. Adverse outcomes of osteoporotic fractures in the general population // J Bone Miner Res, 2003 Jun; 18 (6): 1139–1141.
- Nakamura M., Udagawa N., Matsuura S., et al. Osteoprotegerin regulates bone formation through a coupling mechanism with bone resorbtion // Endocrinology, 2003; 144: 5441–5449.
- Nanakaris N. K., Petsatodis G., Tagil M., Ginnaoudis P. V. Is there a role for bone morphogenetic proteins in osteoporotic fractures? // Injury, 2009; 40 Suppl3, 21–6.
- Petronis S., Skagers A., Pilmane M., et al. New biphasic calcium phosphate in orthopedic surgery: first clinical results // International Symposium on Biomedical Engineering and Medical Physics (ISBEMP) Proceedings, 2012; 38: 174–177.
- Petronis S., Pilmane M., Skagers A., Immunohistochemical comparative analysis of bone tissue in patients with osteoporotic fractures and animals in experiment // Baltic Morphology VII Scientific Conference, 2013.
- Petronis S., Skaģers A., Pilmane M. u. c. Augšstilba kaula proksimālā gala lūzumu statistiskie rādītāji 2007.–2010. gadā Rīgas 2. slimnīcā // RSU Zinātniskie raksti, 2012; 337. lpp.
- Pilmane M., Salms G., Salma I., Skagers A. Time-dependent cytokine expression in bone of experimental animals after hydroxyapatite (Hap) implantation // International conference functional materials and nanotechnologies 2011, Institute of Solid State Physics University of Latvia April 5–8. 2011, P. 153.
- Reinholt F. P., et al., Osteopontin – a possible anchor of osteoblasts to bone // Procl Natl Acad Sci USA, 1990 June; 87 (12): 4473–4475.
- Salma K., Irbe Z., Jakovlevs D., et al. Advanced materials research, 2011; 222, 255–258. doi:10.4028/www.scientific.net/AMR.222.255.
- Salma I., Salms G., Pilmane M., et al. Morphological evaluation of bone after implantation of hydroxyapatite and biphasic ceramic bone substitutes // Symposium Bioceramics and cells fot reinforcement of bone, 18–20.10.2012, Riga, P. 23.
- Sheng Z. F., Xu K., Ma Y. L., et al. Zoledronate reverses mandibular bone loss in osteoprotegerin-deficient mice // Osteoporosis Int, 2009; 20: 151–159.
- Skagers A., Salma I., Pilmane M., et al. Tripple confirmation for bioactivity of synthetic hydroxyapatite (Hap) in bony environment // Termis EU 2011 Annual Meeting Tissue Engineering & Regenerative Medicine International Society 7-10 June 2011, Granada, Spain.
- Uaesoontrachoon K., et al. Osteopontin and skeletal muscle myoblasts: association with muscle regeneration and regulation of myoblast function in vitro // Int J Biochem Biol, 2008; 40 (10): 2303–2314.
- Wang K. X. Osteopontin: Role in immune regulation and stress response // Cytokine Growth Factor Rev, 2008; 19 (5–6): 333–345.