Autologu mezenhimālo šūnu agrīna ietekme uz bifāziska kalcija fosfātu biokeramikas materiāla integrāciju žokļos trušiem ar eksperimentālu osteoporozi
Kopsavilkums
Ievads. Kaulaudu veidošana, uzturēšanas un reģenerācijas labošana ietver ciešu savstarpēju saistību starp kaulu smadzenēs esošajiem diviem cilmes šūnu tipiem: hematoloģisko cilmes šūnu izcelsmes osteoklastiem un mezenhimālo stromas šūnu radītajiem osteoblastiem. Cilmes šūnu un biokeramikas izmantošana, iespējams, var ievērojami uzlabot osteointegrāciju un pacientu dzīves kvalitāti.
Darba mērķis. Noteikt, vai autologas mezenhimālas šūnas ietekmē bifāziska kalcija fosfātu biokeramikas materiāla integrāciju žokļos trušiem ar eksperimentālu osteoporozi.
Materiāls un metodes. Pētījumā tika izmantota Rūdolfa Cimdiņa Rīgas Biomateriālu inovācijas un attīstības centrā ražota sintētiskā porainā HAp biokeramika HAp/TCP 90/10 ar 61% porainību. Desmit trušu mātītēm pēc ovariektomijas un 8 nedēļu metilprednizolona kursa (1 mg/kg) izveidojās eksperimentāla osteoporoze. Tās pašas ovariektomijas laikā savākti omentum majus taukaudu paraugi. Pēc tam apakšžokļa labajā pusē izveidotajā 5 mm diametra caurumā implantētas HAp/TCP 90/10 granulas ar autologām no taukaudiem izaudzētām mezenhimālām šūnām (850 000 šūnu), kreisajā pusē veikta tādu pašu granulu implantācija bez šūnām. Pēc 3 mēnešiem veikta eitanāzija un paņemti paraugi no kaula un mīkstajiem audiem implantācijas vietās.
Rezultāti. Kontaktaudos tieši ap Hap/TCP (90/10) granulām hematoksīna un eozīna krāsojumā vērojama mononukleāru šūnu / plazmocītu un makrofāgu koncentrēšanās. Katru granulu apņem šķiedraini saistaudi. Kontaktā ar HAp granulām novēro makrofāgu reakciju.
Secinājumi.
- Veicot morfometrisko analīzi osteoporotiska apakšžokļa kaulaudu defektiem, salīdzinot defektu ar autologām mezenhimālām šūnām kopā ar HAp/TCP granulām un granulām bez šūnām, struktūra ir līdzīga, būtiskas morfoloģiskas atšķirības netika konstatētas. Netika konstatētas iekaisuma pazīmes.
- Žokļu rajona mīkstajos audos pēc HAp/TCP (90/10) implantācijas kaula defektā ar un bez autologu mezenhimālo šūnu pievienošanas pēc trim mēnešiem ir notikusi granulu iekapsulēšanās ar šķiedrainiem saistaudiem, iekaisuma reakcija ir minimāla, būtisku histoloģisku atšķirību starp abām grupām nav.
Ievads
Osteoporoze ir skeleta sistēmas slimība, kurai ir raksturīgs samazināts kaulu blīvums un mikroarhitektonikas bojājumi, kā rezultātā samazinās kaula stiprība un būtiski palielinās kaula lūzuma risks. Tā ir plaši izplatīta mērenās klimata joslas iedzīvotājiem visā pasaulē un ir tieši saistīta ar vecumu. Datu apkopošana ir laikietilpīga, jo rezultāts parādās lēni, tādēļ izpētes grupas uzturēšana ir sarežģīta pacientu dzīvesvietas maiņas vai nāves dēļ [Pino, 2012].
Dzīvesveids un ar veselību saistīti faktori, piemēram, smēķēšana, alkoholisms un diētas, ir saistīti ar osteoporozes saslimstības palielināšanos. Tik daudzu elementu ietekme uz rezultātiem rada problēmas izveidot homogēnu izpētes grupu. Šo būtisko atšķirību dēļ datos rodas relatīvi lielas pretrunas. Dzīvnieku modeļi nodrošina daudz vienveidīgāku izpētes materiālu un ļauj veikt plašus potenciālo terapijas kursu testus. Rūpīgi izvēlēts, osteoporozes izpētei atbilstošs dzīvnieka modelis samazina ierobežojumus, kuri ir saistīti ar cilvēka slimību izpēti, proti, laika un uzvedības mainīgumu starp izpētes objektiem [Salinas, 2009].
Kaulaudu veidošana, uzturēšanas un reģenerācijas labošana ietver ciešu savstarpēju saistību starp kaulu smadzenēs esošajiem diviem cilmes šūnu tipiem: hematoloģisko cilmes šūnu izcelsmes osteoklastiem un mezenhimālo stromas šūnu radītajiem osteoblastiem. Cēlonis paaugstinātajam kaulu trauslumam un tendencei uz lūzumiem osteoporozes gadījumā ir palielinātā osteoklastoģenēze un nepietiekama osteoblastoģenēze [Cella, 2011].
Osteoporozes gadījumā reciproki nodrošinātais līdzsvars starp diviem diferenciācijas ceļiem ir izmainījies, atvieglojot tauku uzkrāšanos kaulu smadzenēs uz osteoblastu formēšanās rēķina. Tas norāda, ka šī stāvokļa (osteoporozes) gadījumā osteoblastu aktivitāte un mikrovide var būt traucēta [Tokudome, 2011; Bruder, 1994; Jahangiri, 1997].
Osteoporoze ir otrā biežāk sastopamā sistēmiskā slimība uzreiz pēc sirds un asinsvadu slimībām. Pacienti ar osteoporozi bieži cieš no priekšlaicīgas zobu izkrišanas un kaulu masas zuduma. Kvalitatīvi un kvantitatīvi izmainītā žokļu kaulu struktūra ļoti apgrūtina zobu implantāciju. Cilmes šūnu un biokeramikas izmantošana, iespējams, var ievērojami uzlabot osteointegrāciju un pacientu dzīves kvalitāti [Most, 1997].
Darba mērķis
Noteikt, vai autologas mezenhimālas šūnas ietekmē bifāziska kalcija fosfātu biokeramikas materiāla integrāciju žokļos trušiem ar eksperimentālu osteoporozi.
Materiāls un metodes
Preklīniskā pētījumā par biokeramikas materiālu lietošanas iespējām kaulu stiprināšanai slimniekiem ar osteoporozi un tās komplikācijām tika izmantota Rūdolfa Cimdiņa Rīgas Biomateriālu inovācijas un attīstības centrā ražota sintētiskā porainā HAp biokeramika HAp/TCP 90/10 ar 61% porainību. Granulām ir makroporoza struktūra, poru izmērs ir 50–450 mikroni. Sintēze notika divas stundas 1150 °C temperatūrā. Hidroksiapatīta tīrības fāze tika pētīta, izmantojot difraktometriju un Furjē infrasarkano spektroskopiju.
Desmit trušu mātītēm pēc ovariektomijas un 8 nedēļu metilprednizolona kursa (1 mg/kg) izveidojās eksperimentāla osteoporoze. Tās pašas ovariektomijas laikā savākti omentum majus taukaudu paraugi un ievietoti fizioloģiskajā šķīdumā ar heparīnu. Pēc tam paraugus nomazgāja ar fosfātu buferšķīdumu (Phosphate Buffered Saline – PBS) un 2–5 stundas 37 °C apstrādāja ar XI tipa kolagenāzi. Šūnas iesēja audu kultūras kolbas Dulbeko modificētajā Īgla vidē (Dulbecco’s Modified Eagle Medium – DMEM) 20% fetālajā teļu serumā (Fetal Bovine Serum – FBS), tad uz 2 stundām iemērcēja 100 % FBS, kad tika pievienots DMEM / 10 % FBS. Paraugus vienu dienu inkubēja 37 °C 5 % CO2. Pirms implantācijas paraugi divreiz nomazgāti ar PBS.
Pēc tam apakšžokļa labajā pusē izveidotajā 5 mm diametra caurumā implantēja HAp/TCP 90/10 granulas ar autologām no taukaudiem izaudzētām mezenhimālām šūnām (850 000 šūnu), kreisajā pusē veikta tādu pašu granulu implantācija bez šūnām. Pēc 3 mēnešiem notika trušu eitanāzija un paņemti paraugi no implantācijas vietām un mīkstajiem audiem. Pēc tam izgatavoti histoloģiski un imūnhistoķīmiski preparāti, materiāli krāsoti ar hematoksīnu un eozīnu. Defektam pieguļošajiem kaulaudiem veikta datorizēta morfometriska izmeklēšana, lietojot Image Pro+ programmu, veikta datu izvērtēšana, analīze un statistiska apstrāde.
Divās kontroles grupās bija 4 truši: diviem trušiem – 2–2,5 gadus vecām trušu mātītēm – netika veikta ovariektomija un biokeramikas implantācija, lai novērtētu žokļu kaulu morfoloģiju pirms eksperimentālās osteoporozes radīšanas. Otriem diviem trušiem arī netika veikta ovariektomija, bet izveidotajā caurumā apakšžoklī implantētas HAp/TCP granulas, HAp/TCP granulas un mezenhimālas šūnas, lai vērtētu kaula defekta sadzīšanu bez eksperimentālās osteoporozes.
Rezultāti
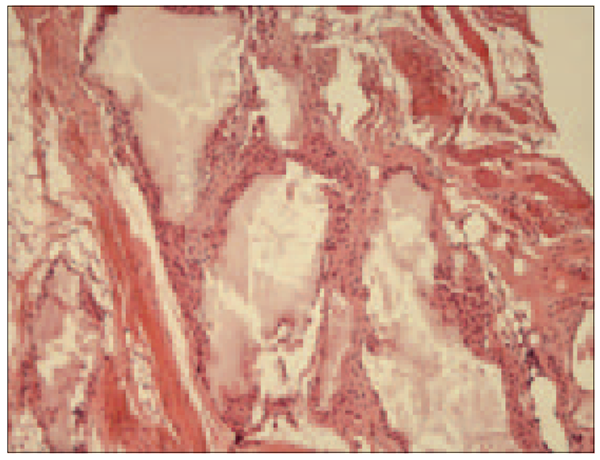
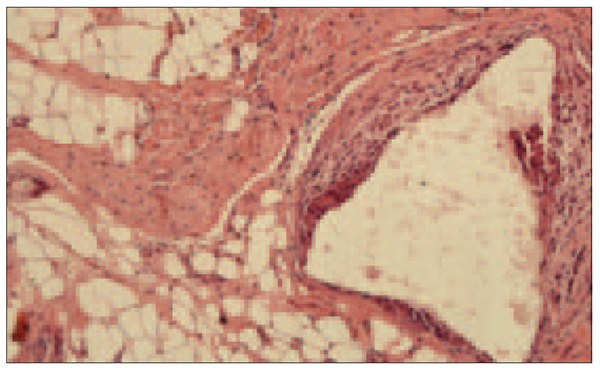
Visām trušu mātītēm pēc HAp/TCP granulu implantācijas mīksto audu struktūra ir saglabāta granulām ar mezenhimālām šūnām. Katru granulu apņem šķiedraini saistaudi. Kontaktā ar HAp granulām novēro makrofāgu reakciju (sk. 1. un 2. att.).
Tika izvērtēta primāra osteointegrācija ap HAp/TCP granulām. Veicot morfometrijas analīzi, tika konstatēts, ka trabekulārā kaula biezums tikai ap Hap/TCP (90/10) granulām ir 274 mkm, trabekulārā kaula biezums ap granulām ar šūnām – 236 mkm (p = 0,107); kortikālā kaula biezums tikai ap HAp/TCP (90/10) granulām ir 739 mkm, kortikālā kaula biezums ap granulām un šūnām – 753 mkm (p = 0,341).
1. attēls. Mīksto audu mikrofotogramma trīs mēnešus pēc HAp/TCP 90/10 un šūnu implantācijas apakšžokļa labajā pusē. Mīksto audu struktūra saglabāta. Katru granulu apņem šķiedraini saistaudi. Kontaktā ar HAp granulām novēro makrofāgu reakciju. Hematoksīna un eozīna krāsošanas metode, × 10 / Soft tissues three months after HAp/TCP 90/10 implantation with mesenchymal cells. Soft tissue structure preserved. Each granule surrounded with fibrous connective tissue. Macrophage reaction in contact with HAp granule. Hem/eos dyeing technique, × 10
Kontroles pusē kortikālā kaula biezums bez granulām un šūnām bija 772 mkm, trabekulārā kaula biezums – 255 mkm. Kontroles pusē kortikālā kaula biezums tikai ap granulām bija 729 mkm, ap granulām un šūnām – 563 mkm; trabekulārā kaula biezums tikai ap granulām – 234 mkm, ap granulām un šūnām – 246 mkm (sk. 3. att.).
2. attēls. Kontroles puse. Mīksto audu mikrofotogramma trīs mēnešus pēc HAp/TCP 90/10 implantācijas. Saistaudu matricē ietvertas HAp granulas. Ap granulām vērojama makrofāgu reakcija. Hematoksīna un eozīna krāsošanas metode, × 10. / Controle. Soft tissues three months after HAp/TCP 90/10 implantation. HAp granules included connective tissues. Macrophage reaction in contact with HAp granule. Hem/eos dyeing technique, × 10
3. attēls. Žokļu kaulu morfometrijas rādītāji vecām trušu mātītēm bez eksperimentālās osteoporozes protokola lietošanas un trīs mēnešus pēc tā / Old rabbits jaw bone morphometric parameters without experimental osteoporosis protocol and three months after that
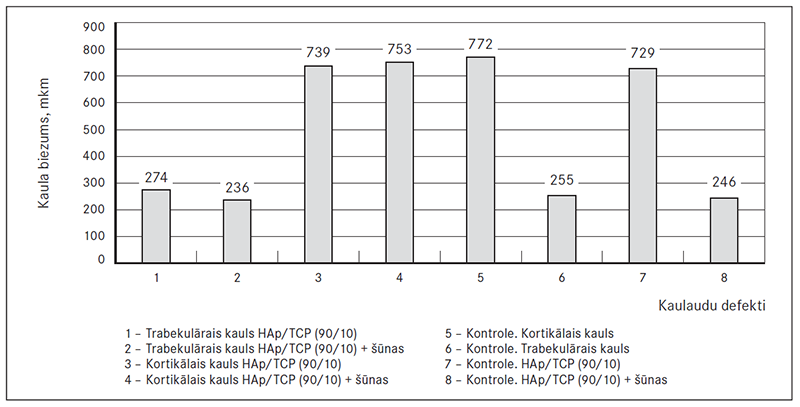
Morfometrijas dati ir gandrīz vienādi visās četrās pētījuma grupās, t. i., vecām trušu mātītēm jau pirms eksperimentālās osteoporozes protokola lietošanas ir izteikta osteoporoze, kuru maz ietekmējusi gan ovariektomija un glikokortikoīdi, gan arī lēni degradējošs (HAp/TCP 90/10) biokeramikas materiāls “tīrā” veidā vai papildināta ar autologām mezenhimālām šūnām lietošana triju mēnešu laikā.
Diskusija
Osteoporozes izpausmju cēlonis žokļu kaulos ir kaulaudu resorbcijas un depozīcijas balansa traucējumi visā organismā un arī specifiski mutes dobuma apstākļi [Hildebolt, 1997; Jagelavičiene, Kubilius, 2006; Slaidiņa, 2008]. Ir arī uzskats, ka sistēmiskā osteoporoze agrīnāk nekā citos kaulos var izpausties žokļu alveolārajā kaulā [Manzke, 1975]. Osteoporozes patoloģijas un ārstēšanas pētījumos, meklējot vispārējās un lokālās terapijas līdzekļus osteoporotisku kaulu pastiprināšanai, arvien vairāk izmanto eksperimentālās osteoporozes modeļus, visbiežāk trušus un žurkas.
Tiešāko sakaru ar lokālu remineralizāciju un, iespējams, arī reosifikāciju var gaidīt no kalciju un fosforu saturošiem kaulaudus aizvietojošiem biomateriāliem, kas ir arī mūsu pētījumu saturs. Ir pierādīts kaula minerālblīvuma un graujošā spēka pieaugums dzīvniekiem ar eksperimentālo osteoporozi pēc Ca un P jonoforēzes [Pap, 2010; Gomez, 2012].
Tiek turpināti meklējumi kaulaudus aizvietojošo biomateriālu mērķtiecīgas bioaktivitātes pastiprināšanai, pievienojot tiem medikamentus, bioloģiski aktīvas molekulas vai šūnas.
Eksperimentā un klīniskajā praksē ir pierādīta žokļu alveolārā kaula minerālblīvuma pastiprināšanās pēc ekstrakcijas, brūču pildīšanas ar HAp, kas papildināts ar bisfosfonātiem, salīdzinot ar HAp bez bisfosfonātiem [Denissen, 2000]. Cella ar līdzautoriem [Cella, et al., 2011], ievadot autologas kaulu smadzeņu progenitoru šūnas žokļu osteonekrozes perēkļos, kuri radās pēc ilgstošas bisfosfonātu lietošanas, panāca, ka pēc 30 mēnešiem nekrozes perēklis bija izzudis un kaula struktūras bija pilnīgi atjaunojusies.
Mūsu veiktajā eksperimentālajā pētījumā autologas mezenhimālās šūnas tika pievienotas HAp/TCP 90/10 granulām, kuras ievietojām žokļa defektos trušiem ar eksperimentālu osteoporozi. Mūsu pētījumā trīs mēnešus pēc osteoporotiska kaula pastiprināšanas ar bifāziska kalcija fosfātu (HAp/TCP 90/10) granulām morfometriski kontaktējošajos kaulaudos nebija statistiski nozīmīgu izmaiņu, ko var skaidrot ar īsu novērojuma periodu un biomateriāla kompozīciju, kurā 90% ir sintētiska HAp biokeramika ar lēnu biodegradāciju attiecībā pret TCP un atbilstoši lēnu Ca un P jonu izdalīšanu.
Osteoporotiskām žurkām ievadot β-TCP nanodaļiņas ap žokli vienu reizi nedēļā 12 nedēļas ilgā laika periodā, tika iegūts statistiski nozīmīgs minerālblīvuma un kaula mehāniskās stiprības pieaugums [Tokudome, 2011]. TCP salīdzinot ar HAp ir vairākas reizes ātrāka noārdīšanās dzīvajos audos un līdz ar to agrāka Ca un P jonu izdalīšanās.
Literatūrā minētie eksperimentālās osteoporozes modeļi bija salīdzinoši jaunas eksperimentālo dzīvnieku (trušu, žurku) mātītes, kurām, vērtējot pēc dažādiem kritērijiem, tika apstiprināta eksperimentālā osteoporoze, kā arī dažādu ārstniecisku līdzekļu ietekme. Mūsu pētījuma atšķirība ir vecu trušu mātīšu izvēle ar izteiktām olnīcu atrofijas un deģenerācijas pazīmēm un, varētu teikt, izteiktu “pēcmenopauzes” osteoporozi, kuru vairs neietekmēja ne papildu patoģenētiskie faktori, ne lietotā lokālā terapija.
Kaula minerālblīvums un no tā atkarīgās kaula biomehāniskās īpašības remineralizācijas rezultātā var mainīties ātrāk nekā kaulaudu histoloģiskā uzbūve trabekulārā un arī kortikālā kaula struktūru palielināšanās virzienā. Trīs mēnešu laika periods var būt pārāk īss būtiskām osteoporotisku kaulaudu morfoloģiskajām izmaiņām gan pēc “tīra”, gan ar autologām mezenhimālām šūnām papildinātas bifāziskas lēni biodegradējošās kalcija fosfātu biokeramikas granulu implantācijas. Izteikta osteoporoze noteiktā tās attīstības stadijā attiecībā pret lokālas terapijas mēģinājumiem varētu būt refraktāra un neatgriezeniska.
Secinājumi
- Veicot morfometrisko analīzi osteoporotiska apakšžokļa kaulaudu defektiem, salīdzinot defektu ar autologām mezenhimālām šūnām kopā ar HAp/TCP granulām un granulām bez šūnām, struktūra ir līdzīga, būtiskas morfoloģiskas atšķirības netika konstatētas. Netika konstatētas iekaisuma pazīmes
- Žokļu rajona mīkstajos audos pēc HAp/TCP (90/10) implantācijas kaula defektā ar un bez autologu mezenhimālo šūnu pievienošanas pēc trim mēnešiem notiek granulu iekapsulēšanās ar šķiedrainiem saistaudiem, ar minimālu iekaisuma reakciju un bez būtiskām histoloģiskām atšķirībām starp abām grupām.
- Vecām žurku mātītēm ar žokļu osteoporozi literatūrā aprakstītais eksperimentālās osteoporozes modelis ir apšaubāms.
Pateicība
Pētījums veikts ar Valsts pētījumu programmas “Daudzfunkcionālie materiāli un kompozīti, fotonika un nanotehnoloģijas (IMIS2) 4. projekta “Nanomateriāli un nanotehnoloģijas Medicīniskajam pielietojumam apakšprojektā 4.1.2” finansējumu.
Abstract
Early Influence of Autologous Mesenchymal Cells on Biphasic Calcium Phosphate Bioceramic Material Integration in Rabbits’ Jaws with Experimental Osteoporosis
Current trend is biologisation of non-organic bioceramic material to be close to natural living bone and the replacement of bone grafting by bioceramics saturated with growth factors or/and potential cells.
The aim of the study was to determine the effect of autologous mesenchymal cells on biphasic calcium phosphate bioceramic material integrated in rabbits’ jaws with experimental osteoporosis.
Synthetic porous HAp ceramics HAp/TCP 90/10 with open porosity 61% produced in Rudolfs Cimdins Biomaterials Innovations and Development Centre were used. Granules have macroporous structure with pore size 50–450 μm.
10 Californian rabbits under general anaesthesia with Dormicum and Ketamine experimental osteoporosis by ovariectomy and 8 weeks intramusculary metilprednisolone 1 mg/kg were developed. During the same surgery fat tissue from omentum majus were collected in tubes (Sarstedt) with physiological solution and heparin. Implants loaded with cells on the one side, and pure HAp/TCP on the other side in rabbits’ lower jaw hole was inserted. Samples were taken out after three months.
Essential osseointegration of HAp/TCP granules in jaw bone and soft tissues was estimated. No signs of inflammation were detected.
Period of three months may be too short for major osteoporotic bone morphological changes at both “clean” and autologous mesenchymal cells.
Morphometric measurement of osteoporotic bone osseointegrated with HAp/TCP (90/10) granules implanted in rabbits’ lower jaw with and without autologous mesenchymal cells after six-month observation period was without statistically significant morphological differences.
In the rabbits’, lower jaw soft tissues area after HAp/TCP (90/10) granules implantation with and without autologous mesenchymal cells, after three months observation was granules encapsulation around connective tissue without significant histological differences between two groups.
Literatūra
- Pino A. M., Clifford J. R., Rodrigue P. J. In osteoporosis, differentiation of mesenchymal stem cells (MSCs) improves bone marrow adipogenesis // Biol Res, 2012; 45: 279–287.
- Salinas C. N., Anseth K. S. Mesenchymal stem cells for craniofacial tissue regeneration: designing hydrogel delivery vehicles // Journal of Dental Research, 2009; 88 (8): 681–692.
- Cella L., Oppici A., Arbasi M., et al. Autologous bone marrow stem cell intralesional transplantation repairing bisphosphonate related osteonecrosis of the jaw // Head and Face Medicine, 2011; 67: 16–20.
- Tokudome Y., Ito A., Otsuka M. Effect of zinc-containing β-tricalcium phosphate nano particles injection on jawbone mineral density and mechanical strength of osteoporosis model rats // Biol Pharm Bull, 2011; 34 (8): 1215–1216.
- Bruder S. P., Fink D. J., Caplan A. I. Mesenchymal stem cells in bone development, bone repair, and skeletal regeneration therapy // J Cell Biochem, 1994; 56 (3): 283–294.
- Jahangiri L., Kim A., Nishimura I. Effect of ovariectomy on the local residual ridge remodeling // J Prosthet Dent, 1997; 77 (4): 435–443.
- Most W., Wee-Pals L., Ederveen A., et al. Ovariectomy and orchidectomy induce a transient increase in the osteoclastogenic potential of bone marrow cells in the mouse // Bone, 1997; 20 (1): 27–30.
- Hildebolt C. F. Osteoporosis and oral bone loss // Dentomaxillofacial Radiology, 1997; 26: 3–15.
- Jagelavičiene E., Kubilius R. The relationship between general osteoporosis of the organism and periodontal disease // Medicina, 2006; 42: 613–618.
- Slaidiņa A., Soboļeva U., Daukste I. u. c. Osteoporozes ietekme uz bezzobu žokļa kaula rentgenoloģiskajiem rādījumiem // RSU Zinātniskie Raksti, 2008; 364–371.
- Pap I., Gomez I. Development of natural calcium- and phosphate-donating microparticles and a new iontophoretic apparatus for the topical treatment of local osteoporosis: in vitro and in vivo studies // Joint Bone Spine, 2010; 77: 426–431.
- Gomez I., Szabo A., Pap L., et al. In vivo calcium and phosphate iontophoresis for the topical treatment of osteoporosis // Physical Therapy, 2011; 92: 289–297.
- Tokudome Y., Ito A., Otsuka M. Effect of zinc-containing β-tricalcium phosphate nano particles injection on jawbone mineral density and mechanical strength of osteoporosis model rats // Biol Pharm Bull, 2011; 34 (8): 1217–1218.
- Denissen H., Montanari C., Martinetti R., et al. Alveolar bone response to submerged bisphophonate-complexed hydroxyapatite implants // Journal Periodontol, 2000; 71: 279–286.
- Cella L., Oppici A., Arbasi M., et al. Autologous bone marrow stem cell intralesional transplantation repairing bisphoshonate related osteonecrosis of the jaw // Head and Face Medicine, 2011; 67: 20–25.


