KRAS gēna varianta rs61764370 ietekme uz saslimšanu ar krūts vēzi un pacienšu dzīvildzi
Kopsavilkums
Ģenētiskie marķieri, to skaitā viena nukleotīda nomaiņas, ir aktuāls pētījumu objekts krūts vēža patoģenēzē. KRAS gēnā lokalizētais sekvences variants rs61764370 ir jauns biomarķieris, kura klīniskā nozīme audzēju attīstībā pagaidām nav skaidra. Datu par rs61764370 ietekmi uz krūts vēža attīstību un prognozi ir salīdzinoši maz, tāpēc darba mērķis bija noteikt rs61764370 ietekmi uz saslimšanu ar krūts vēzi un pacientu dzīvildzi.
Pētījumā analizēja 2652 secīgu krūts vēža slimnieču un 861 praktiski vesela brīvprātīgā asins donora DNS paraugus, kas izolēti no venozajām asinīm. Rs61764370 klātbūtni DNS paraugos noteica ar restrikcijas fragmentu garuma polimorfisma (RFLP) metodi, ko verificēja ar Sangera sekvenēšanu. Pieejamos klīniskos un biometriskos datus apkopoja un apstrādāja, izmantojot statistiskās apstrādes un analīzes metodes.
Iegūtie rezultāti liecina, ka rs61764370 pozitīvām sievietēm ir palielināts risks saslimt ar krūts vēzi (RR = 1,41; p = 0,006), un šis sekvences variants varētu būt predisponējošs faktors krūts vēža attīstībai saistībā ar hormonālām svārstībām. Starp sekvences varianta rs61764370 nēsātājām novēroja tendenci pieaugt trīskārši negatīvu audzēju īpatsvaram, taču šie dati nesasniedza statistisko ticamību. Pētījumā nenovēroja rs61764370 korelāciju ar krūts vēža slimnieču dzīvildzes datiem un atsevišķiem krūts vēža riska faktoriem.
Ievads
Latvijā, tāpat kā citur pasaulē, tieši krūts vēzis ir visbiežāk sastopamā audzēja lokalizācija sievietēm [Gardovskis, 2005]. Vadoties pēc Slimību profilakses un kontroles centra sniegtajiem datiem, Latvijā 2013. gadā vien diagnosticēti 1133 jauni krūts vēža gadījumi [SPKC, 2014]. Visbūtiskākie riska faktori saslimšanai ar krūts vēzi ir dzimums un vecums, taču ir aprakstīti arī citi, piemēram, radiācija, aptaukošanās, augsts estrogēna līmenis, menstruāciju sākšanās agrā vecumā, vēla menopauzes iestāšanās un krūts vēža gadījumi ģimenes vēsturē [Pennery, 2008]. Pārmantotie krūts vēža gadījumi sastāda apmēram 5 % no visiem krūts vēža gadījumiem Latvijā, līdzīgi rādītāji ir novēroti arī citās populācijās Eiropā [Gardovskis, 2005].
Zinātnieki ir izcēluši specifiskas izmaiņas dažādos gēnos, kas ierosina audzēju attīstību normālos audos. Šīs gēnu alēles palielina risku saslimt ar vēzi un veicina tā attīstību, izmainot šūnu struktūru un funkcijas [Bunz, 2008]. Visvairāk ir aprakstīta DNS sekvences izmaiņu ietekme uz krūts vēža attīstību tieši BRCA1 un BRCA2 gēnos, taču pastāv arī citi ar slimību saistīti gēni, piemēram, PTEN, TP53, CHEK2 un citi [Plakhins, 2011; Berzina, 2013; Olopade, 2008].
Viens no potenciāliem krūts vēža ģenētiskajiem marķieriem ir KRAS gēna 3’ netranslējamā reģionā lokalizēta viena nukleotīda nomaiņa rs61764370 [Cerne, 2012]. Tā izmaina KRAS gēna ekspresiju inhibējošās mikroribonukleīnskābes (miRNS) let-7 saistīšanās sekvenci, tā kavējot let-7 piesaisti, kā rezultātā tiek pārmērīgi ekspresēts KRAS gēns [Jančík, 2010]. KRAS gēna kodētais proteīns savukārt ir iesaistīts šūnu dalīšanās procesā, augšanas, diferenciācijas, hemotakses un apoptozes regulācijā, to nodrošina proteīna spēja pārraidīt ārējos signālus šūnas kodolam [Zuber, 2000].
Pārmantota viena nukleotīda nomaiņa KRAS onkogēna netranslējamā daļā rs61764370 (T>G) ir sastopama reti, šis sekvences variants gandrīz nemaz nav sastopams Austrumāzijā, reti sastopams Āfrikā un eksistē kā minorā alēle Eiropā (7,6 %) [Chin, 2008]. Līdz šim ir aprakstīta šī sekvences varianta saistība ar plaušu vēža, galvas un kakla vēža, epiteliālā olnīcu vēža un kolorektālā vēža attīstību, bet datu par sekvences varianta rs61764370 ietekmi uz krūts vēža attīstību un prognozi ir salīdzinoši maz, kas pamato šī pētījuma aktualitāti [Chin, 2008; Ratner, 2010; Pharoah, 2011; Christensen, 2009; Smits, 2011].
Darba mērķis
Noteikt KRAS gēna sekvences varianta rs61764370 ietekmi uz saslimšanu ar krūts vēzi un pacientu dzīvildzi.
Materiāls un metodes
Pētījumā iekļāva 2652 secīgas krūts vēža slimnieces vecumā no 24 līdz 95 gadiem (vidējais vecums 60,05 ± 12,41 gadi), kas laika posmā no 2000. gada 7. marta līdz 2013. gada 20. jūnijam reģistrētas Paula Stradiņa Klīniskajā universitātes slimnīcā, Latvijas Onkoloģijas centrā, Daugavpils Onkoloģijas slimnīcā un Liepājas Onkoloģiskajā slimnīcā. Pacientes, kurām ir pierādītas ciltstēva mutācijas (5382 insC, 4153delA, 300T/G) BRCA1 gēnā vai ģimenes anamnēzes dati liecina par slimības pārmantotību, tika izslēgtas no gadījuma grupas.
Kontroles grupa sastāvēja no 861 praktiski vesela brīvprātīga asins donora vecumā no 18 līdz 92 gadiem (vidējais vecums 47,63 ± 19,07 gadi), kas reģistrēts Paula Stradiņa Klīniskajā universitātes slimnīcā laika posmā no 2008. gada 31. marta līdz 2011. gada 13. oktobrim bez konstatētām onkoloģiskām slimībām pieteikšanās brīdī.
Gan pacientus, gan brīvprātīgos asins donorus iepriekš informēja par pētījuma mērķiem un iespējamiem riskiem, kas tika rakstiski akceptēts. Pētījumu veica ar Rīgas Stradiņa universitātes Ētikas komisijas atļauju.
Izmantojot reaģentu komplektu FlexiGene DNA Kit (Qiagen, Vācija), no pacientu un brīvprātīgo donoru venozo asiņu paraugiem izolēja pētāmo DNS. Rs61764370 noteikšanai izstrādāja metodi, kas balstīta uz restrikcijas fragmentu garuma polimorfisma (RFLP) metodes principa. Veica Touch-down polimerāzes ķēdes reakciju (TD-PĶR), amplificējot rs61764370 saturošu fragmentu KRAS gēna 3’ netranslējamā reģionā. Amplifikācijā izmantoja specifisku tiešo praimeri ar nukleotīdu secību: 5’-CCTGAGTAGCTGGGATTACA-3’ un atgriezenisko praimeri 5’-GGATACCATATACCCAGTGCCTT-3’.
TD-PĶR veica šādos apstākļos: sākotnējā denaturācija 96 °C 10 minūtes; 20 cikli ar denaturāciju 96 °C 30 sekundes, praimeru hibridizāciju 63 °C 30 sekundes un elongāciju 72 °C 45 sekundes, samazinot praimeru hibridizācijas temperatūru par 0,5 °C katrā ciklā; 20 cikli ar denaturāciju 96 °C 30 sekundes, praimeru hibridizāciju 53 °C 30 sekundes, elongāciju 72 °C 45 sekundes; noslēdzošā fāze 72 °C 10 minūtes. Amplifikācijas produktus sašķēla ar HinfI restrikcijas enzīmu, kura saistīšanās reģions atbilst rs61764370 lokalizācijai sekvencē, tā padarot to detektējamu. Pēc restrikcijas sekoja fragmentu vizualizēšana 2 % agarozes gēlā, kur pēc iegūtajiem fragmentu garumiem noteica rs61764370 klātbūtni analizētajā DNS.
Izstrādāto metodi verificēja ar Sangera sekvenēšanu ģenētiskajā analizatorā (Applied Biosystems, ASV) pēc ražotāja instrukcijām. Iegūtos datus apkopoja un statistiski apstrādāja, izmantojot programmas R-3.1.0, Microsoft Excel 2010 un brīvpieejas programmu MedCalc.
Rezultāti
Sekvences variantu rs61764370 konstatēja 312 (11,76 %) no 2652 gadījuma grupā iekļautām krūts vēža slimniecēm un 72 (8,36 %) no 861 kontroles grupā iekļautā praktiski veselā brīvprātīgā asins donora. Izmantojot hī kvadrāta testu, nenovēroja statistiski ticamu atšķirību starp vidējo vecumu diagnozes noteikšanas brīdī krūts vēža slimniecēm ar sekvences variantu rs61764370 (62,73 gadi) un bez tā (60,25 gadi) (p = 0,802), taču novēroja pozitīvu sekvences varianta biežuma korelāciju ar krūts vēža slimnieču vecumu (sk. 1. tab.).
Kopējo sekvences varianta rs61764370 varbūtību krūts vēža slimnieču grupā un kontroles grupā noteica, izmantojot gadījuma kontroles pētījumu metodi. Iegūtie rezultāti liecina, ka krūts vēža slimniecēm kopumā ir 1,48 reizes lielāka iespēja būt sekvences varianta nesējām nekā veselām sievietēm (OR = 1,48; 95 % TI = 1,12–1,97; hī kvadrāta tests, p = 0,005). Šo saistību pārbaudīja arī dažādās vecuma grupās pēc Mentela–Henzela metodes. Apkopojot rezultātus, ieguva, ka statistiski ticami (p = 0,002) sievietēm ar krūts vēzi 40–60 gadu vecuma grupā ir lielāka varbūtība būt šī sekvences varianta nēsātājām, salīdzinot ar tāda paša vecuma kontroles grupas veselām sievietēm (OR = 2,32; 95 % TI = 1,30–4,44). Pārējās vecuma grupās iegūtie dati nesasniedz statistisko ticamību.
Izmantojot MedCalc brīvpieejas statistikas programmu un Mentela–Henzela metodi, konstatēja palielinātu krūts vēža saslimšanas relatīvo risku sievietēm, kas ir sekvences varianta rs61764370 nēsātājas (RR = 1,41; 95 % TI = 1,10–1,80; p = 0,006).
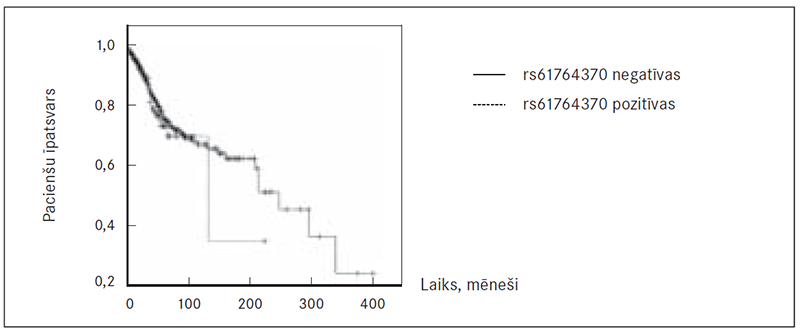
Dzīvildzes dati bija pieejami 2439 (91,97 %) no pētījumā iekļautajām krūts vēža slimniecēm. Balstoties uz šiem datiem, izveidoja Kaplana–Meijera līkni, kas ļauj salīdzināt audzēja specifisko dzīvildzi pacientēm ar sekvences variantu rs61764370 un bez tā 400 mēnešu (33,33 gadi) periodā (sk. 1. att.). Izmantojot log-rank testu (p = 0,501), nekonstatēja statistiski ticamu atšķirību audzēja specifiskās dzīvildzes rādītājos krūts vēža slimniecēm ar rs61764370 sekvences variantu un bez tā.
1. tabula. Sekvences varianta rs61764370 biežums dažādās pacientu vecuma grupās diagnozes noteikšanas brīdī / Frequency of sequence variant rs61764370 in different patient groups by age at the moment of diagnosis
| Vecuma grupa, gadi | Pacienšu skaits grupā, n | rs61764370 pozitīvo pacienšu skaits | |
|---|---|---|---|
| n | % | ||
| ≤ 40 | 154 | 17 | 11,04 |
| 41–60 | 1174 | 131 | 11,16 |
| 61–80 | 1191 | 143 | 12,01 |
| > 80 | 133 | 21 | 15,79 |
1. attēls. Kaplana–Meijera līkne, kas raksturo audzēja specifisko dzīvildzi krūts vēža slimniecēm ar rs61764370 sekvences variantu un bez tā / Kaplan–Meier curve, describing overall survival among sequence variant rs61764370 positive and negative breast cancer patients
Informācija par audzēja molekulāro apakštipu bija pieejama 276 no pētījumā iekļautajām krūts vēža slimniecēm. Izmantojot hī kvadrāta testu, nekonstatēja statistiski ticami (p = 0,571) palielinātu kāda audzēja molekulārā apakštipa īpatsvaru starp sekvences varianta rs61764370 nēsātājām un pacientēm bez šīs alēles, taču novēroja tendenci palielināties trīskārši negatīvā audzēja īpatsvaram un samazināties luminālā B audzēja īpatsvaram rs61764370 pozitīvo pacienšu grupā (sk. 2. tab.).
Divsimt septiņām pētāmās grupas krūts vēža slimniecēm bija pieejama papildu informācija par atsevišķiem biometriskajiem datiem no iepriekš sagatavotām un apkopotām anketām. Izmantojot hī kvadrāta testu, nenovēroja statistiski ticamas atšķirības pieejamo biometrisko datu rādītājos pacientēm, kas ir sekvences varianta rs61764370 nēsātājas, un pacientēm bez šīs alēles.
Iegūtie rezultāti (sk. 2. att.) liecina, ka vidējais grūtniecību skaits rs61764370 pozitīvo pacienšu vidū ir tāds pats kā rs61764370 negatīvajām krūts vēža slimniecēm – trīs grūtniecības (p = 0,138), arī ķermeņa masas indeksa vidējā vērtība krūts vēža slimniecēm ar sekvences variantu rs61764370 (28,02) neatšķiras no pacientēm bez tā (28,07) (p = 0,620).
2. tabula. Audzēju molekulāro apakštipu īpatsvars sekvences varianta rs61764370 nēsātājām un pacientēm bez šīs alēles / Proportion of molecular subtypes of tumors among sequence variant rs61764370 carriers and patients without this allele
| Audzēju molekulārie apakštipi | ||||
|---|---|---|---|---|
| Pacienšu grupa | Luminālais A | Luminālais B | HER-2 | Trīskārši negatīvais |
| rs61764370 pozitīvas, n (%) | 14 (34,15) | 11 (26,83) | 6 (14,63) | 10 (24,39) |
| rs61764370 negatīvas, n (%) | 77 (32,77) | 83 (35,32) | 29 (12,34) | 46 (19,57) |
2. attēls. Sekvences varianta rs61764370 saistība ar krūts vēža slimnieču biometriskajiem datiem / Sequence variant rs61764370 association with biometrical data of breast cancer patients
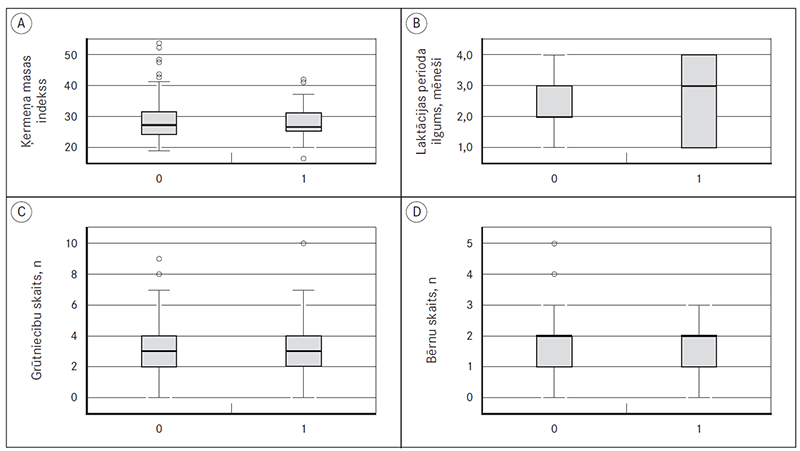
0 – rs61764370 negatīvas pacientes,
1 – rs61764370 pozitīvas pacientes.
Starp abām šīm grupām nenovēroja statistiski ticamu atšķirību bērnu skaitā (vidēji divi bērni abās grupās) un laktācijas perioda ilgumā (2,31 mēneši sekvences varianta nēsātājām, 2,57 mēneši pacientēm bez sekvences varianta, p = 0,925). Tāpat neatšķīrās vecums pirmo menstruāciju laikā (p = 0,925), kas sekvences varianta rs61764370 nēsātāju grupā bija 36 % pēc 14 gadu vecuma, 64% – pirms 14 gadu vecuma, bet pacientēm bez sekvences varianta – 32,78 % pēc 14 gadu vecuma, 67,22 % – pirms 14 gadu vecuma.
Diskusija
Pēdējās desmitgades laikā vēža izpēte ir fokusējusies uz personalizētu medicīnu. Ir aprakstīti dažādi proteīni un biomarķieri, kas papildina prognostisko informāciju par ļaundabīgo audzēju attīstības gaitu un palīdz izvēlēties visefektīvāko ārstēšanas metodi. Rs61764370 ir jauns ģenētiskais marķieris, kura klīniskā nozīme audzēju attīstībā pagaidām nav skaidra.
Apkopojot šajā pētījumā iegūtos rezultātus, sekvences variantu rs61764370 konstatēja 11,76 % pētāmajā grupā iekļauto krūts vēža slimnieču un 8,36 % kontroles grupā iekļauto praktiski veselo brīvprātīgo asins donoru. Aprēķinātais rs61764370 sastopamības biežums kontroles grupā (8,36 %) ir līdzīgs literatūrā aprakstītajam sekvences varianta biežumam Eiropā (7,6 %) [Chin, 2008]. Nelielo atšķirību varētu izskaidrot ar dažādu etnisko sastāvu Latvijas populācijā.
Atšķirības sekvences varianta rs61764370 biežumā novēroja, arī sadalot krūts vēža slimnieces četrās vecuma grupās, kā rezultātā pacientēm vecumā līdz 40 gadiem diagnozes noteikšanas brīdī rs61764370 sastopamības biežums ir ievērojami mazāks (11,04 %) nekā pacientēm pēc 80 gadu vecuma diagnozes noteikšanas brīdī (15,52 %). Tas liecina, ka sekvences variantam rs61764370 varētu būt ietekme uz krūts vēža attīstību, turklāt tās efekts izpaužas, palielinoties sievietes vecumam. Tomēr, ņemot vērā nelielo pacientu skaitu šajās vecuma grupās, šādas hipotēzes apstiprināšanai nepieciešami papildu pētījumi, paplašinot pētāmo grupu.
Pētījuma rezultāti liecina, ka sievietēm ar sekvences variantu rs61764370 ir nedaudz palielināts risks (RR = 1,41; 95 % TI = 1,10–1,80; p = 0,006) dzīves laikā saslimt ar krūts vēzi. Šis apgalvojums ir pretrunā ar cita pētījuma rezultātiem, kurā neatklāja sekvences varianta saistību ar risku saslimt ar sporādisku vai pārmantotu krūts vēzi [Cerne, 2012]. Līdz šim ir ziņots, ka rs61764370 būtiski palielina risku saslimt ar olnīcu vēzi (OR = 2,46; 95 % TI = 1,14–5,29; p = 0,020), kā arī ar plaušu vēzi tām personām, kuru smēķēšanas apjoms gadā ir mazāks par 41 paciņu (OR = 2,3; 95 % TI = 1,1–4,6; p = 0,02) [Ratner, 2010; Chin, 2008].
Stratificējot pacientus četrās vecuma grupās, vislielāko iespējamību būt par sekvences varianta rs61764370 nēsātāju konstatēja krūts vēža slimniecēm vecumā no 40 līdz 60 gadiem (OR = 2,32; 95 % TI = 1,30–4,44; p = 0,002), ko asociē ar fizioloģiskām izmaiņām sievietes organismā un menopauzi. Acīmredzamā asociācija starp sekvences variantu rs61764370 un krūts vēža risku šajā vecumā norāda uz to, ka sekvences variants varētu būt predisponējošs faktors vēža attīstībai saistībā ar hormonālām svārstībām. Šādai saistībai un potenciālajiem mehānismiem nepieciešama tālāka validēšana populāciju pētījumos vai audzēju iniciācijas modeļos.
Līdz šim jau ir ziņots, ka rs61764370 varētu būt ģenētiskais marķieris palielinātam trīskārši negatīva krūts vēža riskam sievietēm tieši premenopauzes vecumā (OR = 2,307; 95 % TI = 1,261–4,219; p = 0,0067) [Paranjape, 2011]. Jāņem vērā, ka daļa sieviešu menopauzes laikā lieto hormonu aizvietošanas terapiju, kas jau ir aprakstīta kā faktors, kurš palielina risku saslimt ar krūts vēzi (RR = 1,77, 95 % TI 1,40–2,24; p = 0,02) [Bakken, 2011]. Lai noteiktu, vai iepriekšminētā krūts vēža slimnieču vecuma korelācija ar iespējamību būt par sekvences varianta rs61764370 nēsātāju nav saistīta tieši ar hormonu aizvietošanas terapijas lietošanu, nepieciešams turpināt pētījumus, ievācot detalizētu informāciju par menopauzes laikā lietotajiem medikamentiem, to devām un lietošanas ilgumu.
Ir publicēti dati par statistiski ticami palielinātu risku (OR = 2,307; 95 % TI = 1,261–4,219; p = 0,0067) attīstīties trīskārši negatīvam krūts vēzim rs61764370 pozitīvo premenopauzes vecuma pacienšu grupā [Paranjape, 2011]. Līdzīgi arī mūsu pētījumā novēroja tendenci palielināties trīskārši negatīvā audzēja īpatsvaram rs61764370 pozitīvo pacienšu grupā (24,39 %), salīdzinot ar rs61764370 negatīvo krūts vēža slimnieču grupu (19,57 %), taču salīdzinoši mazās pacientu grupas dēļ šie dati nesasniedza statistisko ticamību. Lai apstiprinātu šo hipotēzi, nepieciešams paplašināt to pacientu grupu, kam ir pieejama informācija par audzēja molekulārajiem subtipiem.
Pētījuma rezultāti liecina, ka sievietēm ar sekvences variantu rs61764370 KRAS gēna 3’ netranslējamā reģionā ir palielināts risks saslimt ar krūts vēzi un vislielākā iespējamība būt par sekvences varianta nēsātāju ir pacientēm vecumā no 40 līdz 60 gadiem. Šo secinājumu nepieciešams apstiprināt ar turpmākiem pētījumiem, un pētāmā grupa būtu jāpapildina ar pilnīgiem pacientu slimības vēstures datiem. Informatīva būtu arī analīze par pacientu slimības gaitu – audzēja specifiskajām klīniskajām un patoloģiskajām pazīmēm, atbildes reakciju uz pretvēža medikamentiem, citas lokalizācijas primāro audzēju klātbūtni, audzēja proliferācijas pakāpi, metastāžu attīstību, recidīva risku un citiem parametriem gan rs61764370 nēsātāju grupā, gan pacientēm bez šī sekvences varianta.
Iegūtie rezultāti veicina izpratni par miRNS darbību kavējošu sekvenču variantu lomu ļaundabīgu audzēju bioloģijā, kam ir atšķirīgas funkcijas nekā vairumam līdz šim aprakstīto ļaundabīgo audzēju ģenētisko marķieru. Lai pārliecinātos par sekvences varianta rs61764370 ietekmi uz let-7 funkcionalitāti, jāveic padziļināti gēnu ekspresijas pētījumi, kas ļautu izprast šos molekulāros mehānismus un, iespējams, vedinātu uz jaunas terapijas stratēģijas izveidi.
Secinājumi
- Sievietēm ar sekvences variantu rs61764370 ir palielināts risks saslimt ar krūts vēzi, jo īpaši vecumā no 40 līdz 60 gadiem (OR = 2,32; p = 0,002).
- Sekvences variantam rs61764370 nav statistiski ticamas ietekmes uz krūts vēža slimnieču dzīvildzi.
- Starp sekvences varianta rs61764370 nēsātājām ir tendence pieaugt trīskārši negatīvu audzēju īpatsvaram, taču šie dati nesasniedz statistisko ticamību.
- Nav statistiski ticamas saistības starp sekvences variantu rs61764370 un citiem krūts vēža riska faktoriem.
Pateicība
Pētījums izstrādāts Rīgas Stradiņa universitātes Onkoloģijas institūta Molekulārās ģenētikas laboratorijā Valsts pētījumu programmas “Jaunu profilakses, ārstniecības, diagnostikas līdzekļu un metožu, biomedicīnas tehnoloģiju izstrāde sabiedrības veselības uzlabošanai” projekta Nr. 4 “Pārmantotā un sporādiskā vēža klīnisko, molekulāro un morfoloģisko korelāciju izpēte, agrīnas diagnostikas, terapijas efektivitātes un pacientu dzīves kvalitātes uzlabošanai” ietvaros.
Abstract
Effect of KRAS Variant rs61764370 on Breast Cancer Morbidity and Patient Survival
Genetic markers, including single nucleotide replacements, are topical study objects in breast cancer pathogenesis. Sequence variant rs61764370, localised in KRAS gene, is a new biomarker whose clinical significance in tumour development is not yet clear. There are relatively few data about rs61764370 effects on breast cancer development and prognosis; therefore, the aim of the respective study was to determine the rs61764370 sequence variant impact on breast cancer morbidity and patient survival.
DNA from 2652 consecutive breast cancer patients and 861 healthy voluntary blood donors were isolated form venous blood samples and analysed in this study. Presence of sequence variant rs61764370 in DNA samples was detected by RFLP method and verified by Sanger sequencing. Available clinical and biometrical data were collected and processed using statistical analysis methods.
The obtained results suggest that rs61764370 positive patients are at an increased risk of developing breast cancer (RR = 1.41; p = 0.006), and this sequence variant may be a predisposing factor for breast cancer development in association with hormonal fluctuations. The research allowed us to notice an upward trend of triple negative breast cancer proportion in rs61764370 positive patient group. No linkage between rs61764370 and patient survival or examined breast cancer risk factors was determined.
Literatūra
- Bakken K., Fournier A., Lund E., et al. Menopausal hormone therapy and breast cancer risk: impact of different treatments. The European Prospective Investigation into Cancer and Nutrition // International Journal of Cancer, 2011; 128 (1): 144–156.
- Berzina D., Nakazawa-Miklasevica M., Zestkova J., et al. BRCA1/2 mutation screening in high-risk breast / ovarian cancer families and sporadic cancer patient surveilling for hidden high-risk families // BMC Medical Genetics, 2013; 14: 61.
- Bunz F. Principles of cancer genetics. – 1st ed. – New York: Springer Science + Business Media B.V., 2008. – P. 325.
- Cerne J. Z., Stegel V., Gersak K., Novakovic S. KRAS rs61764370 is associated with HER2-overexpressed and poorlydifferentiated breast cancer in hormone replacement therapy users: a case control study // BioMed Central Cancer, 2012; 12: 105.
- Chin L. J., Ratner E., Leng S., et al. A SNP in a let-7 microRNA complementary site in the KRAS 3’ untranslated region increases non-small cell lung cancer risk // Cancer Research, 2008; 68 (20): 8535–8540.
- Christensen B. C., Moyer B. J., Avissar M., et al. A let-7 microRNA-binding site polymorphism in the KRAS 3’ UTR is associated with reduced survival in oral cancers // Carcinogenesis, 2009; 30 (6): 1003–1007.
- Gardovskis A., Irmejs A., Miklasevics E., et al. Clinical, molecular and geographical features of hereditary breast / ovarian cancer in Latvia // Hereditary Cancer in Clinical Practice, 2005; 3 (2): 71–76.
- Jančík S., Drábek J., Radzioch D., Hajdúch M. Clinical relevance of KRAS in human cancers // Journal of Biomedicine and Biotechnology, 2010; 2010: 13.
- Olopade O. I., Grushko T. A., Nanda R., Huo D. Advances in breast cancer: pathways to personalized medicine // Clinical Cancer Research, 2008; 14 (24): 7988–7999.
- Paranjape T., Heneghan H., Lindner R., et al. A 3′-untranslated region KRAS variant and triple-negative breast cancer: a case-control and genetic analysis // The Lancet Oncology, 2011; 12 (4): 377–386.
- Pennery M., Speechley V., Rosenfield M. Breast cancer. – London: Class Publishing Ltd, 2008. – P. 188.
- Pharoah P. D., Palmieri R. T., Ramus S. J., et al. The role of KRAS rs61764370 in invasive epithelial ovarian cancer: implications for clinical testing // Clinical Cancer Research, 2011; 17 (11): 3742–3750.
- Plakhins G., Irmejs A., Gardovskis A., et al. Genotype-phenotype correlations among BRCA1 4153delA and 5382insC mutation carriers from Latvia // BMC Medical Genetics, 2011; 12: 147.
- Ratner E., Lu L., Boeke M., et al. A KRAS-variant in ovarian cancer acts as a genetic marker of cancer risk // Cancer Research, 2010; 70 (16): 6509–6515.
- Slimību profilakses un kontroles centrs. Onkoloģija. Statistikas dati par pacientu skaitu sadalījumā pa reģioniem, lokalizācijas veidiem, dzimuma un vecuma grupām no 2009. gada līdz 2013. gadam // http://www.spkc.gov.lv/veselibas-aprupes-statistika/ (sk. 15.06.2014.).
- Smits K. M., Paranjape T., Nallur S., et al. A let-7 microRNA SNP in the KRAS 3’UTR is prognostic in early-stage colorectal cancer // Clinical Cancer Research, 2011; 17 (24): 7723–7731.
- Zuber J., Tchernitsa O. I., Hinzmann B., et al. A genome-wide survey of RAS transformation targets // Nature Genetics, 2000; 24 (2): 144–152.


