Orālo antikoagulantu klīniskā lietojuma tendenču salīdzinājums divu gadu laika posmā pacientiem ar priekškambaru mirgošanu
Kopsavilkums
Nevalvulāras priekškambaru mirgošanas (NVPM) pacientiem izvēles medikamenti trombembolijas profilaksei ilgstoši bija K vitamīna antagonisti (KVA), kuru klīniskais lietojums rada grūtības gan pacientiem, gan ārstiem. Jaunie jeb tiešas iedarbības (tiešie) orālie antikoagulanti (TOAK) dod cerību problēmas atrisināt, tomēr Latvijā šo medikamentu ieviešana praksē joprojām norit gausi.
Darba mērķis. Analizēt galvenās dažādu antikoagulantu klīniskā lietojuma problēmas pacientiem ar nevalvulāru priekškambaru mirgošanu, speciālistu viedokļus un izmaiņas divu gadu laikā.
Materiāls un metodes. Aptaujāti 3542 Latvijas slimnīcu un ģimenes ārstu prakšu pacienti ar NVPM un antikoagulantu terapiju. Pacientu grupā tika analizētas problēmas, kas saistītas ar medikamentu blaknēm, mijiedarbību un lietošanas sarežģītību. Otro grupu veidoja 269 praktizējoši ārsti ar klīnisko pieredzi NVPM pacientu ārstēšanā, izmantojot antikoagulantus. Analizētas tika medikamentu izvēles, terapijas uzsākšanas un tās efektivitātes kontroles problēmas. Salīdzināti tika 2013. gada un 2015. gada janvāra – jūnija dati, kuri iegūti, aptaujājot 466 ārstus.
Rezultāti. Pēc 2014. gada rudenī un 2015. gada pavasarī apkopotajiem datiem kļuva zināms, ka 2214 (62,5 %) pacienti lietoja KVA, 1328 (37,5 %) – TOAK (702 – dabigatrānu un 626 – rivaroksabānu).
CHA2DS2-VASc KVA grupā bija 3,4 ± 1,8, TOAK grupā – 2,5 ± 1,5. Dažādu blakņu skaits pārliecinoši augstāks bija KVA grupā. Visu veidu asiņošanas konstatētas 31 % KVA un 3,3 % TOAK (p < 0,001); klīniski nozīmīgas liela apjoma asiņošanas KVA grupā bija 52 pacientiem (2,3 %) un trim (0,2 %) TOAK lietotāju grupā. Klīniski nozīmīgas neliela apjoma asiņošanas KVA grupā konstatētas 194 pacientiem (8,76 %) un 21 (1,6 %) TOAK (p < 0,01) grupā. Netika novērota būtiska atšķirība starp dabigatrāna (deva 150 mg) un rivaroksabāna (deva 20 mg) ietekmi. KVA lietotājiem ir statistiski nozīmīgi biežāka blakņu sastopamība.
Vairāk nekā 50 % pacientu atzīst, ka viņiem ir grūtības piemērot KVA devu, 31,8 % grūtības sagādā starptautiskā koeficienta INR (international normalized ratio) kontrole.
Pētījuma ārstu grupā TOAK izvēlējās 48,5 % ārstu, bet 81,3 % būtu gatavi to darīt biežāk. TOAK lietošanas galvenās problēmas ārsti saskata medikamentu izmaksās un nepietiekamā klīniskajā pieredzē, kā arī asinsreces rādītāju kontroles nepilnībās.
Lietojot KVA, nozīmīgākās problēmas ir šādas: pacientu līdzestības trūkums un grūtības piemērot devu. Uzsākot terapiju, ārsti visbiežāk (vairāk nekā 50 % gadījumu) ņem vērā šādus faktorus: insultus / trombembolijas anamnēzē, pacientu vecumu, vaskulāras slimības, pacienta līdzestību un finansiālās iespējas. Elektrisko kardioversiju grupā pārsvars ir TOAK lietojumam atbilstīgi vadlīnijām (dabigatrāns / rivaroksabāns – 54,6 % un varfarīns – 45,6 %), ar statistiski pārliecinoši mazāku blakņu skaitu (p < 0,001) un saglabātu drošību pret neiroloģiskām komplikācijām.
Secinājumi. Orālo antikoagulantu (OAK) klīniskais lietojums NVPM pacientiem ir komplicētāks KVA grupā medikamentu blakņu, lietošanas sarežģītības un informācijas trūkuma dēļ. TOAK piemīt pārliecinoši augstāka drošība, un tiem ir būtiski mazāks blakņu, to skaitā asiņošanas, risks.
Elektrisko kardioversiju grupā TOAK lietošanai ir priekšrocības pirms un pēc procedūras (atbilstīgi vadlīnijām un klīniskajiem pierādījumiem). Pirms OAK terapijas uzsākšanas NVPM pacientiem netiek pietiekami ņemti vērā asiņošanas un trombemboliju izveidošanās riska faktori.
Ievads
Priekškambaru mirgošana (PM) ir biežāk sastopamā pastāvīgas sirds aritmijas forma ar 1‒2 % sastopamību vispārējā populācijā, un tās izplatībai ir tendence pieaugt tuvāko 50 gadu laikā (Stewart, 2011; Go, 2001). PM izplatība palielinās līdz ar vecumu, no 0,5 % cilvēku 40‒50 gadu vecumā līdz 5‒17 % 80‒85 gadu vecumā (Stewart, 2011; Go, 2001; Camm, 2012; Lip, 2015). Vīriešiem PM izplatība ir augstāka nekā sievietēm. Risks, ka dzīves laikā attīstīsies priekškambaru mirgošana, 55 gadu vecumā Eiropas populācijā ir vidēji 23,8 % vīriešu un 22,2 % sieviešu (Heeringa, 2006). PM ir saistīta ar palielinātu kardiovaskulāro notikumu risku, tā korelē ar trombemboliju veidošanos, išēmiska insulta, kreisā kambara disfunkcijas un sirds mazspējas rašanos, līdz ar to – ar samazinātu dzīves kvalitāti un paaugstinātu mirstību (Kirchhof, 2007).
Nevalvulāras PM pacientiem, kuriem trombemboliju attīstības riska mazināšanai ir indicēta orālo antikoagulantu (OAK) terapija, tā bieži ir ilgstoša, tādēļ jārēķinās ar spēju izraudzīto medikamentu lietot regulāri, kontrolēti un saskarties ar tā iespējamām blaknēm gadiem ilgi. Arī ārstējošajam ārstam jāņem vērā šie medikamentu lietošanas aspekti (Heidbuchel, 2013).
Latvijā ir pieejami un Latvijas Zāļu valsts aģentūrā reģistrēti vecākās paaudzes OAK, piemēram, K vitamīna antagonists (KVA) varfarīns un jaunās paaudzes tiešas darbības OAK (TOAK) dabigatrāna eteksilāts, rivaroksabāns un apiksabāns, savukārt Eiropas Medicīnas aģentūra ir reģistrējusi lietošanai arī edoksabānu. Vecākās paaudzes OAK lietošana ir efektīva, tomēr prasa ievērojamu pacienta līdzestību, kā arī rada virkni gan subjektīvu, gan objektīvu sarežģījumu pacientam un ārstam. TOAK darbība un īpašības dod cerību šīs problēmas atrisināt. Tiek uzskatīts, ka jaunie OAK ir daudz tuvāk ideālam orālajam antikoagulantam, kuram izvirzītie kritēriji ir šādi: pierādīta darbības efektivitāte, zems (zemāks) asiņošanas risks, fiksētas devas, laba orālā biopieejamība, nav nepieciešams ikdienā kontrolēt asinsreces rādītājus, atgriezeniskums, ātrs darbības sākums, maza mijiedarbība ar aktīvajām vielām un ēdienu. 2015. gadā jau ir apstiprināti un klīniskajā praksē tuvākajā laikā būs pieejami antidoti (Steffel, 2011; Pollack, 2015).
2012. gada augustā tika izdotas Eiropas Kardiologu asociācijas (EKA) vadlīnijas PM ārstēšanai – 2012 Focused Update of the ESC Guidelines for the Management of Atrial Fibrillation, kas ir 2010. gadā izdoto vadlīniju uzlabots papildinājums. To ieviešanai sekoja vairākas korekcijas PM terapijā, piemēram, nevalvulāras PM pacientiem trombembolijas attīstības riska mazināšanai vadlīnijās iekļaujot jaunās paaudzes orālos antikoagulantus (Camm, 2012). 2013. gadā tika izdotas gan Latvijas profesionālo asociāciju kopējās praktiskās rekomendācijas (Ērglis, 2013), gan Eiropas Sirds ritma asociācijas (EHRA) zinātniskās rekomendācijas (Heidbuchel, 2013), kā arī ievērojami izmainītās un mūsdienīgās Amerikas kardiologu asociāciju un Pasaules Sirds ritma asociācijas (HRS) kopējās vadlīnijas (January, 2014) un praktiskās TOAK lietošanas rekomendācijas (Camm, 2014; Lip, 2015; Kovac, 2015).
Latvijā jauno OAK ieviešana praksē joprojām norit gausi, par spīti plašiem klīniskiem pētījumiem un publikācijām, kas pierāda to efektivitāti un vienkāršo lietošanu. Tāpēc būtiski ir salīdzināt un analizēt, kādas ir klīniskā lietojuma priekšrocības un trūkumi abām OAK grupām no ārstu un pacientu skatu punkta, vai jaunajiem OAK ir nākotnes izredzes Latvijas tirgū blakus tik izplatītajiem un ilgi lietotajiem K vitamīna antagonistiem.
PM gadījumā visbiežāk sastopamās trombembolijas sekas ir išēmisks insults – vidēji 2,3 % risks (letalitāte – 30 %). Akūtas mezenteriālas išēmijas biežums ir 0,14 % (letalitāte – 70 %) un akūtas ekstremitāšu išēmijas – 0,4 % (letalitāte – 16 %). Kopumā aptuveni 80 % ar embolijām saistīto nāvju cēlonis ir insults un 20 % – sistēmiska trombembolija (Menke, 2010).
Insulta sastopamība PM pacientiem ir mainīga intervālā no 1 % līdz 20 % (vidēji 4,5 % gadā), atkarībā no blakusslimībām un pacienta kardiovaskulāro notikumu anamnēzes (Furie, 2012; January, 2014).
Antikoagulanti, kas tiek izmantoti pretrombotiskajai profilaksei nevalvulāras PM pacientiem, galvenokārt ir K vitamīna antagonisti, kā arī tā dēvētie jaunie jeb tiešie orālie antikoagulanti: Xa faktora inhibitori un tiešie trombīna inhibitori, kas klīniskajā praksē nonākuši diezgan nesen (Camm, 2012; Heidbuchel, 2013; Shulman, 2014; Kovac, 2015).
PM insultu un sistēmisko trombemboliju profilaksei no KVA Latvijā tiek lietots varfarīns (warfarinum). 2011. gadā Latvijā tas bija visbiežāk izrakstītais antikoagulants (Kalējs, 2010, 2013). Varfarīna pusizvades laiks ir 35‒45 stundas (Purviņš, 2011).
Varfarīna efektivitāti nosaka pēc starptautiskā koeficienta INR (international normalized ratio). Koeficientu veido matemātiski koriģēti dati, lai līdzsvarotu iespējamo tromboplastīna reaģentu jutīgumu starpību. Šī korekcija dod iespēju salīdzināt dažādās laboratorijās veiktos INR mērījumus. INR tiek aprēķināts, ņemot vērā pacienta protrombīna laiku (PL) (Ahrens, 2010; Zāļu valsts aģentūra, 2011, 2012). Ar PL primāri nosaka no K vitamīna atkarīgos koagulācijas faktorus II, VII un X (Gomes, 2012). Rekomendētais INR nevalvulāras PM slimniekiem ir 2–3 (Camm, 2012; Furie, 2012). Lietojot KVA, nepieciešama regulāra INR monitorēšana (Zāļu valsts aģentūra, 2011, 2012). Trombembolijas profilaksei PM gadījumā ir svarīgi, lai INR būtu diapazonā 2–3 vairāk nekā 70 % no varfarīna lietošanas ilguma (Camm, 2012).
Viena no KVA problēmām ir augsts individuālais INR mainīgums, ko nosaka farmakoģenētika, īpaši citohroma P450 2C9 gēns (CYP2C9), kas saistīts ar asiņošanas risku, un K vitamīna epoksīda reduktāzes kompleksa-1 gēns (VKORC1), kas ietekmē individuālo KVA devu atšķirības (Kalējs, 2010). KVA ir raksturīga mijiedarbība ar medikamentiem, pārtiku un alkoholu.
Bieži novērots, ka varfarīna terapijas blakusparādība ir asiņošana. Hemorāģijas risks vidēji ir 3,8 % (95 % TI: 3,8‒3,9 %) persongadā (Latvijas Republikas Zāļu reģistrs, 2012; Zāļu valsts aģentūra, 2012). KVA lietotājiem asiņošanas risks ir 10‒17 % no visām asiņošanas komplikācijām 100 pacientgados, no tām 2‒5 % attiecas uz nopietnām un 0,5‒1 % – uz fatālām asiņošanām (Watson, 2009).
Eiropas Savienībā ir centrāli reģistrēts un nevalvulāras PM slimniekiem terapijā akceptēts tiešais trombīna inhibitors dabigatrāna eteksilāts (dabigatranum etexilatum) (Freeman, 2011), no asinsreces faktora Xa inhibitoriem Eiropas Savienībā ir centrāli reģistrēts rivaroksabāns (rivaroxabanum) un apiksabāns (apixabanum) (Eiropas Savienībā centrāli reģistrēto zāļu saraksts, Rivaroxaban (update 20/01/2012)). Latvijas Republikas 2012. gada Zāļu reģistrā fiksēts un Latvijā pieejams ir rivaroksabāns (Eiropas Savienībā centrāli reģistrēto zāļu saraksts, Rivaroxaban (update 20/01/2012)), kopš 2013. gada jūnija ir pieejams apiksabāns.
Gadījumos, ja nevalvulāras PM pacientiem, kuriem ir nepieciešamība lietot OAK un nav iespējams piemērot KVA (INR 2‒3), jo ir grūtības iekļauties INR noteiktajās robežās KVA blakņu, INR kontrolēšanas grūtību vai citu iemeslu dēļ, tiek rekomendēta TOAK lietošana (Camm, 2012).
Starptautisko asociāciju vadlīnijās, kā arī medikamentu drošības un lietojuma pētījumos TOAK devas jānoteic, vadoties pēc nieru darbības rādījumiem (glomerulu filtrācijas ātruma, kreatinīna līmeņa), pacientu vecuma, citu medikamentu potenciālā mijiedarbības riska un blakusslimībām (Camm, 2012; You, 2012; Skanes, 2012; Ogawa, 2011; Camm, 2014).
Pirms kardioversijas nevalvulāras PM pacientiem, kuriem PM ilgusi vairāk nekā 48 stundas vai tās ilgums nav zināms, ieteikta OAK terapija (KVA ar INR 2‒3 vai dabigatrāns): trīs nedēļas vai ilgāk pirms kardioversijas un četras nedēļas vai ilgāk pēc kardioversijas – neatkarīgi no kardioversijas metodes (pierādījumu līmenis IB) (Camm, 2012; Larsen, 2013). Kopš 2014. gada starptautiskajās vadlīnijās noteikts, ka elektriskā kardioversija ir lietojama gan ar dabigatrānu, gan rivaroksabānu, gan apiksabānu (January, 2014), taču vienīgais randomizēti kontrolētais speciāla dizaina pētījums šai pacientu grupai ir X-Vert ar rivaroksabānu (Capatto, 2014; Ezekowitch, 2014; Kalejs, 2015).
Pacientiem ar insulta riska faktoriem vai PM recidīviem OAK terapija būtu jāturpina mūža garumā, neatkarīgi no šķietamas sinusa ritma atgūšanas pēc kardioversijas (Camm, 2012; Larsen, 2013; January, 2014; Kalejs, 2015).
Darba hipotēze, mērķis un uzdevumi
Darba hipotēze: vecākās paaudzes orālo antikoagulantu lietojums gan nevalvulāras priekškambaru mirgošanas pacientiem, gan viņu ārstiem ir klīniski problemātiskāks nekā jauno orālo antikoagulantu terapija.
Darba mērķis – analizēt salīdzinājumā kopš 2012. gada galvenās orālo antikoagulantu klīniskā lietojuma problēmas Latvijā pacientiem ar nevalvulāru priekškambaru mirgošanu un ārstējošajiem speciālistiem.
Uzdevumi:
- noskaidrot, veicot anketēšanu, kādas grūtības ir pacientiem ar nevalvulāru priekškambaru mirgošanu un ārstiem, lietojot vecās un jaunās paaudzes orālos antikoagulantus;
- analizēt, veicot statistisko datu apstrādi, dominējošās orālo antikoagulantu lietojuma problēmas, kopīgo un atšķirīgo ārstu un pacientu viedokļos;
- balstoties uz analīzi, sagatavot ierosinājumus, kas palīdzētu mazināt un novērst klīniskās problēmas orālo antikoagulantu lietojumā;
- salīdzināt iegūtos datus no 2013. gada janvāra–jūnija līdz 2015. gada janvārim–jūnijam.
Materiāls un metodes
Pētījums kvalificējams kā kvantitatīvs, analītisks šķērsgriezuma klīnisks pētījums. Pamata metode datu ieguvei – anketēšana.
Pētījumā tika aptaujātas divas dalībnieku grupas. Pirmajā grupā iesaistīti dažādu Latvijas slimnīcu – Paula Stradiņa Klīniskās universitātes slimnīcas, Rīgas Austrumu klīniskās universitātes slimnīcas dažādu profilu nodaļu, Ventspils, Liepājas un Daugavpils reģionālo slimnīcu – un atsevišķu, nejauši atlasītu ģimenes ārstu prakšu pilngadīgi un lemtspējīgi pacienti, kuriem diagnosticēta nevalvulāra priekškambaru mirgošana un ir lietota OAK terapija. Otro grupu veido praktizējoši ārsti: kardiologi, ārsti internisti, ģimenes ārsti, citu specialitāšu ārsti, kā arī ārsti rezidenti ar klīnisko pieredzi nevalvulāras priekškambaru mirgošanas slimnieku ārstēšanā un aprūpē, lietojot OAK.
Primārie dati iegūti no 2012. gada 1. oktobra līdz 2013. gada 1. jūnijam, apkopoti anketu dati par 519 nevalvulāras priekškambaru mirgošanas pacientiem un 269 ārstu klīnicistu aizpildīto anketu dati. Nākamā datu ieguve tika veikta 2014. gadā un 2015. gada janvārī – jūnijā. Apkopota informācija par 3542 pacientiem un 466 ārstu anketu ziņas.
Anketu izstrāde veidota, akcentējot nozīmīgākās problēmas, ar kurām varētu sastapties aptaujātie abās grupās. Pacientu aspektā apskatītas problēmas, kas saistītas ar OAK blaknēm un mijiedarbību, pacientu informētību, medikamentu lietošanas sarežģītību. Ārstu aspektā analizētas problēmas saistībā ar OAK izvēli un terapijas uzsākšanu, pacientu aprūpi un komunikāciju.
Pacientu grupā netika iekļauti slimnieki ar valvulāru PM, protezētiem sirds vārstuļiem (mehāniskās sirds vārstuļu protēzes), ņemot vērā jauno OAK reģistrētās lietošanas indikācijas.
Datu statistiskā apstrāde veikta, izmantojot IBM SPSS Statistics 20.0 programmu. CHA2DS2-VASc skalas punkti pacientiem aprēķināti, izmantojot Microsoft Office Excel 2007 programmu. Dati pacientu grupā vairumā gadījumu analizēti, salīdzinot K vitamīna antagonistu un TOAK lietotāju grupas, ar TOAK saprotot Xa asinsreces faktora inhibitorus un tiešos trombīna inhibitorus.
Parametri atainoti kā absolūtie biežumi, relatīvie biežumi – procenti, moda, mediāna, kvartiles. Atainoti datu 95 % ticamības intervāli. Par statistiski ticamu uzskatāma p vērtība < 0,05.
Kvantitatīvajiem datiem veikta to normālsadalījuma analīze ar Kolmogorova‒Smirnova testu, izlašu dispersijas pārbaudītas ar Levena testu. Konstatējot datu neatbilstību normālsadalījumam vai normālam dispersijas sadalījumam, datu salīdzināšana veikta ar neparametriskajām analīzes metodēm – Manna‒ Vitnija (Mann–Whitney) testu. Kvalitatīvajiem rādītājiem, to skaitā rangu skalas datiem, aprēķinos lietotas šķērstabulas, analīzei izmantojot Pīrsona hī kvadrāta (χ2) metodi vai Fišera precīzo testu 2 × 2 tabulām ar n < 5 kādā no šūnām.
Ņemot vērā statistiski ticamas atšķirības atsevišķiem parametriem starp KVA un TOAK lietotāju grupām, veikta korelācijas analīze – Spīrmena neparametriskā korelācija.
Pētnieciskā darba veikšana iepriekš saskaņota ar Rīgas Stradiņa universitātes Ētikas komiteju, saņemta atļauja veikt pētījumu.
Rezultāti
Pacientu grupas datu analīze. Nevalvulārās PM 3542 pacientu vidū, pēc 2014.–2015. gada datiem, joprojām saglabājas liela KVA izplatība (sk. 1. tab.).
1. tabula. KVA un TOAK klīniskās attiecības starp tos lietojošo pacientu grupām / Proportion between users of VKA and DOAC
| Pazīme | KVA lietotāju skaits, n | KVA lietotāju skaits, % | Tiešo OAK lietotāju skaits, n | Tiešo OAK lietotāju skaits, % | |
|---|---|---|---|---|---|
| Kopējais OAK lietotāju skaits (2013) | 1412 | 71,5 | 564 | 28,5 | |
| Kopējais OAK lietotāju skaits (2014–2015) | 2214 | 62,5 | 1328 | 37,5 | |
| Jaunā OAK veids | Dabigatrāns | — | — | 702 | 52,9 |
| Rivaroksabāns | — | — | 626 | 47,1 | |
| Dzimums (2015. gada dati) | Sievietes | 1095 | 49,5 | 567 | 42,7 |
| Vīrieši | 1119 | 50,5 | 761 | 57,3 | |
| Vecums (2015. gada dati) | ≤ 64 g. v. | 828 | 37,4 | 721 | 54,3 |
| 65–74 g. v. | 943 | 42,6 | 503 | 37,9 | |
| 75–84 g. v. | 438 | 19,8 | 94 | 7,0 | |
| ≥ 85 g. v. | 5 | 0,3 | 10 | 0,7 | |
KVA – K vitamīna antagonisti, TOAK – tiešas iedarbības orālie antikoagulanti.
Salīdzinājumam – 2012. gada dati – no 519 nevalvulāras PM slimniekiem, kuri lietoja OAK, 82,5 % bija KVA lietotāji, 17,5 % – TOAK lietotāji. KVA grupā bija 44,7 % sieviešu, TOAK grupā – 50 % sieviešu. Vecuma sadalījums un OAK lietošanas ilgums ir analizējami kā neparametriski, kvalitatīvi rādītāji, ņemot vērā iepriekš anketās veikto sadalījumu rangos. Vecuma sadalījums veidots, vadoties pēc CHA2DS2-VASc skalā noteiktajām vecuma grupām. Kvalitatīvu datu salīdzinājumu KVA un jauno OAK grupās sk. 1. un 2. tabulā. Redzams, ka TOAK ir pārliecinoša tendence pieaugt gan kopumā, gan arī atsevišķās grupās (sk. 2. tab.).
Pacientu kopas analīzes dati (sk. 1. tab.) apliecina vairākas likumsakarības: nav ievērojamu atšķirību starp pacientu dzimumu grupās, taču TOAK vairāk lieto cilvēki, kas jaunāki par 64 gadiem un 64–74 gadu vecumā, kā arī pacienti ar lēkmjveida PM. Tas skaidrojams gan ar elektrokardioversiju (EKV) īpatsvaru lēkmjveida PM grupai, gan arī ar sociāli ekonomisko aktivitāti. Viens no skaidrojumiem ir TOAK lietošanas specifika pacientiem pēc 75 gadu vecuma, kā dēļ daļa ārstu tos baidās rekomendēt, par spīti literatūrā minētajiem datiem par efektivitātes un drošības pārākumu. Salīdzinot skaitļus par TOAK lietošanu pirms diviem un trijiem gadiem, redzams, ka līdzsvarojusies proporcija starp dabigatrānu un rivaroksabānu. Ievērojami vairāk pacientu lieto TOAK kopumā, savukārt dabigatrāna dominante iepriekšējos gados skaidrojama ar tā ilgāku atrašanos klīniskajā apritē. Interesanti, ka, salīdzinot pēc CHA2DS2-VASc punktu skalas, TOAK vairāk lieto pacienti ar zemāku insulta risku, lai gan, pamatojoties uz pierādījumiem, vajadzētu būt otrādi.
K vitamīna antagonisti (varfarīns) un to lietošanas apgrūtinājumi atainoti 3. tabulā. Ja INR kontroli 1–2 reizes mēnesī veic vairāk nekā 50 % pacientu, kas ir puslīdz normāli stabilu INR datu gadījumā, tad diemžēl kontrole un adekvātas devas izvēle / INR līmeņa noturēšana sagādā problēmas lielākajai daļai šo pacientu. Jāņem vērā arī sociālie faktori un nepieciešamība regulāri apmeklēt medicīnas iestādes. Šis apstāklis ir ievērojams arguments par labu jaunajiem OAK.
2. tabula. Pacientu sadalījuma attiecības pēc CHA2DS2-VASc punktu skalas / Proportion of patients depend on CHA2DS2-VASc risk scores
| Punkti | KVA lietotāju skaits, % | TOAK lietotāju skaits, % |
|---|---|---|
| 0 | 2,8 | 3,0 |
| 1 | 10,0 | 12,3 |
| 2 | 18,5 | 21,8 |
| 3 | 26,5 | 23,9 |
| 4 | 20,5 | 20,1 |
| 5 | 13,3 | 13,4 |
| 6 | 5,4 | 4,8 |
| 7 | 2,2 | 0,7 |
| 8 | 0,8 | 0,0 |
| 9 | 0,1 | 0,0 |
KVA – K vitamīna antagonisti, TOAK – tiešas iedarbības orālie antikoagulanti.
3. tabula. OAK lietošanas problēmas raksturojošie dati KVA grupā / Problems in practic usage in vitamin K antagonists patients group
| Pazīme | Pacientu skaits | ||
|---|---|---|---|
| n | % | ||
| Grūtības piemērot OAK devu | 1320 | 62,7 | |
| Regulāra INR kontrole | 1914 | 90,9 | |
| INR kontroli veic | > 1 reizi nedēļā | 14 | 0,7 |
| 1 reizi nedēļā | 400 | 19,0 | |
| 1–2 reizes mēnesī | 1173 | 55,7 | |
| < 1 reizi mēnesī | 518 | 24,6 | |
| Grūtības INR noturēt robežās 2,0–3,0 | 1450 | 68,9 | |
| Ir INR paškontroles ierīce | 18 | 0,9 | |
| Uzskata, ka nepieciešama INR paškontroles ierīce | 1125 | 53,4 | |
| Ir pietiekami informēti par INR kontroli | 1913 | 90,9 | |
| INR kontrole sagādā grūtības | 846 | 40,2 | |
| INR kontroles grūtību iemesli (n = 846) | |||
| Dzīvo tālu no kontroles vietas | 379 | 44,8 | |
| Aizņemtība darbā / mājās | 272 | 32,1 | |
| Lieli transporta izdevumi | 236 | 27,9 | |
| Uzskata, ka INR kontrole nav tik bieži nepieciešama | 85 | 10,0 | |
| Cits iemesls | 345 | 40,8 | |
KVA – K vitamīna antagonisti, TOAK – tiešas iedarbības orālie antikoagulanti.
Ikdienā diemžēl INR kontrole joprojām sagādā ievērojamas problēmas pacientiem, kuri lieto KVA. Pēc literatūras datiem zināms, ka optimāli ir vismaz 70 % laika INR robežās 2,0–3,0, taču, ja kontrole tiek veikta vienu vai divas reizes mēnesī, tad šis secinājums nav korekts, jo tik reti veikta kontrole nesniedz pietiekami prognozējamus datus par koagulācijas sistēmas stāvokli un medikamenta (K vitamīna antagonista varfarīna) darbības efektivitāti. Nav statistiski ticamu atšķirību starp grupām pacientu informētības ziņā, kas apliecina medicīnas personāla veiktā izglītojošā darba efektivitāti, tajā pašā laikā ievērojami atšķiras komplikāciju biežums TOAK un varfarīna grupās. Statistiski ticami biežāks dažādu asiņošanu risks ir varfarīna lietotājiem, turklāt varfarīna grupā asiņošanas izraisīja hospitalizācijas nepieciešamību.
Visu veidu asiņošanas konstatēja: 31,1 % KVA grupā pret 3,3 % TOAK (p < 0,001); salīdzinājumā ar 2012. gada datiem asiņošanu skaits ir mazinājies kopumā, taču ar pieaugošu tendenci KVA grupā. Liela apjoma klīniski nozīmīgas asiņošanas, pēc Starptautisko asociāciju kritērijiem (Shulman, 2014), KVA grupā bija 52 pacientiem (2,3 %) pret trim TOAK (0,2 %). Trīs klīniskie notikumi (viens ar dabigatrāna 150 mg devu, viens ar rivaroksabāna 20 mg devu un viens ar apiksabāna 5 mg) neļauj veidot kādus secinājumus par iespējamajām riska atšķirībām, taču pasaules medicīniskajā literatūrā 2014. gadā rakstīts, ka iezīmējusies tendence pievērst pastiprinātu uzmanību gastrointestinālā trakta asiņošanām, jo īpaši pacientiem, kuri lieto dabigatrānu. Kopējā TOAK proporcija – 702 dabigatrāna lietotāji un 626 rivaroksabāna lietotāji (apiksabāna parādīšanās Latvijā notika 2013. gada vēlā rudenī un tā lietojums joprojām ir nenozīmīgs, ap 50 iepakojumi mēnesī) – ļauj secināt, ka (pēc 2014. gada vasaras – rudens datiem) starp abu medikamentu klīnisko lietojumu pastāv līdzsvars. Tas gan ir ievērojami izmainījies kopš 2014. gada rudens par labu rivaroksabāna lietošanas pieaugumam, turklāt – vairākas reizes, taču šīs tendences analizēt nav šā raksta uzdevums.
Pacienti pirms un pēc elektriskās kardioversijas (EKV) ir atsevišķa grupa, kas OAK lieto relatīvi īsu laiku. Salīdzinošie dati 4. un 5. tabulā ļauj secināt, ka pacienti, kuri lieto TOAK, pārsvarā ir pirms un pēc EKV.
4. tabula. KVA un TOAK lietošanas ilgums pirms EKV / Duration of using VKA and DOAC before ECV
| OAK lietošanas ilgums | KVA lietotāju skaits, % | TOAK lietotāju skaits, % |
|---|---|---|
| < 1 mēnesis | 2,5 | 3,2 |
| 1–5 mēneši | 24,5 | 73,1 |
| 6–11 mēneši | 10,4 | 18,3 |
| 1–2 gadi | 15,2 | 4,8 |
| > 2 gadi | 47,3 | 0,6 |
| Pacienti pirms sirds ritma atjaunošanas | 18,4 | 84,4 |
EKV – elektriskā kardioversija, KVA – K vitamīna antagonisti, PM – priekškambaru mirgošana, TOAK – tiešas iedarbības orālie antikoagulanti.
Tajā pašā laikā jāatzīmē, ka mūsu analizētās pacientu grupas ir ar augstāku kopējo insultu un kardiovaskulāro risku, augstāku asiņošanas risku, gados vecāki, ar ieilgušām aritmijas epizodēm, ar plašāku paralēli lietojamo medikamentu skaitu – tātad viņu stāvoklis ir smagāks un sarežģītāks nekā tiem pacientiem, kuru dati aplūkoti klīniskajos pētījumos: gan retrospektīvajā RE-LY analīzē (Nagarakanti, 2011), gan X-Vert (Cappatto, 2014).
15,6 % pacientu bija vecāki par 70 gadiem, savukārt TOAK grupā gados vecāko pacientu īpatsvara rādītāji pārliecinoši bija augstāki (attiecībā pret varfarīnu), kas apliecina gan TOAK drošību, gan arī Latvijas mediķu rekomendāciju tendences. Ieilgušas ātriju fibrilācijas, anamnēzē – TIL, cukura diabēts, augsti insulta un asiņošanas riski arī atšķīrās no klasiskajos pētījumos konstatētā. Tomēr salīdzinošie dati pēc trim un sešiem mēnešiem rādīja minimālu komplikāciju un klīnisko notikumu biežumu TOAK lietotājiem, kā arī relatīvi zemu aritmijas recidīvu risku.
5. tabula. Kopējie pacientu dati pirms EKV un dažādu OAK lietojums / Summary of patients data before ECV and different OAC’s
| Pacientu dati | Pacientu kopējais skaits | Varfarīna lietotāju skaits | Dabigatrāna lietotāju skaits (150 mg divas reizes dienā) | Dabigatrāna lietotāju skaits (110 mg divas reizes dienā) | Rivaroksabāna lietotāju skaits (20 mg) | ||||
|---|---|---|---|---|---|---|---|---|---|
| n | n | % | n | % | n | % | n | % | |
| Pacientu skaits | 1512 | 539 | 35,65 | 405 | 26,78 | 302 | 19,97 | 266 | 17,59 |
| Sievietes | 597 | 252 | 42,21 | 126 | 21,1 | 135 | 22,61 | 84 | 14,07 |
| Vīrieši | 915 | 287 | 31,36 | 279 | 30,49 | 167 | 18,25 | 182 | 19,89 |
| Vecums, gadi | 40–79 | 44–71 | 40–75 | 45–79 | 45–79 | ||||
| Vecums ≥ 70 gadiem | 236 (15,6%) | 69 | 29,03 | 31 | 13,13 | 65 | 27,54 | 71 | 30,08 |
| Persistējoša ĀF | 1193 (78,90%) | 487 | 40,82 | 364 | 30,51 | 205 | 17,18 | 137 | 11,48 |
| Ilgstoši persistējoša PM | 319 (21,09%) | 99 | 31,03 | 107 | 33,54 | 22 | 6,89 | 91 | 28,52 |
| CHA2DS2VASc riska skala ≥ 3 | 508 (33,59%) | 228 | 44,88 | 147 | 28,93 | 27 | 5,31 | 106 | 20,86 |
| HASBLED riska skala ≥ 3 | 214 (14,15%) | 74 | 34,57 | 20 | 9,34 | 48 | 22,42 | 72 | 33,64 |
| Kreisā ātrija dilatācija ≥ 50 mm | 315 (20,83%) | 134 | 42,53 | 88 | 27,93 | 38 | 12,06 | 55 | 17,46 |
| PM ilgums ≥ 6 mēneši | 260 (17,19%) | 109 | 41,93 | 76 | 29,23 | 32 | 12,30 | 43 | 16,53 |
| TIL / insults anamnēzē | 153 (17,19%) | 58 | 37,90 | 37 | 24,18 | 13 | 8,49 | 45 | 29,41 |
| EKV anamnēzē | 895 (51,95%) | 471 | 52,62 | 304 | 33,96 | 63 | 7,03 | 57 | 6,36 |
| Arteriālā hipertensija | 1086 (71,82%) | 517 | 47,60 | 413 | 38,02 | 96 | 8,83 | 60 | 5,52 |
| HSM | 1010 (66,79%) | 466 | 46,13 | 389 | 38,51 | 75 | 7,42 | 80 | 7,92 |
| KSS | 497 (32,87%) | 232 | 46,68 | 173 | 34,80 | 51 | 10,26 | 41 | 8,24 |
| PKI vai AKŠ | 235 (15,54%) | 101 | 42,97 | 67 | 28,51 | 33 | 14,04 | 34 | 14,46 |
| CD | 355 (23,47%) | 117 | 32,95 | 145 | 40,84 | 63 | 17,74 | 30 | 8,45 |
AKŠ – aortokoronārā šuntēšana, ĀF – ātriju fibrilācija, CD – cukura diabēts, EKV – elektriskā kardioversija, HSM – hroniska sirds mazspēja, KSS – koronārā sirds slimība, n – pacientu skaits, OAK – orālie antikoagulanti, PKI – perkutānā koronārā intervence, PM – priekškambaru mirgošana, TIL – transitīva išēmiska lēkme.
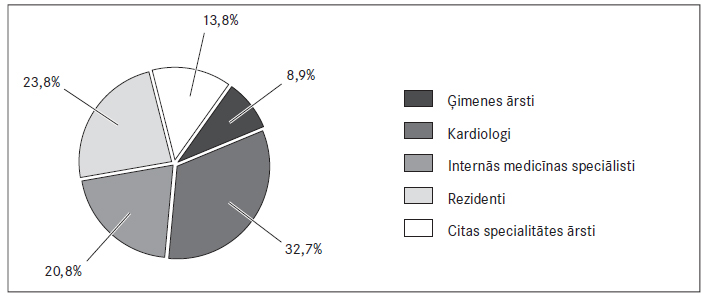
Ārstu grupas datu analīze. Ārstu grupā iepriekš tika aptaujāti 269 speciālisti no vairākām Latvijas slimnīcām un ģimenes ārstu praksēm. No tiem 70,3 % bija sievietes (n = 188; 95 % TI: 60,8‒78,3). Ārstu kopā 17,1 % bija ārsti kardiologi (n = 46), 44,2 % – ģimenes ārsti (n = 119), 17,8 % – iekšķīgo slimību ārsti (n = 48), 6,3 % – citas specialitātes ārsti (n = 17) un 14,5 % – ārsti rezidenti (n = 39).
Speciālistu grupas 79,6 % (95 % TI: 74,3‒83,9) dalībnieku pēdējo divu gadu laikā bija apmeklējuši konferences vai tālākizglītības kursus par OAK lietošanu PM pacientiem (sk. 1. att.).
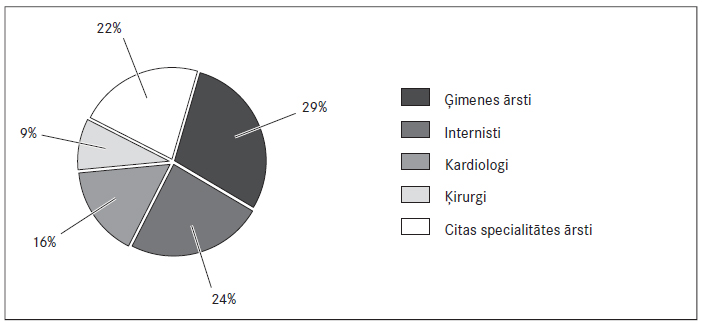
2014.–2015. gada dati tika iegūti no 466 ārstu aptaujām. Šajā grupā starp 89 kardiologiem, 135 internistiem, 164 ģimenes ārstiem, 49 ķirurgiem un 128 cita profila ārstiem (ieskaitot rezidentus) 48,5 % lietoja TOAK praksē, 81,3 % tos labprāt ieteiktu biežāk, taču galvenie ierobežojumi ir medikamentu cena, nepietiekamā pieredze un informācijas trūkums. Varfarīna lietošanas galvenās problēmas ārsti saista ar līdzestības trūkumu, neprognozējamām mijiedarbībām un apgrūtinātu INR kontroli. CHA2DS2- VASc riska skalu ikdienā lieto 78 % ārstu. Šie dati atšķiras no 2012.–2013. gada informācijas (sk. 1. un 2. att.) gan ar aptaujāto ārstu specialitāšu proporciju, gan ar tendencēm.
Aplūkojot faktorus, kuri tiek ņemti vērā pirms OAK terapijas uzsākšanas nevalvulāras PM pacientiem, redzams, ka vairāk nekā 50 % ārstu ņem vērā trombembolijas anamnēzē, pacientu vecumu, vaskulārās slimības, pacientu līdzestību un finansiālās iespējas, bet mazāk nekā 50 % ņem vērā citus trombembolijas vai asiņošanas attīstības riska faktorus (attiecīgi pēc CHA2DS2-VASc un daļēji HAS-BLED riska skalām).
1. attēls. Orālo antikoagulantu rekomendēšana pacientiem reālajā klīniskajā praksē / Recomendations of oral anticoagulants for patients in real clinical praxis
2. attēls. Dažādu specialitāšu ārstu proporcionālais sadalījums 2014. gadā / Proportion of physicians according specialities
Apkopojot ārstu aptaujas datus, tika konstatēts:
- Lietojot praksē KVA, ārsti (n = 466) par ļoti būtisku klīniskās izmantošanas problēmu uzskata pacientu līdzestības trūkumu un neizpratni – 23,4 %; 35,1 % – asinsreces rādītāju kontroles nepietiekamību; 26,7 % – grūtības izraudzīties KVA devu. Medikamentu blaknes par galveno problēmu min 10,7 % speciālistu, bet tikai 2,2 % ārstu kā galveno atzīmē citu problēmu, norādot, ka “ārsti varfarīnu bieži neieteic vispār – tā ir vieglāk ārstam un pacientam”. KVA lietojumu par problemātisku neuzskata 14,5 % ārstu, šī attieksme ievērojami atšķiras no 2012. gada datiem (4,5 %). Aktīvo vielu, medikamentu un pārtikas produktu izvēles nozīmi, lietojot KVA, izprot 81,2 % ārstu.
- Praksē pacienti, kuri izmanto ierīces INR noteikšanai mājas apstākļos, ir 5,0 % ārstu, bet 94,1 % ārstu ieteiktu INR paškontroles ierīci saviem pacientiem, ja būtu šāda iespēja.
- TOAK izraksta vairāk nekā 50 % ārstu (iepriekš – 48,7 %), turklāt vērojama būtiska progresa tendence. Diemžēl saglabājas uzskats, ka tā ir tikai speciālistu – kardiologu un neirologu – kompetence, tajā pašā laikā aizvien biežāk sastopama tendence sākt OAK lietošanu, un priekšroka tiek dota TOAK pacientiem pirms sirds ritma atjaunošanas, jau ģimenes ārstu aprūpes laikā.
- Joprojām saglabājas viedoklis, ka antikoagulanti kā medikamentu grupa paši par sevi ir bīstami. Šādu uzskatu galvenokārt pauž ārsti, kas vecāki par 60 gadiem, ar minimālu pieredzi darbā ar pacientiem, kam ir aritmija, un ķirurgi.
Diskusija
Lai analizētu PM pacientu grūtības lietojot OAK, svarīgi ir izvērtēt pētījumā iesaistītās pacientu grupas kvalitatīvos rādītājus, kas varētu ietekmēt OAK veida izvēli, trombemboliju rašanos un medikamentu lietošanas paradumus.
Pētījumā iekļautie nevalvulāras PM pacienti vairumā gadījumu bija KVA lietotāji, taču, salīdzinot ar 2012.–2013. gada datiem, ir vērojama nozīmīga TOAK pieauguma tendence un, kas jo īpaši svarīgi, tendence ne tikai pirms un pēc EKV, kas bija raksturīgi 2012.–2013. gadā, bet ilgtermiņa lietošanā. Šā rādītāja atšķirības grupu starpā ir statistiski nozīmīgas, un tās apstiprina arī korelācijas analīze. Mūsdienu (2014. un 2015. gada dati) vadlīnijas paredz OAK lietošanu ilgāk nekā četras nedēļas pēc elektrokardioversijas, iesakot tos lietot mūža garumā pacientiem ar insulta riska faktoriem vai PM lēkmju atkārtošanos (Camm, 2012; Lip, 2012; January, 2014). Pētījuma laikā netika mērķtiecīgi iegūta informācija par pacientu grupu pēc EKV, tomēr šāda analīze ir veikta, apsekojot, vai pacienti turpina lietot TOAK, vai notiek pāreja uz KVA, vai šāda terapija vispār tiek izmantota, un iegūtie dati apliecina TOAK priekšrocības.
Svarīgi ir ārstu grupas analizētie dati par TOAK lietošanas ilgumu – TOAK grupā pieaug to pacientu skaits, kas medikamentus lietojuši ilgāk par sešiem mēnešiem.
Trūkst ziņu, vai šiem pacientiem ir atkārtotas PM epizodes, vai PM ilgums ir objektīvi pierādāms. Šo faktoru identifikācija PM veida noteikšanai bieži ir apgrūtinoša arī klīniskajā praksē, sevišķi ņemot vērā asimptomātisku PM lēkmju varbūtību, kas savukārt saistās ar ievērojami pieaugošu insultu risku.
OAK lietotāju vidū vairāk nekā 25% no visiem pacientiem ir smēķētāji. Tas apgrūtina sekmīgu trombemboliju novēršanu ilgākā laika periodā, jo smēķēšana ir riska faktors, kas varbūtību saslimt ar PM palielina divas reizes (Yanbaeva, 2007), kā arī palielina iespējamību saslimt ar citām sirds un asinsvadu slimībām (Hansen, 2010), kas ir insulta attīstības riska faktors.
OAK lietošanas ilgums un laiks pirms PM diagnosticēšanas KVA grupā ir lielāks. Tas parāda tendenci nemainīt iesākto terapiju par spīti varbūtējām grūtībām medikamentu lietojumā.
Aplūkojot OAK lietotāju klīniskās problēmas, kas saistītas ar medikamentu blaknēm, uzsvars tika likts uz pastiprinātas asiņošanas epizodēm un hemorāģiju rašanos abās OAK grupās. Šīs blakusparādības vērtējamas kā biežāk sastopamās abās OAK grupās (Gomes, 2012), tāpat tās analizētas RE-LY, ROCKET-AF, ARISTOTLE pētījumos (Camm, 2012; Lip, 2012). Joprojām ārstu un arī secīgi pacientu vidē vērojama tendence par vienu no būtiskām TOAK priekšrocībām minēt regulāro INR kontroļu trūkumu, neakcentējot efektivitāti un drošību, – tas atzīmējams kā izglītības darba defekts. Šī problēma gan tiek labota un, kas būtiski, RSU Tālākizglītības fakultāte jau divus gadus organizē izbraukuma kursus Latvijas reģionos (tajos nav farmācijas industrijas tiešas līdzdalības, tāpēc nav iespējas lobēt vienas vai citas intereses).
Iespējams, atšķirības OAK lietotāju starpā ietekmē medikamentu lietošanas ilgums, kas KVA grupā ir augstāks. Tāpat 68,2 % KVA lietotāju atzīmējuši grūtības INR noturēt terapeitiskajās robežās un 62,4 % – grūtības piemērot KVA devu – tas paaugstina asiņošanas un hemorāģiju risku. Arī ārsti praksē visbiežāk sastopas ar pacientu grūtībām kontrolēt asinsreces rādītājus un noturēt tos terapeitiskajās robežās KVA lietotāju grupā.
Klīniski nozīmīgs abās OAK grupās ir antiagregantu lietotāju relatīvais biežums, kas var ievērojami paaugstināt asiņošanas risku PM pacientiem, duālās terapijas gadījumā varfarīna lietotājiem par 13,9 % gadā. Pēc ārstu aptaujas datiem redzams, ka, uzsākot OAK terapiju, tikai 45,5 % ārstu pievērš uzmanību citu medikamentu vai aktīvo vielu paralēlai lietošanai, tā palielinot asiņošanas risku pacientiem. Mazāk nekā puse ārstu atzīmē, ka ņem vērā pacientu nieru darbību, aknu slimības un arteriālo hipertensiju, kas ir nozīmīgi asiņošanas attīstības riska faktori un iekļauti HAS-BLED asiņošanas riska skalā PM pacientiem. Nieru darbības rādītāji ir nozīmīgi arī piemērojot TOAK devas (De Caterina, 2012). Eiropas Zāļu aģentūra (European Medicines Agency), Austrālijas Terapeitisko preču pārvalde (Therapeutic Goods Administration) un ASV Pārtikas un zāļu pārvalde (Food and Drug Administration) stingri iesaka noteikt nieru funkcionālās spējas pirms TOAK uzsākšanas, ņemot vērā ziņojumus par asiņošanas epizodēm (Menke, 2010; Heidbuchel, 2013; Camm, 2014; Shulman, 2014; Kovac, 2015).
Diemžēl arī CHA2DS2-VASc skalā ietvertie trombemboliju attīstības riska faktori netiek pietiekami ņemti vērā, lielāku uzmanību pievēršot vienīgi trombembolijām anamnēzē, vecumam un vaskulārajām slimībām.
Lai gan vairums ārstu atzīst, ka informē pacientus par aktīvo vielu, medikamentu un pārtikas produktu izvēles nozīmi, lietojot KVA, tikai 25,9 % pacientu KVA un 27,8 % TOAK grupā uzskata, ka ir pietiekami informēti par OAK mijiedarbību ar aktīvajām vielām, un mazāk nekā 30 % seko tai līdzi ikdienā. Tas būtiski apgrūtina OAK lietošanu, sevišķi KVA grupā, kur ir augsta medikamentu un diētas mijiedarbība, kas ietekmē varfarīna efektu (Camm, 2012). TOAK grupā ir mazāka medikamentu mijiedarbības varbūtība (De Caterina, 2012).
KVA lietotāji ikdienā sastopas ar problēmām, kas saistītas ar OAK devu noteikšanu un INR kontroles grūtībām. 90,6 % pacientu regulāri veic INR kontroli, vairumā gadījumu to darot vienu līdz divas reizes mēnesī. Nepieciešamība kontrolēt INR ir individuāla, tomēr, ņemot vērā, ka INR būtu jānotur terapeitiskajās robežās 70 % no visa lietošanas laika (Camm, 2012) un vairums pacientu sastopas ar grūtībām šajā aspektā, pietiekama INR kontrole ir apšaubāma.
Svarīga ir pacientu līdzestība, kas, spriežot pēc ārstu aptaujas datiem, Latvijā ir nopietna problēma, ar ko ārsti sastopas bieži. Līdzestības trūkums ir atzīmēts kā galvenā ārstu problēma, strādājot ar KVA lietotājiem, tas ir arī viens no galvenajiem faktoriem, ko ārsti apsver pirms OAK terapijas uzsākšanas. Tas bieži ir iemesls terapijas neuzsākšanai, antiagregantu izrakstīšanai PM pacientiem tad, kad būtu skaidri indicēta OAK terapija. Šeit gan jānorāda par iepriekš minētajām atšķirībām pacientu informētības līmenī. Iespējams, vāju līdzestību izraisa pacientu un ārstu savstarpējās komunikācijas trūkums un KVA lietošanas sarežģītība. Līdzestību veicina vienkārša medikamentu lietošanas procedūra, fiksētas devas (Camm, 2012), ko var piedāvāt TOAK lietošana, tā atrisinot šo klīniskā izmantojuma problēmu gan pacientu, gan ārstu grupā.
Vairāk nekā puse aptaujāto ārstu praksē lieto TOAK, pārsvarā izrakstot tos samērā reti. Kardiologi, citu specialitāšu ārsti (galvenokārt neirologi) un ārsti rezidenti, kuri TOAK iesaka / lieto vadošā ārsta uzraudzībā, ir līderi TOAK izvēles ziņā. Tomēr jāsecina, ka ģimenes ārstu grupā TOAK rekomendējošo speciālistu daļa ievērojami pieaug. Pozitīvi vērtējamas tendences ir tālākizglītības kursu par OAK lietojumu PM pacientiem augstā apmeklētība un progresējošā ārstu gatavība lietot TOAK praksē biežāk.
TOAK izvēles aspektā mazinās līdzestības problēmas aktualitāte, tomēr priekšplānā Latvijas ārsti izvirza izmaksu jautājumu. Jāņem vērā, ka dažādās valstīs izmaksas atšķiras, tomēr atkārtoti jāuzsver arī citāda izmaksu efektivitātes izpratne, kas minēta jau iepriekš. Pētījuma rezultāti liecina – kamēr Latvijā TOAK izmaksas būs nesamērīgi augstas, salīdzinot ar KVA, to plašāks lietojums būs apgrūtināts. Tiesa gan, kopš 2014. gada decembra ievērojami samazinājusies rivariksabāna tirgus cena un kopš 2015. gada marta – dabigatrāna cena, kas pozitīvi ietekmēja šo medikamentu pieejamību.
Pētījuma struktūra ietver subjektīvas pacientu un ārstu atbildes, kas apgrūtina objektīvu blakņu un blakusslimību sastopamības izvērtējumu. Aptaujāto dalībnieku skaits ir diezgan neliels, tomēr ietver abas OAK lietotāju grupas un vairāku specialitāšu ārstu grupas, pārstāvot plašu Latvijas teritoriju.
Uzskatām, ka šāda veida pētījumus ir vērts turpināt un paplašināt, aptaujājot ambulatoros pacientus, kuri vēršas pie ģimenes ārsta. Būtiski ir aptaujāt plašu speciālistu loku, aptverot pēc iespējas visu Latvijas teritoriju.
Galvenie ierosinājumi:
- atrisināt TOAK izmaksu jautājumu, lai aktīvāk ieviestu TOAK lietošanu praksē un novērstu biežāk sastopamās KVA lietojuma problēmas;
- ieviest praksē paškontroles ierīces, lai palīdzētu atrisināt KVA lietotāju galvenās grūtības – INR kontroli;
- uzlabot ārstu un pacientu savstarpējo komunikāciju, veltot vairāk laika pacientu informēšanai par OAK lietojuma īpatnībām, mijiedarbību, izvēles iespējām;
- aktīvāk un plašāk informēt ārstus par faktoriem, kas jāņem vērā pirms OAK terapijas uzsākšanas.
Jaunu OAK ieviešana PM pacientu terapijā vērtējama kā pozitīva tendence. Ir cerība, ka tie veicinās OAK lietojumu nevalvulāras PM slimniekiem, kuriem ir indicēti OAK, taču problemātiskā lietojuma dēļ netiek izmantoti. TOAK nav brīnumlīdzeklis, arī to lietošanā iespējami sarežģījumi, tomēr tie dod ko ļoti būtisku un līdz šim OAK izmantošanā nebijušu – izvēles iespēju lietot klīniskajā praksē gan drošākus, gan arī efektīvākus medikamentus insulta un sistēmiskās embolijas profilaksē.
Secinājumi
Orālo antikoagulantu klīniskais lietojums nevalvulāras priekškambaru mirgošanas pacientiem ir komplicētāks KVA grupā medikamentu blakņu, lietošanas sarežģītības un informācijas trūkuma dēļ.
Jaunajiem orālajiem antikoagulantiem ir pārliecinoši augstāka drošība, un tiem ir būtiski mazāks blakņu, to skaitā asiņošanas, risks. Elektrisko kardioversiju grupā jauno orālo antikoagulantu lietošanai ir priekšrocības pirms un pēc procedūras (atbilstīgi vadlīnijām un klīniskajiem pierādījumiem).
Pirms orālo antikoagulantu terapijas uzsākšanas nevalvulāras priekškambaru mirgošanas pacientiem netiek pietiekami ņemti vērā asiņošanas un trombembolijas izveidošanās riska faktori.
Abstract
Comparison of Last Two Years’ Tendencies in Clinical Usage of Different Oral Anticoagulants by Patients with Atrial Fibrillation
Oral anticoagulants (OAC) have been first line medication for prevention of thromboembolic events by patients (pts) with non-valvular atrial fibrillation (NVAF) for a long time, although the usage of vitamin K antagonists (VKA) causes many problems for patients and physicians. Novel OAC (NOAC) promise to solve those problems; however, their implementation in practice is undergoing slowly.
The study enrolled 3542 pts with NVAF under OAC therapy in different hospitals and ambulatory praxis in Latvia. Problems associated with OAC were analysed. Bleeding was defined as Clinical Relevant Major Bleeding (CRMB) and clinical relevant non-major bleeding (CRNMB) according to international guidelines. The second group included 269 physicians with clinical experience in treatment and care of non-valvular AF patients applying OAC and following 466 physicians after 2014.
There were 2214 (62.5 %) users of VKA and 1328 (37.5 %) users of NOAC. CHA2DS2-VASc in VKA group was 3.4 ± 1.8, in NOAC group it was 2.5 ± 1.5. Significantly higher incidence of side effects was detected among VKA compared to NOAC users. Bleeding: 31 % in VKA vs. 3.3 % in NOAC users (p < 0.001); CRMB in VKA group was observed in 52 pts (2.3 %) vs. 3 (0.2 %) CRMB in NOAC (702 dabigatran and 626 rivaroxaban). CRNMB in VKA group was observed in 194 pts (8.76 %) vs. 21 (1.6 %) in NOAC (p < 0.01). No significant difference between dabigatran 150 mg and Rivaroxaban 20 mg, 1 CRNMB in dabigatran 110 mg. More than 50 % of the VKA users had difficulties to adjust OAC dose and to keep the INR between 2.0 and 3.0, and 31.8 % had problems with INR control. NOAC’s were was preferred in pts in electrical cardioversion group 64.7 % vs. 35.3 % VKA with significantly lower rates of adverse events (p < 0.001) as bleeding and high safety.
Physicians: 13.9 % cardiologists, 20.8 % internal specialities, 23.8 % general practitioners, 8.9 % surgeons and others, 32.7 % resident physicians, which total to 48.5 %, use NOAC in their practice, but 81.3 % of physicians were willing to do it more often. High costs and not sufficient clinical experience were mentioned as main problems for NOAC. According to the physicians, the main problems for VKA are lack of compliance, poor INR control and difficulties in dose adjustment. 82 % of doctors did explain interaction of active substances with OAC to their patients.
Clinical usage of OAC for AF patients is more complicated in VKA group due to side effects, complexity of use and lack of information. NOAC are safer and have significantly less complications and bleeding rate. In electrical cardioversion group, NOAC are preferable for use before and after procedure. Physicians find the usage of NOAC less problematic and they would be ready to use NOAC in their practice more often. Thromboembolic and bleeding risk factors are not considered properly enough before starting OAC therapy.
Literatūra
1. Ahrens I., Lip G. Y. H., Peter K. New oral anticoagulant drugs in cardiovascular disease // Thromb Haemost, 2010; 104 (1): 49‒60.
2. Ansell J., Jacobson A., Levy J., et al. Anticoagulation IS-MAfO. Guidelines for implementation of patient self-testing and patient self-management of oral anticoagulation. International consensus guidelines prepared by International Self-Monitoring Association for Oral anticoagulation // Int J Cardiol, 2005; 99 (1): 37‒45.
3. Baker W. L., Phung O. J. Systematic review and adjusted indirect comparison meta-analysis of oral anticoagulants in atrial fibrillation // Circ Cardiovasc Qual Outcomes, 2012; 5 (5): 711‒719.
4. Camm A., Savelieva I. Practical considerations for using novel oral anticoagulants in patients with atrial fibrillation // Clinical Cardiology, 2014; Vol. 7; issue 1: 32–47.
5. Camm A. J., Kirchhof P., Lip G. Y. H., et al. Guidelines for the management of atrial fibrillation: the Task force for the management of Atrial fibrillation of the European Society of Cardiology (ESC) // European Heart Journal, 2010; 31 (19): 2369‒2429.
6. Camm A. J., Lip G. Y. H., De Caterina R., et al. 2012 focused update of the ESC guidelines for the management of atrial fibrillation: An update of the 2010 ESC guidelines for the management of atrial fibrillation // European Heart Journal, 2012; 33: 2719‒2747.
7. Cappatto R., et al. Eur Heart J, 2014 // DOI:10.1093/eurheart/ehu367 (sk. 01.02.2015.).
8. Chamberlain A. M., Agarwal S. K., Folsom A. R., et al. Smoking and incidence of atrial fibrillation: results from the Atherosclerosis risk in communities (ARIC) study // Heart Rhythm, 2011; 8 (8): 1160‒1166.
9. Connolly S. J., Ezekowitz M. D., Yusuf S., et al. Investigators R-LSCa. Dabigatran versus warfarin in patients with atrial fibrillation // N Engl J Med, 2009; 361 (12): 1139‒1151.
10. Corley S. D., Epstein A. E., DiMarco J. P., et al. Relationships between sinus rhythm, treatment, and survival in the Atrial fibrillation follow-up investigation of rhythm management (AFFIRM) study // Circulation, 2004; 109 (12): 1509‒1513.
11. De Caterina R., Husted S., Wallentin L., et al. New oral anticoagulants in atrial fibrillation and acute coronary syndromes: ESC Working group on thrombosis-task force on anticoagulants in heart disease position paper // J Am Coll Cardiol, 2012; 59 (16): 1413‒1425.
12. Douxfils J., Mullier F., Robert S., et al. Impact of dabigatran on a large panel of routine or specific coagulation assays.
Laboratory recommendations for monitoring of dabigatran etexilate // Thromb Haemost, 2012; 107: 985–999.
13. European Medicines Agency // Apixaban: 20/12/2012 // http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Product_Information/human/002148/WC500107728.pdf (sk. 01.02.2015.).
14. European Medicines Agency // Apixaban: 20/12/2012 // http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002148/human_med_001449.jsp&mid=WC0b01ac058001d124 (sk. 01.02.2015.).
15. European Medicines Agency // Dabigatran: 04/09/2012. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Product_Information/human/000829/WC500041059.pdf (sk. 01.02.2015.).
16. European Medicines Agency // Rivaroxaban: 20/01/2012. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Product_Information/human/000944/WC500057108.pdf (sk. 01.02.2015.).
17. European Medicines Agency // Rivaroxaban: 20/01/2012 // http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000944/human_med_001155.jsp&mid=WC0b01ac058001d124 (sk. 01.02.2015.).
18. Ērglis A., Latkovskis G., Kalējs O. u. c. Antikoagulantu lietošana pacientiem ar ātriju fibrilāciju kardioemboliskā insulta novēršanai. Latvijas Kardiologu biedrības, Latvijas Internistu biedrības un Latvijas Neirologu biedrības Zinātniskais nolēmums. – Rīga, 2013. – 5., 7.–9., 15., 18. lpp.
19. Freeman J. V., Zhu R. P., Owens D. K., et al. Cost-effectiveness of dabigatran compared with warfarin for stroke prevention in atrial fibrillation // Ann Intern Med, 2011; 154 (1): 1‒11.
20. Furie K. L., Goldstein L. B., Albers G. W., et al. [on behalf of the American Heart association stroke council CoQoCaOR, Council on Cardiovascular nursing, Council on Clinical cardiology, and Council on Peripheral vascular disease]. Oral antithrombotic agents for the prevention of stroke in nonvalvular atrial fibrillation: A science advisory for healthcare professionals from the American Heart association / American Stroke Association // Stroke, 2012; 43 (12): 3442‒3453.
21. Go A. S., Hylek E. M., Phillips K. A., et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the Anticoagulation and risk factors in atrial fibrillation (ATRIA) study // Journal of the American Medical Association, 2001; 285: 2370–2375.
22. Gomes T., Mamdani M. M., Holbrook A. M., et al. Rates of hemorrhage during warfarin therapy for atrial fibrillation // Canadian Medical Association Journal, 2013; 185 (2): E 121‒127.
23. Granger C. B., Alexander J. H., McMurray J. J., et al. Apixaban versus warfarin in patients with atrial fibrillation // N Engl J Med, 2011; 365 (11): 981‒989.
24. Hansen M. L., Sørensen R., Clausen M. T., et al. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation // Arch Intern Med, 2010; 170 (16): 1433‒1441.
25. Hart R. G., Halperin J. L. Atrial fibrillation and stroke: concepts and controversies // Stroke, 2001; 32: 803‒808.
26. Heeringa J., Van der Kuip D. A., Hofman A., et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study // European Heart Journal, 2006; 27 (8): 949‒953.
27. Heidbuchel H., Verhamme P., Alings M., et al. Europace, 2013; 15 (5): 625–651. doi: 10.1093/europace/eut083 28. Heneghan C., Ward A., Perera R., et al. Self-monitoring of oral anticoagulation: systematic review and meta-analysis of individual patient data // Lancet, 2012; 379 (9813): 322‒334.
29. Horsti J., Uppa H., Vilpo J. A. Poor agreement among prothrombin time international normalized ratio methods: comparison of seven commercial reagents // Clin Chem, 2005; 51 (3): 553‒560.
30. January C. T., et al. 2014 AHA/ACC/HRS Atrial fibrillation guidelines // Circulation, 2014; 130: 2071–2104.
31. Kalejs O. Rivaroxaban and two dosages dabigatran versus warfarin in patients with high risk of stroke and embolism undergoing electrical cardioversion with persistent and long-acting atrial fibrillation // Heart Rhythm, 2015; PO 06–113.
32. Kalējs O., Jirgensons J. Aritmijas // Klīniskā medicīna / A. Lejnieka redakcijā. – Rīga: Medicīnas apgāds, 2010, 1. sēj. – 154.‒155. lpp.
33. Kalējs O., Luriņa B., Strēlnieks A. u. c. Orālo antikoagulantu klīniskā pielietojuma problēmu analīze pacientiem ar priekškambaru mirgošanu // Rīgas Stradiņa universitāte. Zinātniskie Raksti, 2013; 138–159.
34. Kalvelis A. Klīniskā elektrokardioloģija. – Rīga: Nacionālais apgāds, 2008. – 147. lpp.
35. Kirchhof P., Auricchio A., Bax J., et al. Outcome parameters for trials in atrial fibrillation: executive summary. Recommendations from a consensus conference organized by the German Atrial fibrillation competence NETwork (AFNET) and the European Heart rhythm association (EHRA) // European Heart Journal, 2007; 28: 2803–2817.
36. Kovacs R. J., et al. Practical management of anticoagulation in patients with atrial fibrillation // J Am Coll Cardiol, 2015; 65 (13): 1340–1360. doi:10.1016/j.jacc.2015.01.049
37. Lip G. Y. H., Banerjee A., Lagrenade I., et al. Assessing the risk of bleeding in patients with atrial fibrillation: the Loire valley Atrial fibrillation project // Circ Arrhythm Electrophysiol, 2012; 5 (5): 941‒948.
38. Menke J., Lüthje L., Kastrup A., Larsen J. Thromboembolism in atrial fibrillation // Am J Cardiol, 2010; 105 (4): 502‒510.
39. Olesen J. B., Torp-Pedersen C., Hansen M. L., Lip G. Y. H. The value of the CHA2DS2-VASc score for refining stroke risk stratification in patients with atrial fibrillation with a CHA2DS2 score 0‒1: a nationwide cohort study // Thrombosis and Haemostasis, 2012; 107 (6): 1172‒1179.
40. Onalan O., Crystal E. Left atrial appendage exclusion for stroke prevention in patients with nonrheumatic atrial fibrillation // Stroke, 2007; 38 (2 Suppl): 624‒630.
41. Patel M. R., Mahaffey K. W., Garg J., et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation // N Engl J Med, 2011; 365 (10): 883‒891.
42. Purviņš I., Purviņa S. Praktiskā farmakoloģija. – Rīga: Zāļu infocentrs, 2011. – 351.–352., 359. lpp.
43. Schneeweiss S., Gagne J. J., Patrick A. R., et al. Comparative efficacy and safety of new oral anticoagulants in patients with atrial fibrillation // Circ Cardiovasc Qual Outcomes, 2012; 5 (4): 480‒486.
44. Shulman S. Advantages and limitations of the new anticoagulants // Journal of Internal Medicine, 2014; Vol. 275, Issue 1: 1–11.
45. Steffel J., Braunwald E. Novel oral anticoagulants: focus on stroke prevention and treatment of venous thromboembolism // European Heart Journal, 2011; 32 (16): 1968‒1976.
46. Stewart S., Hart C. L., Hole D. J., McMurray J. J. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew / Paisley study // Am J Med, 2002; 113 (5): 359‒364.
47. Stewart S., Hart C. L., Hole D. J., McMurray J. J. Population prevalence, incidence, and predictors of atrial fibrillation in the Renfrew / Paisley study // Heart, 2001; 86: 516–521.
48. Van Dulmen S., Sluijs E., Van Dijk L., et al. Patient adherence to medical treatment: a review of reviews // BMC Health Serv Res, 2007; 7: 55.
49. Watson T., Shantsila E., Lip G. Y. H. Mechanisms of thrombogenesis in atrial fibrillation: Virchow’s triad revisited // Lancet, 2009; 373 (9658): 155‒166.
50. Wolf P. A., Abbott R. D., Kannel W. B. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study // Stroke, 1991; 22 (8): 983‒988.
51. Yanbaeva D. G., Dentener M. A., Creutzberg E. C., et al. Systemic effects of smoking // Chest, 2007; 131 (5): 1557‒1566.
52. Zāļu valsts aģentūra / Latvijas Republikas Zāļu reģistrs. 2012. gads. – Rīga: Zāļu valsts aģentūra, 2012. – 492.–493. lpp.
53. Zāļu valsts aģentūra / Zāļu patēriņa statistika 2011. – Rīga: Zāļu valsts aģentūra, 2012. – 22. lpp.
54. Zāļu valsts aģentūras Medicīnas ierīču katalogs. Reģistrētās medicīnas ierīces // http://latmed.zva.gov.lv/public/precuKatalogs.aspx (sk. 12.03.2015.).