Plaušu artēriju trombembolijas attēldiagnostikas metožu informatīvais salīdzinājums
Kopsavilkums
Plaušu artēriju trombembolija (PATE) ir kardiovaskulāra patoloģija. Tā ir viens no galvenajiem mirstības un hospitalizācijas iemesliem Eiropā, tādēļ ir nozīmīgi to laikus diagnosticēt un sākt ārstēšanu. Diagnozes apstiprināšanai tiek izmantotas dažādas attēldiagnostikas metodes, no kurām visbiežāk lieto datortomogrāfijas plaušu angiogrāfiju (DTPA) un / vai ehokardiogrāfiju (EHO).
Darba mērķis ir noskaidrot attēldiagnostikas metožu (DTPA un EHO) jutību PATE gadījumā un salīdzināt to informativitāti.
Materiāls un metodes. Apkopota Paula Stradiņa Klīniskās universitātes slimnīcas medicīniskajā arhīvā pieejamā informācija par 190 Latvijas Kardioloģijas centra pacientiem, kas ārstējušies ar diagnozi PATE no 2013. gada 1. janvāra līdz 2014. gada 31. oktobrim. Tika analizēti DTPA izraksti un EHO rādītāji.
Rezultāti. Izpētes grupā 66,3 % (126) bija sievietes un 33,7 % (64) vīrieši. DTPA tika veikta 93,7 % (118) sieviešu, no kurām PATE diagnoze apstiprināta 99,2 % (117), un 98,4 % (63) vīriešu, no kuriem PATE apstiprināta 96,8% (61) gadījumu. Galvenajās plaušu artērijās pildījuma defekti tika novēroti 63,6 % (75) sieviešu un 55,6 % (35) vīriešu, daivu artērijās – 50,8 % (60) un 31,7% (20), segmentālās – 86,4 % (102) un 84,1 % (53). Abpusēja PATE bija sastopama 82,9 % (97) sieviešu un 82,0 % (50) vīriešu, masīva – 68,7 % (81) un 60,4 % (38), centrāla – 78,0 % (92) un 66,7 % (42). DTPA sirds labās puses dilatācija tika konstatēta 47,0 % (31) un 43,3 % (13).
EHO tika veikta 73,8 % (93) sieviešu un 81,0 % (51) vīriešu. Labā priekškambara laukums (RAA) virs normas bija abu dzimumu pacientiem (58,7 % jeb 81), taču statistiski ticami augstāks tas bija vīriešiem 21,7 (± 6,7) nekā sievietēm 19,4 (± 5,4) cm2 (p = 0,029). Labā kambara sistoliskais spiediens (LKSS) – paaugstināts abu dzimumu pacientiem (76,3 % jeb 103) – sievietēm 42,5 (35; 55) un vīriešiem 40,0 (33; 50) mm Hg. Kreisā priekškambara tilpuma indekss (LAVI) arī abu dzimumu pētījuma dalībniekiem bija paaugstināts, attiecīgi – 29,0 (24; 35) un 28,5 (23; 39) ml/m2. Izsviedes frakcija (EF Simpson) vīriešiem bija pie apakšējās robežas – 55,0 (45; 60) % (samazināta – 41,2 % (21) vīriešu), un statistiski bija ticama atšķirība (p = 0,009) no sievietēm, kam izsviedes frakcija atbilda normai 60,0 (55; 60) % (samazināta tikai 17,4 % (16) sieviešu). Trikuspidālā regurgitācija pacientiem, kam tika veikta EHO, – sastopama 95,7 % (89) sieviešu un 100 % (51) vīriešu (visbiežāk – 2. pakāpes).
Secinājumi. DTPA ir zelta standarts PATE diagnostikā (jutība 98,3 %), tomēr gadās situācijas, ka to veikt nav iespējams (hemodinamiskas nestabilitātes, smagas nieru mazspējas dēļ u. tml.). Šādos gadījumos var izvēlēties ehokardiogrāfiju, kuras jutība ir 50,7–76,3 %. Veicot DTPA, visbiežāk pildījuma defekti tiek novēroti abpusēji segmentālajās artērijās, taču sirds dilatāciju apraksta < 50 % gadījumu. Pastāv statistiski ticama korelācija starp EHO noteiktu palielinātu labā priekškambara laukumu (RAA) un DTPA noteiktu sirds labās puses dilatāciju.
Ievads
Plaušu artēriju trombembolija (PATE) ir kardiovaskulāra patoloģija, kas pieder pie venozām trombembolijām (VTE) un visbiežāk rodas no dziļo vēnu trombozes. VTE ir trešā biežākā kardiovaskulārā saslimšana (pēc sirds infarkta un smadzeņu insulta) ar sastopamības biežumu 100–200 gadījumu uz 100 000 iedzīvotāju gadā (Anderson, 2003; Konstantinides, 2014). Apmēram trešdaļa VTE izpaužas ar PATE, kas savukārt ir viens no galvenajiem mirstības un hospitalizācijas iemesliem Eiropā (Cohen, 2007; Konstantinides, 2014). Tādēļ, lai novērstu augsto letalitāti un hroniskas slimības attīstību, nozīmīgi ir to laikus diagnosticēt un sākt ārstēšanu (Heit, 2008; Konstantinides, 2014). Statistiskas dati rāda, ka no visiem pacientiem ar primāro darba diagnozi PATE 8–39 % šī diagnoze tiek apstiprināta (Heit, 2008; Konstantinides, 2014).
PATE diagnostikai izmanto multidisciplināru pieeju. Sāk ar klīnisko simptomu un risku izvērtēšanu, no kā izriet turpmākā izmeklējumu nepieciešamība un secība, kurā ietilpst laboratorisko rādītāju (D-dimēru u. c.) noteikšana, datortomogrāfijas plaušu angiogrāfija (DTPA), transtorakāla ehokardiogrāfija (TTE), kā arī citi, retāk izmantoti, izmeklējumi (Hert, 2008; Konstantinides, 2014; Stein, 2012).
Izmeklējumu informativitāte atšķiras: DTPA gadījumā tiek pierādītas tiešas izmaiņas plaušu artērijās, bet TTE gadījumā – netieši norādījumi par PATE, precīzāk, par sirds labās puses akūtu mazspēju. Lai gan DTPA ir zelta standarts PATE diagnostikā, šo izmeklējumu ne vienmēr var veikt, jo pastāv dažādas relatīvas un absolūtas kontrindikācijas, kā arī, izvērtējot katra pacienta klīnisko stāvokli individuāli, tiek lemts par attiecīgo izmeklējumu lietošanas secību un informativitāti (Hert, 2008; Beccatini, 2011; Konstantinides, 2014). Tādēļ ir svarīgi izvērtēt dažādo PATE attēldiagnostikas metožu, precīzāk – DTPA un TTE, informativitāti, jutīgumu, specifiskumu un to lietojumu dažādās klīniskās situācijās (Sanchez, 2008; Beccatini, 2011; Farrell, 2011).
Darba mērķis
Darba mērķis ir noskaidrot attēldiagnostikas metožu (DTPA un TTE) jutību plaušu artērijas trombembolijas gadījumā un salīdzināt to informativitāti.
Darba uzdevumi
- Atrast un apkopot literatūras avotus un jaunākos pētījumus par plaušu artērijas trombembolijas attēldiagnostikas metožu, precīzāk – DTPA un TTE, jutību, specifiskumu, informativitāti, indikācijām un kontrindikācijām.
- Retrospektīvi izpētīt Paula Stradiņa Klīniskās universitātes slimnīcas arhīvā pieejamās pacientu slimības vēstures, kurās minēta diagnoze plaušu artērijas trombembolija, no 2013. gada 1. janvāra līdz 2014. gada 31. oktobrim.
- Izdarīt secinājumus par dažādo attēldiagnostikas metožu informativitāti, jutību, indikācijām un kontrindikācijām konkrētās situācijās.
Pētījumā izmantotās metodes
Veikts retrospektīvs pētījums, apkopojot Paula Stradiņa Klīniskās universitātes slimnīcas medicīniskajā arhīvā pieejamās slimības vēstures par 190 Latvijas Kardioloģijas centra pacientiem ar diagnozi PATE, no 2013. gada 1. janvāra līdz 2014. gada 31. oktobrim. Dati analizēti, izmantojot MS Excel un IBM SPSS 22.0 programmu. Vidējie rādītāji atspoguļoti kā mediāna (I; III kvartīle) neparametriski sadalītiem rādītājiem vai kā vidējais aritmētiskais (± standartdeviācija) rādītājiem normālsadalījumā, savukārt pazīmju sastopamība – procentuāli (n – absolūtos skaitļos).
Plaušu artērijas trombembolija
Definīcija un epidemioloģija. Plaušu artērijas trombembolija (PATE) ir kardiovaskulāra patoloģija, kas pieder pie venozām trombembolijām (VTE) un visbiežāk rodas kā dziļo vēnu trombozes komplikācija. VTE ir trešā biežākā kardiovaskulārā saslimšana ar sastopamības biežumu 100–200 uz 100 000 iedzīvotāju gadā (Heit, 2008; Konstantinides, 2014). Apmēram trešdaļai visu VTE pacientu ir PATE (Hert, 2008; Konstantinides, 2014). Tas ir biežākais nāves cēlonis pēc ķirurģiskām operācijām. PATE ir viens no galvenajiem mirstības un hospitalizācijas iemesliem Eiropā, tādēļ, lai novērstu augsto letalitāti vai hroniskas slimības attīstību (hroniskas trombemboliskas plaušu hipertensijas), nozīmīgi ir to laikus diagnosticēt un uzsākt ārstēšanu (Mača, 2014; Hert, 2008; Konstantinides, 2014).
Statistiskie dati rāda, ka no visiem pacientiem, kas stacionēti ar aizdomām par PATE, 8–39 % gadījumu šī diagnoze apstiprinās (Mača, 2014; Konstantinides, 2014). Pētījumā, kas publicēts 2014. gadā, secināts, ka no 696 pacientiem ar primāro darba diagnozi PATE tā apstiprinājās 20,8 % (145), visbiežākā sūdzība (59,3 %) bija par elpas trūkumu (Mača, 2014; Konstantinides, 2014). Neārstētas PATE gadījumā mirstība var sasniegt pat 30–35 %, taču, laikus diagnosticējot un ārstējot, mirstību var samazināt līdz 2–8 % (Aujesky, 2011). Precīzu PATE epidemioloģiju ir grūti noteikt, jo tā var noritēt asimptomātiski, tā arī var parādīties kā nejauša atrade, veicot izmeklējumus citu iemeslu dēļ (Douma, 2011; Mača, 2014; Bova 2014).
Venozās trombembolijas risks pieaug līdz ar vecumu (> 40 gadi un risks dubultojas ar katru nākamo dekādi), tāpēc, ņemot vērā demogrāfiskās tendences, šo pacientu skaits arvien palielināsies (Mača, 2014; Konstantinides, 2014). PATE risks sevišķi paaugstinās pēc 60 gadu vecuma (Mača, 2014). Vidējais PATE pacientu vecums ir 61–79 gadi, un PATE sastopama vienlīdz bieži kā sievietēm, tā vīriešiem (Heit, 2008; Konstantinides, 2012, 2014). Pēc klīniskiem datiem redzams, ka vidējais PATE sastopamības vecums ir 60–70 gadi, bet pēc autopsijas datiem – augstākais slimības biežums ir 70–80 gadu vecumā (Konstantinides, 2014).
Veicot lielu pētījumu sešās Eiropas Savienības valstīs, tika secināts, ka no 317 000 ar VTE saistītām nāvēm 34 % gadījumu bija pēkšņa, fatāla PATE, 59 % mira no PATE, kas tika secināts tikai autopsijas laikā, un tikai 7 % gadījumu bija pareizi diagnosticēti ar PATE pirms agrīnas nāves. Citā pētījumā (publicēts 2013. gadā) pēc autopsijas datiem secināts, ka pirms nāves PATE diagnosticēta tikai 30–45 % pacientu (Heit, 2008; Konstantinides, 2012; Kearon, 2012; Mača, 2014).
Patoģenēze, klasifikācija un prognoze. Patoģenētiski akūta PATE ietekmē gan asins cirkulāciju, gan skābekļa un ogļskābās gāzes apmaiņu plaušās, tādēļ rodas gan hemodinamiskas, gan respiratoras izmaiņas. Plaušu artērijas spiediens pieaug tikai tad, ja vismaz 30–50 % no kopējā plaušu artēriju šķērsgriezuma laukuma ir nosprostoti ar trombemboliem (Kearon, 2012; Konstantinides, 2012, 2014). Šajā gadījumā notiek arī reflektora vazokonstrikcija, kas paaugstina vaskulāro rezistenci, kas savukārt veicina labā kambara dilatācijas attīstību un spiediena pārslodzi. Smagākos gadījumos spiediena pārslodze labajā kambarī nosaka arī kambaru starpsienas nobīdi, labā kūlīša blokādes rašanos, traucētu kreisā kambara uzpildi diastolē un attiecīgi sekojošu sistēmisku hipotensiju un hemodinamisku nestabilitāti (Konstantinides, 2014). Augstā letalitāte un pēkšņā nāve tiek skaidrota ar izteiktu labā kambara spiediena pārslodzi (Coutance, 2011; Konstantinides, 2014).
PATE iedala centrālā un perifērā, atkarībā no nosprostotā asinsvada lokalizācijas. Centrālas PATE gadījumā ir iesaistīts plaušu stumbrs (truncus pulmonalis), galvenās plaušu artērijas (a. pulmonalis dextra et sinistra) un / vai daivu artērijas (aa. lobares), savukārt perifēras PATE gadījumā – segmentālās un / vai subsegmentālās artērijas (aa. segmentales et subsegmentales) (Jaff, 2011; Kearon, 2012; Konstantinides, 2014). Masīva PATE rodas, ja tā skar abas galvenās plaušu artērijas vai radusies ir hemodinamiska nestabilitāte (Mača, 2014; Konstantinides, 2014).
PATE riska novērtēšanu veic, analizējot trīs prognostiskos rādītājus:
- klīnisko stāvokli;
- labā kambara pārslodzes pazīmes;
- miokarda bojājuma bioķīmiskos marķierus (troponīnu I/T).
Augsta riska PATE galvenā pazīme ir hemodinamiska nestabilitāte – hipotensija vai kardiogēns šoks (pēkšņs sistoliskā asinsspiediena samazinājums < 90 mm Hg vai samazinājums ≥ 40 mm Hg no pacienta normālā asinsspiediena) (Heit, 2008; Kearon, 2012; Konstantinides, 2014). Vidēja un zema riska PATE galvenā pazīme ir hemodinamiska stabilitāte un attiecīgi ar / bez labā kambara pārslodzes pazīmēm un ar / bez pozitīvu troponīnu I/T (Lankeit, 2011; Dellas, 2014; Konstantinides, 2014).
PATE pacientu prognoze ir atkarīga no slimības smaguma un ārstēšanas uzsākšanas savlaicīguma. Prognostiski labā kambara pārslodzes radītie sekundārie simptomi, kā arteriāla hipotensija un kardiogēns šoks, norāda uz augstu letalitātes risku (Konstantinides, 2014). Arī sinkope, tahikardija, nopietnas blakusslimības asociējas ar nelabvēlīgu īstermiņa prognozi. Piemēram, RIETE (Registro Informatizado de la Enfermedad Thromboembolica venoza) pētījumā imobilizācija neiroloģiskas slimības dēļ, vecums virs 75 gadiem un vēzis tiek asociēti ar paaugstinātu letalitātes risku pirmo trīs mēnešu laikā pēc VTE (Jimenez, 2014; Konstantinides, 2014). Savukārt hemodinamiski stabilam pacientam letalitātes risks ir izteikti zemāks, laikus uzsākot antikoagulantu terapiju. Mirstība ir zem 5 % pirmo 3–6 mēnešu laikā, lietojot antikoagulantus. Arī PATE recidīvs šajā laikā ir zem 5 %, lai gan 10 gadu laikā tas iespējams līdz 30 % gadījumu (Lankeit, 2012, 2013; Ert, 2008; Konstantinides, 2014).
Diagnostika. PATE diagnostikai izmanto multidisciplināru pieeju. Sāk ar klīnisko simptomu novērtēšanu: hemodinamiska nestabilitāte – hipotensija vai šoks, sinkope, pēkšņs elpas trūkums, tahipnoja, tahikardija, sāpes krūškurvī, pleirālas sāpes, asinis krēpās. Turpina diagnostiku ar PATE iespējamības noteikšanu, izvērtējot riska faktorus un klīniskās pazīmes pēc Ženēvas vai Velsa rādītājiem (Geneva score vai Wells rule), kā arī laboratoriski nosakot D-dimērus un miokarda bojājuma bioķīmiskos marķierus (troponīnus). Parasti tiek veikta arī elektrokardiogrāfija un plaušu rentgens diferenciāldiagnozes nolūkos (Gibson, 2008; Jia, 2012; Konstantinides, 2014). Diagnozi apstiprina ar attēldiagnostikas metodēm – datortomogrāfijas plaušu angiogrāfiju (zelta standarts PATE diagnostikā), plaušu ventilācijas– perfūzijas scintigrāfiju, plaušu angiogrāfiju (agrāk), ehokardiogrāfiju, vēnu kompresijas ultrasonogrāfiju (Kearon, 2012; Stein, 2012; Konstantinides, 2014).
Jaunākajās – 2014. gada – vadlīnijās tiek piedāvāti divi diagnostiskie algoritmi atkarībā no tā, vai ir augsta riska PATE varbūtība. Ja radušās aizdomas par augsta riska PATE (ir šoks, hipotensija), kas ir dzīvībai bīstams stāvoklis, tad primāri ir jāveic transtorakāla ehokardiogrāfija, kas attēlos akūtu plaušu hipertensiju un labā kambara disfunkciju, tādējādi liecinot par akūtu PATE kā hemodinamiskās nestabilitātes cēloni. Retos gadījumos var ieraudzīt arī trombus labajā sirds pusē. Ja iespējams, var veikt arī transezofageālu ehokardiogrāfiju, lai ieraudzītu trombus plaušu artērijās, kā arī – vēnu kompresijas ultrasonogrāfiju, lai noteiktu proksimālo dziļo vēnu trombozi. Kad pacienta stāvoklis ir stabilizēts, ieteicams gūt galējo apstiprinājumu ar DTPA (Heit, 2008; Konstantinides, 2014).
Ja nav augsta riska PATE (nav šoka, hipotensijas), tad pirms attēldiagnostikas metožu izmantošanas jāizdara vēl citi izmeklējumi. Primāri veic D-dimēru testu, izvērtējot to kopā ar klīnisko varbūtību (pēc Velsa vai Ženēvas rādītājiem), kas kopsummā ļauj izslēgt PATE diagnozi līdz pat 30% pacientu (ja neārstē, tad trīs mēnešu trombembolijas risks šiem pacientiem ir < 1 %) (Gibson, 2008; Jia, 2012; Konstantinides, 2014). D-dimēru testu nav vērtīgi noteikt pacientiem ar augstu PATE klīnisko varbūtību, kā arī hospitalizētajiem. Turpmāk tiek veikta DTPA tiem pacientiem, kam ir paaugstināts (un izvērtēts kopā ar klīnisko ainu) D-dimēru tests. Pieņemts, ka PATE diagnoze tiek apstiprināta, ja DTPA redz plaušu lielo asinsvadu oklūziju, daivu artēriju un / vai segmentālo artēriju oklūziju. Izolētas subsegmentālas oklūzijas atrade vēl ir pretrunīga (Righini, 2011, 2014). Savukārt, ja ir kontrindikācijas veikt DTPA, var lietot vēnu kompresijas ultrasonogrāfiju, jo 30–50 % PATE pacientu atrod proksimālo dziļo vēnu trombozi. Jaunām sievietēm DTPA vietā var izvēlēties ventilācijas–perfūzijas scintigrāfiju, lai samazinātu iespējamu krūts vēža attīstības risku DTPA radiācijas dēļ (Gibson, 2008; Jia, 2012; Konstantinides, 2014).
Datortomogrāfijas plaušu angiogrāfija. Kopš 1998. gada, kad tika atklāta un ieviesta praksē multidetektoru datortomogrāfijas plaušu angiogrāfija, šis izmeklējums kļuvis par pirmās izvēles attēldiagnostikas metodi PATE noteikšanā. Šī metode ir kvalitatīvāka par iepriekš lietotajām, jo īsākā laikā tiek iegūts lielāks skaits ar precīzākiem, plānākiem (0,625–1,25 mm) šķērsgriezumiem, nodrošinot labāku izšķirtspēju, kā arī pacientam tā ir ērtāka, jo attiecīgi elpa jāaiztur īsāku brīdi (10–17 s). Šī metode ir arī mazāk invazīva, salīdzinot ar plaušu angiogrāfiju, kas iepriekš tika atzīta par zelta standartu PATE diagnostikā. Multidetektoru DTPA jutība ir 83 % un specifiskums 96 % (noteikts 2006. gada prospektīvā pētījumā PIOPED II – Prospective investigation on pulmonary embloism diagnosis) (Jia, 2012; Van Es, 2013). Šajā pašā pētījumā (un arī citos, vēlākos pētījumos) tika uzsvērta iepriekš noteiktas PATE klīniskās iespējamības (pēc Velsa rādītājiem) ietekme uz DTPA datu interpretāciju. Secināts, ka izmeklējuma jutība uz pozitīvu atradi augstāka (92–96 %) ir tad, ja pastāv vidēja vai augsta PATE klīniskā varbūtība pēc Velsa rādītājiem, bet krietni zemāka (58 %), ja ir zema klīniskā varbūtība. Un attiecīgi pretēji – DTPA jutība uz negatīvu atradi ir augstāka (96 %) tad, ja ir zema vai vidēja PATE klīniskā varbūtība, bet zemāka (60 %), ja šī klīniskā varbūtība ir augsta. DTPA jutīgums pieaug līdz 93 %, ja papildus šā paša izmeklējuma laikā ar to pašu, jau iepriekš ievadīto, kontrastvielas daudzumu tiek veikta datortomogrāfijas venogrāfija (DTV), lai diagnosticētu proksimālo dziļo vēnu trombozi (Kearon, 2012; Stein, 2012; Konstantinides, 2014). Taču DTV paaugstina uzņemto starojuma devu pacientam, tādēļ nav ieteicama, īpaši jaunām sievietēm. Tās vietā var izmantot vēnu kompresijas ultrasonogrāfiju. Paula Stradiņa Klīniskās universitātes slimnīcā 16 slāņu multidetektoru DTPA izmanto kopš 2006. gada, bet 64 slāņu – kopš 2008. gada (Mača, 2014).
Multidetektoru DTPA ļauj vizualizēt pat plaušu segmentālās un subsegmentālās artērijas. Tomēr pastāv pierādījumi, ka atrasta tikai subsegmentālo artēriju oklūzija nevar būt galvenais iemesls pacienta hospitalizācijai PATE dēļ, kā arī nav vajadzības šajā gadījumā uzsākt agresīvu ārstēšanu. Šādā situācijā būtu jāveic papildu vēnu kompresijas ultrasonogrāfija, lai novērtētu proksimālo vēnu trombozi. Veikti ir pētījumi par pacientiem, kuriem ar atrastu izolētu subsegmentālu plaušu artēriju trombemboliju tika uzsākta antikoagulantu terapija. Viņiem smagas asiņošanas risks bija 5,3 %, bet atkārtota venozā trombembolisma risks – tikai 0,7 %. Tātad ieguvums neattaisnoja risku (Jia, 2012; Kearon 2012; Stein, 2012; Konstantinides, 2014).
2012. gadā publicētā pētījumā par 579 akūtas PATE pacientiem secināts, ka hemodinamiski stabiliem pacientiem letalitātes risku paaugstina centrāla PATE (30 dienu mirstības sastopamība – 11,2 %), savukārt zems risks ir pacientiem ar perifēru PATE (5,7 %). Šajā pašā pētījumā secināts, ka visbiežāk sastop bilaterālu (77 %) un centrālu (60 %) PATE. Savukārt citos avotos secināts, ka visbiežāk embolus atrod bilaterāli segmentālās artērijās. Tas nav pretrunā ar iepriekšējā teikumā secināto, jo trombemboli segmentālās artērijās (tas liecina par perifēru PATE) var būt arī centrālas PATE gadījumā, ja iesaistīti lielākie plaušu asinsvadi (Jaff, 2011; Konstantinides, 2012; Sharifi, 2013).
Negatīva DTPA atrade ir pietiekams kritērijs, lai nediagnosticētu PATE pacientiem ar vidēju vai zemu klīnisko varbūtību (Agterof, 2003; Bamber, 2013; Mača, 2014).
Veicot DTPA, var arī noteikt labā kambara palielinājumu (beigu diastolisko diametru salīdzinājumā ar kreiso kambari), kas liecina par labā kambara disfunkciju. Tā prognostiskā vērtība tika pierādīta, veicot prospektīvu kohortas pētījumu 457 pacientiem (publicēts 2011. gadā). Nāve slimnīcā vai klīniskās ainas pasliktināšanās tika novērota 44 pacientiem ar un astoņiem pacientiem bez labā kambara disfunkcijas, kas noteikta DTPA. Izvēlētais kritērijs (labā un kreisā kambara dimensiju attiecība > 0,9) 92 % gadījumu korelēja ar ehokardiogrāfijā pierādītu labā kambara disfunkciju. Citā kohortas pētījumā, kurā tika iekļauti 777 pacienti (publicēts 2014. gadā), tika novērota vidēji ZRaksti / RSU 97 2015 stipra korelācija (Spīrmena rangu (Spearman rank) korelācijas koeficients 0,54, p < 0,001) starp šiem pašiem kritērijiem. Veikts arī pētījums (publicēts 2012. gadā), kurā noskaidrota prognostiskā precizitāte starp radiologu subjektīvi un objektīvi noteiktu labā kambara dilatāciju PATE pacientiem DTPA izmeklējuma laikā. Jutības ziņā nebija nozīmīgas atšķirības, taču specifiskums augstāks izrādījās subjektīvi noteiktajam izmēram. Rezultātā tika pierādīts, ka nav nepieciešami kompleksi RV / LV diametru attiecības mērījumi, lai paaugstinātu prognostisko vērtību izmeklējumam, bet pietiek ar subjektīvu pieredzējuša radiologa slēdzienu par sirds labās puses dilatāciju. DTPA noteikta labā kambara dilatācija ir saistīta ar paaugstinātu nelabvēlīga iznākuma risku. Tomēr, lai to precizētu, ir jānosaka arī miokarda bojājuma bioķīmiskie marķieri (Sanchez, 2008; Stein, 2012; Engelberger, 2014; Konstantinides, 2014).
DTPA var noteikt arī kustīgus trombus sirds labajā pusē, taču konstatētā apstiprināšanai ir nepieciešams pēc tam veikt arī ehokardiogrāfiju. Pētījumā (publicēts 2011. gadā) ar 340 PATE pacientiem noteikts, ka 3,5 % gadījumu bija kustīgi trombi sirdī, kas konstatēts DTPA un EHO, savukārt šo trombu izplatība augsta riska PATE pacientiem bija 22 %. Tiem pacientiem, kam tika noteikti trombi sirdī ar DTPA, šajā pašā izmeklējumā vienmēr konstatēja arī sirds labās puses dilatāciju, savukārt viltus pozitīvi noteiktu trombu gadījumā sirds dilatāciju nekonstatēja (p < 0,0001) (Douma, 2011; Coutance, 2011).
DTPA izmeklējuma laikā var noteikt arī citus sirds labās puses pārslodzes rādītājus, kas noder pacienta riska izvērtēšanai – kambaru starpsienas novietojumu un formu (D-forma), galvenās plaušu artērijas platumu, plaušu artērijas un aortas platumu attiecību, samazinātu kreisā priekškambara un plaušu vēnu diametru, kā arī kontrastvielas atpakaļplūsmu uz aknu vēnām vai apakšējo dobo vēnu (Sanchez, 2008; Stein, 2012; Engelberger, 2014; Konstantinides, 2014).
PIOPED II pētījumā konstatēts, ka multidetektoru DTPA izmeklējumā saņemtā starojuma deva pacientam ir 3,8 mSv. Citos pētījumos šī deva variē no 3–5 mSv, kas atbilst divu gadu fona radiācijas devai. Radiācija paaugstina vēža attīstības risku, taču izvērtējot riskus un ieguvumus, multidetektoru DTPA ir labākā metode PATE diagnozes precizēšanai. Turklāt DTPA izmeklējuma laikā var iegūt papildu informāciju, lai noraidītu (vai apstiprinātu) citas diferenciāldiagnozes – tas viss paaugstina šā izmeklējuma vērtīgumu un nepieciešamību. Sievietēm, kas jaunākas par 50 gadiem un kam ir normāla vai tikai nedaudz izmainīta plaušu rentgenogramma, DTPA vietā var veikt ventilācijas–perfūzijas scintigrāfiju, lai mazinātu starojuma devu (krūts vēža attīstības riska dēļ), taču šā izmeklējuma jutība ir zemāka (Van Es, 2013; Engelberger, 2014; Konstantinides, 2014).
DTPA ir kontrindicēta vairākos gadījumos – smagas nieru mazspējas, alerģijas pret jodu saturošo kontrastvielu, grūtniecības, hemodinamiski nestabiliem pacientiem kritiskā stāvoklī, kā arī smagas aptaukošanās gadījumā, ja pacientu nav iespējams ievietot aparātā vai pacienta svars pārsniedz pieļaujamo. Šādās situācijās var iztikt tikai ar ehokardiogrāfiju vai arī – veikt plaušu ventilācijas–perfūzijas scintigrāfiju un vēnu kompresijas ultrasonogrāfiju (Konstantinides, 2014).
Ehokardiogrāfija. Transtorakāla ehokardiogrāfija (TTE) primāri ir jāveic hemodinamiski nestabilam PATE pacientam ar hipotensiju vai šoku, lai apstiprinātu diagnozi un nekavējoties izvēlētos optimālo ārstēšanas stratēģiju. Akūta PATE rada labā kambara pārslodzi, spiediena paaugstināšanos tajā un disfunkciju, ko var noteikt, veicot ehokardiogrāfiju. Ja šīs izmaiņas nekonstatē, tad var noraidīt plaušu emboliju kā hemodinamikas nestabilitātes cēloni. Ehokardiogrāfijas laikā izvērtē labā kambara dilatāciju un disfunkciju – labā un kreisā kambara attiecību (RV / LV > 1); labā kambara brīvās sienas hipokinēziju, salīdzinot ar sirds galotnes kontraktilitāti (McConnell sign); kambaru starpsienas izvelvēšanos uz kreiso sirds pusi sistoles laikā (D-forma) un trikuspidālās regurgitācijas plūsmas ātrumu (> 2,7 m/s), kas liecina par plaušu hipertensiju; trikuspidālā vārstuļa gredzena plaknes sistolisko ekskursiju (TAPSE), kas PATE gadījumā bieži ir samazināta; trombus labajā sirds pusē; kā arī apakšējās dobās vēnas dilatāciju bez saplakšanas ieelpas laikā (saplok < 40 %). Labā kambara dilatāciju atrod vismaz 25 % PATE pacientu. Masīvas PATE gadījumā EHO šīs embolijas radītās sekundārās izmaiņas redzamas līdz pat 80 % pacientu. Nosakot labā kambara dilatāciju, disfunkciju un trikuspidālo regurgitāciju, TTE jutība ir apmēram 50 % un specifiskums 90 % PATE pacientu (Douma, 2011; Coutance, 2011; Konstantinides, 2012, 2014).
Negatīva EHO atrade neļauj noraidīt PATE diagnozi, jo jutība ir tikai 40–50 %. 2013. gadā publicētā pētījumā 30 PATE pacientiem, veicot EHO, tika noteikta jutība 50 % un specifiskums 98 %. Tas tika skaidrots ar to, ka šai nelielajai populācijai vidējais vecums bija tikai 49 gadi, tāpēc, iespējams, EHO nebija novērojama hroniskas obstruktīvas plaušu slimības ietekme uz sirdi (Klok, 2010; Kearon, 2012).
Ja papildus ir nepieciešams un iespējams, var veikt arī transezofageālu ehokardiogrāfiju (TEE), kuras laikā noteikt centrālu plaušu trombemboliju ar jutīgumu 70 %, bet kopsummā šā izmeklējuma jutīgums un specifiskums PATE gadījumā ir attiecīgi 59 % un 77 %. TTE izmeklējumā trombus labajā sirds pusē (parasti labajā priekškambarī) atrod < 5 % (citā avotā minēts, ka 4–18 %) PATE pacientu, bet, veicot TEE, centrālus trombus plaušu artērijās var noteikt līdz pat 70 % pacientu. Citā pētījumā (publicēts 2009. gadā) TEE jutība noteikta 92 % hemodinamiski nestabiliem pacientiem, kuriem ir augsta bilaterālo centrālo trombembolu izplatība. Kustīgi sirds labās puses trombi apstiprina diagnozi, un to atrade liecina par labā kambara disfunkciju un augstu agrīno mirstību. Tomēr EHO nav pirmās izvēles diagnostikas metode PATE pacientiem (hemodinamiski stabiliem slimniekiem, kuriem ir iespēja veikt citus izmeklējumus, piemēram, primāri – DTPA), ņemot vērā TTE zemo specifiskumu un TTE, kā arī TEE zemo jutību. Jebkurā gadījumā EHO var palīdzēt diferenciālās diagnostikas nolūkos, lai atrastu šoka cēloni, piemēram, nosakot perikarda tamponādi, akūtu vārstuļu disfunkciju, smagu kreisā kambara disfunkciju, miokarda infarktu vai aortas disekciju (Sanchez, 2008; Douma, 2011; Coutance, 2011; Konstantinides, 2012, 2014).
Lai noteiktu prognozi hemodinamiski stabilam, normotensīvam PATE pacientam, pēc DTPA arī ieteicams veikt ehokardiogrāfiju. Prognozes izvērtēšanā ietilpst labā kambara dilatācija (RVD1), palielināta labā un kreisā kambara diametra attiecība (RV / LV), brīvās labā kambara sienas hipokinēzija, palielināts trikuspidālās regurgitācijas plūsmas ātrums (VTR) un / vai samazināta trikuspidālā vārstuļa gredzena plaknes sistoliskā ekskursija (TAPSE). Meta analīzēs ir pierādīts, ka ehokardiogrāfijā noteikta labā kambara disfunkcija saistās ar palielinātu īstermiņa mirstību hemodinamiski stabiliem pacientiem. Analizējot 3283 hemodinamiski stabilu akūtas PATE pacientu datus (pētījums publicēts 2014. gadā), tika secināts, ka labā kambara disfunkcija, kas noteikta EHO izmeklējumā, paaugstina īstermiņa mirstības risku 2,29 reizes. Par paaugstinātu mirstības iespējamību liecina arī priekškambaru starpsienas šunts caur ovālo atveri (foramen ovale) un trombi sirds labajā pusē. Analizējot 411 normotensīvu akūtas PATE pacientu datus (pētījums publicēts 2014. gadā), tika noteikts, ka priekšroka labā kambara disfunkcijas noteikšanai un attiecīgi pacienta prognozei jādod TAPSE rādītājam, nevis RV / LV diametru attiecībai. TAPSE ≤ 15 mm saistīta ar palielinātu 30 dienu mirstības risku, savukārt TAPSE > 20 mm liecina par zemu risku (Coutance, 2011; Konstantinides, 2012, 2014).
Ehokardiogrāfijas izmeklējums, salīdzinot ar DTPA, ir lētāks un viegli īstenojams, to var veikt pie slimnieka gultas (svarīgi hemodinamiski nestabiliem pacientiem kritiskā stāvoklī), neinvazīvs, bez radiācijas un komplikācijām, kā arī šis izmeklējums var palīdzēt precizēt citas diferenciāldiagnozes. Ehokardiogrāfijas izmeklējuma veikšanai nav kontrindikāciju (Coutance, 2011; Konstantinides, 2012, 2014; Kucher, 2014).
Materiāls un metodes
Veikts retrospektīvs pētījums, apkopojot Paula Stradiņa Klīniskās universitātes slimnīcas medicīniskajā arhīvā pieejamās slimības vēstures par 190 Latvijas Kardioloģijas centra (32. un 27. nodaļas) pacientiem, kas ārstējušies ar diagnozi PATE no 2013. gada 1. janvāra līdz 2014. gada 31. oktobrim. No slimības vēsturēm iegūta informācija par datortomogrāfijas plaušu angiogrāfijas (DTPA) un transtorakālās ehokardiogrāfijas (TTE) izmeklējumiem.
Veicot pētījumu, tika atsevišķi izdalītas un pēc tam savstarpēji salīdzinātas sieviešu un vīriešu grupas. Pētījumā iekļautas 126 sievietes un 64 vīrieši. Abi attēldiagnostikas izmeklējumi veikti 85 sievietēm un 50 vīriešiem, tikai DTPA veikta 33 sievietēm un 13 vīriešiem, bet tikai TTE – astoņām sievietēm un vienam vīrietim.
Pēc DTPA izrakstiem tika analizēti ar trombiem nosprostotie plaušu artēriju zari, oklūzijas lokalizācija (abpusēja vai vienpusēja); tika noteikts, vai PATE ir masīva, centrāla vai perifēra; kā arī –, vai ir aprakstīta sirds labās puses dilatācija. DTPA tika veikta kā pirmās izvēles izmeklējums (no attēldiagnostikas metodēm) pirmajā stacionēšanas dienā 87,3 % (103) sieviešu un 88,9 % (56) vīriešu.
Pēc ehokardiogrāfijas protokoliem tika analizēti šādi dati: RAA, RVD1, LKSS, LAVI, LVMI, EF Simpson, MR, TR un TAPSE. Pirmo trīs dienu laikā ehokardiogrāfija tika veikta 54,2 % (78) pacientu, bet pirmās nedēļas laikā kopš stacionēšanas – 86,1 % (124) pacientu. Ehokardiogrāfijas skrīnings pirmajā stacionēšanas dienā tika veikts 21,5 % (31) pacientu (24,7 % (23) sieviešu un 15,7 % (8) vīriešu).
Dati tika analizēti, izmantojot MS Excel un IBM SPSS Statistics 22.0 programmu. Vidējie rādītāji atspoguļoti kā mediāna (I; III kvartīle) neparametriskiem rādītājiem vai kā vidējais aritmētiskais (± standartdeviācija) rādītājiem normālsadalījumā, savukārt pazīmju sastopamība – procentuāli (n – absolūtos skaitļos). Rādītāji normālsadalījumā – RAA, RVD1, LVMI, bet neparametriskie rādītāji – LAVI, EF Simpson, LKSS un TAPSE. Neparametriskiem rādītājiem izmantots Manna–Vitnija (Mann–Whitney) tests ar starpkvartīļu izkliedi. Pētījumā par statistiski ticamu uzskatāma vērtība p < 0,05.
Apstiprinājums pētījuma veikšanai iegūts no RSU Ētikas komitejas.
Rezultāti
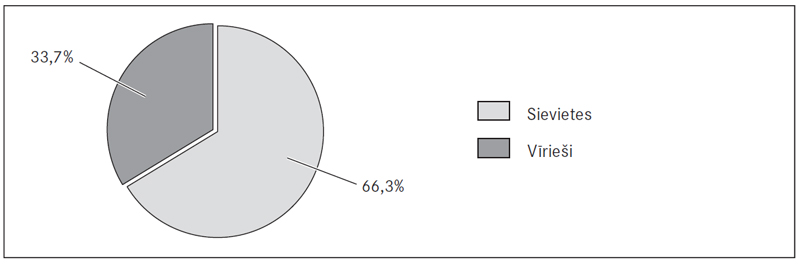
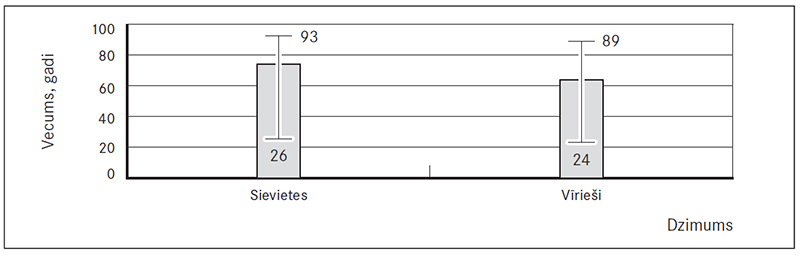
Starp pētījumā iekļautajiem 190 plaušu artērijas trombembolijas pacientiem (PATE) 66,3 % (126) bija sievietes un 33,7 % (64) – vīrieši (sk. 1. att.). Vidējais šo pacientu vecums bija 74 (26; 93) gadi sievietēm un 64 (24; 89) gadi vīriešiem (šie dati neatbilst normālsadalījumam, tādēļ izmantots Manna–Vitnija tests) (sk. 2. att.).
1. attēls. Pētījuma dalībnieku iedalījums pēc dzimuma / Patients by gender (%)
2. attēls. Pētījuma dalībnieku vecumu sadalījums / Age of the patients (years)
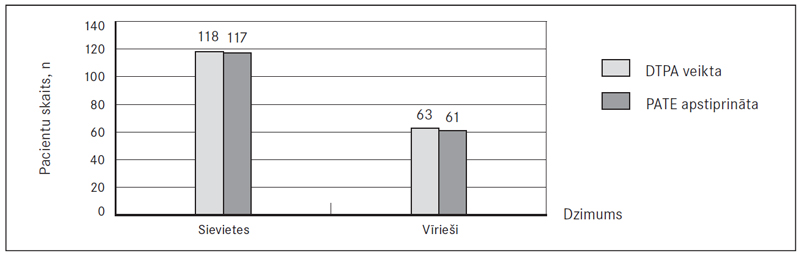
Datortomogrāfijas plaušu angiogrāfijas rezultāti. Datortomogrāfijas plaušu angiogrāfija (DTPA) tika veikta 93,7 % (118) sieviešu, no kurām PATE diagnoze apstiprināta 99,2 % (117), un 98,4 % (63) vīriešu, no kuriem PATE apstiprināta 96,8 % (61) gadījumu (sk. 3. att.). Kopsummā DTPA jutība ir ļoti augsta – 98,3 %.
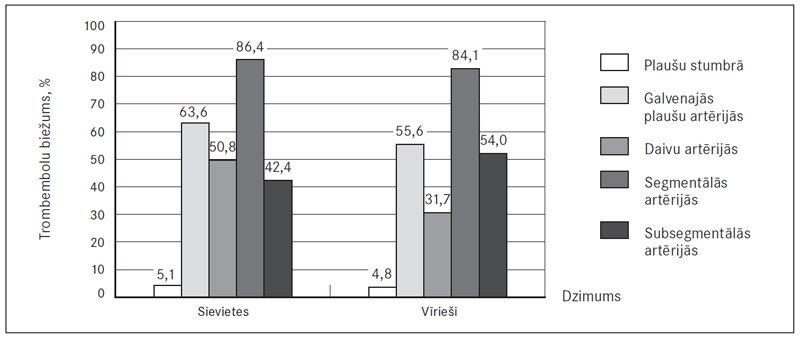
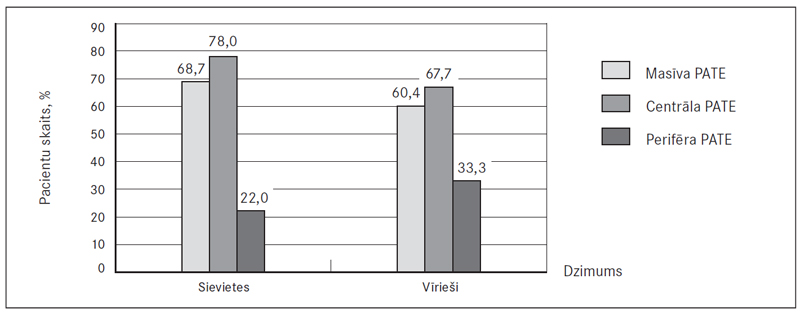
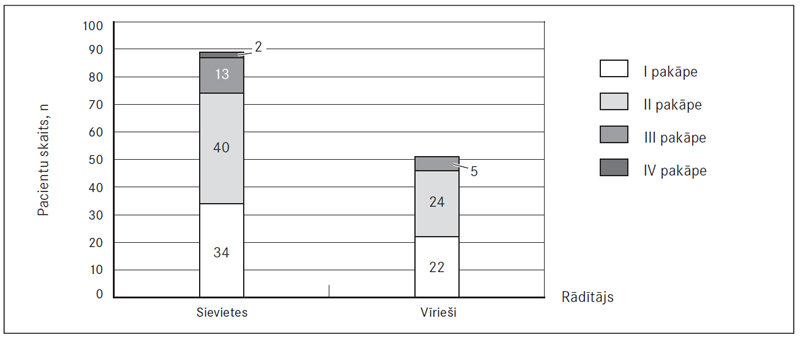
Pildījuma defekti plaušu stumbrā novēroti 5,1 % (sešām) sieviešu un 4,8 % (trim) vīriešu, galvenajās plaušu artērijās – 63,6 % (75) sieviešu un 55,6 % (35) vīriešu, daivu artērijās – 50,8 % (60) un 31,7 % (20), segmentālās – 86,4 % (102) un 84,1 % (53), subsegmentālās – 42,4 % (50) un 54,0 % (34) (sk. 4. att.). Attiecīgi masīva PATE novērojama 68,7 % (81) sieviešu un 60,4 % (38) vīriešu (izvērtējot tikai plaušu asinsvadu oklūzijas vietas, ne klīnisko ainu). Centrāla PATE vērojama 78,0 % (92) sieviešu un 66,7 % (42) vīriešu, bet perifēra PATE – attiecīgi 22,0 % (26) un 33,3 % (21) (sk. 5. att.).
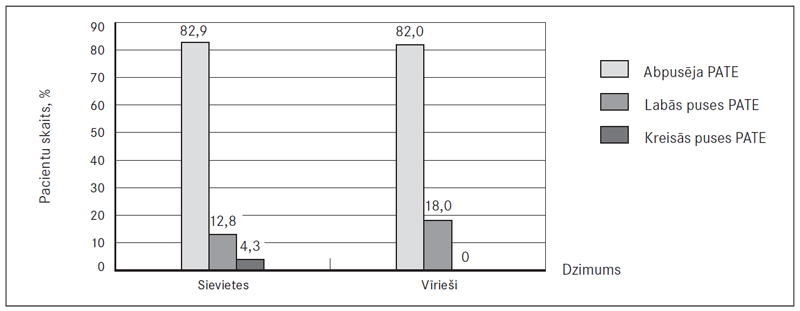
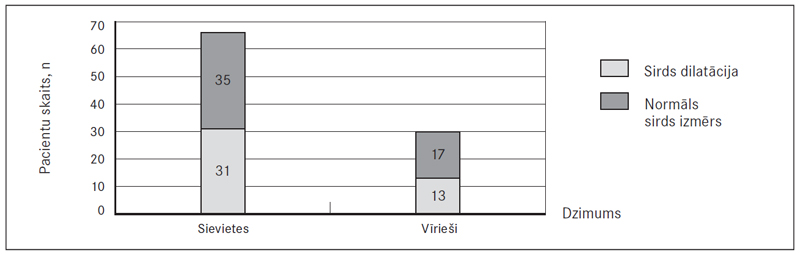
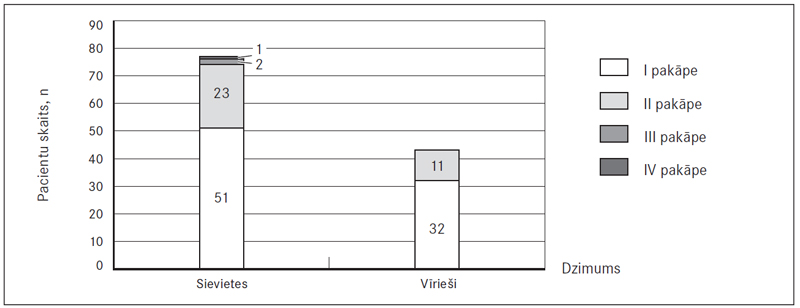
Visbiežāk novērota abpusēja PATE – 82,9 % (97) sieviešu un 82,0 % (50) vīriešu, savukārt labās puses PATE – attiecīgi 12,8 % (15) un 18,0 % (11), bet kreisās puses – 4,3 % (piecām) un 0 % (sk. 6. att.). Veicot DTPA, sirds izmēri ne vienmēr tika aprakstīti, bet no pieminētajiem gadījumiem (52,4 % (66) sieviešu un 46,9 % (30) vīriešu) labās puses sirds dilatācija konstatēta 47,0 % (31) sieviešu un 43,3 % (13) vīriešu (sk. 7. att.).
DTPA ir zelta standarts PATE diagnostikā (jutība 98,3 %), tomēr ir situācijas, ka to veikt nav iespējams (hemodinamiski nestabils pacients, smaga nieru mazspēja, alerģija pret jodu saturošo kontrastvielu, izteikta adipozitāte). Veicot DTPA, visbiežāk pildījuma defekti tiek novēroti abpusēji segmentālajās artērijās, kā arī galvenajās plaušu artērijās, taču sirds dilatācija aprakstīta retāk nekā 50 % gadījumu. Visbiežāk tiek konstatēta masīva un centrāla PATE.
3. attēls. Pacienti, kam veikta DTPA un apstiprināta PATE / Number of pulmonary CTA performed and PATE confirmed
DTPA – datortomogrāfijas plaušu angiogrāfija.
4. attēls. Pildījuma defektu (trombembolu) biežums plaušu artērijās / Affected arteries
5. attēls. PATE klasifikācija un sastopamības biežums / Classification and occurrence of pulmonary embolism
6. attēls. PATE lokalizācijas (abpusējas, labās vai kreisās puses) biežums / PATE localisations
7. attēls. Datortomogrāfijas plaušu angiogrāfijā noteiktais sirds dilatācijas biežums / Heart dilatation confirmed by computerised tomographic pulmonary angiography
Ehokardiogrāfijas rezultāti. Transtorakālā ehokardiogrāfija veikta 73,8 % (93) sieviešu un 81,0 % (51) vīriešu.
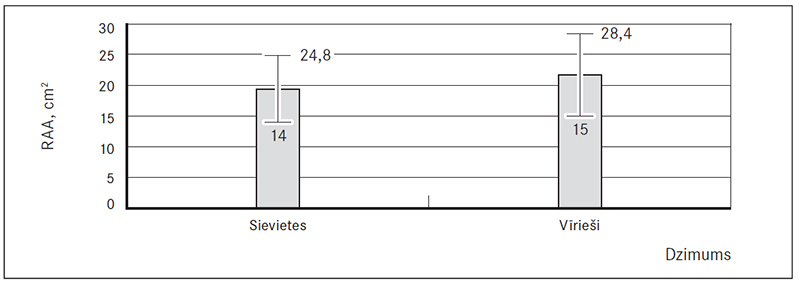
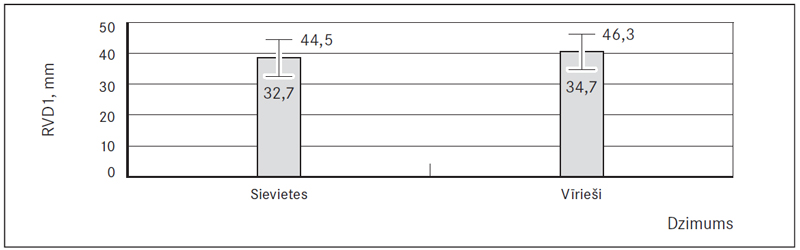
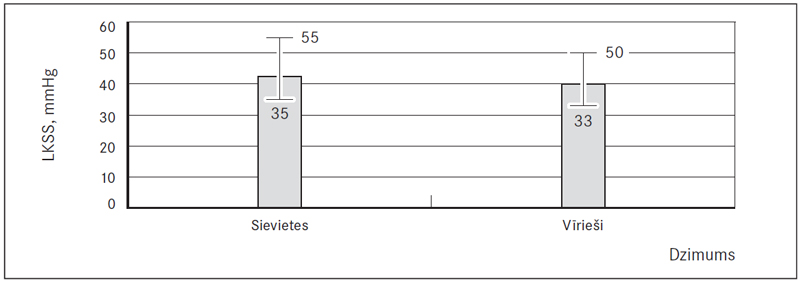
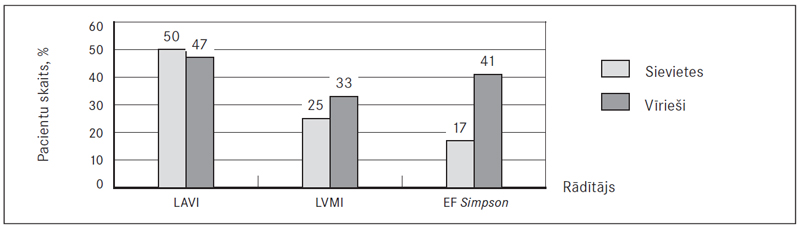
Labā priekškambara laukums (RAA) virs normas tika konstatēts abu dzimumu pacientiem (58,7 % jeb 81), taču statistiski ticami augstāks tas bija vīriešiem 21,7 (± 6,7) cm2 nekā sievietēm 19,4 (± 5,4) cm2 (p = 0,029) (sk. 8., 11. att.). Savukārt labā kambara bazālais diametrs (RVD1) abiem dzimumiem atbilda normai – 38,6 (± 5,9) mm sievietēm un 40,5 (± 5,8) mm vīriešiem, bet paaugstināts šis rādītājs (RVD1 > 42 mm) bija 33,1 % (45) pacientu (sk. 9., 11. att.). Labā kambara sistoliskais spiediens (LKSS) bija paaugstināts abiem dzimumiem (76,3 % jeb 103) – sievietēm 42,5 (35; 55) mm Hg un vīriešiem 40,0 (33; 50) mm Hg (sk. 10., 11. att.).
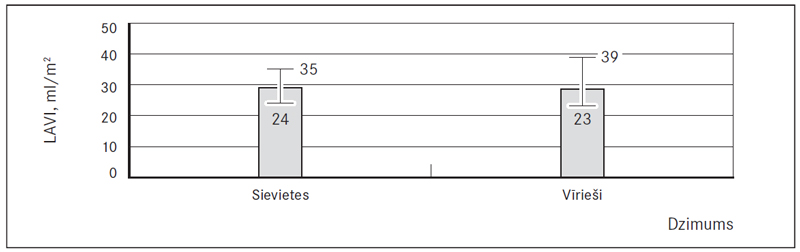
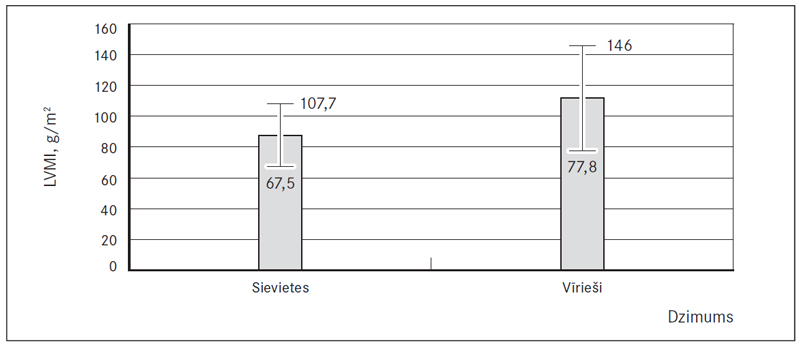
Kreisā priekškambara tilpuma indekss (LAVI) abu dzimumu pacientiem bija paaugstināts (48,8 % jeb 61) – 29,0 (24; 35) ml/m2 sievietēm un 28,5 (23; 39) ml/m2 vīriešiem (sk. 12., 15. att.). Kreisā kambara masas indekss (LVMI) abiem dzimumiem atbilda normai, attiecīgi 87,6 (± 20,1) g/m2 un 111,9 (± 34,1) g/m2, bet paaugstināts šis rādītājs bija 25 % (11) sieviešu (LVMI > 95 g/m2) un 33,3 % (10) vīriešu (LVMI > 115 g/m2) (sk. 13., 15. att.). Izsviedes frakcija (EF Simpson) vīriešiem atradās pie normas apakšējās robežas, vidēji 55,0 % (45; 60) (samazināta 41,2 % jeb 21 vīrietim) un bija statistiski ticama atšķirība (p = 0,009) no sievietēm, kurām izsviedes frakcija atbilda normai 60,0 % (55; 60) (samazināta tikai 17,4 % jeb 16 sievietēm) (sk. 14., 15. att.).
8. attēls. Labā priekškambara laukums (RAA), cm2 / Right atrium area (RAA), cm2
9. attēls. Labā kambara bazālais diametrs (RVD1), mm / Right ventricular basal diameter (RVD1), mm
10. attēls. Labā kambara sistoliskais spiediens (LKSS), mm Hg / Right ventricular systolic pressure (RVSP), mm Hg
11. attēls. Paaugstinātu rādītāju (RAA, RVD1, KSS) biežums PATE slimniekiem / Change in echocardiography findings (RAA, RVD1, RVSP) patient with PATE
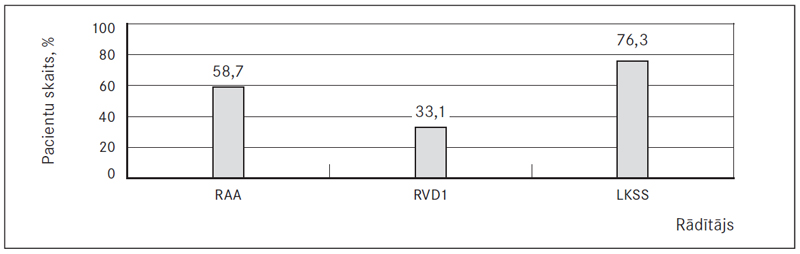
RAA – labā priekškambara laukums / right atrium area, RVD1 – labā kambara bazālais diametrs / right ventricular basal diameter, LKSS – labā kambara sistoliskais spiediens / right ventricular systolic pressure.
12. attēls. Kreisā priekškambara tilpuma indekss (LAVI), ml/m2 / Left atrium volume index (LAVI), ml/m2
13. attēls. Kreisā kambara masas indekss (LVMI), g/m2 / Left ventricular mass index (LVMI), g/m2
Trikuspidālā regurgitācija (TR) sastopama 95,7 % (89) sieviešu un 100 % (51) vīriešu. Visbiežāk PATE pacientiem bija 2. pakāpes TR – 44,9 % (40) un 47,1 % (24), bet arī 1. pakāpes TR bija bieži – 38,2 % (34) un 43,1 % (22), savukārt 4. pakāpes TR sastop ļoti reti – 2,2 % (divām) un 0 % (sk. 16. att.). Mitrālā regurgitācija (MR) sastopama attiecīgi 82,8 % (77) un 84,3 % (43). Visbiežāk bija 1. pakāpes MR – 66,2 % (51) un 74,4 % (32), salīdzinoši retāk – 2. pakāpes MR – 29,9 % (23) un 25,6 % (11), bet 3. un 4. pakāpe bija < 2,5 % pacientu (sk. 17. att.).
Trikuspidālā vārstuļa gredzena plaknes sistoliskā ekskursija (TAPSE) abiem dzimumiem atbilda normai – 18 (16; 20) mm sievietēm un 17 (15; 21) mm vīriešiem, bet samazināts šis rādītājs (TAPSE ≤ 16 mm) bija 32,9 % (23) sieviešu un 38,1 % (16) vīriešu.
14. attēls. Izsviedes frakcija (EF Simpson), % / Ejection fraction, EF

15. attēls. Paaugstinātu rādītāju (LAVI, LVMI, EF Simpson) biežums PATE slimniekiem / Change in echocardiography findings (LAVI, LVMI, EF) patient with PATE
LAVI – kreisā priekškambara tilpuma indekss / left atrium volume index, LVMI – kreisā kambara masas indekss / left ventricular mass index, EF Simpson – izsviedes frakcija / ejection fraction.
16. attēls. Trikuspidālās regurgitācijas sastopamība PATE slimniekiem / Tricuspid valve regurgitation incidence in patient with PATE
Veidojot korelācijas starp ehokardiogrāfijas rādītājiem, varēja pamanīt tieši proporcionālu, stipru korelāciju (Spīrmena rangu (Spearman’s rank) korelācijas koeficients 0,794) starp RAA un RVD1, kas ir loģiski skaidrojams ar labā kambara un labā priekškambara ciešo saistību – attiecīgi vienam palielinoties izmēros, arī otra izmēri palielinās. Savukārt vidēji stipras korelācijas (0,4–0,6) vērojamas starp vairākiem ehokardiogrāfijā noteiktajiem dažādiem rādītājiem (sk. 1. tab.). Līdzīgi kā iepriekš par sirds labo pusi ir skaidrojama arī korelācija starp LAVI un LVMI sirds kreisajā pusē. Saprotama korelācija ir starp LKSS un RAA / RVD1 / TR, jo, palielinoties labā kambara sistoliskajam spiedienam, attiecīgi veidojas sirds labās puses dilatācija, kas savukārt tālāk rada trikuspidālo regurgitāciju (LKSS un TR korelācijas koeficients ir uz robežas starp vidēji stipru un stipru korelāciju). MR korelācija ar LAVI ir skaidrojama ar kreisā priekškambara dilatācijas ietekmi uz atrioventrikulāro plakni un attiecīgi uz mitrālo vārstuli, radot regurgitāciju. Pastāv apgriezti proporcionāla, vidēji stipra korelācija starp EF Simpson un LVMI, kas būtu skaidrojams ar to, ka, palielinoties kreisā kambara masas indeksam (kas norāda uz dilatāciju / disfunkciju), attiecīgi samazinās kreisā kambara izsviedes frakcija. Līdzīga korelācija ir arī starp EF Simpson un RAA / RVD1, ko varētu skaidrot ar samazinātu kreisā kambara pirmsslodzi, kam seko samazināta izsviedes frakcija situācijā, kad ir sirds labās puses dilatācija.
Ehokardiogrāfijas jutība šajā pētījumā bija 76,3 %. Jutība noteikta, izmantojot LKSS, paaugstināts LKSS (norma ≤ 30 mm Hg) tika pieņemts kā norāde par labā kambara disfunkciju. Ja vadās pēc RAA, tad EHO jutība ir 58,7 %, ja pēc RVD1, tad – 33,1 %, ja pēc TAPSE, tad – 34,8 %. Vidēji, ņemot vērā visus šos rādītājus, EHO jutība ir 50,7 %, kas sakrīt arī ar citos zinātniskās literatūras avotos un pētījumos minēto izmeklējuma jutību.
17. attēls. Mitrālās regurgitācijas sastopamība PATE slimniekiem / Mitral valve regurgitation incidence in patients with PATE
1. tabula. Spīrmena rangu korelācijas koeficienti starp ehokardiogrāfijas rādītājiem / Spearman’s rank correlation coeficient in echocardiography findings
| RAA | RVD1 | LAVI | LVMI | LKSS | EF Simpson | |
|---|---|---|---|---|---|---|
| RAA | — | 0,794 | 0,458 | 0,459 | 0,478 | –0,505 |
| RVD1 | 0,794 | — | 0,273 | 0,335 | 0,556 | –0,428 |
| LAVI | 0,458 | 0,273 | — | 0,482 | 0,186 | –0,325 |
| LVMI | 0,459 | 0,335 | 0,482 | — | 0,007 | –0,455 |
| MR | 0,279 | 0,185 | 0,546 | 0,237 | 0,169 | –0,344 |
| TR | 0,506 | 0,433 | 0,179 | 0,208 | 0,599 | –0,258 |
RAA – labā priekškambara laukums / right atrium area, RVD1 – labā kambara bazālais diametrs / right ventricular basal diameter, LAVI – kreisā priekškambara tilpuma indekss / left atrium volume index, LVMI – kreisā kambara masas indekss / left ventricular mass index, LKSS – labā kambara sistoliskais spiediens / right ventricular systolic pressure, EF Simpson – izsviedes frakcija / ejection fraction, MR – mitrālā regurgitācija / mitral valve regurgitation, TR – trikuspidālā regurgitācija / tricuspidal valve regurgitation.
Abu attēldiagnostikas metožu informativitātes salīdzinājums. DTPA gadījumā tiek pierādītas tiešas izmaiņas plaušu artērijās, redz konkrētās oklūzijas vietas, kā arī nereti var noteikt sirds labās puses dilatāciju. Transtorakālās ehokardiogrāfijas gadījumā redzami netieši norādījumi par PATE, precīzāk, – sirds labās puses akūta mazspēja, uz ko norāda RAA, RVD1 un LKSS palielināšanās, TAPSE samazināšanās, trikuspidālā regurgitācija, kā arī retos gadījumos var redzēt kustīgus trombus sirds labajā pusē.
Var novērot statistiski ticamu (p = 0,011) korelāciju starp ehokardiogrāfijā noteiktu palielinātu labā priekškambara laukumu (RAA) un DTPA noteiktu labās puses sirds dilatāciju.
Diskusija
Šajā pētījumā vidējais PATE pacientu vecums bija 74 gadi sievietēm un 64 gadi vīriešiem, kā arī šī slimība biežāk sastopama sievietēm nekā vīriešiem (2:1). Vidējie vecuma rādītāji sakrīt ar citos pētījumos pieejamiem datiem (61–79 gadi), taču atšķiras dzimumu sadalījums, jo literatūras avotos aprakstīts, ka PATE sastopama vienlīdz bieži kā sievietēm, tā vīriešiem. Iespējams, atšķirību varētu skaidrot ar to, ka Latvijā ir lielāks sieviešu īpatsvars (1,7 reizes vairāk) šajā vecuma grupā, kurā PATE ir biežāk sastopama (2013. gada dati – vecuma grupā 60–79 gadi sievietes ir 256 964, vīrieši – 152 013).
Multidetektoru DTPA jutība šajā pētījumā bija 98,3 %, kas ir krietni augstāka, salīdzinot ar 2006. gadā veikto prospektīvo pētījumu PIOPED II, kurā noteiktā jutība bija 83%. Tas varētu būt skaidrojams ar to, ka, iespējams, izvērtējot DTPA izmeklējuma laikā iegūtos attēlus, tika ņemta vērā arī pacienta PATE klīniskā varbūtība (pēc Velsa rādītājiem). Attiecīgi PIOPED II pētījumā tas arī tika norādīts kā ieteicamais izvērtējums, lai paaugstinātu izmeklējuma jutību (92–96 %).
Šajā pētījumā secināts, ka visbiežāk sastop bilaterālu (82,6 %), centrālu (75,3 %) un masīvu (66,9 %) PATE. Šie rādītāji ir nedaudz augstāki, salīdzinot ar citos pētījumos pieejamiem datiem – bilaterāla (77 %) un centrāla (60 %) PATE.
Labā kambara dilatācija DTPA izmeklējuma laikā noteikta 45,8 % PATE pacientu, kas ir krietni vairāk nekā aprakstīts literatūras avotos, kur minēts, ka RV dilatācija sastopama vismaz 25 % pacientu. DTPA izrakstos sirds labās puses dilatācija tika vien pieminēta, bez konkrētas RV / LV diametru attiecības, no kā varētu secināt, ka radiologs šo attiecību nemaz nav noteicis un, tikai balstoties uz savu subjektīvo viedokli, aprakstījis sirds dilatāciju. Taču, kā minēts 2012. gadā veiktā pētījumā, subjektīvi aprakstīta sirds dilatācija ir pat ar labāku prognostisko vērtību.
TTE jutība šajā pētījumā bija 76,3 %, nosakot pēc LKSS paaugstinājuma, bet, ņemot vērā arī citus sirds labās puses dilatācijas un disfunkcijas rādītājus (RAA, RVD1, TAPSE), jutība bija 50,7 %, kas atbilst arī zinātniskajā literatūrā aprakstītajai jutībai (50 %).
Lai izvērtētu labā kambara disfunkciju, ir jānosaka arī labā kambara brīvās sienas hipokinēzija, salīdzinot ar sirds galotnes kontraktilitāti (McConnell sign), kambaru starpsienas izvelvēšanos uz sirds kreiso pusi sistoles laikā, palielinātu trikuspidālās regurgitācijas plūsmas ātrumu, kā arī apakšējās dobās vēnas dilatāciju bez saplakšanas ieelpas laikā. Taču šos rādītājus šajā pētījumā nebija iespējams izvērtēt, jo ehokardiogrāfijas protokolos netika aprakstīti vai arī tika noteikti atsevišķos gadījumos, mazam pacientu skaitam.
Lai gan ir pierādīta stipra korelācija starp RAA un RVD1, statistiski ticama korelācija pastāv tikai starp EHO noteiktu palielinātu RAA un DTPA noteiktu sirds labās puses dilatāciju. Tas varētu būt skaidrojams ar to, ka RAA paaugstinājums PATE pacientiem šajā pētījumā bija sastopams biežāk (58,7 %) nekā RVD1 paaugstinājums (33,1 %).
Secinājumi
- Datortomogrāfijas plaušu angiogrāfija ir zelta standarts plaušu artērijas trombembolijas diagnostikā (jutība 98,3 %), tomēr ir situācijas, ka to veikt nav iespējams. Šādos gadījumos var veikt citus izmeklējumus, to skaitā ehokardiogrāfiju, kuras jutība ir 50,7–76,3 %.
- Transtorakāla ehokardiogrāfija ir primāri jāveic hemodinamiski nestabilam PATE pacientam ar hipotensiju vai šoku, lai apstiprinātu diagnozi un nekavējoties izvēlētos optimālo ārstēšanas stratēģiju.
- Izmeklējumu informativitāte atšķiras: DTPA gadījumā tiek pierādītas tiešas izmaiņas plaušu artērijās, kā arī var noteikt sirds dilatāciju, bet ehokardiogrāfijas gadījumā – netieši norādījumi par PATE, precīzāk, – sirds labās puses akūta mazspēja.
- Var novērot statistiski ticamu korelāciju starp TTE noteiktu palielinātu labā priekškambara laukumu (RAA) un DTPA noteiktu sirds labās puses dilatāciju.
- Veicot DTPA, visbiežāk pildījuma defektus gan sievietēm, gan vīriešiem atrod abpusēji segmentālās artērijās, kā arī galvenajās plaušu artērijās, taču sirds dilatāciju konstatē < 50 % gadījumu.
- Masīva PATE novērojama 68,7 % sieviešu un 60,4 % vīriešu, bet centrāla PATE vērojama 78,0 % sieviešu un 66,7 % vīriešu.
- Ehokardiogrāfijas datos labā priekškambara laukums (RAA) ir virs normas abiem dzimumiem (58,7 %), bet labā kambara bazālais diametrs (RVD1) nav palielināts (lai gan 33,1 % pacientu tas ir virs normas). Savukārt labā kambara sistoliskais spiediens (LKSS) ir paaugstināts abu dzimumu (76,3 %) pacientiem, sievietēm vidēji 42,5 un vīriešiem 40,0 mm Hg.
- Gandrīz katram pacientam novēro trikuspidālo regurgitāciju (visbiežāk 2. pakāpes), kā arī bieži – mitrālo regurgitāciju (visbiežāk 1. pakāpes).
- Datortomogrāfijas plaušu angiogrāfijai ir kontrindikācijas – hemodinamiski nestabils pacients kritiskā stāvoklī, smaga nieru mazspēja, alerģija pret jodu saturošu kontrastvielu, grūtniecība, izteikta adipozitāte. Ehokardiogrāfijas izmeklējumam savukārt kontrindikāciju nav.
- Diagnostisko izmeklējumu izvēli nosaka vairāki faktori – klīniskā PATE varbūtība, pacienta veselības stāvoklis, radiācijas izvērtējums, izmeklējumu pieejamība un izmaksas.
Abstract
Comparison of Informative Values on Different Imaging Methods in Diagnostic of Pulmonary Embolism
Pulmonary embolism (PE) is a cardiovascular pathology which is one of the main causes of mortality and hospitalisation in Europe, so it is important to diagnose it in time and to start the appropriate treatment. The diagnosis is confirmed by different imaging techniques from which most frequently computerised tomographic pulmonary angiography (CTPA) and/or echocardiography (ECHO) are used.
The aim of the study was to clarify the sensitivity of imaging techniques (CTPA and ECHO) for diagnosing PE and to compare them informatively.
The information was collected from medical archive of Pauls Stradins Clinical University Hospital. The study included 190 patients of Latvian Cardiology Centre who were treated with the diagnosis of PE from 01.01.2013 to 31.10.2014.
From 190 patients, 66.3 % (126) were women and 33.7 % (64) – men. CTPA was performed in 93.7 % (118) of women, with PE diagnosis confirmed in 99.2 % (117), and 98.4 % (63) of men, with PE confirmed in 96.8 % (61). In the main pulmonary arteries filling defects were observed in 63.6 % (75) of women and 55.6 % (35) of men, in lobe arteries – 50.8 % (60) and 31.7 % (20), in segmental – 86.4 % (102) and 84.1 % (53). Bilateral PE was found in 82.9 % (97) of women and 82.0 % (50) of men, massive – 68.7 % (81) and 60.4 % (38), central – 78.0 % (92) and 66.7 % (42). Right heart dilation in CTPA was detected in 47.0 % (31) and 43.3 % (13).
ECHO was performed in 73.0 % (93) of women and 81.0 % (51) of men. Right atrial area (RAA) was above the norm – statistically significantly higher in men 21.7 (± 6.7) than in women 19.4 (± 5.4) cm2 (p = 0.029). Right ventricular systolic pressure (RVSP) was increased in 76.3 % (103) of both genders – women 42.5 (35; 55), men 40.0 (33; 50) mm Hg. Left atrial volume index (LAVI) was also increased – 29.0 (24; 35) vs. 28.5 (23; 39) ml/m2. Ejection fraction (EF Simpson) in men was on the lower limit – 55.0 % (45; 60) (reduced in 41.2 % (21) of men) with a statistically significant difference (p = 0.009) compared to women 60.0 % (55; 60) (reduced only in 17.4 % (16) of women). Tricuspid regurgitation (TR) occurred in 96.7 % (89) of women and 100 % (51) of men (mostly grade 2).
CTPA is the gold standard for diagnosing PE (sensitivity 98.3 %); however, there are situations when it is contraindicated (hemodynamically unstable patient, severe renal failure, etc.). In those cases echocardiography can be performed (sensitivity 50.7–76.3 %). Most frequently CTPA filling defects are observed bilaterally in segmental arteries. There is a statistically significant correlation between the increased RAA (determined in ECHO) and the right heart dilatation described in CTPA.
Literatūra
1. Mača A. Plaušu artērijas trombembolija // Latvijas Ārsts, 2014. okt.; 22.–28. lpp.
2. Agterof M. J., Schutgens R. E., Snijder R. J., et al. Out of hospital treatment of acute pulmonary embolism in patients with a low NT-proBNP level // J Thromb Haemost, 2010; 8: 1235–1241.
3. Anderson F. A. Jr., Spencer F. A. Risk factors for venous thromboembolism // Circulation 2003; 107 (23 Suppl 1): 9–16.
4. Aujesky D., Roy P. M., Verschuren F., et al. Outpatient versus inpatient treatment for patients with acute pulmonary embolism: an international, open-label, randomised, non-inferiority trial // Lancet, 2011; 378: 41–48.
5. Bamber L., Wang M. Y., Prins M. H., et al. Patient-reported treatment satisfaction with oral rivaroxaban versus standard therapy in the treatment of acute symptomatic deep-vein thrombosis // Thromb Haemost, 2013; 110: 732–741.
6. Becattini C., Agnelli G., Vedovati M. C., et al. Multidetector computed tomography for acute pulmonary embolism: diagnosis and risk stratification in a single test // Eur Heart J, 2011; 32: 1657–1663.
7. Becattini C., Casazza F., Forgione C., et al. Acute pulmonary embolism: external validation of an integrated risk stratification model // Chest, 2013; 144: 1539–1545.
8. Bova C., Sanchez O., Prandoni P., et al. Identification of intermediate-risk patients with acute symptomatic pulmonary embolism // Eur Respir J, 2014. [Epub ahead of print].
9. Carrier M., Righini M., Wells P. S., et al. Subsegmental pulmonary embolism diagnosed by computed tomography: incidence and clinical implications. A systematic review and meta-analysis of the management outcome studies // J Thromb Haemost, 2010; 8: 1716–1722.
10. Cohen A. T., Agnelli G., Anderson F. A., et al. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality // Thromb Haemost, 2007; 98: 756–764.
11. Coutance G., Cauderlier E., Ehtisham J., et al. The prognostic value of markers of right ventricular dysfunction in pulmonary embolism: a meta-analysis // Crit Care, 2011; 15: R103.
12. Dellas C., Tschepe M., Seeber V., et al. A novel H-FABP assay and a fast prognostic score for risk assessment of normotensive pulmonary embolism // Thromb Haemost, 2014; 111: 996–1003.
13. Douma R. A., Mos I. C., Erkens P. M., et al. Performance of 4 clinical decision rules in the diagnostic management of acute pulmonary embolism: a prospective cohort study // Ann Intern Med, 2011; 154: 709–718.
14. Farrell C., Jones M., Girvin F., et al. Unsuspected pulmonary embolism identified using multidetector computed tomography in hospital outpatients // Clin Radiol, 2010; 65: 1–5.
15. Gibson N. S., Sohne M., Kruip M. J., et al. Further validation and simplification of the Wells clinical decision rule in pulmonary embolism // Thromb Haemost, 2008; 99: 229–234.
16. Engelberger R. P., Kucher N. Ultrasound-assisted thrombolysis for acute pulmonary embolism: a systematic review // Eur Heart J, 2014; 35: 758–764.
17. Heit J. A. The epidemiology of venous thromboembolism in the community // Arterioscler Thromb Vasc Biol, 2008; 28: 370–372.
18. Jaff M. R., McMurtry M. S., Archer S. L., et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association // Circulation, 2011; 123: 1788–1830.
19. Jia C. F., Li Y. X., Yang Z. Q., Zhang Z. H. Prospective evaluation of unsuspected pulmonary embolism on coronary computed tomographic angiography // J Comput Assist Tomogr, 2012; 36: 187–190.
20. Jimenez D., Kopecna D., Tapson V., et al. On Behalf Of The Protect Investigators. Derivation and validation of multimarker prognostication for normotensive patients with acute symptomatic pulmonary embolism // Am J Respir Crit Care Med, 2014; 189: 718–726.
21. Kearon C., Akl E. A., Comerota A. J., et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines // Chest, 2012; 141 (2 Suppl): e 419–e 494 S.
22. Klok F. A., van Kralingen K. W., van Dijk A. P., et al. Prospective cardiopulmonary screening program to detect chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism // Haematologica, 2010; 95: 970–975.
23. Konstantinides S., Goldhaber S. Z. Pulmonary embolism: risk assessment and management // Eur Heart J, 2012; 33: 3014–3022.
24. Konstantinides S., Torbicki A., Agnelli G., et al. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. The task force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC), endorsed by the European Respiratory Society (ERS) // Eur Heart J, 2014; doi: 10.1093/ eurheartj/ehu283 (sk. 22.02.2015.).
25. Konstantinides S., Torbicki A. Management of venous thrombo–embolism: an update // Eur Heart J, 2014; doi: 10.1093/eurheartj/ehu243 (sk. 22.02.2015.).
26. Kucher N., Boekstegers P., Muller O. J., et al. Randomized, controlled trial of ultrasound–assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism // Circulation, 2014; 129: 479–486.
27. Lang I. M., Pesavento R., Bonderman D., Yuan J. X. Risk factors and basic mechanisms of chronic thromboembolic pulmonary hypertension: a current understanding // Eur Respir J, 2013; 41: 462–468.
28. Lankeit M., Jimenez D., Kostrubiec M., et al. Predictive value of the high-sensitivity troponin T assay and the simplified pulmonary embolism severity index in hemodynamically stable patients with acute pulmonary embolism: a prospective validation study // Circulation, 2011; 124: 2716–2724.
29. Lankeit M., Gomez V., Wagner C., et al. A strategy combining imaging and laboratory biomarkers in comparison with a simplified clinical score for risk stratification of patients with acute pulmonary embolism // Chest, 2012; 141: 916–922.
30. Lankeit M., Dellas C., Benz V., et al. The predictive value of heart-type fatty acid-binding protein is independent from symptom duration in normotensive patients with pulmonary embolism // Thromb Res, 2013; 132: 543–547.
31. Righini M., Roy P. M., Meyer G., et al. The Simplified pulmonary embolism severity index (PESI): validation of a clinical prognostic model for pulmonary embolism // J Thromb Haemost, 2011; 9: 2115–2117.
32. Righini M., Van E. J., den Exter P. L., et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study // JAMA, 2014; 311: 1117–1124.
33. Sanchez O., Trinquart L., Colombet I., et al. Prognostic value of right ventricular dysfunction in patients with haemodynamically stable pulmonary embolism: a systematic review // Eur Heart J, 2008; 29: 1569–1577.
34. Sharifi M., Bay C., Skrocki L. Moderate pulmonary embolism treated with thrombolysis (from the ‘MOPETT’ Trial) // Am J Cardiol, 2013; 111: 273–277.
35. Stein P. D., Goodman L. R., Hull R. D., et al. Diagnosis and management of isolated subsegmental pulmonary embolism: review and assessment of the options // Clin Appl Thromb Hemost, 2012; 18: 20–26.
36. Stein P. D., Matta F. Thrombolytic therapy in unstable patients with acute pulmonary embolism: saves lives but underused // Am J Med, 2012; 125: 465–470.
37. Tapson V. F., Humbert M. Incidence and prevalence of chronic thromboembolic pulmonary hypertension: from acute to chronic pulmonary embolism // Proc Am Thorac Soc, 2006; 3: 564–567.
38. Van Es J., Douma R. A., Kamphuisen P. W., et al. Clot resolution after 3 weeks of anticoagulant treatment for pulmonary embolism: comparison of computed tomography and perfusion scintigraphy // J Thromb Haemost, 2013; 11: 679–685.


