Plaušu artēriju trombembolijas sastopamība un cēloņi, kā arī radioloģiskās ainas un D-dimēru līmeņa korelācija
Kopsavilkums
Plaušu artēriju trombembolija (PATE), ir trešā biežākā kardiovaskulārās sistēmas slimība, kurai raksturīga augsta letalitāte akūtajā periodā vai izteikti funkcionālie traucējumi hroniskas norises gadījumā. Svarīgi ir laikus atpazīt pacientus ar paaugstinātu trombembolijas risku, un to diagnosticēt, lai agrīni uzsāktu ārstēšanu.
Darba mērķis ir izvērtēt plaušu artēriju trombembolijas sastopamību, cēloņus, kā arī novērtēt radioloģiskās ainas un to korelāciju ar D-dimēru līmeni.
Materiāls un metodes. Tika veikts retrospektīvs pētījums, kurā ietverti visi Paula Stradiņa Klīniskās universitātes slimnīcas nodaļās ārstēto pacientu krūšu kurvja orgānu datortomogrāfijas (DT) angiogrāfiskie izmeklējumi, kas veikti no 2014. gada 1. aprīļa līdz 1. septembrim (kopā – 1161). Sīkāk tika analizēti tie izmeklējumi, kuru informācija liecināja par PATE.
Rezultāti. Pētījumā ietverts 1161 DT angiogrāfiskais izmeklējums, 266 pacientiem tas tika veikts, jo bija aizdomas par PATE, diagnoze apstiprināta 26 % gadījumu. Asimptomātisku PATE konstatēja 2,3 % pacientu. Kopā PATE konstatēja 7 % gadījumu no visiem izmeklējumiem. Vidējais saslimšanas vecums bija 66,7 ± 15,2 gadi, 61 % sasirgušo – sievietes. Akūta PATE – 82 % gadījumu, bet 2 % uz hroniskas PATE fona bija attīstījusies akūta trombembolija. Biežāk PATE bija abpusēja – 62 % pacientu, 46 % pacientu tika konstatēta masīva PATE, kas skar visus plaušu artēriju zarus. Unilaterālajos gadījumos PATE biežāk bija labajā plaušā – 20 % (kreisās puses vienpusējā PATE konstatēta 18 %). No visiem gadījumiem 28 % pacientu attīstījās infarktpneimonija. D-dimēru tests bija pozitīvs visiem akūtas PATE pacientiem. Starp akūtas un hroniskas PATE grupām bija statistiski ticama D-dimēru līmeņa atšķirība (p < 0,1) – akūtas PATE gadījumā vidēji 12,05 mg/l un hroniskas – 3,36 mg/l. Nepastāvēja statistiski ticama korelācija starp D-dimēru līmeni un PATE plašumu.
Secinājumi. Statistiski ir ticama D-dimēru līmeņa atšķirība akūtas un hroniskas PATE pacientiem, taču nepastāv korelācija starp D-dimēru līmeni un PATE plašumu. DT angiogrāfija ir uzskatāma par vienīgo prognostiski ticamo rutīnas diagnostikas metodi pacientiem ar aizdomām par PATE.
Ievads
PATE klīniskā izpausme bieži ir sarežģīta, un diagnostika agrīnajā saslimšanas posmā – apgrūtināta. Sākotnēji pirmie simptomi var palikt nepamanīti, ņemot vērā PATE nespecifisko klīnisko ainu. Tomēr agrīnai diagnozei ir fundamentāla nozīme. Nekavējoties sākta ārstēšana ir ļoti efektīva. Atkarībā no klīniskās ainas sākotnējā terapija tiek vērsta uz bloķētās plaušu artērijas asins plūsmas atjaunošanu vai uz potenciāli fatālo agrīno recidīvu novēršanu. Ilgtermiņa antikoagulācijai, ko izmanto kā sekundāru preventīvo metodi, ir jābūt pamatotai katram pacientam individuāli, balstoties uz atbilstīgi apstiprinātu diagnozes stratēģiju.
PATE epidemioloģija ir grūti nosakāma, jo klīniskā aina var saglabāties asimptomātiska vai arī diagnoze var būt nejauša atrade (Cohen, 2007), un atsevišķos gadījumos PATE pirmā izpausme ir pēkšņa nāve (Klok, 2010). Kopumā PATE ir svarīgs saslimstības, hospitalizācijas un mirstības iemesls Eiropā. Pamatojoties uz 2004. gada epidemioloģisko modeli, secināts, ka sešās Eiropas Savienības valstīs (ar kopējo iedzīvotāju skaitu 454,4 miljoni) vairāk kā 317 000 nāves gadījumu bija saistīti ar venozu trombemboliju (VTE) (Cohen, 2007). No šiem gadījumiem 34 % bija pēkšņas nāves un PATE, bet 59 % – letāli gadījumi, kas saistīti ar nediagnosticētu PATE, un tikai mazāk par 7 % nāves gadījumu bija korekti diagnosticēta PATE.
Pacienti, kas vecāki par 40 gadiem, atrodas paaugstināta riska grupā salīdzinājumā ar jaunākiem, un risks gandrīz dubultojas ar katru nākamo dekādi, tāpēc paredzams arvien lielāks cilvēku skaits, kam nākotnē diagnosticēs vai, iespējams, kuri arī mirs PATE dēļ. Klīniskos pētījumos pierādīts, ka visbiežāk PATE rodas 60–70 gadu vecumā, savukārt autopsiju pētījumos – 70–80 gadu vecumā (Morpurgo, 1998). Šo tendenci var skaidrot ar saistību starp vecumu un blakusslimībām, kas ir īstie venozas trombembolijas riska faktori.
Trombemboliskas komplikācijas konstatētas 30–60 % insulta slimnieku, 5–35 % miokarda infarkta slimnieku un vairāk nekā 12 % pacientu, kam ir sastrēguma sirds mazspēja (Stein, 1996).
Noteikt precīzu diagnozi, pamatojoties tikai uz klīniskajiem un laboratoriskajiem datiem, ir grūti, tāpēc attēldiagnostikas metožu lietošanai un pieejamībai ir būtiska nozīme precīzas diagnozes veidošanā. Pēdējo desmit gadu laikā datortomogrāfijas angiogrāfija ir kļuvusi par primāro skrīninga diagnostikas metodi gadījumos, ja rodas aizdomas par PATE. DT angiogrāfijas jutība vidēji ir 83 %, bet specifiskums – 96 % apmērā (Stein, 2006). Tā galvenokārt atkarīga gan no speciālista pieredzes, gan no iegūto datu kvalitātes.
Tomēr arī laboratoriskā diagnostika nav zaudējusi savu aktualitāti. Tai ir mainījušies uzsvari – laboratoriskie izmeklējumi ieņēmuši stabilu vietu skrīningā pirms attēldiagnostisko metožu izmantošanas. Starp laboratoriskām metodēm pēdējā desmitgadē tieši D-dimēriem ir pievērsta plašāka uzmanība, un izrādījās, ka šis ir vērtīgs tests pacientiem, ja radušās aizdomas par trombemboliju. Paaugstinātam D-dimēru līmenim ir prognostiska vērtība pulmonāras trombembolijas konstatēšanā, un arī antikoagulantu medikamentu deva atkarīga no D-dimēru līmeņa un pulmonāras embolijas biežums pacientiem ar aizdomām par plaušu artērijas trombemboliju (Ghanima, 2006).
Dažos pētījumos ir novērots, ka D-dimēru līmenis, iespējams, korelē ar plaušu artēriju obstrukcijas līmeni, novērtējot plaušu artēriju obstrukcijas indeksu, kā arī dažkārt konstatētas dažas saistības starp D-dimēru līmeni un pulmonāras trombembolijas smagumu, bet šie vērojumi ir jāpēta plašāk.
Laikus sākta antikoagulantu terapija ir tieši saistīta ar savlaicīgu diagnozes noteikšanu. PATE gadījumā antikoagulantu terapija samazina pacientu mirstību par 75 %, tas nozīmē, ka neārstētas PATE gadījumā mirstība ir ap 25–30 %. Atbilstīga antikoagulantu terapija samazina arī PATE recidīvu biežumu.
Darba mērķis
Pētījuma mērķis ir izvērtēt plaušu artēriju trombembolijas (PATE) riska faktorus, slimības biežumu, plašumu, vai pastāv DT angiogrāfiski konstatētā PATE plašuma korelācija ar laboratorisko izmaiņu – D-dimēru līmeni.
Materiāls un metodes
Šis ir retrospektīvs gadījumu pētījums. Tajā iekļauti visi Paula Stradiņa Klīniskās universitātes slimnīcas nodaļu un Neatliekamās medicīnas centra pacientu krūšu kurvja orgānu DT angiogrāfijas izmeklējumi, kas veikti no 2014. gada 1. aprīļa līdz 1. septembrim. Papildu nepieciešamie dati par pacientiem tika iegūti no slimības vēsturēm.
Vēl pētījumā tika iekļautas divas lielas cilvēku grupas:
- pacienti, kuri nosūtīti veikt DT angiogrāfijas izmeklējumu un diagnoze bija PATE;
- pacienti ar nejaušu PATE diagnozi, viņi tika nosūtīti uz izmeklējumu, bet figurēja cita diagnoze.
Analizējot DT angiogrāfijas izmeklējumus, tika izvērtēta detalizētāka informācija par trombembolijas anatomisko lokalizāciju – par skarto pusi (labās, kreisās vai abu plaušu artērijas), sagrupēta trombembolu lokalizācija pēc artēriju kalibra (maģistrālie plaušu asinsvadi – truncus pulmonalis, galvenās plaušu artērijas un labās puses interlobārā artērija, vidējie – lobārās un segmentārās artērijas, subsegmentārie zari, sirdī), kā arī tika veikta trombembolijas skarto artēriju sagrupēšana pēc segmentiem.
Pēc DT angiogrāfijas pazīmēm papildus tika izvērtēts, vai trombembolija ir akūta vai hroniska, kā arī tika atzīmēts, vai trombembolija izraisījusi infarktpneimoniju. Papildus tika apskatīti Paula Stradiņa Klīniskās universitātes slimnīcas arhīvā pieejamie pacientu slimības vēsturu dati par pacientu pamatsaslimšanu, lai izvērtētu trombemboliju iespējamos cēloņus, kā arī noskaidrotu D-dimēru līmeni asinīs.
Pētījumā iegūtie dati ir statistiski apstrādāti, izmantojot IBM SPSS Statistics 17.0 programmu. Ticamības intervāli relatīvajiem biežumiem aprēķināti ar Confidence Interval Calculator for proportions. Par statistiski ticamu uzskatāma p vērtība < 0,05. Parametri atainoti kā vidējās vērtības, to standartnovirze, mediāna, absolūtais biežums un relatīvais biežums – procentos.
Parametriem, kas pierādīti kā statistiski ticami atšķirīgi abās grupās, pētīta savstarpējā saistība korelācijas analīzē – Pīrsona korelācijā un loģistiskās regresijas analīzē.
Pētnieciskā darba veikšana iepriekš tika saskaņota ar Rīgas Stradiņa universitātes Ētikas komiteju un saņemta tās atļauja.
Visi pacienti tika izmeklēti pēc vienota protokola. Izmeklējumus veica ar 64 slāņu DT iekārtu. Pacientiem pirms izmeklējuma bija nodrošināta intravenozā pieeja – katetrs perifērajā vēnā (optimāli – kubitālajā vēnā). Pirmajā posmā pacientiem tika veikta plaušu un videnes natīva (bez kontrastvielas) skenēšana, kam sekoja izmeklējuma nākamais posms – ar intravenozu kontrastvielas (bolus) injekciju. Rentgenkontrastviela Sol Visipaque 320 ar automātisko injektoru 100 ml apjomā tika ievadīta ar vidējo ātrumu 4,0 ml/s. Sekoja divas pēckontrasta sērijas. Attēla iegūšanas sākums tika konstatēts, izmantojot automātisko kontrastvielas noteikšanu ar kontrasta monitoringa kursoru. Skenēšana tika veikta, pacientam aizturot elpu. Visi izmeklējumi izdarīti ar plāna slāņa griezumu – 1,25 mm, kas ļauj iegūt maksimāli kvalitatīvus un izvērtējamus attēlus.
Tālāk izmeklējumi turpmākai datu apstrādei tika nosūtīti uz darba staciju. Apstrādājot iegūtos attēlus, tie tika rekonstruēti multiplanāri vairākās plaknēs.
Rezultāti
Plaušu artēriju trombembolijas (PATE) grupas pētījumā kopā tika izanalizēts 1161 krūšu kurvja orgānu DT angiogrāfijas izmeklējums, ko veica minētajā piecu mēnešu laika posmā (no 2014. gada 1. aprīļa līdz 1. septembrim).
Šajā laikā 266 pacientiem nosūtījuma uz DT angiogrāfiju diagnoze bija PATE. Diagnoze tika apstiprināta 26 % gadījumu (68 pacientiem). Izvērtējot visus pārējos krūšu kurvja DT angiogrāfijas izmeklējumus, vēl 21 pacientam tika konstatēta PATE. Kopā starp visiem (1161) DT angiogrāfijas izmeklējumiem piecu mēnešu laikā PATE tika diagnosticēta 7 % gadījumu (89 pacientiem).
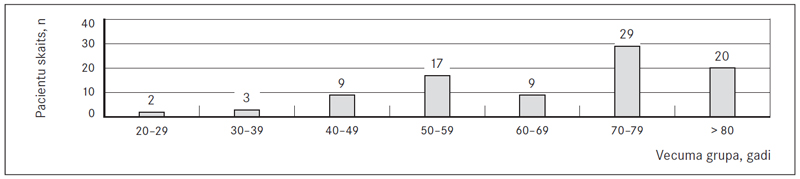
Tika izveidots arī pacientu sadalījums pa vecuma grupām (sk. 1. att.). Visretāk saslimstība konstatēta pacientiem vecumā līdz 39 gadiem. Novērots, ka saslimstība pieaug proporcionāli vecumam, sasniedzot maksimumu 70–79 gadu vecuma grupā. Izņēmums bija 60–69 gadu vecuma grupa, kurā saslimstība bija vienāda ar 40–49 gadu vecuma grupu.
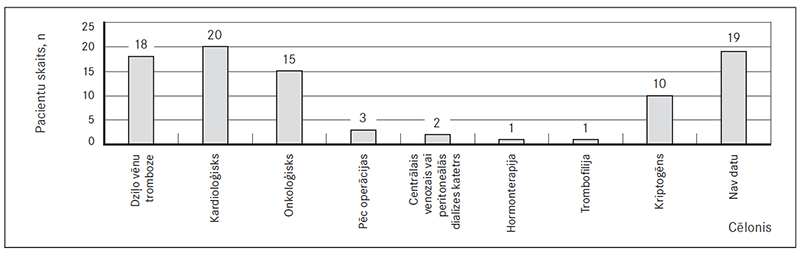
PATE pacientus sadalot grupās pēc trombembolijas iespējamiem cēloņiem, redzams, ka pārliecinoši visvairāk ir pacientu, kuriem konstatēta dziļo vēnu tromboze (20 % gadījumu), tiem seko pacienti ar onkoloģisku saslimšanu (17 % gadījumu), kā arī 23 % kardioloģisko pacientu (sk. 2. att.), kuriem anamnēzē ir mirdzaritmija, nesens miokarda infarkts vai hroniska sirds mazspēja. Samērā maz bija PATE pacientu, kam nesen veikta ķirurģiska operācija, un pacientu, kuriem bija centrālais venozais katetrs vai peritoneālās dialīzes katetrs. Samērā bieži trombembolijas cēlonis, bez visiem iepriekš minētajiem iespējamiem cēloņiem, tā arī palika neskaidrs (11 % gadījumu – sk. 2. att.).
1. attēls. Pacientu sadalījums pa vecuma grupām / Distribution of patients by age groups
2. attēls. PATE cēloņi / Reasons of pulmonary artery embolism
Lai nepieļautu neprecizitātes, nosakot hroniskas PATE gadījumu skaitu, pētījumā tika iekļauti pacientu pirmreizējie izmeklējumi. Ja slimniekam šo piecu mēnešu laikā tika veikta atkārtota – kontroles – DT angiogrāfija, tad tās rezultāti netika iekļauti sarakstā.
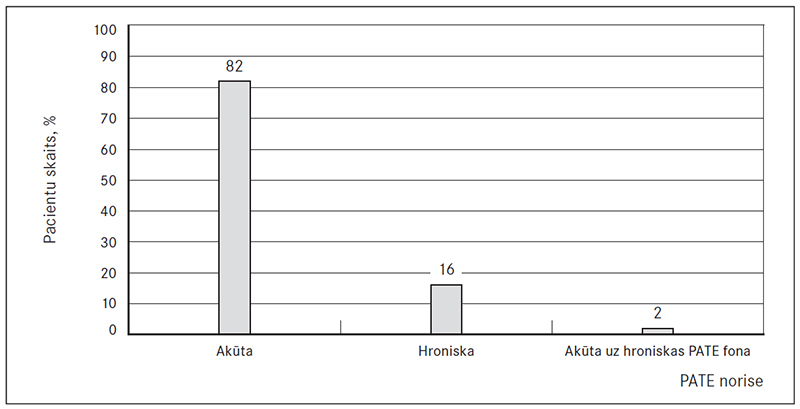
Pārliecinoši lielākajai PATE pacientu daļai trombembolija bija akūta – 82 % gadījumu (sk. 3. att.). Pirmreizēji izmeklētajiem pacientiem hroniska trombembolija bija sastopama 16 % gadījumu. Tomēr 2 % gadījumu uz hroniskas trombembolijas fona tika konstatēta akūta PATE.
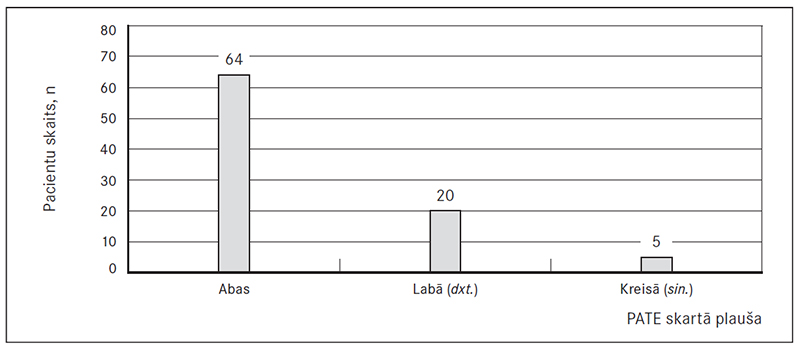
Plaušu artēriju trombembolija pārliecinoši vairākumam bija abpusēja – 72 % gadījumu (64 pacientiem). Savukārt gadījumā, ka trombembolija bija unilaterāla, tad biežāk tika skartas labās plaušas artērijas un to zari – 22 % gadījumu (20 pacientiem, dxt.). Tikai 6 % gadījumu PATE bija sastopama kreisajā pusē (pieciem pacientiem, sin., sk. 4. att.).
Trombu lokalizācija plaušu artērijās PATE pacientiem ir atainota 5. attēlā. Nevienam slimniekam nebija izolēta trombembolija tikai maģistrālajos plaušu asinsvados, t. i., truncus pulmonalis, galvenajās plaušu artērijās vai labās puses starpdaivu artērijā.
3. attēls. PATE norises veids pirmreizēji izmeklētiem pacientiem / PATE scenarios exquisite first-time patients
4. attēls. Trombembolijas skartā plaušu puse / Pulmonary thromboembolism affected party
5. attēls. Trombembolu lokalizācija plaušu artērijās / Trombemboly localization of the pulmonary arteries
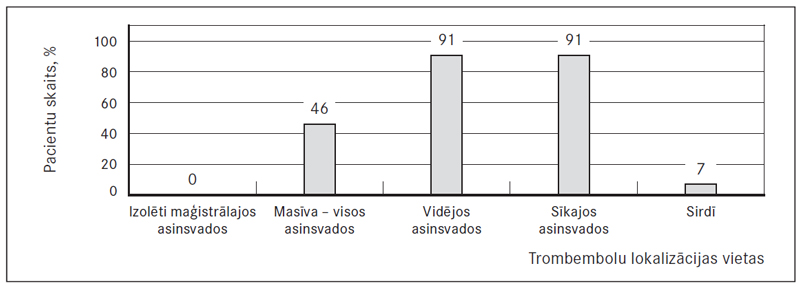
Gandrīz pusei PATE pacientu tika konstatēta masīva PATE: skarti kā maģistrālie, tā arī vidējie un sīkie asinsvadi – 46 % gadījumu (41 pacientam). Ievērojami lielai daļai – 91 % PATE pacientu (81) – skarti vidējie plaušu asinsvadi, t. i., lobārās un segmentārās artērijas. Izolēti trombi tikai vidējās plaušu artērijās bija sastopami 7 % gadījumu.
Līdzīgi trombi sastopami plaušu perifērajās daļās. Subsegmentārie zari bija skarti tieši tikpat bieži, cik vidējās artērijās – 91 % gadījumu (81 pacientam), no kuriem izolēti skarti tikai sīkie zari bija nedaudz biežāk nekā izolēti skarti vidējie zari – 9 % gadījumu (astoņiem pacientiem).
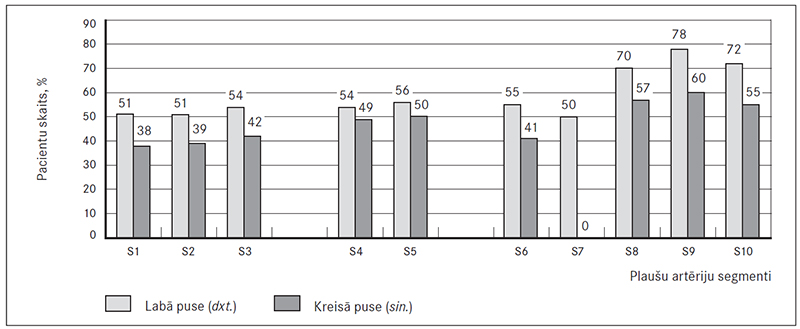
Tika atrasti trombi arī sirds dobumos – 8 % gadījumu (septiņiem pacientiem). Diviem pacientiem tika atklāta izolēta fokāla trombembolija vidēja kalibra plaušu artērijā, šī atrade konstatēta tikai hroniskas trombembolijas slimniekiem. Visbiežāk tika konstatēta lejasdaivu trombembolija gan labajā, gan kreisajā pusē, sevišķi – astotajā, devītajā un desmitajā segmentā un visretāk – kreisās puses pirmajā segmentā (sk. 6. att.).
6. attēls. Trombu atrades plaušu artēriju segmentos / Clot breakdown pulmonary artery segments
No visiem PATE slimniekiem infarktpneimonija konstatēta 28 % gadījumu (n = 25).
No visiem PATE pacientiem D-dimēru līmenis izvērtēšanai bija pieejams 70 gadījumos. Pārējiem 19 pacientiem vai nu D-dimēru tests nebija veikts, vai arī arhīvā pētītajās slimības vēsturēs nebija ziņu par D-dimēru testu. Vēl viena pacienta dati netika pētīti, jo viņam D-dimēru līmenis bija vērtēts pēc mini VIDAS reakcijas.
D-dimēru tests 2,9 % gadījumu (diviem pacientiem) nebija pozitīvs, tie bija hroniskas PATE slimnieki, kuriem konstatēti reziduāli trombi atsevišķos subsegmentārajos plaušu artēriju zaros.
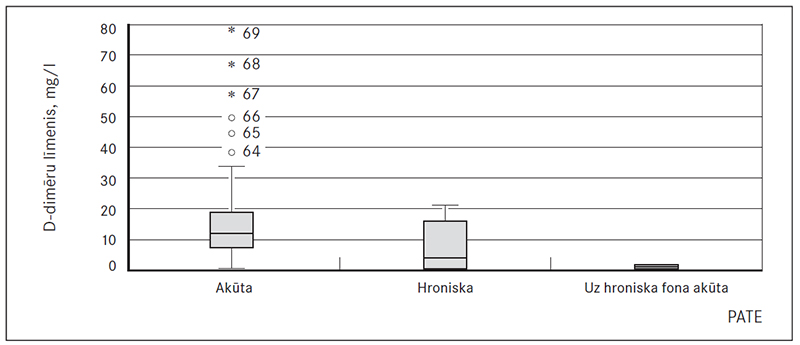
Kopumā vidējais D-dimēru līmenis visiem PATE pacientiem bija 15,33 mg/l (sk. 7. att.).
Visiem hroniskas PATE pacientiem D-dimēru līmenis bija robežās 0,19–21,03 mg/l, vidēji 7,77 mg/l (norma ir mazāk par 0,55 mg/l). Pēc ticamības indeksa aprēķināšanas (95 % CI: 0,62; 14,92), vidējais ticamais rādījums ir 3,86 mg/l.
Visu akūtas PATE pacientu tests bija pozitīvs, robežās 0,66–78,9 mg/l ar vidējo rādījumu 16,84 mg/l. Pēc ticamības indeksa aprēķināšanas (95 % CI: 12,7; 21,0), vidējais ticamais rādījums – 12,05 mg/l.
Pēc Manna–Vitnija (Mann–Whitney) kritērijiem noteiktā ticamības p vērtība ir 0,056, kas norāda, ka starp akūtas un hroniskas PATE grupām ir statistiski ticama D-dimēru līmeņa atšķirība, jo p < 0,1 (sk. 7. att.).
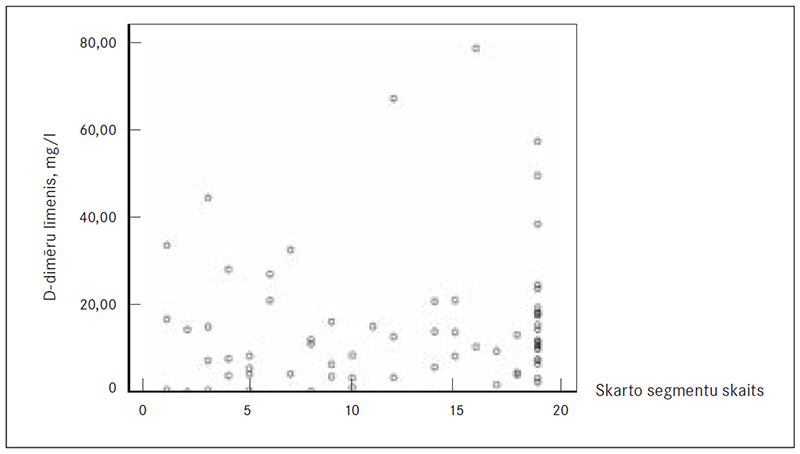
Izvērtējot D-dimēru līmeņa korelāciju ar PATE skarto plaušu segmentu skaitu, pēc, šķietami, D-dimēru līmeņa paaugstināšanās, palielinās arī trombembolijas skarto plaušu segmentu skaits, taču, izmantojot Spīrmena (Spearman) metodi, statistiski ticama korelācija neapstiprinājās (sk. 8. att.).
Nepastāv arī korelācija starp D-dimēru līmeni asins serumā un skarto asinsvadu anatomisko lielumu.
Vērojama arī šāda tendence: gan akūtas, gan hroniskas PATE pacientiem, pieaugot pacientu vecumam, ir konstatējams arī D-dimēru līmeņa pieaugums, sevišķi pēc 40 gadu vecuma (sk. 9. att.). Pacientu skaits, kuri bija jaunāki par 40 gadiem, ir neliels, tāpēc pārliecinoši izteikties par statistiski ticamu korelāciju jauniem pacientiem nevar.
7. attēls. D-dimēru līmenis PATE slimniekiem / D-dimer levels in PATE patients
8. attēls. D-dimēru līmeņa korelācija ar PATE skarto segmentu daudzumu / D-dimer level of correlation with the affected segment of the amount of PATE
9. attēls. Visu PATE slimnieku vecuma korelācija ar D-dimēru līmeni / PATE patients of all age correlation with the D-dimer level
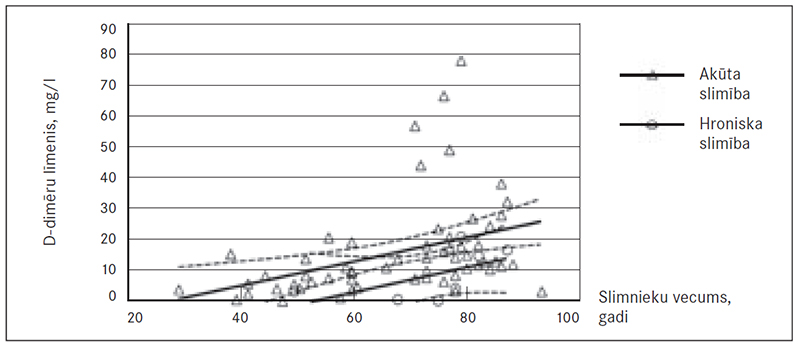
Tika pierādīts, ka D-dimēru līmenis pacientam paaugstinās līdz 0,3 mg/l (p = 0,002, R2 = 0,08) ar katru nākamo gadu.
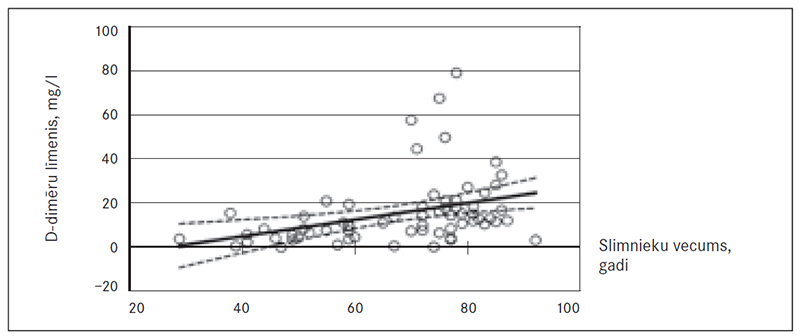
Izvērtējot tikai akūtas PATE pacientus (sk. 10. att.), vērojama izteiktāka tendence palielināties D-dimēru līmenim korelācijā ar pacientu vecumu. Ar katru gadu D-dimēru līmenis paaugstinās par 0,4 mg/l (p = 0,003, R2 = 0,13).
10. attēls. Akūtas PATE slimnieku vecuma korelācija ar D-dimēru līmeni / Acute PATE patients age correlation with the D-dimer level
Atsevišķi izvērtēt hroniskas PATE pacientu vecuma korelāciju ar D-dimēru līmeni statistiski ticami nevar, jo šo pacientu skaits pētījumā bija neliels, un lielākā daļa hroniskas PATE pacientu bija jau lielā vecumā, lai gan tendence pastāv.
Diskusija
Plaušu artēriju trombembolijas epidemioloģija ir grūti nosakāma, nav pieejami precīzi dati, taču tiek lēsts, ka PATE sastopamība ir vidēji 0,5 līdz viens gadījums uz 1000 no kopējā iedzīvotāju skaita (Ghanima, 1998).
Šajā pētījumā piecu mēnešu laikā starp visiem (1161) DT angiogrāfijas izmeklējumiem, PATE tika diagnosticēta 7 % pacientu. Savukārt no visiem pacientiem, kuriem nosūtījuma uz izmeklējumu diagnozē tika izteiktas aizdomas par PATE, tās apstiprinājās 26 % gadījumu. Precīzu skaitu nav iespējams noteikt, jo jāņem vērā arī nediagnosticētie PATE gadījumi – tie ir klīniski asimptomātiski, neletāli gadījumi, kā arī gadījumi, ka PATE pirmā un vienīgā izpausme ir pēkšņa nāve.
No visiem pētījumā iekļautajiem PATE pacientiem 61 % bija sievietes un 39 % – vīrieši. Pēc pasaules pētījumu datiem, nav viena viedokļa un statistiski ticamas atšķirības starp dzimumiem PATE gadījumos. Vienlīdz liels risks saslimst ir kā sievietēm, tā vīriešiem. Atsevišķos pētījumus konstatēts lielāks saslimušo sieviešu īpatsvars, citos pētījumos – vīriešu.
Šajā pētījumā iekļauto pacientu vidējais saslimšanas vecums bija 66,7 ± 15,2 gadi. Pacientu vecums variēja no 21 līdz 92 gadiem, kas liecina, ka PATE nav tikai vecu cilvēku saslimšana. Tomēr saslimstība ar PATE pieauga, palielinoties vecumam, šajā pētījumā iekļautajiem tā maksimumu sasniedza 70–79 gadu vecuma grupā. Šie rādītāji atbilst pasaules pētījumu datiem, kuros apgalvots, ka pacienti virs 40 gadu vecuma ir paaugstinātā riska grupā salīdzinājumā ar jaunākiem un risks paaugstinās ar katru nākamo dekādi. Autopsiju pētījumos pierādīts, ka vairums PATE rodas 70–80 gadu vecumā (Ghanima, 1998). Šo tendenci izskaidro saistība starp vecumu un blakusslimībām, kas ir īstie trombembolijas riska faktori.
Pēc šā pētījuma datiem, galvenie riska faktori PATE izraisīšanā bija kardiālas dabas (miokarda infarkts, sirds mazspēja, mirdzaritmija), dziļo vēnu tromboze (DzVT) un pacienti ar onkoloģisku saslimšanu, kas saskan arī ar pasaules pētījumu datiem. Šie biežākie izraisītāji ierindojas zem augsta un vidēja riska faktoriem. Lielākā daļa trombembolu nāk no apakšējo ekstremitāšu proksimālajām (iliakālajām, femorālajām un popliteālajām) vēnām. Savukārt piecas visbiežākās vēža lokalizācijas laikā, kad tiek konstatēta tromboze, ir:
- plaušas – 17 %;
- aizkuņģa dziedzeris – 10 %;
- resnā zarna un taisnā zarna – 8 %;
- nieres – 8 %;
- prostata – 7 % (Sørensen, 1998).
Dažādi veicinošie faktori ir nepārprotami savstarpēji saistīti, tomēr dati liecina, ka līdz 25 % PATE un DzVT nav klasiska veicinošā faktora (Heit, 2002), kā tas secināts arī šā pētījuma gadījumā, tāpēc daļai pacientu joprojām PATE cēlonis ir kriptogēns.
Akūtās un hroniskās PATE patieso biežumu ir grūti novērtēt gan nespecifisku simptomu, gan mainīgas gaitas un nediagnosticētu gadījumu dēļ. Vēsturiski tiek uzskatīts, ka pacientiem, kuriem ir diagnosticēta akūta PATE, hroniska trombembolija attīstās reti. Sekciju dati lēš, ka hroniskas PATE kopējā sastopamība ir 1–3 % cilvēku. Tomēr, kā vēstī jaunākie pētījumi, hroniska trombembolija sastopama pārsteidzoši biežāk (ap 20 %) (Tiyas Sen Dutt, 2013), līdzīgi kā šajā pētījumā – hroniska PATE bija sastopama 16 % no trombembolijas gadījumu skaita. Līdzīgi ir ar atgriezeniskās PATE sastopamību, kas gan mūsu pētījumā, gan citos konstatēta retāk nekā 5 % gadījumu.
Plaušu artēriju emboli parasti ir lokalizēti bilaterāli, multipli un lielākoties skar plaušu lejasdaivas – šie secinājumi sakrīt arī ar mūsu pētījuma datiem. Aptuveni 3–6 % PATE pacientiem trombi ir lokalizēti lielajos asinsvados (truncus pulmonalis un galvenajās plaušu artērijās). Tradicionāli, šādiem pacientiem bija hemodinamiska nestabilitāte un letāls iznākums. Tomēr retrospektīvi pētījumi liecina, ka starp šādu trombembolu pacientiem tikai 22 % ir hemodinamiski nestabili un mirstība sasniedz 5 % gadījumu (Ryu, 2007). Mazākie trombi, kas lokalizējušies perifēri segmentārajos vai subsegmentārajos zaros, ir biežāk saistīti ar plaušu infarktu un reaktīvu pleirītu.
Mūsu pētījumā novērots, ka no visiem PATE pacientiem infarktpneimonija bija sastopama līdz 28 % gadījumu. Pēc pasaules pētījumu datiem, infarktpneimonija ir mazākajai PATE pacientu daļai (10–15 % gadījumu) un parasti – vecākiem pacientiem ar blakussaslimšanām (sirds un asinsvadu slimībām un pamatā esošu onkoloģisko slimību). Jauniem pacientiem ar “vienkāršu” PATE, ja nav blakusslimību, infarktpneimonija parasti neattīstās. Tā kā mūsu pētījumā lielākā pacientu daļa sirga ar sirds un asinsvadu slimībām, kā arī bija pacienti ar onkoloģisku slimību, tad šie apstākļi izskaidro mūsu salīdzinoši augstākus infarktpneimonijas rādījumus.
Skaidri ir izsekojama tendence – pieaugot pacientu vecumam, kad visbiežāk nākas sastapties ar DzVT un PATE, pieaug D-dimēru līmenis. Tas, neapšaubāmi, mazina šīs laboratoriskās metodes priekšrocības gan vecākiem pacientiem, gan arī pacientiem ar blakussaslimšanām.
Tāpēc negatīvi D-dimēru rezultāti augsti jutīgās asins ķīmiskajās analīzēs droši izslēdz PATE pacientiem ar zemu un vidēju klīnisko varbūtību, kamēr vidēji jutīgie ķīmiskie asins analīžu testi izslēdz PATE tikai pacientiem ar zemu klīnisko varbūtību. Kad tiek izmantota iepriekš aprakstītā divu līmeņu klīnisko varbūtību novērtēšanas shēma, negatīvi D-dimēru rezultāti droši izslēdza PATE pacientiem, kuriem PATE bija mazticama, izmantojot augsti jutīgas vai vidēji jutīgas ķīmiskās asins analīzes.
Lielākā kļūda ir PATE diagnozes apstiprināšanai par pamatu ņemt D-dimēru paaugstināšanos!
Secinājumi
- Pašreiz vēl nav pieejami specifiski klīniskie un laboratoriskie izmeklējumi, kas apstiprinātu PATE (D-dimēru tests nav neapšaubāma skrīninga metode PATE diagnostikā).
- Neliels ir asimptomātiskas, nejauši diagnosticētas PATE biežums (2,3 %).
- Galvenie PATE cēloņi šajā pētījumā sakrīt ar pasaules pētījumu datiem.
- Statistiski ir ticama D-dimēru līmeņa atšķirība akūtas un hroniskas PATE pacientiem.
- Nepastāv statistiski ticama korelācija starp D-dimēru līmeni un PATE plašumu.
- DT angiogrāfija ir uzskatāma par vienīgo prognostiski ticamo rutīnas diagnostikas metodi pacientiem ar aizdomām par PATE, tā ļauj izvērtēt kontrastvielas pildījuma defektus līdz pat subsegmentāro zaru līmenim.
Abstract
Patients with Pulmonary Artery Embolism – Incidence, Causes, Radiological Scenes and D-dimer Level Correlation
Pulmonary embolism (PE) is the third most common cardiovascular disease; this disease is characterised by high lethality during the acute period or severe functional disorders in chronic processes. It is important to detect patients with increased risk of thromboembolism early, as well as timely recognise thromboembolic events that have already occurred.
The aim of this study was to detect PE incidence, causes, radiological scenes and D-dimer level correlation.
The study was conducted as a retrospective study. In this study all patients CT angiography, who were hospitalised at Pauls Stradins Clinical University Hospital in the period from 1.04.2014 until 1.09.2014, were evaluated. Detailed analysis was performed to the examination results where PE had been observed.
In this study, 1161 patients’ CT angiographies were analysed; out of these patients, 266 were sent to pulmonary artery CT angiography suspected to PE, but the diagnosis was confirmed, only in 26 % cases. Incidental asymptomatic PE were found in 2.3 % of the patients. In total, PE was found in 7 % of all cases. The average morbidity age 66.7 ± 15.2 years. Acute PE was found in 82 % cases. Most frequently, PE was mutual – 62 % of patients, unilateral pulmonary embolism more often affected the right lung – 20 %. Almost half (46 %) of all patients had an array of PE, across the trunk, medium and tiny pulmonary artery branches. 28 % of all patients developed pneumonia. D-dimer test was positive for all acute PE patients. Statistically significant D-dimer level difference was detected between acute and chronic PE patient groups. There was no statistically significant correlation between D-dimer level and breadth of PE.
There is a statistically significant D-dimer level difference between acute and chronic PE patients, but there is no correlation between the D-dimer level and breadth of PE. CT angiography is considered as the only reliable predictive routine diagnostic method in patients with suspected PE.
Literatūra
1. Dziļo vēnu tromboze // http://www.lfb.lv/vadlinijas/DTV.pdf%20galiga.pdf (sk. 01.07.2015.).
2. Biss T. T., Brandão L. R., Kahr W. H., Chan A. K., Williams S. Clinical features and outcome of pulmonary embolism in children // Br J Haematol, 2008; 142 (5): 808–818.
3. Blom J. W., Doggen C. J., Osanto S., Rosendaal F. R. Malignancies, prothrombotic mutations, and the risk of venous thrombosis // JAMA, 2005; 293 (6): 715–722.
4. Blanco-Molina A., Trujillo-Santos J., Tirado R., Cañas I., Riera A., Valdés M., Monreal M. Venous thromboembolism in women using hormonal contraceptives. Findings from the RIETE Registry // Thromb Haemost, 2009; 101 (3): 478–482.
5. Brenner D. J., Hall E. J. Computed tomography: an increasing source of radiation exposure // N Engl J Med, 2007; 357 (22): 2277–2284.
6. Cohen A. T., Agnelli G., Anderson F. A., Arcelus J. I., Bergqvist D., Brecht J. G., Greer I. A., Heit J. A., Hutchinson J. L., Kakkar A. K., Mottier D., Oger E., Samama M. M., Spannagl M. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality // Thromb Haemost, 2007; 98 (4): 756–764.
7. Dijk F. N., Curtin J., Lord D., Fitzgerald D. A. Pulmonary embolism in children // Paediatr Respir Rev, 2012; 13 (2): 112–122.
8. Farrell C., Jones M., Girvin F., Ritchie G., Murchison J. T. Unsuspected pulmonary embolism identified using multidetector computed tomography in hospital outpatients // Clin Radiol, 2010; 65 (1): 1–5.
9. Ferrari E., Baudouy M., Cerboni P., et al. Clinical epidemiology of venous thrombo-embolic disease. Results of French multicentre registry // Eur Heart J, 1997; 18: 685–691.
10. Failla P. J., Reed K. D., Summer W. R., Karam G. H. Inferior vena caval filters: key considerations // Am J Med Sci, 2005; 330 (2): 82–87.
11. Ghanima M., Schmid C., Mandelli V. Factors infuencing the clinical diagnosis of pulmonary embolism: analysis of 229 postmortem cases // Int J Cardiol, 1998; 65 (Suppl 1): 79–82.
12. Ghanima W., Abdelnoor M., Mowinckel M.C., Sandset P. M. The performance of STA-Liatest D-dimer assay in outpatients with suspected pulmonary embolism // Br J Haematol, 2006; 132 (2): 210–215.
13. Hann C. L., Streiff M. B. The role of vena caval filters in the management of venous thromboembolism // Blood Rev, 2005; 19 (4): 179–202.
14. Heit J. A., O’ Fallon W. M., Petterson T. M., Lohse C. M., Silverstein M. D., Mohr D. N., Melton L. J. 3rd. Relative impact of risk factors for deep vein thrombosis and pulmonary embolism: a population-based study // Arch Intern Med, 2002; 162 (11): 1245.
15. Henriksson P., Westerlund E., Wallén H., Brandt L., Hovatta O., Ekbom A. Incidence of pulmonary and venous thromboembolism in pregnancies after in vitro fertilisation: cross sectional study // BMJ, 2013; 346: e 8632.
16. Kearon C., Akl E. A. Duration of anticoagulant therapy for deep vein thrombosis and pulmonary embolism // Blood, 2014; 123 (12): 1794–1801.
17. Klok F. A., van Kralingen K. W., van Dijk A. P., Heyning F. H., Vliegen H. W., Kaptein A. A., Huisman M. V. Quality of life in long-term survivors of acute pulmonary embolism // Chest, 2010; 138 (6): 1432–1440.
18. Le Gal G., Righini M., Sanchez O., Roy P. M., Baba-Ahmed M., Perrier A., Bounameaux H. Apositive compression ultrasonography of the lower limb veins is highly predictive of pulmonary embolism on computed tomography in suspected patients // Thromb Haemost, 2006; 95 (6): 963–966.
19. Leick J., Liebetrau C., Szardien S., Willmer M., Rixe J., Nef H., Rolf A., Hamm C., Mollmann H. Percutaneous circulatory support in a patient with cardiac arrest due to acute pulmonary embolism // Clin Res Cardiol, 2012; 101 (12): 1017–1020.
20. Mandelli V., Schmid C., Zogno C., et al. False negatives and false positives in acute pulmonary embolism: A clinicalpostmortem comparison // Cardiologia, 1997; 42: 205–210.
21. Nicolaides A. N., Arcelus J., Belcaro G., et al. Prevention of venous thromboembolism. European consensus conference // Int Angiology, 1992; 11: 151–159.
22. Oudkerk M., van Beek E. J. R., Reekers J. A. Pulmonary angiography: technique, indications and interpretations. In: Oudkerk M, van Beek EJR, ten Cate JW eds. Pulmonary Embolism – Berlin: Blackwell Science, 1999. – Pp. 135–159.
23. Pacouret G., Alison D., Pottier J. M., et al. Free-floating thrombus and embolic risk in patients with angiographically confirmed proximal deep venous thrombosis. A prospective study // Arch Intern Med, 1997; 157: 305–308.
24. Perrier A., Roy P. M., Aujesky D., Bounameaux H., et al. Diagnosing pulmonary embolism in outpatients with clinical assessment, D-dimer measurement, venous ultrasound, and helical computed tomography: a multicenter management study // Am J Med, 2004; 116 (5): 291–299.
25. Pollack C. V., Schreiber D., Kline J. A., et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonaryembolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry) // J Am Coll Cardiol, 2011; 57 (6): 700–706.
26. Pomp E. R., Lenselink A. M., Rosendaal F. R., Doggen C. J. Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study // J Thromb Haemost, 2008; 6 (4): 632–637.
27. Righini M., Aujesky D., Roy P. M., Cornuz J., de Moerloose P., Bounameaux H., Perrier A. Clinical usefulness of D-dimer depending on clinical probability and cutoff value in outpatients with suspected pulmonary embolism // Arch Intern Med, 2004; 164 (22): 2483–2487.
28. Righini M., Le Gal G., Aujesky D., Roy P. M., Sanchez O., Verschuren F., Rutschmann O., Nonent M., Cornuz J., Thys F., Le Manach C. P., Revel M. P., Poletti P. A., Meyer G., Mottier D., Perneger T., Bounameaux H., Perrier A. Diagnosis of pulmonary embolism by multidetector CT alone or combined with venous ultrasonography of the leg: a randomised non-inferiority trial // Lancet, 2008; 371 (9621): 1343–1352.
29. Roy P. M., Colombet I., Durieux P., Chatellier G., Sors H., Meyer G. Systematic review and meta-analysis of strategies for the diagnosis of suspected pulmonary embolism // BMJ, 2005; 331 (7511): 259.
30. Ryu J. H., Pellikka P. A., Froehling D. A., Peters S. G., Aughenbaugh G. L. Saddle pulmonary embolism diagnosed by CT angiography: frequency, clinical features and outcome // Respir Med, 2007; 101 (7): 1537.
31. Schembri G. P., Miller A. E., Smart R. Radiation dosimetry and safety issues in the investigation of pulmonary embolism // Semin Nucl Med, 2010; 40 (6): 442–454.
32. Stein P. D. Pulmonary Embolism. Baltimore: William & Wilkins, 1996: 41–53.
33. Stein P. D., Fowler S. E., Goodman L. R., Gottschalk A., Hales C. A., Hull R. D., Leeper K. V., Jr., Popovich J., Jr., Quinn D. A., Sos T. A., Sostman H. D., Tapson V. F., Wakefield T. W., Weg J. G., Woodard P. K. Multidetector computed tomography for acute pulmonary embolism // N Engl J Med, 2006; 354 (22): 2317–2327.
34. Sørensen H. T., Mellemkjaer L., Steffensen F. H., Olsen J. H., Nielsen G. L. The risk of a diagnosis of cancer after primary deep venous thrombosis or pulmonary embolism // N Engl J Med, 1998; 338 (17): 1169.
35. Szold O., Khoury W., Biderman P., Klausner J. M., Halpern P., Weinbroum A. A. Inhaled nitric oxide improves pulmonary functions following massive pulmonary embolism: a report of four patients and review of the literature // Lung, 2006; 184 (1): 1–5.
36. Timp J. F., Braekkan S. K., Versteeg H. H., Cannegieter S. C. Epidemiology of cancerassociated venous thrombosis // Blood, 2013; 122 (10): 1712–1723.
37. Tiyas Sen Dutt, Murali Mohan B. V., Devi Prasad Shetty, et al. Incidence of Chronic Thrombo-embolic Pulmonary Hypertension Following Acute Pulmonary Thrombo-embolism: An Indian Perspective // The Indian Journal of Chest Diseases & Allied Sciences, 2013; Vol. 55: 205–207.
38. Torbicki A., Perrier A., Konstantinides S., et al. ESC guidelines of the diagnosis and management of acute pulmonary embolism // European Heart Journal, 2008; 29: 2276–2315.
39. Van Beek E. J. R., Ten Cate J. W. The diagnosis of venous thromboembolism: an overview. In: Hull R. D., Raskob G. E., Pineo G. F., eds. Venous Thromboembolism: an evidence-based atlas. – Armonk: Futura Publishing Co, 1996. – Pp. 93–99.
40. Van Ommen C. H., Heijboer H., Büller H. R., Hirasing R. A., Heijmans H. S., Peters M. Venous thromboembolism in childhood: a prospective two-year registry in The Netherlands // J Pediatr, 2001; 139 (5): 676–681.


