Epidurālās atsāpināšanas ietekme uz dzemdību norisi un jaundzimušā stāvokli
Kopsavilkums
Darba mērķis. Noteikt sakarību starp epidurālās atsāpināšanas (EA) ietekmi uz dzemdību procesu atšķirīga dzemdību ceļu atvēruma gadījumos, kā arī EA ietekmi uz jaundzimušā stāvokli.
Pētījuma materiāls un metodes. Pētījumā tika iekļautas sievietes ar dzemdību sākumu 37.–42. grūtniecības nedēļā. Viņas dzemdību atsāpināšanai saņēma EA Paula Stradiņa Klīniskās universitātes slimnīcas Dzemdību nodaļā. Pētījuma populācija tika iedalīta trīs grupās: nulliparas ar spontānu dzemdību sākumu (A), nulliparas ar dzemdību indukciju (B) un multiparas (C). Katra grupa tika iedalīta apakšgrupās, ņemot vērā dzemdes kakla atvērumu brīdī, kad tika uzsākta EA: 1–4 cm (agrīni) vai 5–8 cm (vēlīni). Starp apakšgrupām tika salīdzinātas dzemdību atrisināšanas metodes, dzemdību progress un jaundzimušā stāvoklis, kas tika vērtēts pēc Apgares skalas. Pētījumā piedalījās 201 paciente, t. sk. A grupā tika iekļautas 90, B grupā – 39 un C grupā – 72 sievietes.
Rezultāti. A grupā, agrīni uzsākot EA, dzemdības atrisinājās ar ķeizargriezienu 34 % gadījumu, bet vēlīni uzsākot, – 21 % gadījumu (p = 0,12), B grupā – atbilstīgi 39 % un 0 % gadījumu (p < 0,05), C grupā atbilstīgi – 5,9 % un 0 % (p = 0,22), A grupā oksitocīna lietošana pēc EA bija nepieciešama 45 % gadījumu, ja EA tika uzsākta agrīni, un 49 % gadījumu, ja – vēlīni (p = 0,43), B grupā šis rādītājs attiecīgi bija 50 % un 9 % sieviešu (p < 0,05), C grupā – atbilstoši 6 % un 13 % (p = 0,25). A grupā otrā dzemdību perioda vidējais ilgums bija 100 minūtes agrīnajā apakšgrupā un 140 minūtes vēlīnajā apakšgrupā (p < 0,05). B grupā atbilstīgi – 110 un 187 minūtes (p < 0,05). A grupā jaundzimušā stāvoklis pēc Apgares skalas 1. minūtes beigās 13 % gadījumu agrīnajā apakšgrupā un 5 % vēlīnajā bija < 7 balles (p = 0,16), 5. minūtes beigās – atbilstīgi 11 % un 0 % (p < 0,05), B grupā attiecīgi bija 11 % un 9 % (p = 0,69), C grupā atbilstīgi – 3 % un 0 % (p = 0,47).
Secinājumi. Agrīna EA lietošana dzemdībās ir saistīta ar paaugstinātu ķeizargrieziena risku, lielāku nepieciešamību lietot oksitocīnu, sliktāku jaundzimušā stāvokli, vērtējot to pēc Apgares skalas, bet tā nav saistīta ar garāku dzemdību otro periodu.
Ievads
Dzemdības ir fizioloģisks process, tomēr dzemdētājām tas rada stipras sāpes. Pēc 1984. gadā publicētās Melzaka (Melzack) sāpju skalas dzemdību sāpes ir kvalificējamas kā vienas no stiprākajām cilvēkam zināmajām sāpēm [10, 323]. Mūsdienās atsāpināšanai dzemdību procesā izvēles un biežāk lietojamā metode ir epidurālā atsāpināšana (EA). Trešdaļa sieviešu Lielbritānijā un 77 % sieviešu ASV dzemdībās saņem epidurālo atsāpināšanu [3, 50]. Savukārt Latvijā, Paula Stradiņa Klīniskajā universitātes slimnīcā (PSKUS), EA tiek lietota 25 % dzemdību.
Parasti epidurālā atsāpināšana tiek lietota pirmajā dzemdību periodā, kad notiek dzemdes kakla dilatācija. Epidurālās analgēzijas atsāpinošais efekts ļauj dzemdētājai atpūsties ieilgušu dzemdību laikā, tas sabalansē elpošanas frekvenci un amplitūdu, turklāt, novēršot sāpes, samazinās endogēno kateholamīnu – adrenalīna un noradrenalīna – izdalīšanās. Ir noskaidrots, ka adrenalīns samazina dzemdes kontrakciju spēku, bet noradrenalīns saīsina laika intervālus starp kontrakcijām, neļaujot dzemdei pilnvērtīgi relaksēties, un kavē dzemdību pirmo periodu [2, 1137]. Tātad, noņemot simpātiskās sistēmas efektus ar EA palīdzību, notiek efektīvāka dzemdes kakla atvēršanās, taču simpātiskā denervācija mēdz arī nomākt dzemdību darbību. To var izskaidrot ar hipotensiju, tai sekojošu miometrija apasiņošanas pavājināšanos, kā rezultātā pasliktinās dzemdes kontraktilās spējas [7, 380]. Galvenais dzemdības stimulējošais aģents ir oksitocīns. Tas ir hipofīzes mugurējās daļas hormons, kas izdalās kā atbildes reakcija uz krūtsgalu stimulāciju, dzemdes kakla un maksts sienu iestiepumu. Kā jau tika minēts, EA samazina augšupejošo ceļu signālus no šīs zonas un var novest pie oksitocīna nepietiekamas izdalīšanās asinsritē [2, 1137]. Ja izveidojas ne tikai sensorā, bet arī motorā blokāde, tad pavājinās dzemdētājas kontrole pār vēderpreses muskulatūru, kam ir būtiska nozīme izstumšanas procesā, kā arī palielinās distocijas attīstības iespēja. Dabiskajās dzemdībās iegurņa pamatnes muskulatūras funkcija ir šāda: sasprindzinoties ievirzīt augļa galviņu dzemdību ceļos pareizajā pozīcijā, lai tā virzītos cauri iegurnim savā vismazākajā lielumā, t. i., mazā, slīpā diametrā. Lietojot epidurālo atsāpināšanu, zūd iegurņa pamatnes muskulatūras tonuss, tā relaksējas un vairs nespēj tik precīzi virzīt augļa galviņu, tātad predisponē malpozīcijai [7, 381]. Tas potenciāli pagarina dzemdību otro periodu, kā arī palielina risku, ka jāmaina dzemdību vadīšanas stratēģija no dzemdībām pa dabiskajiem ceļiem uz ķirurģiskajām vaginālajām metodēm (vakuumekstrakciju vai stangām).
Neiroaksiālās analgēzijas ietekme uz dzemdību procesu ir pretrunīgi vērtējama. EA var divējādi ietekmēt dzemdību procesu – gan stimulēt dzemdību pirmo periodu, gan kavēt dzemdību pirmo un (vai) otro periodu. Pateicoties EA atsāpinošajam efektam, tiek mazināta simpātiskās sistēmas aktivitāte un tiek bloķēti augšupejošo ceļu impulsi ķermeņa lejasdaļā [2, 1136].
Salīdzinot EA un opioīdu radītos efektus, tika atklāts, ka, veicot EA dzemdībās, palielinās instrumentālu vaginālo dzemdību risks, kā arī prasības pēc oksitocīna lietošanas, un pagarinās dzemdību otrais periods, kā arī, iespējams, palielinās ķirurģisko dzemdību risks dzemdes distocijas un augļa distresa dēļ [1, 17; 8, 997; 13, 853]. Dažos pētījumos pierādīts, ka agrīni uzsākta epidurālā atsāpināšana ir saistīta ar paaugstinātu ķeizargrieziena risku un sliktāku jaundzimušā stāvokli [4, 1204], taču citos pētījumos šī atziņa tiek apstrīdēta [6, 68; 12, 16]. Mūsdienās valda uzskats, ka sievietei ir jāļauj pieprasīt EA arī maza dzemdes kakla atvēruma brīdī, ja viņa to vēlas. Jābūt individuālai pieejai, izvēloties atsāpināšanu, izvērtējot iespējamās dzemdību un atsāpināšanas komplikācijas.
Darba mērķis
Noteikt sakarību starp epidurālās atsāpināšanas ietekmi uz dzemdību procesu dzemdību ceļu dažāda atvēruma brīžos, kā arī EA ietekmi uz jaundzimušā stāvokli.
Materiāls un metodes
Pētījums tika veikts, respektējot Helsinku deklarācijas noteikumus un Cilvēktiesību konvenciju. Tika saņemta Paula Stradiņa Klīniskās universitātes slimnīcas (PSKUS) un Rīgas Stradiņa universitātes (RSU) Ētikas komitejas atļauja veikt pētījumu. Tika saņemta pacienšu piekrišana brīvprātīgi piedalīties pētījumā. Darbs kvalificējams kā prospektīvs aprakstošs kohortas pētījums. Dati tika savākti PSKUS Dzemdību nodaļā no 2015. gada 1. septembra līdz 2016. gada 1. februārim. Dalībnieču iekļaušanai pētījumā bija šādi kritēriji:
- spontāns vai inducēts dzemdību sākums 37.–42. gestācijas nedēļā;
- vienaugļa grūtniecība;
- auglis atrodas garguļā, galva – priekšguļā;
- iestāšanās brīdī nav dzemdību komplikāciju, kas prasītu steidzamu ķeizargrieziena operāciju.
Tā kā dzemdību iznākumu ietekmē paritāte un dzemdību indukcija, pacientes tika iedalītas trīs grupās:
- nulliparas ar spontānu dzemdību sākumu (A) – sievietes, kuras dzemdē pirmo reizi un dzemdības ir sākušās spontāni;
- nulliparas ar indukciju (B) – sievietes, kuras dzemdē pirmo reizi, bet dzemdības ir inducētas medicīniski ar amniotomiju vai mizoprostolu pēc shēmas;
- multiparas (C) – sievietes, kuras dzemdē atkārtoti.
Multiparas dzemdētājas, kam anamnēzē bija ziņas par ķeizargriezienu, netika iekļautas pētījumā.
Katra grupa tika iedalīta apakšgrupās, ņemot vērā dzemdes kakla atvērumu brīdī, kad tika veikta epidurālā atsāpināšana. Par agrīnu tika pieņemta EA uzsākšana brīdī, kad atvērums bija 1–4 cm, par vēlīnu – 5–8 cm. Dzemdību atrisinājums, oksitocīna lietojums, otrā dzemdību perioda ilgums un jaundzimušā vērtējums pēc Apgares skalas 1. un 5. minūtes beigās tika salīdzināts starp apakšgrupām katrā grupā. Par nepieciešamību lietot oksitocīnu pēc EA uzsākšanas tika pieņemts lēmums, ievērojot nosacījumu, ka tas netika lietots jau pirms EA. Otrā dzemdību perioda ilgums tika fiksēts minūtēs un tikai tajos gadījumos, kad dzemdības atrisinājās pa dabiskiem dzemdību ceļiem.
Visos gadījumos pirms EA uzsākšanas tika pārbaudīts, vai epidurālais katetrs atrodas epidurālajā telpā. EA tika veikta ar vājas koncentrācijas (0,125 % Bupivacain) vai vidēji stipras koncentrācijas (0,250 % Bupivacain) bupivakaīna šķīdumu ar vai bez fentanila L2–L3 vai L3–L4, vai L4–L5 starpskriemeļu spraugā. Vāja atšķaidījuma bupivakaīna šķīduma devas tika papildus ievadītas caur epidurālo katetru pēc nepieciešamības.
Pētījumā tika izmantotas šādas metodes iegūto datu apstrādei un analīzei:
- aprakstošā metode – literatūras datu analīze par EA ietekmi uz dzemdību progresu un jaundzimušā stāvokli, kā arī komplikācijām;
- prospektīva datu atlase – pacienšu dzemdību vēstures analīze, kā arī pacienšu intervēšana par komplikācijām pēcdzemdību periodā;
- datu apkopošana un statistiskā analīze – iegūto datu apkopošanai tika izmantota Microsoft Excel programma, bet datu statistiskajai analīzei – IBM SPSS Statistics programma. Kategorisko mainīgo analīzei tika izmantots Fišera (Fisher’s exact) tests, bet nepārtrauktiem mainīgajiem – Manna–Vitnija (Mann Whitney) U tests. Par statistiski nozīmīgu tika pieņemts p < 0,05.
Rezultāti
Šā pētījuma populācija sastāv no 201 pacientes, kuras tika ietvertas pētījumā atbilstīgi izstrādātajiem iekļaušanas kritērijiem. Vidējais pacienšu vecums bija 31 gads (SD ± 5,3; 18–46), un tas statistiski nozīmīgi neatšķiras starp agrīnas un vēlīnas EA uzsākšanas apakšgrupām. Vājas koncentrācijas bupivakaīna šķīdums (0,125 % Bupivacain) tika lietots 67 % gadījumu (n = 135), vidēji stipras koncentrācijas bupivakaīna šķīdums (0,250 % Bupivacain) tika lietots 32,8 % gadījumu (n = 66).
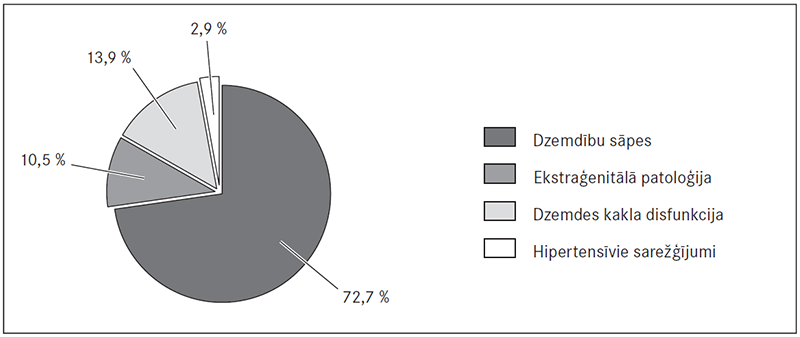
EA tika lietota, ņemot vērā šādas indikācijas:
- dzemdību sāpes (73 %);
- hipertensīvie sarežģījumi dzemdībās (6 %);
- dzemdes kakla disfunkcija (14 %);
- ekstraģenitālā patoloģija, piemēram, VCC, epilepsija, WPW sindroms (10 %), sk. 1. att.
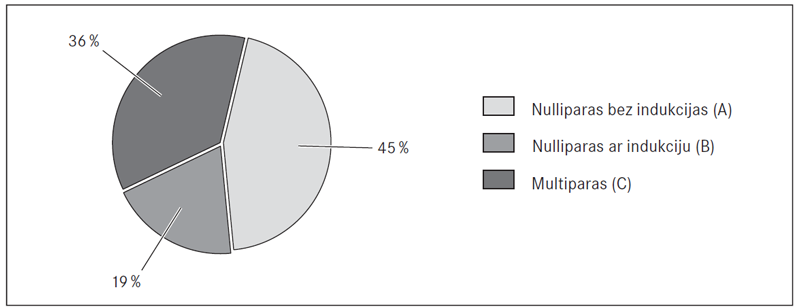
Pētījumā piedalījās 90 (45 %) nulliparas grūtnieces ar spontānu dzemdību sākumu (A grupa), 39 (19 %) nulliparas grūtnieces ar dzemdību indukciju (B grupa) un 72 (36 %) multiparas grūtnieces (C grupa). A grupā bija 47 sievietes ar agrīnu EA lietojumu, kad dzemdes kakla atvērums bija 1–4 cm, un 43 sievietes ar vēlīnu EA lietojumu, kad atvērums bija 5–8 cm; B grupā – 28 pacientes ar agrīnu EA un 11 ar vēlīnu; C grupā – 34 ar agrīnu un 38 ar vēlīnu EA lietojumu.
Dzemdētāju iedalījumu grupās sk. 2. att.
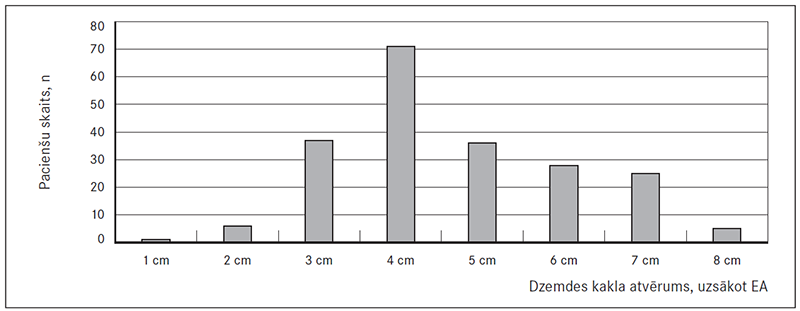
Trešdaļai sieviešu EA tika nodrošināta brīdī, kad dzemdes kakla atvērums bija četri centimetri. Līdzīgs skaits pacienšu saņēma EA, kad dzemdes kakla atvērums bija trīs un pieci centimetri. Kopējais EA biežums katrai dzemdes kakla atvēruma grupai parādīts 3. attēlā.
1. attēls. Epidurālās atsāpināšanas indikācijas / Indications for epidural analgesia
2. attēls. Dzemdētāju iedalījums grupās / Parturiens divided in groups
3. attēls. Epidurālās atsāpināšanas biežums atkarībā no dzemdes kakla atvēruma / Incidence of epidural analgesia and dilatation of cervix
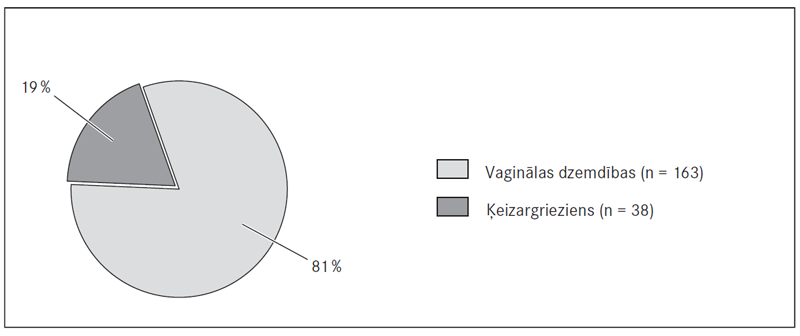
Dzemdību atrisināšanas metodes. Pētījuma laikā nebija neviena gadījuma ar dzemdību vadīšanas stratēģijas maiņu no dzemdībām pa dabiskajiem ceļiem uz vaginālām ķirurģiskām dzemdībām. Dzemdību atrisināšanas metožu biežumu sk. 4. att.
4. attēls. Dzemdību atrisināšanas metodes / Methods of delivery
A grupā (nulliparas ar spontānu dzemdību sākumu) ķeizargriezienu biežums starp tām sievietēm, kas tika nodrošinātas ar EA agrīna dzemdes kakla atvēruma gadījumā, bija 34 % (n = 16), bet starp tām, kas saņēma EA vēlīna atvēruma gadījumā, – 20,9 % (n = 9), (p = 0,12). Fišera tests nenorādīja uz statistiski būtisku atšķirību starp grupām, taču ir vērojama tendence, ka ķeizargriezienu skaits prevalē apakšgrupā ar agrīnu EA uzsākšanu.
B grupā ķeizargrieziena biežums bija 39,3 % (n = 11) agrīni uzsāktas EA un 0 % vēlīnas EA gadījumā (p < 0,05). Fišera tests uzrādīja statistiski būtisku atšķirību starp grupām.
C grupā dzemdību atrisinājums ar ķeizargriezienu bija tikai apakšgrupā ar agrīnu EA uzsākšanu 5,9 % (n = 2), (p = 0,22).
Sīkāk analizējot gadījumus, kad dzemdības atrisinājās pa dabiskiem dzemdību ceļiem un kad tās atrisinājās ar ķeizargrieziena operāciju, katrā no grupām (A, B, C) tika konstatēts, ka kopējais lietotā bupivakaīna daudzums neietekmē dzemdību vadīšanas metodi. Respektīvi, kopējā lietotā bupivakaīna daudzuma aprēķinātā mediānas vērtība statistiski neatšķīrās starp tām sievietēm, kas piedzemdēja pašas, un tām, kam veica ķeizargrieziena operāciju. A grupā tika lietoti 5,1 mg un 5,5 mg (p = 0,16) preparāta, B grupā – 4,5 mg un 6,2 mg (p = 0,12) un C grupā – 3,3 mg un 3,5 mg (p = 0,42).
Analizējot ķeizargrieziena cēloņus, no pētījuma populācijas A grupas tika izdalītas tikai tās pacientes, kam dzemdības atrisinājās ķirurģiskā ceļā. Ķeizargrieziena cēloņi tika iedalīti divās grupās: tie, kuri var būt saistīti ar EA (dzemdes distocija un (vai) augļa distress), un citi, ar EA nesaistītie ķeizargrieziena cēloņi. Fišera tests parāda, ka agrīnas EA apakšgrupā ir vairāk ķeizargriezienu tieši dzemdes distocijas un (vai) augļa distresa dēļ (94 %, n = 15) nekā vēlīnās EA apakšgrupā (56 %, n = 5), (p < 0,05). B un C grupā dzemdes distocija un (vai) augļa distress bija ķeizargrieziena cēlonis tikai agrīnās EA uzsākšanas apakšgrupās.
Oksitocīna lietošana. A grupā oksitocīns tika lietots 44,7 % sieviešu (n = 21) agrīnas EA uzsākšanas un 48,8 % (n = 21) vēlīnas uzsākšanas (p = 0,43) gadījumu. B grupā tika iegūta statistiski ticama atšķirība oksitocīna lietošanai atkarībā no dzemdes kakla atvēruma brīža, kad EA tika lietota. Apakšgrupā ar EA lietojumu, kad atvērums bija 1–4 cm, nepieciešamība lietot oksitocīnu bija 50 % (n = 14), bet apakšgrupā ar atvērumu 5–8 cm – tikai 9,1 % (n = 1), (p < 0,05) gadījumu. C grupā oksitocīnu saņēma 5,9 % (n = 2) pacienšu agrīnas EA uzsākšanas apakšgrupā un 13,2 % (n = 5) pacienšu vēlīnas EA uzsākšanas apakšgrupā (p = 0,26).
Otrā dzemdību perioda ilgums. Otrā dzemdību perioda vidējais ilgums nulliparām sievietēm ar spontānu dzemdību sākumu (A grupa), uzsākot EA dažāda dzemdību ceļu atvēruma gadījumos, atšķiras par 40 minūtēm. Tas bija 100 minūtes (SD ± 54; 13–223), veicot EA agrīni, un 140 minūtes (SD ± 69; 25–313), veicot EA vēlīni (p < 0,05). B grupā otrā perioda vidējais ilgums bija 110 minūtes (SD ± 58; 35–210) agrīnas EA uzsākšanas gadījumā un 187 minūtes vēlīnas (SD ± 93; 62–275), uz statistiski nozīmīgu atšķirību norāda Manna–Vitnija U tests (p < 0,05). C grupā otrā dzemdību perioda vidējais ilgums būtiski neatšķīrās starp agrīni un vēlīni uzsāktas EA apakšgrupām – atbilstoši 53 (± 50; 10–244) un 58 (± 59; 12–265) minūtes.
Jaundzimušā stāvokļa vērtējums pēc Apgares skalas pirmās minūtes beigās. A grupā vērojama tendence, ka sliktākie rādītāji pēc Apgares skalas ir tiem jaundzimušajiem, kuru mātēm EA tika uzsākta pirmā dzemdību perioda latentajā fāzē, kad dzemdes kakla atvērums bija 1–4 cm. Apakšgrupā ar agrīnu EA uzsākšanu 12,8 % (n = 6) jaundzimušo vērtējums bija < 7 balles pēc Apgares skalas, savukārt vēlīnajā grupā tas bija 4,7 % (n = 2) gadījumu (p = 0,16).
B grupā pirmās minūtes beigās 10,7 % (n = 3) jaundzimušo agrīnajā apakšgrupā vērtējums pēc Apgares skalas bija < 7 balles un 9,1 % (n = 1) jaundzimušo vēlīnajā apakšgrupā vērtējums bija < 7 balles. Rezultāts nav statistiski ticams (p = 0,69).
C grupā 2,9 % jeb vienam jaundzimušajam pēc Apgares skalas bija < 7 balles agrīnajā apakšgrupā, visiem jaundzimušajiem vēlīnajā apakšgrupā vērtējums pēc Apgares skalas bija ≥ 7 balles (p = 0,47).
Jaundzimušā stāvokļa vērtējums pēc Apgares skalas piektās minūtes beigās. A grupā tika atrasta statistiski nozīmīga atšķirība Apgares skalas rādītājos jaundzimušajiem, kuru mātēm EA tika lietota agrīni dzemdībās, un tiem, kas bija vēlīnas EA apakšgrupā. Uzsākot EA agrīni dzemdībās, 10,6 % (n = 5) jaundzimušo vērtējums pēc Apgares skalas bija < 7 balles, bet, uzsākot EA vēlīni, visiem jaundzimušajiem bija ≥ 7 ballēm (p < 0,05). B un C grupā visiem jaundzimušajiem vērtējums pēc Apgares skalas bija ≥ 7 ballēm gan agrīnas, gan vēlīnas EA apakšgrupā. Rezultātu apkopojumu sk. 1. tab.
1. tabula. Epidurālās atsāpināšanas lietošanas rezultātu apkopojums / Summary of epidural analgesia results
| Nulliparas ar spontānu dzemdību sākumu (A) | Nulliparas ar dzemdību indukciju (B) | Multiparas (C) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1–4 cm | 5–8 cm | p vērtība | 1–4 cm | 5–8 cm | p vērtība | 1–4 cm | 5–8 cm | p vērtība | |
| Ķeizargrieziens, % | 34 | 20 | 0,12 | 39 | 0 | < 0,05 | 5,9 | 0 | 0,22 |
| Oksitocīna lietošana, % | 44,7 | 48,8 | 0,43 | 50 | 9,1 | < 0,05 | 5,9 | 13,2 | 0,26 |
| Otrā dzemdību perioda ilgums, min | 100 | 140 | < 0,05 | 110 | 187 | < 0,05 | 53 | 58 | 0,9 |
| Apgares skala 1. minūtes beigās < 7 balles, % | 12,8 | 4,7 | 0,16 | 10,7 | 9,1 | 0,69 | 2,9 | 0 | 0,47 |
| Apgares skala 5. minūtes beigās < 7 balles, % | 10,6 | 0 | < 0,05 | 0 | 0 | — | 0 | 0 | — |
Diskusija
Epidurālā atsāpināšana var divējādi ietekmēt dzemdības – gan stimulēt, gan kavēt dzemdību progresu. Pateicoties EA atsāpinošajam efektam, tiek mazināta simpātiskās sistēmas aktivitāte, tiek bloķēti augšupejošo ceļu impulsi ķermeņa lejasdaļā. Lai noskaidrotu, kā epidurālā atsāpināšana ietekmē dzemdību procesu, tika veikti gan aprakstoši, gan randomizēti kontrolēti pētījumi, kuros pacientes tika iedalītas grupās atbilstīgi dzemdību analgēzijas metodei. Pētnieki, kas pievērsušies šai jomai, salīdzina dzemdību iznākumu un jaundzimušā stāvokli dzemdētājām, kas saņem EA, opioīdus sistēmiski vai arī slāpekļa oksīda inhalācijas, vai nefarmakoloģiskas atsāpināšanas metodes. Prospektīvos pētījumos, kuros randomizācijas rezultātā viena pacienšu grupa saņēma epidurālo atsāpināšanu, bet otra saņēma opioīdu analgēziju, tika konstatēts, ka EA grupā ir par 5–15 % lielāks instrumentālu vaginālu dzemdību īpatsvars, salīdzinot ar grupu, kur EA netika veikta [9, 717; 13, 853]. Šī asociācija tika atzīta par nozīmīgu arī randomizētu pētījumu metaanalīzē [1, 17].
Pāreja no vaginālām dzemdībām uz asistētām vaginālām dzemdībām ir saistīta ar iespējamām komplikācijām kā sievietei (nopietni starpenes ievainojumi), tā arī jaundzimušajiem (galviņas mīksto audu hematoma un ievainojumi) [8, 997]. Dažos pētījumos apstiprinās EA un ķeizargrieziena asociācija dzemdes distocijas [13, 853] un augļa distresa dēļ [11, 787]. Ar dzemdes distociju saprot to, ka dzemdes kontrakcijas nenoved pie dzemdes kakla atvēršanās vai augļa galviņas ieslīdēšanas dzemdību ceļos, bet par augļa distresu liecina sirdsdarbības frekvences samazinājums. Savukārt citi pētījumi un metaanalīzes šādu asociāciju neapstiprina [1, 17; 9, 717]. Jautājums par to, kāpēc dažos pētījumos pastāv šāda asociācija un vai tā ir tikai asociācija vai arī tieši EA ir ķeizargrieziena cēlonis, paliek pretrunīgs. Lai arī pētnieki mēģina maksimāli izlīdzināt atšķirības starp izpētes grupām, tomēr pastāv uzskats, ka sievietēm, kam dzemdībās ir nepieciešana EA, jau sākotnēji ir smagākas dzemdības, un viņām būtu paaugstināts ķeizargrieziena risks arī bez tās [8, 993]. Par to, ka epidurālās atsāpināšanas lietojums izraisa lielāku nepieciešamību pēc oksitocīna lietojuma un ka tas pagarina otro dzemdību periodu, pētniekiem nav domstarpību. Nepieciešamība pēc oksitocīna substitūcijas EA grupā pieaug vidēji par 20 %, salīdzinot ar intravenozo opioīdu atsāpināšanas grupu [1, 17]. Otrais dzemdību periods ir garāks aptuveni par 20 minūtēm EA grupā [1, 17; 9, 717]. Dzemdības ietekmē divus pacientus – māti un augli, tādējādi augļa un jaundzimušā labklājības nodrošināšana ir viens no dzemdību atsāpināšanas uzdevumiem. Epidurālajai analgēzijai ir priekšroka šajā ziņā. Tā nepasliktina Apgares skalas rādītājus 1. un 5. minūtes beigās, salīdzinot ar opioīdu atsāpināšanu [9, 717]. Turklāt pēc sistēmiskas opioīdu lietošanas jaundzimušajam dažreiz ir nepieciešama naloksona ievadīšana, kas nav vajadzīga pēc EA, jo šajā gadījumā analgētiskie līdzekļi nenonāk augļa asinsritē.
Vēl 2000. gadā Amerikas Dzemdību speciālistu un ginekologu koledža (The American College of Obstetricans and Gynecologists) publicēja rekomendācijas neveikt dzemdību atsāpināšanu ar EA, ja dzemdes kakla atvērums ir mazāks par četriem līdz pieciem centimetriem, ja tas ir iespējams, jo saistīja to ar paaugstinātu ķeizargrieziena risku. Bet jau 2006. gadā šī rekomendācija tika pārskatīta, jo jaunie pētījumi parādīja, ka EA nepalielina ķeizargrieziena biežumu, ja to dzemdībās uzsāk agrīni [5, 1486]. Iepriekšējo uzskatu, ka agrīni uzsākta EA var tieši vai netieši negatīvi ietekmēt dzemdību procesu, nomainīja atziņa, ka agrīns pieprasījums pēc EA var būt marķieris citiem disfunkcionālu dzemdību riska faktoriem un rezultātā – ķeizargriezienam [12, 16]. 2014. gadā veiktā metaanalīze, kas kopumā iekļāva 15 752 sievietes, parādīja, ka agrīni uzsākta EA nav saistīta ar palielinātu ķirurģisku vaginālu dzemdību skaitu, ķeizargrieziena biežumu, oksitocīna lietošanu, kā arī, uzsākot EA latentajā dzemdību fāzē, nav pierādījies sliktāks iznākums jaundzimušajam, spriežot pēc Apgares skalas rādītājiem 1. un 5. minūtes beigās. Tomēr ir minēts, ka sievietes, kas tika randomizētas vēlīnās EA grupā, saņēma alternatīvas atsāpināšanas metodes, līdz dzemdes kakla atvērums sasniedza 4–5 cm, tāpēc ir grūti skaidri un viennozīmīgi novērtēt iepriekš minētos rezultātus [6, 66].
Šī pētījuma rezultāti nesaskan ar pasaulē prevalējošo uzskatu par EA lietojumu agrīni dzemdībās – tika novērota palielināta ķeizargrieziena riska tendence, lielāka nepieciešamība lietot oksitocīnu un sliktāks jaundzimušā vērtējums pēc Apgares skalas [6, 68]. Nevar noteikti apgalvot, ka tieši agrīna EA uzsākšana bija tā visa cēlonis. Pat stipra asociācija starp diviem notikumiem nepierāda to, ka viens izraisa otru, jo var eksistēt arī trešais nosacījums, kas izraisa abus notikumus. Veiktajā pētījumā tika mēģināts nepieļaut šeit minēto situāciju, tādēļ pētāmā populācija tika iedalīta grupās, lai pēc iespējas mazinātu jaucējfaktoru ietekmi uz rezultātiem. Tomēr ne visus no tiem var definēt. Iespējams, ka sievietes, kas izjūt ļoti stipras sāpes un pieprasa EA jau pirmā perioda latentajā fāzē, jau sākotnēji ir vairāk predisponētas disfunkcionālu dzemdību attīstībai. Bet nevar arī aizmirst par to, ka cilvēkiem ir atšķirīgs sāpju slieksnis un agrīnu EA uzsākšanu dzemdībās pieprasa tieši sievietes ar zemāku sāpju slieksni.
Secinājumi
Agrīns EA lietojums dzemdībās (kad dzemdību ceļu atvērums 1–4 cm) ir saistīts ar paaugstinātu ķeizargrieziena risku, īpaši dzemdes distocijas un augļa distresa dēļ, ar lielāku nepieciešamību lietot oksitocīnu, sliktāku jaundzimušā stāvokli, vērtējot pēc Apgares skalas 1. un 5. minūtes beigās, bet EA lietojums nav saistīts ar dzemdību garāku otro periodu.
Abstract
Effects of Epidural Analgesia on a Labour Progress and a New-born
The aim of the study was to assess the influence of timing of epidural analgesia (EA) on the progress of labour and the state of a new-born.
The study was conducted at Pauls Stradiņš Clinical University Hospital. Only term parturients with epidural pain relief in labour were included. Patients were divided into three groups: nulliparous with spontaneous onset of labour (A), nulliparous with induction (B), multiparous (C), and multiparous. Each of them was divided in subgroups by dilatation of cervix when EA was performed – 1–4 cm (early) and 5–8 cm (delayed). The progress of labour and a new-born state were compared between subgroups. A total of 201 patients participated in this study: 90 parturients in group A, 39 in group B and 72 in group C.
In Group A, the caesarean rate among women receiving epidural analgesia with dilation 1–4 cm was 34 % compared to 21 % among those who did not receive it with dilation 5–8 cm (p = 0.12); in Group B – 39 % and 0 % respectively (p < 0.05); in Group C – 5.9 % and 0 % respectively (p = 0.22).
In Group A, 45 % women in early epidural subgroup and 49 % women in delayed epidural subgroup received oxytocin augmentation after analgesia (p = 0.43); in Group B – 50 % and 9 % respectively (p < 0.05); in Group C – 6 % and 13 % respectively (p = 0.26). The length of the second stage of labour was 100 minutes in the early subgroup and 140 minutes in the delayed in group A (p < 0.05); 110 and 187 minutes respectively in group B (p < 0.05). There was no significant difference of duration of second stage of labour in multiparous women. Apgar score in Group A less than 7 in one minute was 13 % in subgroup with dilation 1–4 cm and 5 % in subgroup with dilation 5–8 cm (p = 0.16); in Group B – 11 % and 9 % respectively (p = 0.69); in Group C – 3 % and 0 % respectively (p = 0.47).
Early initiation of epidural analgesia in labour is related to increased risk of caesarean section, increased oxytocin augmentation, worse Apgar score at one and five minutes after birth, but not to prolonged second stage of labour.
Literatūra
- Anim-Somuah, M., Smyth, R., Jone, L. Epidural versus non-epidural or no analgesia in labour (review). The Cochrane Collaboration. 2011, 127.
- Bromage, F. R. Continuous lumbar epidural analgesia for obstetrics. Canadian Medical Association Journal. 1961, 85, 1136–1140.
- Cambic, C. R., Wong, C. A. Labour analgesia and obstetric outcomes. British Journal of Anaesthesia. 2010, 105(1), 50–60.
- Chestnut, D. H., McGahrt, J. M., Vincent, R. D. et al. Does early administration of epidural analgesia affect obstetric outcome in nulliparous women who are in spontaneous labor? The Journal of American Society of Anesthesiologist. 1994, 80(6), 1201–1208.
- Committee on Obstetric Practice. Analgesia and Cesarean Delivery Rates. American College of Obstetricians and Gynecologist. 2006, 339, 1486–1487.
- Dickinson, J. E., Paech, M. J., McDonald, S. et al. The impact of intrapartum analgesia on labour and delivery outcome in nulliparous women. The Australian & New Zealand Journal of Obstetrics & Gynaecology. 2002, 42, 65–72.
- King, T. Epidural anesthesia in labor. Benefits versus risks. Journal of Nurse-midwifery. 1997, 42, 377–388.
- Lieberman, E., Lang, J. M., Cohen A. et al. Association of epidural analgesia with cesarean delivery in nulliparas. Obstetrics & Gynecology. 1996, 88, 903–1070.
- Loughnan, B. A., Carli, F., Romney, M. et al. Randomized controlled comparison of epidural bupivacaine versus pethidine for analgesia in labour. British Journal of Anesthesia. 2000, 84, 715–719.
- Melzak, R. The myth of painless childbirth. Pain. 1984, 19, 321–337.
- Ramin, S. M., Gambling, D. M., Lucas M. J. et al. Randomized trial of epidural versus intravenous analgesia during labor. Obstet Gynecol. 1995, 86, 783–789.
- Sng, B. L., Leong, W. L., Zeng, Y. Early versus late initiation of epidural analgesia for labour. The Cochrane Collaboration. 2014, 80.
- Thorp, J. A., Hu, D. H., Albin, R. M. et al. The effect of intrapartum epidural analgesia on nulliparous labor: a randomized, controlled, prospective trial. American Journal of Obstetrics and Gynecology. 1993, 169(4), 851–858.


