Morfoloģisko un imūnhistoķīmisko kritēriju korelācija ar klīniski laboratoriskajiem rādītājiem sekretējošas multiplas mielomas gadījumos
Kopsavilkums
Ievads. Multiplās mielomas (MM) šūnās imūnhistoķīmiski ir konstatēta vairāku onkogēno un aberanto marķieru ekspresija: p53, ciklīnu D1, CD56, LCA u. c., kuru nozīme literatūrā tiek vērtēta pretrunīgi.
Darba mērķis. Analizēt korelācijas starp kaulu smadzeņu morfoloģisko, imūnhistoķīmisko raksturojumu un laboratoriskiem testiem MM progresēšanas gaitā.
Materiāls un metodes. Tika analizēti 42 pacienti ar MM dažādās tās stadijās. Salīdzinājām klīniski laboratoriskos, kaulu smadzeņu morfoloģiskos un imūnhistoķīmiskos parametrus. Noteicām CD138, CD20, LCA, ciklīna D1, p53, Ki-67, BCL2, kappa / lambda vieglo ķēžu un CD56 ekspresiju. Statistiskā analīze veikta ar Graph Pad Prism 5 versiju.
Rezultāti. Konstatējām, ka paaugstināts M gradienta un ß2 mikroglobulīna līmenis statistiski ticami korelē ar paaugstinātu CD138+ šūnu procentuālo daudzumu, plazmoblastisku diferenciāciju, paaugstinātu celularitāti un paaugstinātu p53 ekspresiju. Paaugstināts ß2-mikroglobulīna līmenis asinīs korelē ar izteiktāku ciklīna D1 ekspresiju un CD56 zudumu. Klīniskā stadija pēc Salmon–Durie klasifikācijas pozitīvi korelē ar kaulu smadzeņu celularitāti un plazmoblastisko diferenciāciju. Kalcija līmeņa paaugstināšanās asinīs korelē ar paaugstinātu celularitāti, plazmoblastisko MM diferenciāciju un CD56 ekspresijas zudumu. p53 ekspresija, ciklīna D1 pozitivitāte, CD138+ procentuālais daudzums un kaulu smadzeņu celularitāte trešajā stadijā bija statistiski ticami lielāka nekā otrajā.
Paaugstināta kaulu smadzeņu celularitāte, liels plazmocītu skaits, kā arī plazmoblastiska diferenciācija korelē ar ß2 mikroglobulīna, M gradienta līmeņa paaugstināšanos un hemoglobīna līmeņa pazemināšanos, kas raksturīgs vēlīnākām MM stadijām.
Secinājumi. CD56 ekspresijas izzušana attīstās paralēli ar slimības progresēšanu un laboratorisko testu pasliktināšanos: kreatinīna un kalcija, ß2-mikroglobulīna līmeņa paaugstināšanos un trombocītu skaita samazināšanos. Pastiprināta p53 un ciklīna D1 ekspresija, iespējams, ietekmē MM progresiju.
Ievads
Multiplajai mielomai (MM) kā ļaundabīgai hematoloģiskai slimībai ir raksturīga klonāla plazmocītu proliferācija kaulu smadzenēs, un parasti slimniekiem konstatē monoklonālu paraproteīnu (M gradientu) asinīs un / vai urīnā [Singhal, et al., 2006], bet MM vēlīnās stadijās mielomas šūnas lielā daudzumā parādās perifērajās asinīs. MM gadījumā ir raksturīgi osteolītiski bojājumi, patoloģiski lūzumi, sāpes kaulos, hiperkalcēmija un anēmija [Elaine, et al., 2001].
MM ir daudzpakāpju audzēju ģenēzes process, iesaistot gēnus, kas kontrolē šūnu attīstības ciklu. Piemēram, p53 akumulācija korelē ar pacienta dzīvildzi, vecumu, klīnisko stadiju un recidīvu biežumu. Ir dati, ka p53 imūnhistoķīmisko ekspresiju atipiskos plazmocītos var izmantot kā prognostisku MM faktoru [Pruneri, et al., 2003]. MM ir maligna B limfocitāras ģenēzes neoplāzija, kas veidojas no folikulāro centru B limfocītiem, kas diferencējas par plazmocītiem [Bergsagel, et al., 2001].
Latvijā gadā tiek reģistrēti ap 100 pacientu ar MM, tas ir, 5 gadījumi uz 100 000 iedzīvotāju. Piecu gadu dzīvildze ir 10–50 % gadījumu, tomēr, pateicoties jaunākajiem ārstēšanas paņēmieniem, pacienti dzīvo 10–20 vai pat vairāk gadu [Pildava, 2012; Lejniece u. c., 2014].
MM klīnisko stadiju nosaka, izmantojot M. Durie un S. Salmon 1975. gadā izstrādāto klasifikāciju [Durie, Salmon, 1975], bet kopš 2005. gada – Starptautiskā mielomas fonda (International Myeloma Foundation) MM stadiju klasifikāciju, nosakot ß2-mikroglobulīna līmeni [Greipp, et al., 2005]. Izmantojot Salmon–Durie klasifikāciju, nosaka vairākus klīniskus un laboratoriskus parametrus, bet Starptautiskā mielomas fonda klasifikācijā stadiju nosaka pēc ß2-mikroglobulīna līmeņa (sk. 1. tab.).
Ļoti svarīga ir agrīna slimības diagnostika, tai skaitā, izmantojot trepānbiopsiju imūnhistoķīmiskos izmeklējumus. Kaulu smadzeņu imūnhistoķīmiskā analīzes metode ir ļoti svarīga slimības prognozes noteikšanā, jo var kvalitatīvi un kvantitatīvi izvērtēt svarīgus proteīna biomarķierus [Santra, et al., 2011].
MM gadījumā konstatē vairāku marķieru aberanto ekspresiju mielomas šūnās, piemēram, CD56, LCA (CD45), CD20 u. c. [Harrington, et al., 2009].
1. tabula. Salmon–Durie klasifikācijas un Starptautiskā mielomas fonda multiplās mielomas klasifikācijas kritēriji / Classification of Multiple Myeloma accordingly Salmon-Durie and International Staging System for Multiple Myeloma
| Stadija | Salmon–Durie klasifikācija | Starptautiskā mielomas fonda klasifikācija | Dzīvildze, mēneši |
|---|---|---|---|
| I |
|
| 62 |
| II | Pazīmes starp I un III stadiju |
| 44 |
| III |
| ß2-mikroglobulīna līmenis > 5,5 mg/l | 29 |
Normāli plazmocīts attīstoties zaudē specifiskus B-limfocitārus marķierus, piemēram, CD19, CD20 un LCA (CD45), un sāk ekspresēt CD138. Aberanta CD56 ekspresija raksturīga atipiskiem plazmocītiem MM gadījumā. Savukārt LCA (CD45) antigēna klātbūtnes bioloģiskā loma mielomas šūnās joprojām ir strīdīga [Kumar, et al., 2005]. Aberanta BCL2 ekspresija raksturīga MM slimniekiem ar hromosomālu aberāciju t(14;18). BCL2 ir svarīgs ieprogrammētas šūnu nāves inhibīcijas proteīns. BCL2 ekspresiju atrod ap 97 % MM gadījumu [Wei, 2003].
Ciklīna D1 ekspresiju nosaka, izmantot imūhistoķīmisko, kā arī in situ hibridizācijas metodi kaulu smadzeņu parafīna griezumos. MM slimniekiem ciklīna D1 imūnhistoķīmiskā ekspresija atipiskos plazmocītos atbilst FISH pozitivitātei. Pētījumos ir konstatēta statistiski nozīmīga korelācija starp izteiktu ciklīna D1 ekspresivitāti un šūnu malignitātes līmeni, kā arī paaugstinātu mielomas šūnu infiltrāciju kaulu smadzenēs. Ciklīna D1 ekspresija korelē ar augstāku MM histoloģisko stadiju [Athanasiou, et al., 2001].
Normāli CD56 ekspresiju konstatē dabīgajās galētājšūnās (angl. natural killers, NK cells) un kaulu smadzenēs osteoblastos, bet 1990. gadā pierādīta aberanta CD56 ekspresija mielomas šūnās. Šo pozitivitāti nosaka, izmantojot imūnhistoķīmisku metodi kaulu smadzeņu parafīna griezumos un / vai ar plūsmas citometriju kaulu smadzeņu aspirātā vai perifērajās asinīs. Aberantu CD56 ekspresiju mielomas šūnās konstatē 70–80 % MM gadījumu [Harrington, et al., 2009]. Aberantā marķiera CD56 ekspresijas, kā arī hromosomālas aberācijas t(11;14) trūkumu mielomas šūnās saista ar plazmoblastisku diferenciāciju mielomas šūnās, augstāku ß2-mikroglobulīna līmeni, izteiktāku nieru mazspēju, trombocitopēniju un sliktu MM prognozi, kā arī īsāku dzīvildzi pacientiem, kuri ārstēti ar lielām ķīmijterapijas devām [Hundemer, et al., 2007].
Plazmoblastiskām šūnām ir raksturīga zemāka diferenciācija. Tajās konstatē lielu, visbiežāk centrāli novietotu kodolu ar vairākiem kodoliņiem, palielinātu kodola un citoplazmas attiecību, un ļoti bieži konstatē perinukleārās “halo zonas” zudumu [Athanasiou, et al., 2001].
Pētnieku grupa no Grieķijas ir pierādījusi, ka pRb (retinoblastomas gēna RB1 produkts), p16 (CDKN2A/p16INK4a audzēju supresorgēna produkts) un Ki-67 marķieri vienmēr ekspresējas MM malignajās šūnās, turklāt proporcionāli slimības malignitātes pakāpei. P53 ekspresijas palielināšanos mielomas šūnās saista ar neoplāzijas progresiju. Izteikta P53 pozitivitāte korelē ar vēlīnu MM klīnisko stadiju, histoloģiskās stadijas progresiju un Ki-67 ekspresiju mielomas šūnās vairāk par 10 %. Ki-67 ekspresija (> 10 % mielomas šūnu) līdzīgi korelē ar MM audzēja stadiju un slimības histoloģiskās stadijas progresiju. P53 un Ki-67 imūnhistoķīmiskie marķieri kaulu smadzenēs var palīdzēt noteikt MM potenciālo agresivitāti [Kanavaros, et al., 2000].
Savukārt citi autori secina, ka p53 mutācija MM gadījumā ir salīdzinoši reta un liecina par ierobežotu tās lomu MM slimības patoģenēzē. Ir pētījumi, kuros neatrod korelāciju starp MM prognozi un ciklīna D1 un p53 pozitivitāti trepanbiopsijās slimniekiem ar MM [Marković, et al., 2004]. Bet Toronto zinātnieku grupa pierādīja, ka p53 proteīna nukleārā ekspresija, nosakot ar standarta imūnhistoķīmiskajām metodēm un FISH metodi, trepānbiopsijās stingri korelē ar TP53 delēciju un nelabvēlīgu klīnisku iznākumu MM slimniekiem [Chang, et al., 2007]. Pacientiem ar paaugstinātu mielomas šūnu proliferācijas indeksu (ar Ki-67 marķētas šūnas > 10 %) konstatē īsāku dzīvildzi nekā pacientiem ar zemāku proliferācijas ātrumu [Marković, et al., 2005].
P53 ekspresijas noteikšanu ar imūnhistoķīmisko metodi var lietot kā alternatīvu FISH metodei, kad nosaka del (17p13)(TP53). Imūnhistoķīmiskie izmeklējumi ir lētāki un vienkāršāki to interpretācijā. MM slimniekiem ar FISH metodi ir pierādīta delēcija 15 % gadījumu, bet ar imūnhistoķīmisko metodi – 13 % gadījumu [Chen, et al., 2012]. Klīniski svarīgi ir noteikt iepriekš aprakstīto marķieru ekspresiju dažādās MM stadijās.
Darba mērķis
Izvērtēt kaulu smadzeņu trepānbiopsiju morfoloģisko un imūnhistoķīmisko raksturojumu un salīdzināt to ar laboratoriskiem testiem pacientiem ar primāri diagnosticētu sekretējošu MM dažādās tās stadijās.
Materiāls un metodes
Retrospektīvā pētījumā tika analizēti 42 multiplā mielomas slimnieku gadījumi, kuriem laika periodā no 2011. gada janvāra līdz 2014. gada martam tika veikta trepānbiopsija un diagnoze apstiprināta histoloģiski. Klīniskie un laboratoriskie dati tika iegūti no pacientu ambulatorajām kartēm un slimības vēsturēm.
Tika noteikta klīniskā stadija pēc Salmon–Durie klasifikācijas (IA, IB, IIA, IIB, IIIA, IIIB).Tika ņemts vērā pacientu vecums un dzimums. Pētījumā izvērtējām šādus laboratoriskos datus, kas bija noteikti E. Gulbja laboratorijā (iekavās norādīta norma): ß2-mikroglobulīns (0–3 mg/l); LDH – laktātdehidrogenāze (125–240 IU/l); albumīns (34–52 g/l); kopējais olbaltumvielu daudzums (64–84 g/l); hemoglobīna līmenis (♂ 126–175 g/l, ♀ 118–161 g/l); trombocītu skaits (150–410 × 109 l); GFĀ – glomerulu filtrācijas ātrums (ml/min); kreatinīns (♂ 62–115 μmol/l, ♀ 53–106 μmol/l); CRO – C reaktīvais olbaltums (< 8 mg/l); kalcija līmenis (2,2–2,6 mmol/l); kālija līmenis (3,5–5,3 mmol/l); M gradients (N–0 g/l); IgG (800–1800 mg/dl), IgA (40–400 mg/dl). Analizētajā grupā netika ietverti nesekretējošas MM gadījumi.
Kaulu smadzeņu bioptāti (trepānbiopsijas) tika fiksēti 10 % neitrālā (pH = 7) buferētā formalīnā, tie tika dekalcinēti, lietojot Microdecfast šķidrumu, apstrādāti, izmantojot vakuuma procesoru (Sakura Tissue-Tek VIP 5) un ieguldīti parafīnā. Morfoloģisko datu izpētē lietojām ≤ 4–5 mikronu biezus trepānbiopsijas griezumus uz priekšmetstikliem. Tika veiktas šādas rutīnas histoķīmiskās krāsošanas metodes: hematoksilīns un eozīns, perjodskābes–Šifa reakcija (PAS), Gimzas metode, Gordona retikulīna noteikšana.
Mikropreparātos analizējām kaulu smadzeņu šūnu sastāvu, izteiktu procentos, plazmatisko šūnu procentuālo daudzumu, plazmatisko šūnu atipiskumu un citoloģiskās īpatnības (piemēram, plazmoblastiska un / vai limfocitāra diferenciācija); mielopoēzes un eritropoēzes īpatnības; megakariocītu daudzumu un raksturojumu; mielofibrozes esamību un tās pakāpi; kaulaudu trabekulu mikroskopisku bojājumu (mikroosteolīzes fokusi).
Visās trepānbiopsijās imūnhistoķīmiski tika izvērtēti šādi marķieri: CD138 (antivielas klons M15, gatava lietošanai, Dako), CD20 (antivielas klons L26, gatavs lietošanai, Dako), LCA-CD45 (antivielas klons 2B11 + PD7/26, atšķaidījums 1 : 50, Dako), ciklīns D1 (antivielas klons SP4, gatavs lietošanai, Dako), p53 (antivielas klons Do-7, gatavs lietošanai, Dako), Ki-67 (antivielas klons MIB-1, atšķaidījums 1 : 50, Dako), BCL2 (antivielas klons 124, gatavs lietošanai, Dako), kappa vieglā ķēde (gatavs lietošanai, Dako), lambda vieglā ķēde (gatavs lietošanai, Dako), CD56 (antivielas klons 123C3, atšķaidījums 1 : 50, Dako).
Darbā tika lietota EnVision imūnhistoķīmiskā vizualizācijas sistēma uz speciāliem elektrostatiskiem priekšmetstikliņiem – HistoBond+. Iegūtos rezultātus interpretējām, lietojot puskvantitatīvo metodi, izvērtējot imūnhistoķīmiskā marķiera ekspresiju neoplastiskās šūnās, izteiktu %, kā arī nosakot reakcijas intensitāti.
Objektīvākai rezultātu interpretācijai imūnhistoķīmisko marķieru ekspresiju iedalījām trīs pakāpēs, modificējot Pruneri puskvantitatīvo histoloģisko citometrijas novērtēšanas metodi [Pruneri, et al., 2002]:
- pozitīva marķiera reakcija (imūnreaktivitāte ir pozitīva 30–50 % šūnu ar augstu krāsojuma intensitāti);
- vāji pozitīva marķiera reakcija (vājas intensitātes pozitīva imūnreaktivitāte un / vai tās ekspresija 16–30 % šūnu);
- ļoti zema marķiera reakcija līdz pat tās zudumam (ekspresija 0–15 % maligno šūnu).
CD138, CD20, LCA, BCL2, kappa vieglās ķēdes, lambda vieglās ķēdes un CD56 ekspresiju noteicām citoplazmā un / vai šūnu membrānā (citolemmā), bet p53, Ki-67 un ciklīna D1 reaktivitāti diagnosticējām šūnu kodolos. CD138 pozitīvās šūnas jeb plazmocītus noteicām procentuāli. Pārējos marķierus interpretējām, iegūtos rezultātus sadalot trīs iepriekš aprakstītajās grupās. Kappa, lambda, CD56, BCL2 marķieru ekspresiju interpretējām kā pozitīvu vai negatīvu. Kontroles grupa bija trīs pacientu mugurkaula operācijas materiāls ar diagnozi “deformējošs spondilīts”.
Dati tika apstrādāti ar Microsoft Excel 2010 un Graph Pad Prism 5. versijas programmu. Datu sadalījums normālajam tika pārbaudīts, izmantojot D’agostino–Pīrsona (D’Agostino–Pearson) metodi. Rezultāti tika novērtēti kā statistiski ticami, ja p < 0,05. Grupas tika salīdzinātas ar Benferoni pēctestu. Korelācija tika vērtēta ar Pīrsona testu.
Rezultāti
Pētījuma grupā bija iekļauti 42 pacienti ar klīniski un histoloģiski apstiprinātu diagnozi “multipla mieloma”. No tiem 22 bija vīrieši un 20 – sievietes. Pacientu vidējais vecums bija 63,6 ± 10,61 gadi (tas variēja no 36 līdz 81 gadam).
Mūsu analizētajā slimnieku grupā saslimšanas klīniskās stadijas pēc Salmon–Durie bija šādas: IA stadija tika noteikta 5 pacientiem; IIA un IIB stadija tika noteikta 31 pacientam, bet IIIA un IIIB stadija bija 6 pacientiem. Visu noteikto laboratorisko testu, morfoloģisko kritēriju un imūnhistoķīmisko rādītāju rezultāti ir atspoguļoti 2. tabulā.
2. tabula. Laboratorisko, morfoloģisko un imūnhistoķīmisko izmeklējumu raksturojums multiplas mielomas gadījumā / Characteristics of lab tests, morphological and immunohistochemical examinations in multiple myeloma cases
| Iegūtie dati | Pētījuma grupa (N = 42) | Stadija pēc Salmon-Durie klasifikācijas, pacientu grupa | ||
|---|---|---|---|---|
| IA stadija (n = 5) | IIA un IIB stadija (n = 31) | IIIA un IIIB stadija (n = 6) | ||
| Vīriešu / sieviešu skaits, n | 22/20 | 2/3 | 16/15 | 4/2 |
| Vecums, gadi | 63,6 ± 10,61 (36–81) | 60,8 ± 9,628 (52–76) | 65,13 ± 9,573 (47–81) | 58 ± 1,4 (36–73) |
| Kreatinīns, μmol/l | 93,29 ± 54,1 (9–304) | 67,4 ± 8,112 (58–76) | 92,06 ± 56,65 (9–304) | 121,2 ± 55,49 (52–191) |
| C reaktīvais olbaltums, mg/l | 8,65 ± 13,11 (0,2–60,4) | 7,42 ± 5,356 (3,2–14) | 6,941 ± 10,98l (0,2–44,6) | 17,93 ± 22,83 (0,5–60,4) |
| ß2-mikroglobulīns, mg/l | 3,467 ± 2,454 (1,5–12,63) | 2,923 ± 0,8095 (2,03–3,69) | 2,76 ± 1,138 (1,5–5,66) | 6,855 ± 4,424 (3,28–12,63) |
| Laktātdehidrogenāze, IU/l | 319,4 ± 102,3 (37,2–459) | 382,7 ± 36,47 (255–424) | 310,5 ± 119,9 (37,2–459) | 305,3 ± 24,55 (291–342) |
| Kālijs, mmol/l | 4,033 ± 0,9598 (1,2–5,58l) | 4,245 ± 0,9158 (3,5–5,58) | 4,033 ± 1,04 (1,2–5,3) | 3,862 ± 0,6965 (3,03–4,7) |
| Kalcijs, mmol/l | 2,36 ± 0,184 (1,99–3,04) | 2,386 ± 0,1723 (2,19–2,6) | 2,341 ± 0,1537 (1,99–2,66) | 1,167 ± 0,3193 (2,1–3,04) |
| Paraproteinūrija | n = 29 (69 %) | n = 3 (40 %) | n = 23 (74 %) | n = 3 (50 %) |
| Paraproteīna smagās ķēdes klase | IgG n = 34 (81 %) IgA n = 8 (19 %) | IgG n = 5 (100 %) | IgG n = 24 (77 %) IgA n = 7 (23 %) | IgG n = 5 (83 %) IgA n = 1 (17 %) |
| Albumīns, g/l | 43,54 ± 31,48 (20–238) | 43,08 ± 7,562 (34–53) | 45,55 ± 36,29 (20–238) | 33,53 ± 5,82 (26–41,5) |
| Kopējais OBV daudzums, g/l | 90 ± 25,3 (12,6–162) | 124,2 ± 11,69 (89–103,7) | 87,86 ± 19,48 (44,9–144) | 95,64 ± 53,29 (12,6–162) |
| Trombocīti, × 109 l | 213 ± 74,81 (69–370) | 237 ± 36,6 (174–269) | 225,5 ± 71,82 (75–370) | 128,3 ± 61,01 (69–209) |
| GFĀ, ml/min | 84,48 ± 33,34 (20–150) | 105 ± 12,59 (88–122) | 83,19 ± 29,37 (20–140) | 74 ± 56,99 (25–150) |
| M gradients serumā, g/l | 28,75 ± 16,68 (2,6–75,7) | 29,5 ± 8,466 (18–41,9) | 24,75 ± 12,89 (2,6–48,4) | 48,83 ± 25,36 (5,26–75,7) |
| Hemoglobīns, g/dl | 106,3 ± 15,4 (72–137) | 124,2 ± 11,69 (109–137) | 107,7 ± 10,62 (90–127) | 84,17 ± 15,46 (72–115) |
| Celularitāte, % | 47,69 ± 19,43 % (15–90 %) | 47 ± 9,747 % (35–60 %) | 47,69 ± 19,43 % (15–90 %) | 73,33 ± 18,623 % (40–90 %) |
| Plazmocītu daudzums, CD138 (+) | 41,33 ± 21,89 % (15–85 %) | 41 ± 27,02 % (15–70 %) | 42,84 ± 17,01 % (15–80 %) | 63,33 ± 24,43 % (20–85 %) |
| Kaulu smadzeņu infiltrācijas tips | INT: n = 6 FOK: n = 4 INT + FOK: n = 22 DIF: n = 10 | INT: n = 2 INT + FOK: n = 2 DIF: n = 1 | INT: n = 4 FOK: n = 4 INT + FOK: n = 18 DIF: n = 5 | INT + FOK: n = 2 (33 %) DIF: n = 4 (67 %) |
| Plazmoblastiska diferenciācija | 10,12 ± 15,68 % (0–60 %) | 5 ± 7,07 % (0–15 %) | 7,06 ± 12,16 % (0–40 %) | 30 ± 23,02 % (0–60 %) |
| Limfocitāra diferenciācija | 3,929 ± 8,87 % (0–40 %) | 3 ± 6,708 % (0–15 %) | 9,206 ± 3,797 % (0–30 %) | 6,67 ± 16,33 % (0–40 %) |
| Vieglās ķēdes klase | Kappa / lambda = 29/13 | Kappa / lambda = 4/1 | Kappa / lambda = 11/20 | Kappa / lambda = 5/1 |
| Mikroskopiska osteolīze | n = 17 (40 %) | n = 1 (20 %) | n = 13 (42 %) | n = 3 (50 %) |
| BCL2 | Pozitīvs: n = 35 (83 %) Negatīvs: n = 7 (17 %) | Pozitīvs: n = 5 (100 %) | Pozitīvs: n = 26 (84 %) Negatīvs: n = 5 (16 %) | Pozitīvs: n = 4 (67 %) Negatīvs: n = 2 (33 %) |
| Ciklīns D1 | Pozitīvs: n = 23 (55 %) Vāji pozitīvs: n = 5 (12 %) Negatīvs: n = 14 (33 %) | Pozitīvs: 3 (60 %) Vāji pozitīvs: 2 (40 %) | Pozitīvs: n = 14 (45 %) Vāji pozitīvs: n = 3 (10 %) Negatīvs: n = 14 (45 %) | Pozitīvs: n = 6 (100 %) |
| CD56 | Pozitīvs: n = 35 (83 %) Negatīvs: n = 7 (17 %) | Pozitīvs: n = 5 (100 %) | Pozitīvs: n = 26 (84 %) Negatīvs: n = 5 (16 %) | Pozitīvs: n = 4 (67 %) Negatīvs: n = 2 (33 %) |
| CD20 | Vāji pozitīvs: n = 5 (12 %) Negatīvs: n = 37 (88 %) | Vāji pozitīvs: n = 1 (20 %) Negatīvs: n = 4 (80 %) | Vāji pozitīvs: n = 3 (10 %) Negatīvs: n = 28 (90 %) | Vāji pozitīvs: n = 1 (17 %) Negatīvs: n = 5 (83 %) |
| Ki-67 | Pozitīvs: n = 12 (28 %) Vidēji pozitīvs: n = 7 (17 %) Negatīvs: n = 23 (55 %) | Pozitīvs: n = 2 (60 %) Negatīvs: n = 3 (40 %) | Pozitīvs: n = 10 (31 %) Vidēji pozitīvs: n = 6 (21 %) Negatīvs: n = 15 (48 %) | Vāji pozitīvs: n = 1 (17 %) Negatīvs: n = 5 (83 %) |
| p53 | Pozitīvs: n = 15 (36 %) Vāji pozitīvs: n = 12 (28 %) Negatīvs: n = 15 (36 %) | Pozitīvs: n = 2 (40 %) Vāji pozitīvs: n = 1 (20 %) Negatīvs: n = 2 (40 %) | Pozitīvs: n = 7 (23 %) Vāji pozitīvs: n = 11 (35 %) Negatīvs: n = 13 (42 %) | Pozitīvs: n = 6 (100 %) |
| LCA (CD45) | Vāji pozitīvs: n = 31 (74 %) Negatīvs: n = 11 (26 %) | Vāji pozitīvs: n = 3 (60 %) Negatīvs: n = 2 (40 %) | Vāji pozitīvs: n = 23 (74 %) Negatīvs: n = 8 (26 %) | Vāji pozitīvs: n = 5 (83 %) Negatīvs: n = 1 (17 %) |
OBV – olbaltumvielas, INT – intersticiāla infiltrācija, FOK – fokāla infiltrācija, DIF – difūza infiltrācija.
Albumīna līmenis MM slimniekiem vidēji bija 43,54 ± 31,48 (tas variēja no 20 līdz 238 g/l), bet 3. stadijā samazinājās līdz 33,53 ± 5,82. Kopējais olbaltumvielu līmenis serumā svārstījās no 126 līdz 152 g/l (vidēji 90 ± 25,3 g/l). Hemoglobīna līmenis slimniekiem bija 106,3 ± 15,4 (72–134) g/dl. Trombocītu skaits bija 213 ± 74,8 (69–370) × 109 l, bet vēlīnā stadijā samazinājās līdz 128,3 ± 61,01. Mielomas slimniekiem glomerulu filtrācijas ātrums (GFĀ) bija 84,48 ± 33,34, dažādās slimības stadijās tas variēja no 20 līdz 150 ml/min. Kreatinīna līmenis vidēji bija 93,29 ± 54,1 (9–304) μmol/l, bet III stadijā palielinājās līdz 121,2 ± 55,49. Kalcija līmenis MM slimniekiem bija 2,36 ± 0,184 (1,99–3,04) mmol/l, bet, slimībai progresējot, tas pazeminājās līdz 1,17 ± 0,32.
Savukārt M gradients vidēji bija 28,75 ± 16,68 (2,6–75,7) g/l, bet III stadijas slimniekiem tas palielinājās līdz 48,83 ± 25,36. Astoņdesmit vienam procentam (n = 34) pacientu paraproteīns bija IgG klases, bet 8 (19 %) – IgA klases. Divdesmit deviņiem slimniekiem konstatēja paraproteinūriju (M gradients urīnā).
CRO līmenis bija 8,65 ± 13,11 (0,2–60,4) mg/l, un tas bija noteikts 40 analizētās grupas pacientiem. ß2-mikroglobulīna līmenis vidēji bija 3,467 ± 2,454 (1,5–12,63) mg/l, un tas tika noteikts 30 (71 %) pētāmās grupas pacientiem. Pacientiem ar MM III stadiju tas pieauga līdz 6,86 ± 4,42. Kālija līmenis bija 4,033 ± 0,9598 (1,2–5,58) mmol/l, un tas tika izvērtēts 32 (76 %) MM grupas pacientiem. LDH līmenis bija 319,4 ± 102,3 (37,2–459) IU/l, un tas tika noteikts 22 (52 %) mielomas slimniekiem.
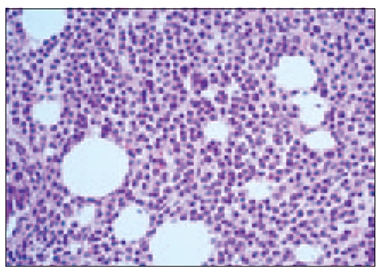
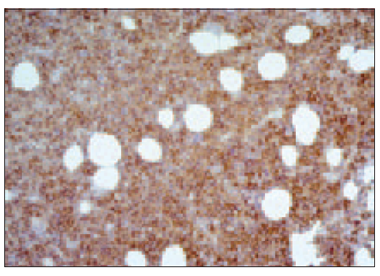
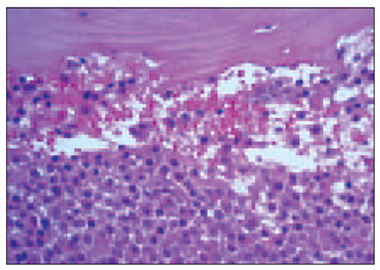
Trepānbiopsiju morfoloģiskie izmeklējumi pierādīja, ka kaulu smadzeņu procentuālā celularitāte svārstījās no 15 % līdz 90 % (vidēji 47,69 ± 19,43 %). Kaulu smadzeņu atipisko plazmocītu (sk. 1. un 2. att.) procentuālais daudzums (visi plazmocīti ekspresē CD138+ marķieri) attiecībā pret visām kaulu smadzeņu nukleārajām šūnām dažādās MM stadijās variēja no 15 % līdz 85 % (vidēji 41,33 ± 21,89 %).
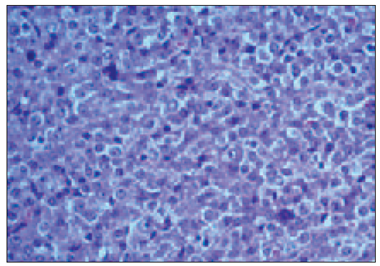
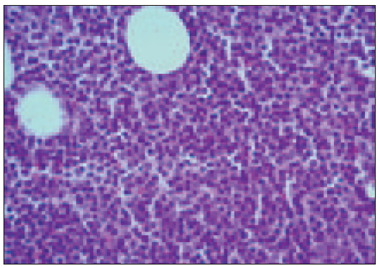
Atipisko plazmocītu ar plazmoblastisku diferenciāciju (sk. 3. att.) daudzums variēja no 0 % līdz 60 %, vidēji 10,12 ± 15,68 %, bet ar limfocitāru diferenciāciju (sk. 4. att.) – no 0 līdz 40 %, vidēji 3,929 ± 8,87 %. Kaulaudu trabekulu mikroskopisku bojājumu, t. s. mikroosteolīzi (sk. 5. att.), konstatējām 17 gadījumos (40 %). Kappa vieglās ķēdes ekspresiju plazmatiskajās šūnās konstatēja 29 (69 %) gadījumos, bet lambda vieglās ķēdes ekspresija plazmatiskajās šūnās bija 13 (31 %) gadījumos.
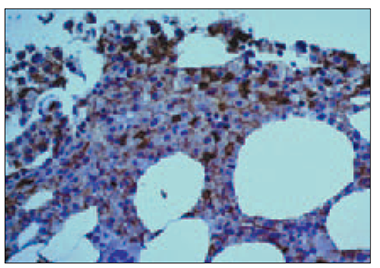
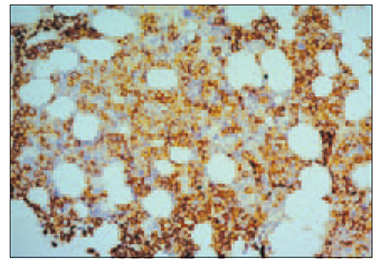
Normālam plazmocītam nav raksturīga CD20, LCA (CD45), CD56 ekspresija, bet atipiskos plazmocītos (mielomas šūnās) atrod šo marķieru aberanto ekspresiju. Vāju LCA (CD45) aberanto ekspresiju (sk. 6. att.) plazmatiskajās šūnās konstatēja 31 (74 %) gadījumā, bet vāju CD20 aberanto ekspresiju plazmatiskajās šūnās konstatēja 5 (12 %) gadījumos. CD56 aberanto ekspresiju plazmatiskajās šūnās (sk. 7. att.) pierādījām 35 (83 %) gadījumos.
Ki-67 ekspresiju vairāk par 30–50 % mielomas šūnu konstatē 12 (28 %) slimnieku trepānbiopsijā, bet Ki-67 ekspresiju 16–29 % mielomas šūnu – 7 (17 %) slimnieku.
1. attēls. Difūza subtotāla mazu un vidēju atipisko plazmocītu (mielomas šūnu) infiltrācija kaulu smadzenēs. Hematoksilīns un eozīns, × 250 / Diffuse subtotal infiltration of bone marrow by small and medium sized atypical neoplastic plasma cells (myeloma cells). H/E, × 250 | 2. attēls. Subtotāla mielomas šūnu infiltrācija kaulu smadzenēs, CD138 ekspresija citolemmā. EnVision metode, × 250 / Bone marrow subtotally infiltrated by neoplastic plasma cells. Immunoexpression of CD138 in cytolemma. EnVision method, × 250 |
|
|
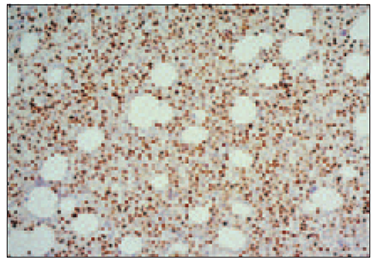
Plazmocītos BCL2 ekspresija bija 35 (83 %) gadījumos. Ciklīna D1 ekspresija plazmatiskajās šūnās bija 23 (55 %) gadījumos, bet vāju ciklīna D1 pozitivitāti pierādījām 5 (12 %) gadījumos. Savukārt p53 ekspresija plazmocītos (sk. 8. att.) konstatēta 15 (36 %) gadījumos, bet vāja p53 pozitivitāte – 12 (28 %) slimnieku trepānbiopsijā.
Visas izvērtētās korelācijas atspoguļotas 3. tabulā. Konstatējām, ka pazemināts hemoglobīna līmenis asinīs, kā arī paaugstināts M gradienta un ß2-mikroglobulīna līmenis statistiski ticami (p < 0,05) korelē ar paaugstinātu atipisko plazmocītu procentuālo daudzumu kaulu smadzenēs, ar mielomas šūnu plazmoblastisku diferenciāciju, biežāk sastopamo mielomas šūnu difūzu infiltrācijas tipu, ar paaugstinātu kaulu smadzeņu procentuālo celularitāti un ar paaugstinātu p53 ekspresiju. Noteicām, ka paaugstināts ß2-mikroglobulīna līmenis asinīs korelē ar paaugstinātu ciklīna D1 ekspresiju (Rho = +0,3696; p = 0,0444) un CD56 negativitāti mielomas šūnās (Rho = −0,4624; p = 0,0101).
3. attēls. Vidēji un lieli atipiskie plazmocīti (mielomas šūnas) ar plazmoblastisku diferenciāciju kaulu smadzeņu trepānbiopsijā. Hematoksilīns un eozīns, × 400 / Bone marrow rich with medium and large sizeed atypical neoplastic plasma cells (myeloma cells) with plasmoblastic differentiation. H/E, × 400 | 4. attēls. Subtotāla difūza mazu mielomas šūnu ar limfocitāru diferenciāciju infiltrācija kaulu smadzenēs. Hematoksilīns un eozīns, × 400 / Bone marrow subtotal diffuse infiltration by small sized atypical plasmocytes with lymphocyte differentiation. H/E, × 400 |
|
|
5. attēls. Mikroskopisks osteolīzes perēklis trepānbiopsijā. Hematoksilīns un eozīns, × 400 / Microscopic osteolytic focus in bone marrow trepan biopsy. H/E, × 400 | 6. attēls. Aberanta LCA-CD45 vājas intensitātes ekspresija mielomas šūnu citolemmā. EnVision metode, LCA-CD45, × 400 / Aberrant low positivity of LCA-CD45 in the cytolemma of neoplastic plasma cells. EnVision method, × 400 |
|
|
7. attēls. Kaulu smadzeņu intersticiāla un fokāla mielomas šūnu infiltrācija, kuras ekspresē aberanto CD56 marķieri plazmolemmā. EnVision metode, × 250 / Bone marrow interstitial and focal infiltration by neoplastic plasmocytes with aberrant CD56 expression in its cytolemma. EnVision method, × 250 | 8. attēls. Augstas intensitātes p53 intranukleāra pozitivitāte vairumā mielomas šūnu. EnVision metode, × 200 / High intensity of p53 intranuclear expression in almost of all neoplastic plasmocytes. EnVision method, × 200 |
|
|
Statistiski ticama pozitīva korelācija (p < 0,05) bija starp MM klīnisko stadiju pēc Salmon–Durie klasifikācijas un kaulu smadzeņu procentuālo celularitāti (Rho = +0,3817; p = 0,0126), kaulu smadzeņu difūzu infiltrācijas tipu (Rho = +0,3411; p = 0,0270) un mielomas šūnu ar plazmoblastisko diferenciāciju procentuālo skaitu (Rho = +0,4357; p = 0,0039) un p53 ekspresiju (Rho = +0,3306; p = 0,0325).
Paaugstināts kalcija līmenis asinīs kaulu smadzenēs morfoloģiski korelē ar paaugstinātu celularitāti (Rho = +0,3285; p = 0,0337) un ar augstāku atipisko plazmocītu ar plazmoblastisko diferenciāciju procentuālo skaitu (Rho = +0,5397; p = 0,002), kā arī ar CD56 aberantā marķiera negativitāti (Rho = −0,4286; p = 0,0046).
Pētāmo pacientu grupā konstatējām statiski ticamu pozitīvu korelāciju starp M gradienta līmeni un kaulu smadzeņu atipisko plazmocītu procentuālo daudzumu (Rho = −0,4866; p = 0,0011), mielomas šūnu procentuālu plazmoblastisku diferenciāciju (Rho = −0,4336; p = 0,0041), mielomas šūnu infiltrācijas tipu, tendenci uz kaulu smadzeņu difūza tipa infiltrāciju (Rho = −0,4826; p = 0,0012), kaulu smadzeņu procentuālu celularitāti (Rho = −0,4385; p = 0,0037) un paaugstinātu p53 ekspresiju.
Pētījumā konstatējām negatīvu korelāciju starp CD56 ekspresiju un ß2-mikroglobulīna līmeni (Rho = −0,4624; p = 0,0101), starp CD56 un samazinātu trombocītu daudzumu asinīs (Rho = −0,3148; p = 0,0423) un paaugstinātu kreatinīna līmeni (Rho = −0,3562; p = 0,0206), starp CD56 un kalcija līmeni serumā (Rho = −0,4286; p = 0,0046).
Tomēr starp CD56 ekspresiju un GFĀ (Rho = +0,3517; p = 0,0224) konstatējām pozitīvu korelāciju. Negatīva korelācija bija starp BCL2 ekspresiju un albumīna līmeni serumā (Rho = −0,3317; p = 0,0319).
Analizētajā pacientu grupā netika konstatēta korelācija starp mikroskopiskiem osteolīzes perēkļiem, kā arī LCA, CD20 ekspresiju un klīniski laboratoriskiem datiem.
Salīdzinājām slimnieku morfoloģiski imūnhistoķīmiskās atrades dažādu MM klīnisko stadiju (pēc Salmon–Durie klasifikācijas) gadījumā, izmantojot ANOVA sistēmu ar Bonferoni pēctestu. Mūsu analizēto grupu pacientiem konstatējām, ka p53 ekspresija, ciklīna D1 pozitivitāte, atipisko plazmocītu (CD138+) procentuālais daudzums un kaulu smadzeņu trepānbiopsijās noteiktā celularitāte III stadijā bija lielāka nekā II stadijā (p < 0,05). Kaut gan netika pierādīta statistiski ticama korelācija, tomēr novērojām tendenci, ka BCL2 un CD56 marķiera zudums mielomas šūnās pieaug vēlīnākās MM stadijās. BCL2 un CD56 ekspresija MM I stadijā bija 100 % gadījumu, II stadijā – 84 %, bet III – 67 % gadījumu.
3. tabula. Laboratorisko datu korelācija ar morfoloģiski imūnhistoķīmiskiem datiem, izmantojot Pīrsona testu / Correlations between lab tests, morphological and immunohistochemical data in myeloma patients
| Klīniskie dati | Celularitāte | Plazmocītu daudzums, CD138 | Infiltrācijas tips | Plazmoblastiska diferenciācija | Kappa / lambda | BCL2 | Ciklīns D1 | CD56 | Ki-67 | p53 |
|---|---|---|---|---|---|---|---|---|---|---|
| Kreatinīns, μmol/l | — * | — | — | — | — | — | — | Neg. korelācija Rho = −0,3562; p = 0,0206 | — | — |
| CRO, mg/l | — | — | — | — | — | — | Poz. korelācija Rho = +0,3242; p = 0,0413 | — | — | — |
| ß2-mikroglobulīns, mg/l (n = 30) | Poz. korelācija Rho = +0,5719; p = 0,001 | Poz. korelācija Rho = +0,5292; p = 0,0026 | Poz. korelācija Rho = +0,4222; p = 0,0201 | Poz. korelācija Rho = +0,6917; p ≤ 0,0001 | — | — | Poz. korelācija Rho = +0,3696; p = 0,0444 | Neg. korelācija Rho = −0,4624; p = 0,0101 | — | |
| Kālijs, mmol/l | Neg. korelācija Rho = −0,4222; p = 0,0161 | Neg. korelācija Rho = −0,3554; p = 0,0459 | Neg. korelācija Rho = −0,4737; p = 0,0062 | — | Neg. / poz. korelācija Rho = −0,3551; p = 0,0461 / Rho = +0,3551; p = 0,0461 | — | — | — | — | — |
| Kalcijs, mmol/l | Poz. korelācija Rho = +0,3285; p = 0,0337 | — | — | Poz. korelācija Rho = +0,5397; p = 0,0002 | — | — | — | Neg. korelācija Rho = −0,4286; p = 0,0046 | — | — |
| Albumīns, g/l | Poz. korelācija Rho = −0,3237; p = 0,0365 | — | — | — | — | Poz. korelācija Rho = −0,3317; p = 0,0319 | — | — | — | — |
| Kopējais olbaltumvielu daudzums, g/l | Poz. korelācija Rho = +0,3396; p = 0,0278 | Poz. korelācija Rho = +0,3287; p = 0,0336 | — | — | — | — | — | — | — | — |
| Trombocīti | — | — | — | Neg. korelācija Rho = −0,5570; p = 0,0001 | — | — | — | Neg. korelācija Rho = −0,3148; p = 0,0423 | Neg. korelācija (Rho = −0,3170; p = 0,0408) | — |
| Glomerulu filtrācijas ātrums, ml/min | — | — | — | — | — | — | — | Poz. korelācija Rho = +0,3517; p = 0,0224 | — | — |
| M gradients serumā, g/l | Poz. korelācija Rho = +0,4676; p = 0,0018 | Poz. korelācija Rho = +0,5178; p = 0,0004 | Poz. korelācija Rho = +0,3120; p = 0,0443 | Poz. korelācija Rho = +0,5440; p = 0,0002 | — | — | — | — | — | Poz. korelācija Rho = +0,3329; p = 0,0312 |
| Hemoglobīns, g/l | Neg. korelācija Rho = −0,4385; p = 0,0037 | Neg. korelācija Rho = −0,4866; p = 0,0011 | Neg. korelācija Rho = −0,4826; p = 0,0012 | Neg. korelācija Rho = −0,4336; p = 0,0041 | — | — | — | — | — | Neg. korelācija Rho = −0,3277; p = 0,0341 |
| Klīniskā stadija | Poz. korelācija Rho = +0,3817; p = 0,0126 | — | Poz. korelācija Rho = +0,3411; p = 0,0270 | Poz. korelācija Rho = +0,4357; p = 0,0039 | — | — | — | — | — | Poz. korelācija Rho = +0,3306; p = 0,0325 |
* “—” korelācija nav konstatēta. Poz. – pozitīva, neg. – negatīva.
Diskusija
Pacientiem ar MM kaulu smadzenes raksturojošie morfoloģiskie parametri un imūnhistoķīmiskais raksturojums mūsu analizētajā pacientu grupā korelē ar vairākiem klīniski laboratoriskiem rādītājiem.
Vēlīnākai MM klīniskajai stadijai pēc Salmon–Durie klasifikācijas ir raksturīgs pazemināts hemoglobīna līmenis asinīs un / vai izteikti paaugstināts M gradienta (paraproteīna) līmenis serumā, un / vai paaugstināts kalcija līmenis. Starptautiskā mielomas fonda sistēmas kritēriji ir balstīti uz ß2-mikroglobulīna līmeni un albumīna līmeni asinīs [Greipp, et al., 2005]. MM pacientu dzīvildzi Salmon un Durie saista ar hemoglobīna, M gradienta un kalcija līmeņa izmaiņām [Durie, Salmon, 1975]. Mūsu pētījumā konstatējām, ka, paaugstinoties klīniskajai stadijai pēc Salmon–Durie klasifikācijas, kaulu smadzenēs statistiski ticami pieaug celularitāte, pieaug mielomas šūnu procentuālais daudzums, kā arī biežāk konstatē difūzu infiltrācijas tipu un palielinātu p53 ekspresiju. Atradām arī vāju negatīvu korelācijas tendenci ar BCL2 (Rho = –0,2292; p = 0,1443) un CD56 (Rho = –0,2292; p = 0,1443). Kā zināms, BCL2 ir apoptozes regulācijas gēns [Danial, 2007].
LCA, CD20 marķieru ekspresijas loma MM gadījumā literatūrā ir pretrunīga [Kumar, et al., 2005]. Mūsu pētījumā neatradām statistiski ticamu korelāciju starp LCA un CD20 ekspresiju. Iespējams LCA un CD20 nenosaka MM agresivitāti, bet tikai pierāda plazmas šūnu malignitātes potenciālu, jo normā plazmocīts neekspresē CD20 un LCA. Daži autori [Kanavaros, et al., 2000] piedāvā izmantot Ki-67 marķieri MM agresivitātes noteikšanā, tomēr mūsu pētījumā Ki-67 ekspresija korelēja tikai ar trombocītu skaitu. Ki-67 marķieri ir grūti interpretēt gadījumos ar zemu mielomas šūnu infiltrācijas procentuālo daudzumu kaulu smadzenēs, jo tas marķē arī citas hemopoētiskās šūnas.
Četrdesmit procentos gadījumu mikroskopiski noteicām osteolīzi, taču ne šajā slimnieku grupā (n = 42), ne literatūras avotos netika pierādīta statistiski ticama korelācija ar MM stadiju.
Aberanta BCL2 ekspresija raksturīga MM pacientiem ar t(14;18). BCL2 ir svarīgs ieprogrammētas šūnu nāves inhibīcijas proteīns Pēc Wei, et al. (2003) domām BCL2 ekspresiju atrod ap 97 % MM gadījumu.
Mūsu analizētās grupas slimnieku trepānbiopsiju morfoloģiskā atrade korelē ar Pruneri, et al. (2003), Harrington, et al. (2009), Kanavaros, et al. (2000) pētījumiem, bet mūsu iegūto rezultātu statistiskā datu apstrāde pierāda, ka jāpalielina izmeklēto pacientu skaits tieši ar I un III MM stadiju.
Savukārt mūsu MM slimnieku imūnhistoķīmisko izmeklējumu rezultāti vairumā gadījumu statistiski ticami korelē gan ar trepānbiopsiju morfoloģisko raksturojumu, gan ar laboratoriskajiem rādītājiem. Svarīgi ir pētīt dziļāk mielomas prognostiskos faktorus, jo vairāki autori norāda, piemēram, uz ciklīna D1, p16 un p53 lomu slimības progresēšanas gaitā [Athanasiou, et al., 2001].
Secinājumi
- Morfoloģiskie trepānbiopsiju izmeklējumi pierāda, ka paaugstināta kaulu smadzeņu celularitāte, liels procentuālais plazmocītu skaits un mielomas šūnu plazmoblastiska diferenciācija korelē ar ß2-mikroglobulīna, M gradienta līmeņa paaugstināšanos un hemoglobīna līmeņa pazemināšanos asinīs, kas raksturīgs vēlīnākām multiplās mielomas stadijām pēc Salmon-Durie klasifikācijas.
- Mūsu analizētajā multiplās mielomas slimnieku grupā CD56 marķiera ekspresijas izzušana attīstās paralēli ar slimības progresēšanu un laboratorisko testu pasliktināšanos: kreatinīna un kalcija, ß2-mikroglobulīna līmeņa paaugstināšanos un trombocītu skaita samazināšanos.
- Imūnhistoķīmiskie izmeklējumi pierādīja, ka audzēja supresorā proteīna (p53) aktivācija un šūnu cikla transkripcijas regulatora – ciklīna D1 – pastiprināta aktivitāte nosaka multiplās mielomas progresiju.
Abstract
Morphological and Immunohistochemical Criteria and Their Correlation with Clinical-laboratory Parameters in Secreting Multiple Myeloma Cases
Malignant plasma cells (Ps) express such aberrant markers as p53, cyclin D1, CD56, LCA, etc., and the role of them in literature is reflected contradictory.
The aim of the study was to analyse morphological and immunohistochemical features of bone marrow in correlation with clinical stages of MM.
In 42 patients with MM of its various stages, bone marrow morphological and immunohistochemical and clinical-laboratory parameters of disease were compared. The study allowed determining CD138, CD20, LCA, cyclin D1, p53, Ki-67, BCL2, Kappa / lambda light chain and CD56 expression. Statistical analysis was performed with Graph Pad Prism 5 version software.
It was defined that increased gradient M and β2-microglobulin levels were statistically significant that correlated with the expression of CD138, plasmoblastic differentiation, increased cellularity and overexpression of p53. Increased β2-microglobulin correlates with elevated cyclin D1 expression and loss of CD56. Statistically significant associations were found between MM clinical stage (by Durie, Salmon), and bone marrow cellularity and plasmoblastic differentiation of MM cells.
A positive correlation was found between the calcium level with increased cellularity, plasmoblastic MM differentiation and lack of CD56. Expression of p53, cyclin D1 and increased amount of CD138 labelled cells, and bone marrow cellularity in the third stage was statistically significantly higher than in the second stage of MM.
Increased bone marrow cellularity, mainly plasmoblastic morphology correlated with the increased level of β2-microglobulin, M-gradient and a decrease in haemoglobin and were mainly found in higher MM stages.
It has been proved that lack of CD56 expression in MM cells has developed parallel to the progression of MM and with the subsequent impairment of such laboratory tests as creatinine, calcium, β2-microglobulin and amount of platelets. Increased p53 and cyclin D1 expression possibly influence the progression of MM.
Literatūra
- Athanasiou E., Kaloutsi V., Kotoula V., et al. Cyclin D1 overexpression in multiple myeloma // American Journal of Clinical Pathology, 2001; 116: 535–542.
- Bergsagel P. L., Kuehl W. M. Chromosome translocations in multiple myeloma // Oncogene, 2001; 20 (40): 5611–5622.
- Chang H., Yeung J., Qi C., Xu W., et al. Aberrant nuclear p53 protein expression detected by immunohistochemistry is associated with hemizygous P53 deletion and poor survival for multiple myeloma // British Journal of Haematology, 2007; 138 (3): 324–329.
- Chen M. H., Qi C. X., Saha M. N., Chang H. p53 nuclear expression correlates with hemizygous TP53 deletion and predicts an adverse outcome for patients with relapsed/refractory multiple myeloma treated with lenalidomide // American Journal of Clinical Pathology, 2012; 137 (2): 208–212.
- Durie B. G. M., Salmon S. E. A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival // Cancer, 1975; (36) 3: 842–854.
- Grogan T. M., Van Camp B., Kyle R. A., et al. Ed. by Jaffe E. S., Harris N. L., Stein H., Vardiman J. W. Pathology and genetics of tumours of haematopoietic and lymphoid tissues. – 1st ed. – Lyon: IARC Press, 2001. – Pp. 142–154.
- Greipp P. R., San Miguel J., Durie B. G. M., et al. International staging system for multiple myeloma // Journal of Clinical Oncology, 2005; 23 (15): 3412–6281.
- Harrington A. M., Hari P., Kroft S. H., et al. Utility of CD56 immunohistochemical studies in follow-up of plasma cell myeloma // American Journal of Clinical Pathology, 2009; 132: 60–66.
- Hundemer M., Klein U., Hose D., et al. Lack of CD56 expression on myeloma cells is not a marker for poor prognosis in patients treated by high-dose chemotherapy and is associated with translocation t(11;14) // Bone Marrow Transplantation, 2007; 40: 1033–1037.
- Kanavaros P., Stefanaki K., Rontogianni D., et al. Immunohistochemical expression of the p53, p21/Waf-1, Rb, p16 and Ki-67 proteins in multiple myeloma // Histol Histopathol, 2001; 16 (4): 1005–1012.
- Kumar S., Rajkumar S. V., Kimlinger T., et al. CD45 expression by bone marrow plasma cells in multiple myeloma: clinical and biological correlations // Leukemia, 2005; 19 (5): 1466–1470.
- Lejniece S., Trociukas I., Auziņa D. Mielomas slimība un pašreizējas ārstēšanas vadlīnijas // Latvijas Ārsts, 2014, jūnijs / jūlijs; 27.–31. lpp.
- Marković O., Marisavljević D., Cemerikić V., et al. Immunohistochemical analysis of cyclin D1 and p53 in multiple myeloma: relationship to proliferative activity and prognostic significance // Medical Oncology, 2004; 21 (1): 73–80.
- Marković O., Marisavljević D., Cemerikić V., et al. Proliferative activity of myeloma cells determined by Ki-67 antibody: biological and clinical significance, English Abstract // Bојносанитетски преглед, 2005; (62) 1: 33–38.
- Danial N. N. BCL-2 family proteins: critical checkpoints of apoptotic cell death // Clinical Cancer Research, 2007; 13 (24): 7254–7263
- Pildava S. Pasaules literatūras apskati: Multiplā mieloma // http://www.doctus.lv/2012/7/multipla-mieloma (sk. 24.04.2014.).
- Pruneri G., Carboni N., Baldini L., et al. Cell cycle regulators in multiple myeloma: prognostic implications of p53 nuclear accumulation // Human Pathology, 2002; (34) 1: 41–47.
- Santra M., Jr Shaughnessy J. D., Bellamy W. T. Expression of multiple myeloma specific markers in bone marrow spicules using a novel immunohistochemical technique // Biotechnic & Histochemistry, 2011; 86 (2): 119–123.
- Singhal S., Mehta J. Multiple myeloma // Clinical Journal of the American Society of Nephrology, 2006; 1 (6): 1322–1330.
- Wei A., Juneja S. Bone marrow immunohistology of plasma cell neoplasms // Journal of Clinical Oncology, 2003; 56: 406–411.