Mielomas šūnu morfoloģisko un imūnhistoķīmisko prognostisko parametru raksturojums un to saistība ar nieru funkcionālajiem rādītājiem
Kopsavilkums
Ievads. Multiplā mieloma (MM) ir ļaundabīga hematoloģiska slimība, kas bieži komplicējas ar nieru mazspēju. Kaulu smadzeņu trepānbiopsiju morfoloģiski un imūnhistoķīmiski izmeklējumi ļauj ne vien diagnosticēt plazmatisko šūnu malignitāti, bet, nosakot, piemēram, tādus antigēnus kā CD56, ciklīnu D1, p53 u. c. ļauj raksturot slimības prognozi.
Darba mērķis. Pētīt mielomas šūnu morfoloģiskas, imūnhistoķīmiskas atrades kaulu smadzeņu trepānbiopsijās un nieru funkcijas rādītājus pacientiem ar MM.
Materiāls un metodes. Tika analizēti 70 pacientu dati ar primāri diagnosticētu MM. Salīdzinājām glomerulu filtrācijas ātruma (GFĀ) un kreatinīna rādītājus ar mielomas šūnu morfoloģiskajiem un imūnhistoķīmiskajiem parametriem. Noteicām CD138, LCA, ciklīna D1, p53, BCL2, kappa / lambda un CD56 ekspresiju. Statistiskā analīze veikta ar Graph Pad Prism 5.
Rezultāti. Konstatējām, ka paaugstināts kreatinīna līmenis serumā un samazināts GFĀ statistiski ticami korelē ar paaugstinātu p53 ekspresiju un CD56 antigēna zudumu, biežāku perēkļveida un difūzu infiltrācijas tipu. GFĀ samazināšanās statistiski ticami korelē ar paaugstinātu kaulu smadzeņu celularitāti un palielinātu atipisko plazmocītu ar plazmablastisku diferenciāciju procentuālu daudzumu. Statistiski ticama korelācija starp nieru funkcijas rādītājiem un BCL2, ciklīna D1, LCA un kappa / lambda vieglās ķēdes ekspresiju netika konstatēta.
Secinājumi. 1. Kaulu smadzeņu augsta celularitāte, ievērojams atipisko plazmatisko šūnu procentuāls daudzums ar to plazmablastisku diferenciāciju un kaulu smadzeņu difūzs mielomas šūnu infiltrācijas tips korelē ar nieru funkcijas laboratorisko rādītāju pasliktināšanos MM slimniekiem. 2. CD56 antigēna iztrūkums un p53 marķiera izteikta pozitivitāte mielomas šūnās korelē ar nieru funkcijas pasliktināšanos pacientiem ar MM. 3. Plazmatisko šūnu daudzumam kaulu smadzeņu bioptātos, kā arī ciklīna D1, BCL2, LCA / CD45 ekspresijai nav statistiski ticamas korelācijas ar nieru mazspējas rādītājiem multiplās mielomas slimniekiem.
Ievads
Multiplā mieloma (MM) ir ļaundabīga hematoloģiska slimība, kura attīstās sakarā ar atipisko plazmatisko šūnu proliferāciju kaulu smadzenēs un monoklonālu patoloģisko proteīnu sintēzi, kas, līdzdarbojoties dažādiem citokīniem, piemēram, IL-6 (Interleukin-6), MIP-1α (macrophage inflammatory protein-1α) vai VAGF (vascular endothelial growth factor), aktivē osteoklastus caur RANKL (receptor activator of nuclear factor kappa-B ligand) receptoriem un izraisa osteolīzi (Desikan et al., 2004). Šo procesu ietekmē veidojas MM raksturīgā klīniskā aina – patoloģiski lūzumi un sāpes kaulos, anēmija, nogurums, nespēks, sekundāras infekcijas, kā arī bieži nieru bojājumi (McKenna et al., 2008; Van Rhee et al., 2010; Rajkumar et al., 2014). Nieru mazspēja negatīvi ietekmē MM slimnieku dzīves kvalitāti (Durie et al., 1975; Greipp et al., 2005; Fechtner et al., 2010; Hsiao et al., 2012; Rajkumar et al., 2014; Faiman, 2014).
MM slimniekiem nieru mazspēju apmēram 50 % gadījumu novēro slimības diagnosticēšanas brīdī. Smaga akūta nieru bojājuma dēļ ir indicētas hemodialīzes 10 % gadījumu (Knudsen et al., 1994).
GFĀ ir piemērotākais veids kā novērtēt nieru funkciju, mērot šķidruma tilpumu, kas tiek izfiltrēts caur glomerulu kapilāriem Boumena kapsulā vienā laika vienībā. Kreatinīna līmenis serumā ir indikators, kas rāda balansu starp kreatinīna produkciju muskuļos un tā izvadi caur nierēm Stevens et al., 2006; Sandilands et al., 2013; Lopez-Giacoman et al., 2015).
KDIGO (The Kidney Disease: Improving Global Outcome – Nieru slimības: globāla iznākumu uzlabošanās) vadlīnijās ir norādīti hroniskas nieru slimības (HNS) diagnostiskie rādītāji. Viens no kritērijiem ir laboratoriski pierādīta nieru funkciju pasliktināšanās, kad tiek noteikts GFĀ < 60 ml/min//1,73 m2 ilgāk nekā trīs mēnešus (Lamb et al., 2013).
Vairākos pētījumos ir pierādīts, ka noteiktas izmaiņas kaulu smadzeņu morfoloģijā MM gadījumā, nosaka pacienta dzīvildzi. Kā negatīvi prognostiski faktori ir uzskatāmi zema audzēja šūnu diferenciācija, blastiskas izmaiņas kaulu smadzenēs (Greipp et al., 1985; Rajkumar et al., 1999; Subramanian et al., 2009; Bartl et al., 2002; Singhal et al., 2004), bet autori neanalizē nieru mazspējas rādītājus.
CD56 marķieris, kura ekspresiju novēro 70–80 % MM gadījumu, ir viens no biežāk izmantotajiem imūnhistoķīmiskajiem rādītājiem MM diagnozei (Harada et al., 1993; Harrington et al., 2009). Negatīva CD56 ekspresija ir saistāma ar zemu diferencētu audzēju un plazmoblastisku tā diferenciāciju, kā arī ar sliktāku prognozi (Rawstron et al., 1999; Hundemer et al., 2007; Dunphy et al., 2002).
BCL2 antigēns ir zināms ar savu protoonkogēno darbību, kura antiapoptotiska darbība ir vērsta uz šūnu programmētās nāves novēršanu (Hockenbery et al., 1990). Tā ekspresija tiek konstatēta vairumā maligno audzēju, t. sk. MM gadījumā (Miguel-García et al., 1998; Puthier et al., 1999). Ir novērots, ka BCL2 marķēto šūnu daudzums progresē līdz ar MM stadiju (Miguel-García et al., 1998).
Ciklīns D1 tiek saistīts ar ciklīnatkarīgajām kināzēm un šūnu proliferāciju (Hitomi et al., 1999). Tā ekspresija MM gadījumā saistāma ar ģenētiskiem defektiem (translokāciju, 11. hromosomas polisomiju, CCND1 gēna amplifikāciju u. c.), kā arī labāku pacienta prognozi (Cook et al., 2006). Tomēr šie dati ir pretrunīgi, un vairāki autori nav atraduši korelāciju starp ciklīna D1 ekspresiju un slimības klīniskajiem, laboratoriskajiem un histoloģiskajiem rādītājiem (Markovic et al., 2004).
P53 ir plaši zināms TP53 gēna produkts (Soussi, 2010). TP53 gēns ir viens no šūnu cikla regulētājgēniem. Tas aktivējas brīdī, kad uz normālu šūnu iedarbojas kāds to bojājošs faktors, kā rezultātā p53 proteīns aktivē apoptozes mehānismus. Mutantais p53 veicina audzēja progresiju. MM slimniekiem ar pozitīvu p53 ekspresiju parasti ir smagāka klīniskā stadija. Šādi dati izskaidrojami ar to, ka p53 ekspresija norāda uz TP53 gēna delēciju (Chang et al., 2007; Chen et al., 2012).
CD45, zināms arī kā leukocyte common antigen (LCA), ir pierādīts limfopoētiskajās šūnās; šis glikoproteīns ietekmē šūnu diferencēšanos (Kaplan et al., 1990; Caldwell et al., 1991; Brown et al., 1994; Kumar et al., 2005). Par CD45 / LCA ekspresijas nozīmi MM stadijas un slimības prognozes noteikšanā nav viennozīmīgas nostājas (Kumar et al., 2005; Mateo et al., 2008).
Pētījumos par MM visbiežāk mielomas šūnu imūnhistoķīmiskais raksturojums tiek minēts saistībā ar slimības stadiju un prognozi. Tomēr ir maz pētījumu, kas aplūko vairāku imūnhistoķīmisko biomarķieru ekspresijas korelāciju mielomās šūnās ar nieru mazspējas izpausmēm.
Darba mērķis
Pētīt mielomas šūnu morfoloģiskas, imūnhistoķīmiskas atrades kaulu smadzeņu trepānbiopsijās saistībā ar nieru funkcijas rādītājiem pacientiem ar multiplo mielomu.
Materiāls un metodes
Retrospektīvi prospektīvā pētījumā tika analizēti Rīgas Austrumu klīniskās universitātes slimnīcas Ķīmijterapijas un hematoloģijas klīnikas 70 pacientu trepānbiopsijas un klīniski laboratoriskie dati ar primāri diagnosticētu multiplo mielomu (MM) laikā periodā no 2011. gada līdz 2014. gadam. Klīniskie un laboratoriskie rādītāju rezultāti tika analizēti no slimnieku ambulatorajām kartēm un slimības vēsturēm.
Kaulu smadzeņu bioptāti (trepānbiopsijas) tika fiksēti 10 % neitrālā (pH = 7) buferētā formalīnā. Tie tika dekalcinēti, lietojot Microdecfast šķidrumu, un apstrādāti, izmantojot vakuuma procesoru (Sakura Tissue-Tek VIP 5), kā arī ieguldīti parafīna blokos, un tad veica 5 μm plānus griezumus. Vizualizācijai tika lietotas rutīnas krāsošanas metodes ar standarta protokoliem: hematoksilīns un eozīns, PAS (periodiska skābes Schiff reakcija), Gimza (Giemsa) un Gordona retikulīna noteikšanas metode (Gordon & Sweet’s reticulin silver staining).
Ar rutīnām krāsošanas metodēm kaulu smadzeņu biopsijās noteicām kaulu smadzeņu šūnu sastāvu (t. s. kaulu smadzeņu celularitāti), izteiktu procentos, plazmatisko šūnu procentuālo daudzumu, infiltrācijas tipu, plazmatisko šūnu ar plazmoblastisku diferenciāciju procentuālo daudzumu, kaulaudu trabēkulu mikroskopisku bojājumu (mikroosteolīzi) un mielofibrozes pakāpi. Kaulu smadzeņu plazmatisko šūnu infiltrācijas veidu iedalījām 4 tipos: 1 – intersticiāls (I.), 2 – fokāls (F.), 3 – jaukts (intersticiāls un fokāls (I. + F.)) un 4 – difūzs (D.) (Bartl et al., 2002; Subramanian et al., 2009). Imūnhistoķīmiskai antigēna ekspresijas izpētei izmantojām 3–4 μm biezus trepānbiopsijas griezumus, kas tika uzlikti uz elektrostatiskiem priekšmetstikliņiem (HistoBond), kuri pēc deparafinizācijas un dehidratācijas 10 minūtes tika inhibēti ar 3 % H2O2, lai neitralizētu endogēnās peroksidāzes aktivitāti. Antigēna demaskēšanai tika izmantots svaigi gatavots 0,01 mmol/l nātrija citrāta buferēts šķidrums (pH = 6,0), kurā ievietoja paraugus un pēc tam uz trim cikliem pa 10 minūtēm katru ielikām mikroviļņu krāsnī (jauda 750 W). Pēc atdzesēšanas un skalošanas TRIS buferī paraugus 60 minūtes 37 °C temperatūrā apstrādājām ar primārām antivielām (sk. 1. tab.).
Primāro antivielu reaktivitāti noteicām, izmantojot polimēru metodi (EnVision kit, Dako). Imūnās reakcijas vizualizācijai lietojām 3,3’-diaminobenzidīna-tetrahidrohlorīda dihidrāta hromogēnu (DAB), inkubējot tajā 5–7 minūtes. Pēdējā etapā preparātus vienu minūti kontrastējām ar Meijera (Mayer’s) hematoksilīnu, dehidratējām spirtā, noskalojām tekošā ūdenī un pārklājām ar segstikliņiem.
CD138 pozitīvas šūnas jeb atipisko plazmocītu daudzumu izteicām procentos. CD56, BCL2 antigēna un kappa / lambda vieglās ķēdes ekspresiju mielomas šūnās interpretējām kā pozitīvu pie ekspresijas virs 90 % šūnu, bet negatīvu ar ekspresiju zem 10 %. LCA / CD45 ekspresiju mielomas šūnās interpretējām kā pozitīvu pie ekspresijas virs 20 %.
1. tabula. Pētījumā lietoto primāro antivielu raksturojums / Characteristics of primary antibodies used in the research
| Antiviela | Klons | Ražotājs | Atšķaidījums |
|---|---|---|---|
| CD138 | M15 | Dako | Gatavs lietošanai |
| LCA / CD45 | 2B11 | Dako | 1 : 50 |
| Ciklīns D1 | SP4 | Dako | Gatavs lietošanai |
| P53 | Do-7 | Dako | Gatavs lietošanai |
| BCL2 | 124 | Dako | Gatavs lietošanai |
| Kappa vieglā ķēde | – | Dako | Gatavs lietošanai |
| Lambda vieglā ķēde | – | Dako | Gatavs lietošanai |
| CD56 | 123C3 | Dako | 1 : 50 |
Ciklīna D1 un p53 ekspresiju raksturojām, izmantot puskvantitatīvu sistēmu, sadalot marķieru pozitivitāti 3 pakāpēs: 3+ jeb pozitīva marķiera reakcija (imūnreaktivitāte ir pozitīva 30–50 % šūnās ar augstu krāsojuma intensitāti); 2+ jeb vāji pozitīva marķiera reakcija (vājas intensitātes pozitīva imūnreaktivitāte un / vai tās ekspresija 16–30 % šūnās) un 1+ jeb ļoti zema marķiera reakcija līdz pat tās zudumam (ekspresija 0–15 % maligno šūnu).
Rezultātos 1+ un 2+ grupu savā starpā apvieno kā vāju ekspresiju un 3+ kā pozitīvu (Pruneri et al., 2002). Kontroles grupa bija 3 pacientu mugurkaula operācijas materiāls ar diagnozi deformējošs spondilīts.
Pētījumā visiem slimniekiem izvērtējām šādus laboratoriskos datus, kas bija noteikti E. Gulbja laboratorijā (iekavās norādītas normas): kreatinīna līmenis serumā (♂: 62–115 μmol/l, ♀: 53–106 μmol/l), GFĀ, pēc MDRD II (Modification of Diet in Renal Disease) formulas (> 90 ml/min). Tika noteikta un izvērtēta multiplās mielomas klīniskā stadija pēc Salmon–Durie klasifikācijas (I A/B, II A/B, III A/B), ka arī pacientu vecums, dzimums.
Iegūtie rezultāti tika apstrādāti ar Microsoft Excel 2010 un Graph Pad Prism 5 versijas programmu. Datu normālsadalījums tika pārbaudīts, izmantojot D’Agostino–Pīrsona testu, bet grupās ar pacientu skaitu zem 10 (n < 10), izmantojot jutīgāko Šapiro–Vilka (Shapiro–Wilk) testu. Rezultāti tika uzskatīti par statistiski ticamiem, ja p < 0,05. Korelācija starp neparametriskiem datiem tika vērtēta, izmantojot Spīrmena testu, bet parametriskiem datiem, izmantojot Pīrsona testu. Grupas ar parametriskiem datiem tika salīdzinātas, izmantojot divu izlašu t-testu, bet neparametriskiem – Manna–Vitnija U testu.
Rezultāti
Klīniskās stadijas pēc Durie-Salmon klasifikācijas mūsu pētāmo pacientu grupā bija: I A un I B stadija tika noteikta 14 pacientiem (20 %); II A un II B stadija tika noteikta 30 (43 %) pacientiem, bet III A un III B stadija bija 26 pacientiem (37 %). No 70 pacientiem, kuri bija iekļauti pētījuma grupā ar klīniski un histoloģiski apstiprinātu MM, vīrieši un sievietes bija attiecībā 1 : 1. Pacientu vidējais aritmētiskais vecums bija (M ± SD) 65 ± 10,81 gadi, bet tas variēja no 36 līdz 81 gadam. Visu noteikto laboratorisko testu, morfoloģisko kritēriju un imūnhistoķīmisko rādītāju rezultāti atspoguļoti 2. un 3. tabulā.
2. tabula. Multiplās mielomas slimnieku nieru funkciju laboratorisko parametru raksturojums dažādu kaulu smadzeņu morfoloģisko atradņu gadījumā / The characteristics of renal laboratory tests in case of different bone marrow morphology of multiple myeloma patients
| Nieru funkciju rādītāji | Morfoloģiskie dati | ||||||
|---|---|---|---|---|---|---|---|
| Kaulu smadzeņu celularitāte | Plazmocītu daudzums, % | Infiltrācijas tips | Plazmoblastiska diferenciācija, % | Mielopoēzes raksturojums | Megakariocītu daudzums | ||
| 53,2 ± 19,53 (15–90) | 45,94 ± 20,94 (15–85) | I. – 7 (10 %) F. – 7 (10 %) I. + F. – 37 (53 %) D. – 19 (27 %) | 7,786 ± 14,71 (0–70) | Hipoplazēta 36 (51 %); Kavēta 2 (3 %); Hiperplazēta 12 (17 %); Bez īpatnībām 20 (29 %) | > 3–8 r. l. – 50 (71 %); < 2–7 r. l. – 13 (19 %); < 0–2 r. l. – 7 (10 %) | ||
| GFĀ, ml/min | 83,3 ± 53,17 (6,2–348) | rs = −0,2625; p = 0,0282 | — | rs = −0,3043; p = 0,0104 | r = −0,267; p = 0,0255 | rs = −0,2465; p = 0,0397 | rs = −0,3235; p = 0,0063 |
| Kreatinīns, μmol/l | 130,3 ± 162 (9–1211) | — | — | rs = +0,2659; p = 0,0261 | — | — | — |
D – difūzs, F – fokāls, GFĀ – glomerulu filtrācijas ātrums, I – intersticiāls, r. l. – redzes laukā.
3. tabula. Pacientu nieru funkciju laboratorisko parametru salīdzinājums ar kaulu smadzeņu mielomas šūnu imūnhistoķīmiskām atradēm / Comparison of renal laboratory tests with immunohistochemistry of myeloma cells in bone marrow
| Nieru funkciju rādītāji | Imūnhistoķīmiskie dati | ||||||
|---|---|---|---|---|---|---|---|
| p53 | CD56 | BCL2 | Ciklīns D1 | LCA (CD 45) | Kappa / lambda | ||
| Glomerulu filtrācijas ātrums, ml/min | 83,3 ± 53,17 (6,2–348) | rs = −0,2543; p = 0,0336 | rs = +0,4674; p < 0,0001 | Statistiski ticama korelācija netika atrasta, p > 0,05 | |||
| Kreatinīns, μmol/l | 130,3 ± 162 (9–1211) | rs = +0,2628; p = 0,028 | rs = −0,4387; p = 0,0001 | Statistiski ticama korelācija netika atrasta, p > 0,05 | |||
Vidējais aritmētiskais kreatinīna līmenim serumā bija 130,3 ± 162 (9–1211) μmol/l, bet vidējais aritmētiskais GFĀ bija 83,3 ± 53,17 ml/min, dažādās slimības stadijās tas variēja no 6,2 līdz 348 ml/min. Ņemot vērā GFĀ, 19 (27,1 %) pacientiem tika diagnosticēta nieru mazspējas 2. stadija, 7 (10 %) – 3.a, 6 pacientiem – 3.b stadija, toties 6 (8,6 %) – 4. stadija un 4 (5,7 %) pacientiem – 5. stadija.
Savukārt ar rutīnām krāsošanas metodēm trepānbiopsijās konstatējām, ka kaulu smadzeņu celularitātes vidējā aritmētiskā vērtība bija 53,2 ± 19,53 % un tā svārstījās pacientu bioptātos no 15 % līdz 90 %. Pētāmo pacientu kaulu smadzeņu atipisko plazmocītu procentuālais daudzums (visi plazmocīti ekspresē CD138+ marķieri) attiecībā pret visām kaulu smadzeņu hemopoētiskajām šūnām variēja no 15 % līdz 85 %, un tā vidējā aritmētiskā vērtība bija 45,94 ± 20,94 %.
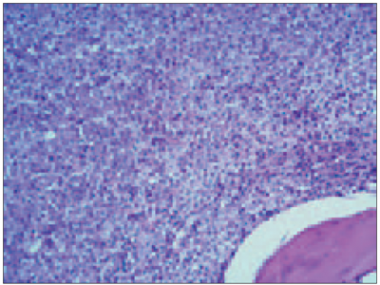
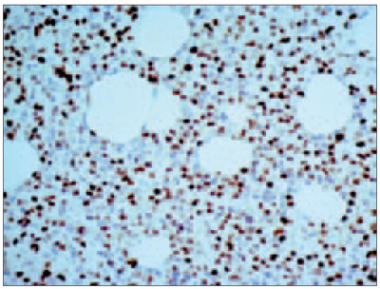
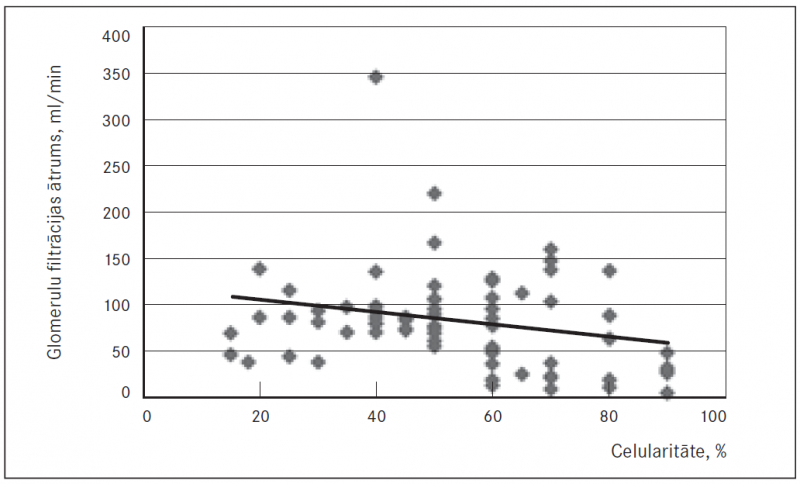
Savukārt atipisko plazmocītu ar plazmoblastisku diferenciāciju (sk. 6. att.) skaits variēja no 0 % līdz 70 %, vidēji tas bija 7,786 ± 14,71 %. Analizējot iegūtos rezultātos, konstatējām, ka paaugstināta kaulu smadzeņu celularitāte, palielināts mielomas šūnu ar plazmoblastisko diferenciāciju skaits, kā arī nomākta vai kavēta mielopoēze un samazināts megakariocītu skaits statistiski ticami korelē ar samazinātu GFĀ (sk. 1. att.).
Paaugstināts kreatinīna līmenis serumā un samazināts GFĀ statistiski ticami korelē ar kaulu smadzeņu mielomas šūnu infiltrācijas tipu, respektīvi, kaulu smadzenēs biežāk konstatē mielomas šūnu difūzu vai jauktu infiltrācijas tipu.
1. attēls. Glomerulu filtrācijas ātruma korelācija ar kaulu smadzeņu celularitāti multiplas mielomas slimniekiem, p = 0,0282 / Correlation of glomerular filtration rate with bone marrow cellularity in multiple myeloma patients, p = 0.0282
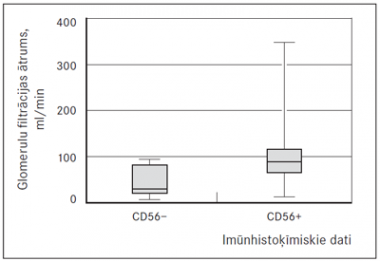
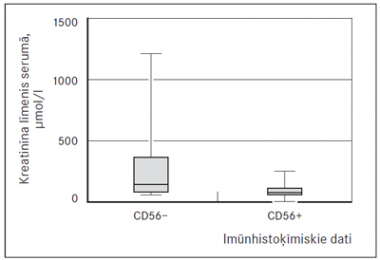
Arī iegūtie imūnhistoķīmiskie rezultāti tika salīdzināti ar nieru funkcijas rādītājiem. Statistiski ticamu korelāciju konstatējām tikai starp CD56, p53 marķieriem un GFĀ un kreatinīna līmeni serumā. CD56 pozitivitāti konstatē 77,1 % (n = 54) gadījumu, bet p53 pozitivitāti (sk. 7. att.) mielomas šūnās konstatē 47,1 % (n = 33) pacientu. MM slimniekiem ar CD56 negatīvu ekspresiju konstatējām statistiski ticami zemāku GFĀ (sk. 2. att.) un augstāku kreatinīna līmeni serumā (sk. 3. att.).
BCL2 pozitivitāti mūsu analizētajā slimnieku grupā konstatējām 90 % (n = 63) gadījumu, bet LCA / CD45 pozitivitāti (vairāk nekā 20% mielomas šūnu) konstatējām 18,6 % (n = 13) gadījumu. Ciklīna D1 pozitivitāti mielomas šūnās konstatējām 58,9 % (n = 37) gadījumu. Mielomas šūnu monoklonalitāti pēc kappa vieglās ķēdes ekspresiju konstatējām 70 % (n = 49) slimnieku, lambda – 30 % (n = 21).
Statistiski ticama korelācija starp nieru funkcijas rādītājiem un BCL2, ciklīna D1, LCA / CD45 un kappa / lambda vieglās ķēdes ekspresiju netika konstatēta (p > 0,05).
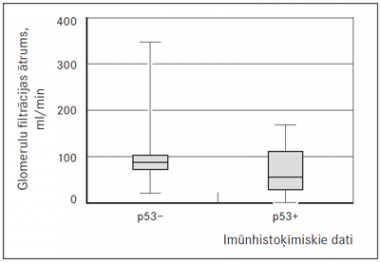
Pacientiem ar izteiktu p53 ekspresiju mielomas šūnās bija noteikta statistiski ticama korelācija ar samazinātu GFĀ (sk. 4. att.) un paaugstinātu kreatinīna līmeni serumā (sk. 5. att.).
2. attēls. Glomerulu filtrācijas ātruma līmenis multiplās mielomas slimniekiem ar pozitīvu un negatīvu CD 56 ekspresiju, p < 0,0001 / Glomerular filtration rate in MM cases with positive and negative expression of CD56 marker, p < 0.0001 | 3. attēls. Kreatinīna līmenis serumā multiplās mielomas slimniekiem ar pozitīvu un negatīvu CD 56 ekspresiju, p = 0,0001 / Serum creatinine level in MM cases with positive and negative expression of CD56 marker, p = 0.0001 |
|
|
4. attēls. Glomerulu filtrācijas ātruma līmenis multiplās mielomas slimniekiem ar izteiktu un vāju p53 ekspresiju, p = 0,0336 / Glomerular filtration rate in MM cases with strong and weak expression of p53 marker, p = 0.0336 | 5. attēls. Kreatinīna līmenis serumā multiplās mielomas slimniekiem ar izteiktu un vāju p53 ekspresiju, p = 0,028 / Serum creatinine level in MM patients with strong and weak expression of p53 marker, p = 0.0336 |
|
|
6. attēls. Totāla vidēja un liela izmēra mielomas šūnu (pārsvarā ar plazmoblastisku diferenciāciju) infiltrācija kaulu smadzenēs (hematoksilīns / eozīns, × 250) / Total infiltration of bone marrow by medium and large sized atypical neoplastic myeloma cells with plasmablastic differentiations (H / E, × 250) | 7. attēls. Izteikta p53 intranukleāra pozitivitāte mielomas šūnās (EnVision metode, × 400) / P53 intranuclear expression in myeloma cells (EnVision method, × 400) |
|
|
Diskusija
Mūsu pētījumā iegūtie rezultāti parādīja, ka slimniekiem MM diagnosticēšanas brīdī bija šādas stadijas pēc Durie-Salmon klasifikācijas: I A un I B stadija tika noteikta 14 slimniekiem (20 %); II A un II B stadija tika noteikta 30 (43 %), bet III A un III B stadija bija 26 pacientiem (37 %). Savukārt nieru mazspējas stadijas pētītajos gadījumos bija šādas: 19 (27,1 %) pacientiem tika diagnosticēta tās 2. stadija, 7 (10 %) – 3.a stadija, 6 (8,6 %) – 3.b stadija, 6 (8,6 %) – 4. stadija un 4 (5,7 %) pacientiem – 5. stadija. Hroniska nieru mazspēja pēc dažādu pētījumu rezultātiem tiek konstatēta līdz 50 % slimnieku MM diagnosticēšanas brīdī, bet mūsu analizētajā slimnieku grupā GFĀ dažādas nieru mazspējas stadijas uzrādīja 42 slimniekiem vai 60 % gadījumu. Pēdējās divās hroniskas nieru slimības stadijās ir nepieciešama hemodialīze.
Vairāki pētījumi pierāda mielomas šūnu morfoloģisko rādītāju nozīmi MM gaitas prognozēšanā, īpaši tādu kā kaulu smadzeņu celularitāte, mielomas šūnu skaits un to infiltrācijas veids un t. s. plazmoblastiskā diferenciācija (Rajkumar et al., 1999; Bartl et al., 2002; Subramanian et al., 2009).
Mūsu analizētajā pacientu grupā mielomas šūnu kaulu smadzeņu celularitāte un to difūzais infiltrācijas tips, kā arī paaugstināts mielomas šūnu ar plazmoblastisku diferenciāciju procentuālais daudzums statistiski ticami korelēja ar nieru mazspējas laboratoriskiem rādītājiem, tādēļ, mūsuprāt, minētās morfoloģiskās atrades var izmantot arī MM biežāko komplikāciju, tajā skaitā nieru mazspējas, prognozē.
Pazemināts GFĀ statistiski ticami korelēja arī ar kaulu smadzeņu mieloīdās rindas hipoplāziju vai tās nobriešanas kavēšanos (novirze pa kreisi), kā arī ar samazinātu megakariocītu skaitu. Iespējams, tas varētu būt saistīts ar slimnieku vecumu vai arī ar to, ka viņiem jau pirms MM attīstības bija nieru funkcijas pasliktināšanās tādu blakusslimību dēļ kā arteriāla hipertensija vai cukura diabēts.
Vairāki autori (Bartl et al., 2002) kā vienu no galvenajiem MM agresivitātes morfoloģiskiem rādītājiem uzskata paaugstinātu procentuālo kaulu smadzeņu plazmatisko šūnu skaitu. Taču mūsu pētījumā šī rādītāja statistiski ticama korelācija ar nieru mazspējas marķieriem netika konstatēta.
Analizējot iegūtos imūnhistoķīmiskos datus, konstatējām statistiski ticamu korelāciju starp nieru mazspējas rādītājiem un CD56 un p53 ekspresijas līmeņiem mielomas šūnās. Mūsu pētāmo pacientu grupā p53 izteikta pozitivitāte mielomas šūnās tika konstatēta slimniekiem ar nieru mazspēju, tā statiski ticami korelē ar samazinātu GFĀ un paaugstinātu kreatinīna līmeni. P53 ir svarīgs šūnu cikla regulētājgēns (Soussi et al., 2010). P53 ekspresiju mielomas šūnās saista ar smagāku MM klīnisko gaitu un īsāku pacientu dzīvildzi. Iespējams, agresīvāka MM gaita izraisa vienu no biežākajām tās komplikācijām – nieru mazspējas attīstību, bet pieejamos literatūras avotos neatradām pētījumus par šo tēmu.
Taču nieru bojājuma patofizioloģiskais mehānisms MM gadījumā ir zināms un izskaidrojams ar brīvajām monoklonālajām vieglajām ķēdēm, kas zemās molekulmasas dēļ tiek brīvi filtrētas caur glomeruliem un tad tiek reabsorbētas proksimālajos nieru kanāliņos endocitozes ceļā. Tā kā MM gadījumā ir šo vieglo ķēžu pārprodukcija, tad tiek pārsniegtas proksimālo nieru kanāliņu epitēlijšūnu reabsorbcijas spējas. Rezultātā rodas tubulointersticiālā nefropātija (Hutchison et al., 2010). Palielināta p53 ekspresija liecina par ļaundabīgo šūnu pastiprināto proliferāciju un, iespējams, ietekmē nieru mazspējas līmeni MM slimniekiem.
Mūsuprāt, CD56 antigēna ekspresijas trūkumam ir zināma loma biežākas MM komplikācijas – nieru mazspējas – attīstībā, jo tās lielumi, līdzīgi kā p53, statistiski ticami korelē ar samazinātu GFĀ un paaugstinātu kreatinīna līmeni. Lielāka daļa autoru, piemēram, Sahara et al., 2002; Hundemer et al. 2007, pierāda CD56 antigēna lomu MM agresivitātes prognozē, uzsverot, ka CD56 negativitāte visbiežāk ir saistīta ar mielomas šūnu zemāku diferenciāciju (Dunphy et al., 2007).
Analizētajā MM slimnieku grupā BCL2 ekspresiju konstatējām 90 % gadījumu, kas atbilst citu pētnieku rezultātiem (Miguel-García, 1998). Statiski ticamu saistību starp nieru mazspēju un BCL2 ekspresiju nepierādījām. BCL2 antiapoptotisko marķiera ekspresiju visticamāk lietderīgi izmantot MM diferenciāldiagnostikā no reaktīvās plazmocitozes, jo kontroles grupā plazmatiskās šūnās BCL2 ekspresiju nekonstatējām.
Ciklīna D1 klātbūtne audzēja šūnās saistīta ar t(11;14) translokāciju (Hitomi et al., 1999). Šī marķiera ekspresijas loma MM gadījumā nav viennozīmīga, kaut gan lielākā daļa autoru ciklīna D1 ekspresiju mielomas šūnās saista ar MM labdabīgu gaitu (Markovic et al., 2004; Cook et al., 2006). Mūsu pētāmo pacientu grupā statistiski ticamu korelāciju starp nieru mazspējas rādītājiem un ciklīna D1 ekspresiju neizdevās pierādīt. Iespējams, ka ciklīna D1 ekspresija nav saistīta ar nieru mazspējas attīstību MM slimniekiem, bet tās ekspresija varētu būt saistīta ar kādu citu MM komplikācijas attīstību, piemēram, osteolītiskām pārmaiņām.
LCA / CD45 antigēna loma mielomas šūnās arī nav viennozīmīga (Kumar et al., 2005; Mateo et al., 2008). Marķiera interpretācija dažkārt ir apgrūtināta, jo tam piemīt koekspresija citās hemopoētiskās šūnās. Mūsu analizēto pacientu grupā nieru mazspējas rādītāju statistiski ticama korelācija ar šī marķiera aberanto ekspresiju netika atrasta.
Mūsuprāt, svarīgi multiplās mielomas slimnieku prognozes novērtējumā ņemt vērā gan Starptautiskā mielomas fonda sistēmas, gan Salmon–Durie klasifikācijas, sevišķi nosakot nefropātijas esamību (Durieet et al., 1975; Fechtner et al., 2010; Faiman, 2014). Pētījumā iegūtos prognostiskos morfoloģiskos, imūnhistoķīmiskos un nieru funkcijas rādītājus plānojam izmantot mūsu analizētās slimnieku grupas izdzīvotības novērtējumā.
Secinājumi
- Kaulu smadzeņu augsta celularitāte, ievērojams atipisko plazmatisko šūnu procentuālais daudzums ar to plazmablastisku diferenciāciju un kaulu smadzeņu difūzs mielomas šūnu infiltrācijas tips korelē ar nieru funkcijas laboratorisko rādītāju pasliktināšanos multiplās mielomas slimniekiem.
- CD56 antigēna trūkums un p53 marķiera izteikta pozitivitāte mielomas šūnās korelē ar nieru funkcijas pasliktināšanos multiplās mielomas slimniekiem.
- Plazmatisko šūnu daudzumam kaulu smadzeņu bioptātos, kā arī ciklīna D1, BCL2, LCA / CD45 ekspresijai nav statistiski ticamas korelācijas ar nieru mazspējas rādītājiem multiplās mielomas slimniekiem.
Abstract
Characteristics of Myeloma Cells Morphological and Immunohistochemical Prognostic Parameters and Their Role in Assessment of Renal Function of Multiple Myeloma Patients
Multiple myeloma (MM) is a malignant haematological disease which, in approximately 50% cases, has chronic kidney disease.
The morphological and immunohistochemical examination of bone marrow (BM) allows not only accurately to diagnose malignancy of plasma cells but also to describe the prognosis of MM by such antigens as CD56, Cyclin D1, p53, BCl2, kappa / lambda.
The objective of the study was to investigate the relationship between the myeloma cells morphological and immunohistochemical characteristics in BM biopsies and renal function of patients with MM.
70 patients with a primary diagnosis of MM and various stages of kidney failure were analysed. Glomerular filtration rate (GFR) and creatinine measurements was compared with myeloma cell morphological and immunohistochemical parameters: CD138, LCA, Cyclin D1, p53, BCL2, Kappa / lambda light chains, CD56.
The study proved that elevated levels of creatinine and reduced GFR statistically correlate with increased expression of p53, loss of CD56 antigen and with the diffuse infiltration type of myeloma cells in BM.
Decline of GFR statistically correlates with the increased cellularity of BM and elevated numbers of plasmablastic cells with atypical differentiation of them expressed in percentages (p < 0.05). Statistically reliable correlation between renal functions and BCL2, Cyclin D1, LCA and light chains kappa / lambda expression was not detected.
Expressed cellularity of BM, significant amount of atypical plasmablasts with plasmablastic differentiation and diffuse type of infiltration of malignant cells correlate with laboratory tests for renal function impairment in the MM patients.
The shortage of CD56 antigen and expressed positively of p53 in myeloma cells correlate with the decreased renal function in patients with MM.
The amount of plasmacytes in the BM, as well as expression of Cyclin D1, BCL2, LCA/CD45 have no statistically reliable correlation with the tests of chronic kidney disease in MM patients.
Literatūra
- Bartl, R. and Frisch, B. Clinical Significance of Bone Marrow and Bone Morphology in Myeloma. J. Mehta, S. Singhai, eds. London: Martin Dunitz LTD, 2002, pp. 269–296.
- Brown, V. K., Ogle, E. W., Burkhardt, A. L., Rowley, R. B., et al. Multiple components of the B cell antigen receptor complex associate with the protein tyrosine phosphatase, CD45. Journal of Biological Chemistry. 1994, 269(25), 17238–17244.
- Caldwell, C. W. and Patterson, W. P. Relationship between CD45 antigen expression and putative stages of differentiation in B-cell malignancies. American Journal of Hematology. 1991, 36(2), 111–115.
- Chang, H., Yeung, J., Qi, C. and Xu, W. Aberrant nuclear p53 protein expression detected by immunohistochemistry is associated with hemizygous P53 deletion and poor survival for multiple myeloma. British Journal of Haematology. 2007, 138(3), 324–329.
- Chen, M. H., Qi, C. X., Saha, M. N. and Chang, H. p53 nuclear expression correlates with hemizygous TP53 deletion and predicts an adverse outcome for patients with relapsed/refractory multiple myeloma treated with lenalidomide. American Journal of Clinical Pathology. 2012, 137(2), 208–212.
- Cook, J. R., His, E. D., Worley, S., Tubbs, R. R., et al. Immunohistochemical analysis identifies two cyclin D1+ subsets of plasma cell myeloma, each associated with favorable survival. American Journal of Clinical Pathology. 2006, 125(4), 615–624.
- Desikan, R., Jagannath, S., Richardson, P. and Munshi, N. C. Multiple myeloma and other plasma cell dyscrasias. Cancer Management: a Multidisciplinary Approach. 2004, 727–729.
- Dunphy, C. H., Nies, M. K. and Gabriel D. A. Correlation of plasma cell percentages by CD138 immunohistochemistry, cyclin D1 status, and CD56 expression with clinical parameters and overall survival in plasma cell myeloma. Applied Immunohistochemistry & Molecular Morphology. 2007, 15(3), 248–254.
- Durie, B. G. M. and Salmon, S. E. A clinical staging system for multiple myeloma correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer. 1975, 3(36), 842–854.
- Faiman, B. Myeloma genetics and genomics: Practice implications and guture directions. Clinical Lymphoma Myeloma and Leukemia. 2014, 14(6), 436–440.
- Fechtner, K., Hillengass, J., Delorme, S., Heiss, C., et al. Staging monoclonal plasma cell disease: Comparison of the Durie-Salmon and the Durie-Salmon PLUS Staging Systems. Radiology. 2010, 257(1), 195–204.
- Greipp, P. R., San Miguel, J., Durie, B. G. M., et al. International Staging System for Multiple Myeloma. Journal of Clinical Oncology. 2005, 23(15):,3412–6281.
- Greipp, P. R., Raymond, N. M., Kyle, R. A. and O’Fallon W. M. Multiple myeloma: Significance of plasmablastic subtype in morphological classification. Blood. 1985, 65(2), 305–310.
- Harada, H., Kawano, M. M., Huang, N., Harada, Y., et al. Phenotypic difference of normal plasma cells from mature myeloma cells. Blood. 1993, 15, 81(10), 2658–2663.
- Harrington, A. M., Hari, P. and Kroft S. H. Utility of CD56 immunohistochemical studies in follow-up of plasma cell myeloma. American Journal of Clinical Pathology. 2009, 132(1), 60–66.
- Hitomi, M. and Stacey, D. W. Cellular ras and cyclin D1 are required during different cell cycle periods in cycling NIH 3T3 cells. Molecular and Cellular Biology. 1999; 19(7), 4623–4632.
- Hockenbery, D., Nunez, G., Milliman, C., Schreiber, R. D., et al. Bcl-2 is an inner mitochondrial membrane protein that blocks programmed cell death. Nature. 1990, 348(6299), 334–336.
- Hsiao, L. T., Yang, C. F., Yang, S. H., Gau, J. P., et al. Chronic kidney disease stage 5 as the prognostic complement of International Staging System for multiple myeloma. European Journal of Haematology. 2012, 88(2), 159–166.
- Hundemer, M., Klein, U., Hose, D., Raab, M. S., et al. Lack of CD56 expression on myeloma cells is not a marker for poor prognosis in patients treated by high-dose chemotherapy and is associated with translocation t (11;14). Bone Marrow Transplantation. 2007, 40(11), 1033–1037.
- Hutchison, C. A. and Bridoux F. Renal impairment in multiple myeloma: Time is of the essence. Journal of Clinical Oncology. 2010; 2 (11), 312–313.
- Kaplan, R., Morse, B., Huebner, K., Croce, C., et al. Cloning of three human tyrosine phosphatases reveals a multigene family of receptor-linked protein-tyrosine-phosphatases expressed in bramin. Proceedings of the National Academy of Sciences of the United States of America. 1990, 87(18), 7000–7004.
- Knudsen, L. M., Hippe, E., Hjorth, M., Holmberg, E., et al. The Nordic Myeloma Study Group. European Journal of Haematology. 1994, 53, 207–212.
- Kumar, S., Rajkumar, S. V., Kimlinger, T., Greipp, P. R., et al. CD45 expression by bone marrow plasma cells in multiple myeloma: clinical and biological correlations. Leukemia. 2005, 19(5), 1466–1470.
- Lamb, E. J., Levey, A. S. and Stevens, P. E. The Kidney Disease Improving Global Outcomes (KDIGO) guideline update for chronic kidney disease: evolution not revolution. Clinical Chemistry. 2013, 59(3), 462–465.
- Lopez-Giacoman, S. and Madero, M. Biomarkers in chronic kidney disease, from kidney function to kidney damage. World Journal of Nephrology. 2015, 4(1), 57–73.
- Markovic, O., Marisavljevic, D., Cemerikic, V., Suvajdzic, N., et al. Immunohistochemical analysis of cyclin D1 and p53 in multiple myeloma: Relationship to proliferative activity and prognostic significance. Medical Oncology. 2004, 21(1), 73–80.
- Mateo, G., Montalbán, M. A., Vidriales, M. B., Lahuerta, J. J., et al. Prognostic value of immunophenotyping in multiple myeloma: a study by the PETHEMA/GEM cooperative study groups on patients uniformly treated with high-dose therapy. Journal of the American Society of Clinical Oncology. 2008, 2 (16), 2737–2744.
- McKenna, R. W., Kyle, R. A., Kuehi, W. M., Gorgan, T. M., et al. Mature B Cells Neoplasms. In: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. / S. H. Swerdlow, E. Campo, N. L. Harris, E. S. Jaffe, et al., eds. 4th ed. Lyon: IARC, 2008, pp. 202–207.
- Miguel-García, A., Orero, T., Matutes, E., Carbonell, F., et al. Bcl-2 expression in plasma cells from neoplastic gammopathies and reactive plasmacytosis: a comparative study. Haematologica. 1998, 83(4), 298–304.
- Pildava, S. Pasaules literatūras apskati: Multiplā mieloma. Iegūts no: http://www.doctus.lv/2012/7/multipla-mieloma (sk. 24.04.2015.).
- Puthier, D., Pellat-Deceunynck, C., Barille, S., Robillard, N., et al. Differential expression of Bcl-2 in human plasma cell disorders according to proliferation status and malignancy. Leukemia. 1999, 13(2), 289–294.32.
- Pruneri, G., Carboni, N., Baldini, L., et al. Cell cycle regulators in multiple myeloma: prognostic implications of p53 nuclear accumulation. Human Pathology. 2002, (34) 1, 41–47).
- Rajkumar, S. V. and Dispenzieri, A. Multiple myeloma and related disorders. In: Abeloff’s Clinical Oncology. J. E. Niederhuber, J. O. Armitage, J. H. Doroshow, M. B Kastan., et al. Eds. 5th ed. Philadephia: Elsevier, 2014, pp. 1991–2017.
- Rajkumar, S. V., Fonseca, R., Lacy, M. Q., Witzig, T. E., Therneau T. M., Kyle R. A., Litzow M. R., Gertz M. A., Greipp P. R. Plasmablastic morphology is an independent predictor of poor survival after autologous stem-cell transplantation for multiple myeloma. Journal of Clinical Oncology. 1999, 17(5), 1551–1557.
- Rawstron, A., Barrans, S., Blythe, D., Davies, F., et al. Distribution of myeloma plasma cells in peripheral blood and bone marrow correlates with CD56 expression. British Journal of Haematology. 1999, 104(1), 138–143.
- Sahara, N., Takeshita, A., Shigeno, K., Fujisawa, S., et al. Clinicopathological and prognostic characteristics of CD56-negative multiple myeloma. British Journal of Haematology. 2002, 117(4), 882–885.
- Sandilands, E. A., Dhaun, N., Dear, J. W. and Webb D. J. Measurement of renal function in patients with chronic kidney disease. British Journal of Clinical Pharmacology. 2013, 76(4), 504–515.
- Singhal, N., Singh, T., Singh, Z. N., Shome, D. K., et al. Histomorphology of multiple myeloma on bone marrow biopsy. Indian Journal of Pathology and Microbiology. 2004, 47(3), 359–363.
- Soussi, T. The history of p53: A perfect example of the drawbacks of scientific paradigms. EMBO Reports. 2010, 11(11), 822–826.
- Stevens, L. A., Coresh, J., Greene, T., and Levey A. S. Assessing kidney function-measured and estimated glomerular filtration rate. New England Journal of Medicine. 2006, 354(23), 2473–2483.
- Subramanian, R., Basu, D. and Dutta T. K. Prognostic significance of bone marrow histology in multiple myeloma. Indian Journal of Cancer. 2009, 46(1), 40–45.
- Rhee, F., van, Anaissie, E., Angtuaco, E., Bartel, T., et al. Myeloma. In: Williams Hematology. M. A. Lichtman, T. J. Kipps, U. Seligsohn, K. Kaushansky, et al., eds. 8th ed. New York: McGraw-Hill; 2010.