Vairogdziedzera folikulocītu blīvo savienojumu proteīna klaudīna-1 imūnekspresijas atšķirības pacientiem ar Hasimoto tireoidītu un Greivsa slimību
Kopsavilkums
Ievads. Hasimoto tireoidīts un Greivsa slimība pieder pie autoimūnām vairogdziedzera slimībām, kuru gadījumā ģenētiskā predispozīcija un noteiktu ārvides faktoru ietekme izraisa imunoloģiskās tolerances zudumu ar sekojošu autoimūnā procesa attīstību. Vairogdziedzera folikula sieniņas epitēlija veidotās barjeras bojājums sekmē imūnās sistēmas šūnu nonākšanu folikula dobumā un tireoīdperoksidāzes imūnprezentāciju, kas ievada autoimūno reakciju Hasimoto tireoidīta gadījumā. Daži pēdējo gadu pētījumu rezultāti liek domāt, ka folikulāro epiteliocītu blīvo savienojumu proteīnu, tostarp klaudīna-1, izmaiņām ir būtiska nozīme šo slimību attīstībā.
Darba mērķis. Izvērtēt klaudīna-1 ekspresiju vairogdziedzera audos pacientiem ar Hasimoto tireoidītu un Greivsa slimību, izmantojot imūnhistoķīmijas metodi.
Materiāls un metodes. Pētījumā tika analizēti vairogdziedzera audu griezumi no RAKUS stacionāra “Gaiļezers” Patoloģijas centra arhīva materiāla, kas tireoīdektomijas operācijas laikā iegūti no 35 pacientiem – 17 Hasimoto tireoidīta un 7 Greivsa slimības, kā arī 11 mezglainas koloīdas strumas slimniekiem, tos iekļaujot salīdzinājuma grupā. Imūnhistoķīmiskā reakcija veikta ar anti-klaudīna- 1 antivielu. Reakciju rezultāti novērtēti puskvantitatīvi. Datu statistiskā apstrāde veikta, izmantojot SPSS 21. versiju.
Rezultāti. Visaugstākā klaudīna-1 vidējā ekspresija tika novērota Hasimoto tireoidīta pacientiem. Tika aprēķināta vidējā klaudīna-1 ekspresija Hasimoto tireoidīta un Greivsa slimības pacientiem, kas bija attiecīgi 1,65 ± 0,63 un 1,22 ± 0,19, savukārt vidējā ekspresija pacientiem ar mezglainu koloīdu strumu bija 1,58 ± 0,44. Klaudīna-1 pozitīvus folikulus redzeslaukā statistiski ticami vairāk konstatējām pacientiem ar Hasimoto tireoidītu, salīdzinot ar strumu (p = 0,03). Vidējais pozitīvo folikulu skaits pacientiem ar Hasimoto tireoidītu un strumu bija attiecīgi 2,85 ± 2,51 un 2,16 ± 1,66. Hasimoto tireoidīta pacientiem tika konstatēta gan ekstrafolikulāra, gan intrafolikulāra CD68 pozitīvu makrofāgu lokalizācija.
Secinājumi. Lai gan Hasimoto tireoidīts un Greivsa slimība pieskaitāmas autoimūnām slimībām, atšķirības autoimūnajā mehānismā izpaužas arī atšķirīgā klaudīna-1 imūnekspresijā. Gan paaugstināta, gan samazināta vai pat negatīva klaudīna-1 imūnekspresija dažādiem Hasimoto tireoidīta pacientiem liecina par blīvo savienojumu proteīnu svarīgo nozīmi epitēlija barjeras integritātes saglabāšanā un iespējamu kompensatoru mehānismu. Intrafolikulāro makrofāgu esība Hasimoto tireoidīta pacientiem ļauj spriest par to līdzdalību anti-TPO atkarīga citotoksiskā mehānisma nodrošināšanā izmainītas folikulāru šūnu integritātes gadījumā.
Ievads
Autoimūnās vairogdziedzera slimības, piemēram, Hasimoto tireoidīts (HT) un Greivsa slimība (GS), ir visbiežākās autoimūnās endokrīnās slimības pasaulē; tās skar pārsvarā sievietes vecumā no 30 līdz 50 gadiem (Huber et al., 2008). Ar autoimūnām vairogdziedzera slimībām slimo līdz 5 % pasaules iedzīvotāju populācijas (Hollowell et al., 2002). un ir zināms, ka HT izplatība pasaulē pēdējo 50 gadu laikā ir krasi palielinājusies (Staii et al., 2010; Rizzo et al., 2010). HT jeb hronisks autoimūns tireoidīts ir biežākais hipotireozes un strumas iemesls, ko raksturo cirkulējošas anti-tireoglobulīna (anti-Tg) un anti-tireoīdperoksidāzes (anti-TPO) antivielas. Savukārt anti-TSH receptoru (anti-TSHR) antivielas ir atrodamas GS slimnieku asinīs (Staii et al., 2010).
Pie HT raksturīgākajām vairogdziedzera audu patoloģiskajām izmaiņām pieder difūza limfoplazmocitāra infiltrācija ar sekundāro limfātisku folikulu veidošanos, dažādas pakāpes stromas fibroze, parenhīmas atrofija, kā arī Hurthle šūnu esamība. Lai arī abas slimības raksturo vairogdziedzera audu limfomonocitāra infiltrācija, tās izpaužas ar diviem klīniski pretējiem sindromiem. HT gadījumā izteikta limfocitāra infiltrācija izraisa vairogdziedzera folikulārā epitēlija bojāeju un sekmē hipotireozes attīstību, savukārt GS gadījumā iekaisuma šūnu infiltrācija nav tik izteikta. GS gadījumā autoimūnā reakcija veicina ar TSH receptoriem saistīto B limfocītu aktivāciju, folikulāru hiperplāziju un izraisa hipertireozi (Orgiazzi, 2012).
Autoimūno vairogdziedzera slimību iemesli vēl nav pilnībā izzināti, tomēr ir zināms, ka ģenētiskie un apkārtējās vides faktori sekmē šo slimību attīstību (Yaron and Amanda, 2009; Zaletel and Gaberšček, 2011; Eschler et al., 2011). HT gadījumā ir noteikta ģenētiska predispozīcija. Daži endogēni un eksogēni faktori var ierosināt vairogdziedzera autoimunitāti, izraisot paaugstinātu antigēnu prezentāciju un samazinātu imūno toleranci. Vairogdziedzera autoimunitātes ierosināšanai ir nepieciešama noteikta mijiedarbība starp tireocītiem, antigēnus prezentējošām šūnām un T limfocītiem. Šīs mijiedarbības rezultātā notiek citokīnu sekrēcija, kas izraisa galvenokārt Th1 un, iespējams, arī Th17 saistīto imūno atbildi (Figueroa et al., 2010; Shi et al., 2010). Palielināta citokīnu, proti, tumora nekrozes faktora alfa (TNF-α), interferona-γ un interleikīna-1 produkcija var novest pie tireocītu un to savienojumu izmaiņām, kas sekmē CD8+ šūnu citotoksicitāti, komplementa sistēmas aktivāciju, un rezultātā izraisa vairogdziedzera folikulu destrukciju (Zaletel and Gaberšček, 2011).
Anti-TPO antivielas atrodamas augstos titros asins serumā 90 % slimnieku ar HT (Rapoport and McLachlan, 2001). Ir noskaidrota anti-TSHR antivielu tiešā patogēnā ietekme Greivsa slimības attīstībā, savukārt anti-Tg un anti-TPO antivielu nozīme vairogdziedzera šūnu destrukcijā slimniekiem ar HT vēl tiek pētīta. Vairogdziedzera folikulārās šūnas ir izvietotas vienā slānī un darbojas kā barjera starp folikula dobumu, kurā tiek glabāti vairogdziedzera hormonu priekšteči un tireoglobulīns, un intersticiālo telpu. Vairogdziedzera folikulāro šūnu savienojumu komplekss sastāv no slēgjūglēm jeb blīvajiem šūnu savienojumiem (zonula occludens) un salipšanas josliņas (zonula adhaerens), tādā veidā pilnīgi noslēdzot šūnstarpu.
Ir zināms, ka TPO ekspresējas uz tireocīta plazmolemmas apikālā domēna, kas ir vērsts gan pret folikula dobumu, gan šūnas citoplazmu (Nilsson et al., 1998). Taču TPO prezentācijas mehānisms imūnai sistēmai, tāpat kā jautājums, kādā veidā antigēnus prezentējošās šūnas nonāk kontaktā ar autoantigēniem, lokalizētiem uz tireocītu plazmatiskās membrānas apikālās daļas vai folikula dobumā, paliek neskaidrs. Tāpēc ir pamats domāt, ka anti-TPO antivielas neuzsāk vairogdziedzera audu bojājumus, tomēr var veicināt to destrukciju, kad folikulārā epitēlija barjera jau ir bojāta.
Viena no hipotēzēm balstās uz vairogdziedzera epitēlija integritātes bojājumu, kas, mainoties šūnu savienojuma proteīnu ekspresijas profilam un lokalizācijai, ļauj imūnkompetentām šūnām virzīties uz folikula dobumu (Nilsson et al., 1998; Rebuffat et al., 2013). Otrkārt, epiteliālās barjeras slēgjūgļu bojājuma gadījumā TPO, pateicoties laterālai difūzijai, varētu tikt pārnesta uz tireocītu bazilaterālo virsmu, kur to spēj atpazīt intersticiālie makrofāgi un dendrītiskās šūnas (Nilsson et al., 1998).
Klaudīni ir galvenie blīvo šūnu savienojumu proteīni, kas atrodas šūnu apikālā gala sānu virsmās. Blīvie šūnu savienojumi noslēdz un pārtrauc paracelulāro transportu, vienlaicīgi izolējot plazmatiskās membrānas apikālos un bazilaterālos domēnus un nosakot ar to saistīto tireocītu dažādu virsmu funkcionālo atšķirību. Ir zināms, ka klaudīnu ekspresija ir izteikti audu specifiska, turklāt lielākā daļa audu ekspresē vairākus klaudīnu saimes locekļus (Singh et al., 2010; Ding et al., 2013).
Daudzu pētījumu rezultāti demonstrē paaugstinātu klaudīnu imūnekspresiju vienu ļaundabīgo audzēju gadījumos, bet pazeminātu – citu audzēju gadījumos (Ding et al., 2013). Piemēram, papillāra un folikula vairogdziedzera vēža gadījumā ir novērota paaugstināta klaudīna-1 un 7 ekspresija, savukārt medulārā vēža gadījumā – klaudīna-4 ekspresija (Fluge et al., 2006; Tzelepi et al., 2008; Abd El Atti and Shash, 2012). Līdz šim maz pētīta ir klaudīna-1 imūnekspresija vairogdziedzera audos pacientiem ar autoimūnām vairogdziedzera slimībām, kaut gan tā ekspresija ir aprakstīta vairākos pētījumos pacientiem ar vairogdziedzera malignitāti.
Darba mērķis
Izvērtēt klaudīna-1 ekspresiju vairogdziedzera audos pacientiem ar Hasimoto tireoidītu un Greivsa slimību, izmantojot imūnhistoķīmijas metodi.
Materiāls un metodes
Pētījumā tika analizēti RAKUS stacionāra “Gaiļezers” Patoloģijas centra arhīva materiāla vairogdziedzera audu paraugi, kas iegūti no 35 pacientiem pēc tireoīdektomijas – 17 HT un 7 GS pacientiem, kā arī 11 pacientiem ar mezglainu koloīdu strumu bez autoimūnā komponenta, kas tika iekļauti salīdzinājuma grupā (diagnozes pamato klīniskie un morfoloģiskie dati). Rīgas Stradiņa universitātes Ētikas komitejas atļauja saņemta 27.05.2014.
No parafīna blokos ielietā vairogdziedzera audu materiāla ar mikrotomu pagatavoti 4–6 mkm biezi histoloģiskie griezumi. Vispārēja pārskata iegūšanai audu griezumi tika krāsoti ar hematoksilīnu un eozīnu. Imūnhistoķīmiskā reakcija veikta ar anti-klaudīna-1 antivielu (orb127883, Biorbyt, Apvienotā Karaliste, 1 : 100). HT pacientiem makrofāgu noteikšanai tika izmantota monoklonālā anti-CD68 antiviela (DacoCytomation, Glostrupa, Dānija, klons PG-M1, 1 : 50). Antigēna un antivielas reakcijas vizualizācijas nodrošināšanai tika izmantota polimēru sistēma (HiDef Detection™ HRP Polymer System, CellMarque, Roklina, Kalifornija, ASV) un diaminobenzidīns lietots kā hromogēns (CellMarque, Roklina, Kalifornija, ASV).
Vairogdziedzera folikulas šūnas ar pozitīvu membranozo reakciju izvērtētas puskvantitatīvi, analizējot 15 redzes laukus gaismas mikroskopa 400 × palielinājumā, kā arī kvantitatīvi, skaitot klaudīna-1 pozitīvos folikulus un vairogdziedzera folikulus ar CD68 pozitīviem intrafolikulāriem makrofāgiem 15 redzes laukos. Klaudīna-1 ekspresija tika aprēķināta procentos un novērtēta no 1 līdz 4; 1 – < 5 %; 2 – no 5 līdz 25 %; 3 – no 26 līdz 50 %; 4 – > 50 % pozitīvu šūnu (modificēts pēc Abd El Atti et al. 2012). Imūnekspresijas atšķirību statistiskā ticamība noteikta, izmantojot Manna–Vitnija U-testu. Būtiskuma līmenis (p) ar vērtību, kas mazāka par 0,05, vērtēts kā statistiski ticams.
Rezultāti
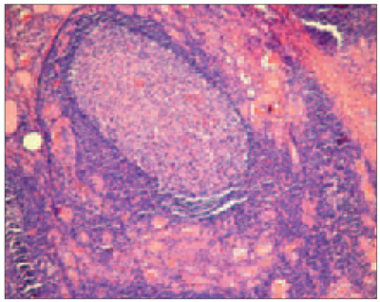
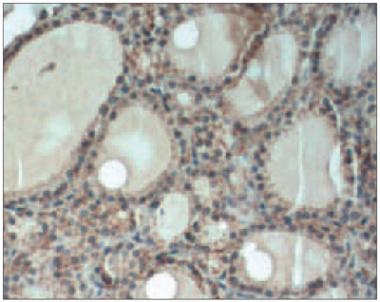
Pacientiem ar HT vairogdziedzera audi veidoti no dažāda izmēra un formas vairogdziedzera folikuliem ar plakanu vai kubisku epitēliju to sieniņās, kā arī ar koloīdu folikulu dobumos. Iekaisuma šūnu infiltrāti stromā tika atrasti visos audu paraugos. HT pacientiem tika novērota gan difūzi (sk. 1. att.), gan atsevišķi limfātiskie folikuli. Atsevišķos gadījumos tika noteikta limfoplazmocitāra infiltrācija bez folikulu veidošanas. Stromas fibroze variēja no starpfolikulu līdz starpdaiviņu fibrozei. Visos audu preparātos tika atrastas Hurthle šūnas – lielas folikulāras šūnas ar graudainu eozinofilu citoplazmu.
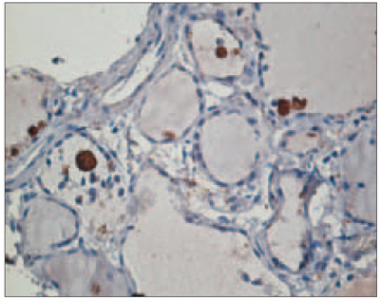
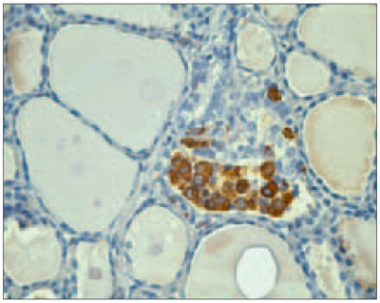
HT slimniekiem tika konstatēta gan ekstrafolikulāra, gan intrafolikulāra CD68 pozitīvo makrofāgu lokalizācija. Intrafolikulāros makrofāgus raksturoja vakuolizēta citoplazma, tie bija individuāli izkliedēti folikulu dobumos (sk. 2. att.) vai organizēti grupās (sk. 3. att.). Vidēji 26,8 % gadījumu vairogdziedzera folikulu dobumos tika atrasti atsevišķi CD68 pozitīvi makrofāgi, savukārt makrofāgu grupas – 1,3 % folikulu dobumos. Folikuli ar makrofāgiem dobumā visbiežāk bija bez koloīda vai ar tā atliekām.
Pacientiem ar GS vairogdziedzera audi bija veidoti no dažāda izmēra hiperplastiskiem folikuliem ar samazinātu koloīda daudzumu un ar augstu cilindrisku sieniņas hiperplastisku epitēliju. Stromā bija atsevišķi iekaisuma šūnu infiltrāti.
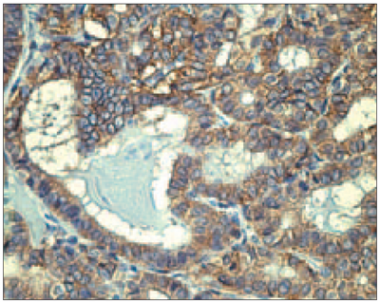
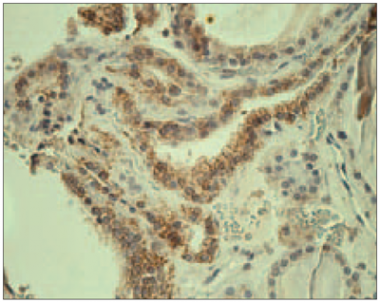
Pozitīva membranoza klaudīna-1 ekspresija vairogdziedzera folikulārajās šūnās (> 5 % pozitīvu šūnu) tika novērota 27 no 35 pacientiem (77,1 %). Visaugstākā klaudīna-1 vidējā ekspresija tika novērota HT pacientiem (sk. 4. att.), lai gan 6 no 17 pacientiem imūnekspresija bija negatīva. Tika aprēķināta klaudīna-1 vidējā ekspresija HT un GS pacientiem (sk. 5. att.), kas bija attiecīgi 1,65 ± 0,63 un 1,22 ± 0,19, savukārt strumas gadījumā ekspresija bija 1,58 ± 0,44.
Tikai 8 no 35 pacientiem (22,9 %) tika novērota maksimālā imūnpozitivitāte > 50 % šūnu, seši no tiem bija pacienti ar HT un divi – ar mezglainu koloīdu strumu (sk. 6. att.). Tomēr deviņiem (81,8 %) pacientiem ar mezglainu koloīdu strumu vidējā klaudīna-1 ekspresija tika novērtēta zemāk par 2. Klaudīna-1 pozitīvus folikulus redzeslaukā statistiski ticami vairāk konstatējām pacientiem ar HT, salīdzinot ar strumu (p = 0,03). Vidējais pozitīvo folikulu skaits pacientiem ar HT un kontroles grupā bija attiecīgi 2,85 ± 2,51 un 2,16 ± 1,66.
1. attēls. Difūza iekaisuma šūnu infiltrācija ar folikulu veidošanos, parenhīmas atrofija un fibroze pacientam ar Hasimoto tireoidītu (hematoksilīns un eozīns, × 100) / Diffuse inflammatory infiltration with germinal centre formation, parenchymal atrophy and fibrosis in HT patient (hematoxylin and eosin, × 100) | 2. attēls. Atsevišķi CD68 pozitīvi makrofāgi izkliedēti Hasimoto tireoidīta slimnieka vairogdziedzera folikulu dobumos (× 400) / CD68-positive macrophages individually dispersed within the thyroid follicles in HT patient (× 400) |
|
|
3. attēls. Vairogdziedzera folikula dobums ar CD68 pozitīvu makrofāgu sakopojumu Hasimoto tireoidīta slimniekam (× 400) / Cluster of CD68 positive macrophages within the thyroid follicle in HT patient (× 400) | 4. attēls. Pozitīva membranoza klaudīna-1 ekspresija vairogdziedzera folikulārajās šūnās pacientam ar Hasimoto tireoidītu (× 400) / Positive membranous claudin-1 expression in thyroid follicular cells of HT patient (× 400) |
|
|
5. attēls. Klaudīna-1 imūnekspresija vairogdziedzera folikulos pacientam ar Greivsa slimību (× 400) / GS patient showing immunopositive claudin-1 thyroid follicles (× 400) | 6. attēls. Pozitīva un negatīva klaudīna-1 ekspresija vairogdziedzera folikulos pacientam ar mezglainu koloīdu strumu (× 400) / Colloid goitre showing both positive and negative membranous claudin-1 immunostaining (× 400) |
|
|
Diskusija
Literatūrā atrodamajos pētījumos tika uzsvērta tireocītu blīvo savienojumu un klaudīnu nozīme paracelulārās caurlaidības regulēšanā (Lal-Nag and Morin, 2009; Markov, 2013). Daudzos pētījumos ir parādīts, ka epitēlijšūnu blīvie savienojumi ir dinamiskas struktūras, kas ir pakļautas izmaiņām epitēlijaudu pārbūves (Soler et al., 1996), brūču dzīšanas (McCartney et al., 1992) un iekaisuma (Riehl and Stenson, 1994) procesos. Tiek analizēta arī šūnu savienojuma proteīnu lokalizācija un ekspresija un to izmaiņas iekaisuma citokīnu ietekmē (Gretzer et al., 2000; Shaw et al., 2001; Ewert et al., 2010; Rebuffat et al., 2013).
Rebufata (Rebuffat) un kolēģu veiktā pētījuma rezultāti liecina, ka folikula sieniņas epitēlijs HT un GS gadījumā uzrāda atšķirīgu savienojuma proteīnu ekspresiju un epitēlija integritātes zudumu, turklāt gan klaudīna-1 un ZO-1 (zonula occludens-1) ekspresijas samazināšanās, gan šūnu blīvo savienojumu reorganizācija noteikta interleikīna-1β ietekmē (Rebuffat et al., 2013). Interesanti, ka pacientiem ar HT, salīdzinot ar GS pacientiem, tika novērota zemāka blīvo savienojumu proteīnu JAM-A (junctional adhesion molecule-A) un ZO-1 ekspresija (Rebuffat et al., 2013) [14], bet augstāka, līdzīgi kā mūsu pētījumā, klaudīna-1 ekspresija.
Mūsu pētījuma rezultāti liecina, ka vairogdziedzera folikuli atšķirīgi ekspresē tireocītu blīvo savienojumu proteīnu klaudīnu-1 HT un GS gadījumā. Klaudīna-1 pozitīvo folikulu skaits pacientiem ar HT ir statistiski ticami lielāks, salīdzinot ar mezglainas koloīdas strumas pacientu audu paraugiem. Lai arī visaugstākā klaudīna-1 vidējā ekspresija mūsu pētījumā tika novērota HT gadījumā, jāatzīmē, ka 6 no 17 pacientiem bija novērota negatīva imūnreakcija, savukārt sešiem pacientiem tika konstatēta maksimālā imūnpozitivitāte – > 50 % pozitīvu šūnu.
Mūsu pētījuma rezultāti liecina par divu HT pacientu grupu esību: viena – ar zemu vai pat negatīvu klaudīna-1 ekspresiju, kad novēro folikulāro šūnu integritātes zudumu ar folikula destrukciju, kāda rodas šīs patoloģijas gadījumā, un otra – ar augstu klaudīna-1 imūnekspresiju. Pēdējā ir samērā negaidīta atrade HT gadījumā un varētu būt saistīta ar epitēlija veidotās barjeras bojājumu un pakāpenisku neoplāzijas attīstību uz hroniska iekaisuma fona. Tā arī var liecināt par blīvo savienojumu nozīmi epitēlijšūnu proliferācijas un diferenciācijas regulācijā (Ding et al., 2013; Runkle and Mu, 2013).
Klaudīnu funkcijas normālas epitēlijšūnu homeostāzes un barjeras nodrošināšanā ir daudz pētītas, taču mūsu zināšanas par klaudīnu nozīmi audzēju attīstībā ir ierobežotas, lai arī saikne starp izmainītu klaudīnu ekspresiju un vēzi ir plaši pētīta kopš klaudīnu atklāšanas brīža (Swisshelm et al., 2005; Oliveira and Morgado-Diaz, 2007). Paaugstināta blīvo šūnu savienojumu proteīna klaudīna-1 imūnekspresija tika noteikta vairāku invazīvu audzēju (Miwa et al., 2001; Kinugasa et al., 2007; Leotlela et al., 2007), tajā skaitā arī vairogdziedzera vēža, gadījumā (Fluge et al., 2006; Tzelepi et al., 2008; Abd El Atti and Shash, 2012). Tā, iespējams, vismaz atsevišķiem vēža veidiem, ir agrīna tumoroģenēzes pazīme.
Viens no iespējamiem skaidrojumiem izmainītai klaudīna-1 ekspresijai, kas minēts Miamori (Miyamori) un kolēģu pētījumā, ir klaudīnu spēja mijiedarboties ar membrānu saistītām matrices metālproteināzēm (MMP), tādējādi paaugstinot matrices metālproteināžu aktivitāti un spēju degradēt ārpusšūnu matrices un bazālās membrānas proteīnus (Miyamori et al., 2001). Tā, piemēram, Davana (Dhawan) un kolēģu veiktajā pētījumā tika novērots, ka augsta klaudīna-1 ekspresija resnās zarnas vēža šūnās paaugstina MMP-2 un MMP-9 aktivitāti, savukārt tā nomākšana MMP aktivitāti pazemina (Dhawan et al., 2005).
Epidemioloģiskie un histoloģiskie dati liecina, ka vairogdziedzera vēzis bieži attīstās uz hroniska autoimūna tireoidīta fona (Guarino et al., 2010) un ka šī saistība ir atkarīga no anti-tireoglobulīna antivielām (Azizi et al., 2014). Ap audzēja šūnām bieži vēro iekaisuma šūnas, proti, limfocītus, makrofāgus, plazmocītus un dendrītiskās šūnas, taču to nozīme audzēja attīstībā vēl nav pilnībā izzināta. Ņemot vērā vairogdziedzera vēža attīstības iespēju uz hroniska autoimūna tireoidīta fona, zināšanas par klaudīna-1 imūnekspresijas īpatnībām pacientiem ar autoimūnu vairogdziedzera slimību ir nozīmīgas, taču līdz šim tās ir maz pētītas.
Jāatzīmē arī CD68 pozitīvu šūnu klātbūtne vairogdziedzera folikulu dobumos HT gadījumā. Tika konstatēta gan ekstrafolikulāra, gan intrafolikulāra CD68 pozitīvo makrofāgu lokalizācija. Tiek aprakstīts, ka anti-TPO antivielas var izraisīt vairogdziedzera šūnu bojāeju, iesaistot no antivielām atkarīgu šūnu citotoksicitāti (ADCC) (Rodien et al., 1996) un / vai komplementatkarīgu citotoksicitāti (CDC) (Chiovato et al., 1993). Jautājums par to, kādas efektoršūnas ir spējīgas izraisīt šādu citotoksisku iedarbību un kāda ir anti-TPO antivielu patogēna loma ADCC mehānismā un tireocītu destrukcijā, joprojām ir atklāts. Anti-TPO antivielu funkcionāla aktivitāte tiek izvērtēta pēc to piesaistes efektoršūnām, izmantojot Fc-gamma receptorus (FcγR). Monocīti / makrofāgi tiek uzskatīti par potenciālām efektoršūnām anti-TPO antivielu saistītajā ADCC mehānismā (Rebuffat et al., 2013).
Interesanti, ka, iesaistoties šajā citotoksiskajā mehānismā, monocīti nogalina ar anti-TPO antivielām klātās vairogdziedzera mērķa šūnas. Bioloģiskais efekts tiek ierosināts ar FcγRI un FcγRII palīdzību, kas ekspresējas uz monocītu virsmas. Turklāt ir zināms, ka vairogdziedzera šūnas ražo monocītu piesaistošo proteīnu-1 un atvieglo tālāko monocītu transportu uz vairogdziedzera audiem (Kasai et al., 1996). Mūsu pētījuma rezultāti liecina, ka vairogdziedzera epitēlija barjeras bojājums ir nozīmīgs imūnās sistēmas šūnu transportam uz folikula dobumu un intrafolikulāro makrofāgu esība ļauj spriest par to līdzdalību anti-TPO atkarīga citotoksiskā mehānisma nodrošināšanā.
Secinājumi
Lai gan Hasimoto tireoidīts un Greivsa slimība pieskaitāmas autoimūnām slimībām, atšķirības autoimūnajā mehānismā izpaužas arī atšķirīgā klaudīna-1 imūnekspresijā, kas bija statistiski ticami augstāka Hasimoto tireoidīta slimniekiem. Gan paaugstināta, gan samazināta vai pat negatīva klaudīna-1 imūnekspresija dažādiem Hasimoto tireoidīta slimniekiem liecina par blīvo savienojumu proteīnu svarīgo nozīmi epitēlija barjeras integritātes saglabāšanā un iespējamu kompensatoru mehānismu. Intrafolikulāro makrofāgu esība Hasimoto tireoidīta slimniekiem ļauj spriest par to līdzdalību anti-TPO atkarīga citotoksiskā mehānisma nodrošināšanā izmainītas folikulāro šūnu integritātes gadījumā.
Balstoties uz atradēm par klaudīna-1 imūnekspresijas heterogenitāti, var pamatot šī marķiera nozīmi vairogdziedzera folikula epitēlija barjeras funkcijas kontrolē, kā arī strādāt pie riska grupas pacientu izveides Hasimoto tireoidīta gadījumā.
Abstract
Follicular Tight Junctions: Heterogeneity of Claudin-1 Immunoexpression in Hashimoto’s Thyroiditis and Graves’ Disease Patients
Hashimoto’s thyroiditis and Graves’ disease are autoimmune thyroid alterations combining genetic susceptibility and environmental encounters leading to the breakdown of immune tolerance. Alterations of tight junction proteins, including claudin-1, play a pivotal role in the development of Hashimoto’s thyroiditis.
The aim of the study was to estimate expression of claudin-1 in the thyroid tissue of patients with Hashimoto’s thyroiditis and Graves’ disease assessed by immunohistochemistry.
35 patients presented with Hashimoto’s thyroiditis (17 cases) and Graves’ disease (7 cases), as well as ordinary colloidal goitre (11 cases) displaying normal thyroid function were enrolled in this study. Immunohistochemical staining was performed using an anti-claudin-1 antibody. The expression levels were calculated semi-quantitatively.
The highest claudin-1 expression level was observed in Hashimoto’s thyroiditis patients simultaneously; 6 out of 17 cases showed negative claudin-1 expression. The mean rate of immunoreactivity for claudin-1 in Hashimoto’s thyroiditis and Graves’ disease thyroid cells was calculated as 1.65 ± 0.63 and 1.22 ± 0.19, respectively; whereas the mean expression level for patients with colloidal goitre was estimated as 1.58 ± 0.44. Only 8 out of 35 cases (22.9%) showed claudin-1 positivity in > 50% of the cells (score 4); six of which were Hashimoto’s thyroiditis and two were colloidal goitres.
Hashimoto thyroiditis and Graves’ disease patients display heterogeneity in follicular tight junction protein expression patterns. The overexpression of claudin-1 in some Hashimoto thyroiditis patients but may be associated with early cellular changes taking place in a step like process of cancer development, including thyroid cancer. Still, molecular mechanisms by which claudins affect tumorigenesis remain largely unknown. The presence of intrafollicular macrophages is in agreement with the loss of thyroid follicular barrier integrity that occurs in this pathology.
Literatūra
- Abd El Atti, R. M. and Shash L. S. Potential diagnostic utility of CD56 and claudin-1 in papillary thyroid carcinoma and solitary follicular thyroid nodules. J Egypt Natl Canc Inst. 2012, 24(4), 175–184.
- Azizi, G., Keller, J. M., Lewis, M., et al. Association of Hashimoto’s thyroiditis with thyroid cancer. Endocrine-Related Cancer. 2014, 21(6), 845–852.
- Chiovato, L., Bassi, P., Santini, F., et al. Antibodies producing complement-mediated thyroid cytotoxicity in patients with atrophic or goitrous autoimmune thyroiditis. J Clin Endocrinol Metab. 1993, 77, 1700–1705.
- Dhawan, P., Singh, A. B., Deane, N. G. et al. Claudin-1 regulates cellular transformation and metastatic behavior in colon cancer. Journal of Clinical Investigation. 2005, 115(7), 1765–1776.
- Ding, L., Lu, Z., Lu, Q., and Chen, Y. H. The claudin family of proteins in human malignancy: a clinical perspective. Cancer Management and Research. 2013, 5, 367–375.
- Doullay, F., Ruf, J., Codaccioni, J. L. and Carayon, P. Prevalence of autoantibodies to thyroperoxidase in patients with various thyroid and autoimmune diseases. Autoimmunity. 1991, 9, 237–244.
- Eschler, D. C., Hasham, A. and Tomer, Y. Cutting edge: the etiology of autoimmune thyroid diseases. Clin Rev Allergy Immunol. 2011, 41(2), 190–197.
- Ewert, P., Aguilera, S., Alliende, C., et al. Disruption of tight junction structure in salivary glands from Sjögren’s syndrome patients is linked to proinflammatory cytokine exposure. Arthritis Rheum. 2010, 62, 1280–1289.
- Figueroa-Vega, N., Alfonso-Pérez, M., Benedicto I., et al. Increased circulating pro-inflammatory cytokines and Th17 lymphocytes in Hashimoto’s thyroiditis. J Clin Endocrinol Metab. 2010, 95, 953–962.
- Fluge, O., Bruland, O., Akslen, L. A., et al. Gene expression in poorly differentiated papillary thyroid carcinomas. Thyroid. 2006, 16(2), 161–175.
- Gretzer, C., Thomsen, P., Jansson, S. and Nilsson M. Co-culture of human monocytes and thyrocytes in bicameral chamber: monocyte-derived IL-1alpha impairs the thyroid epithelial barrier. Cytokine. 2000, 12, 32–40.
- Guarino, V., Castellone, M. D., Avilla, E. and Melillo, R. M. Thyroid cancer and inflammation. Molecular and Cellular Endocrinology. 2010, 321, 94–102.
- Huber, A., Menconi, F., Corathers, S., et al. Joint genetic susceptibility to type 1 diabetes and autoimmune thyroiditis: From epidemiology to mechanisms. Endocr Rev. 2008, 29, 697–725.
- Hollowell, J. G., Staehling, N. W., Flanders, W. D., et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab. 2002, 87, 489–499.
- Kasai, K., Banba, N., Motohashi, S., et al. Expression of monocyte chemoattractant protein-1 mRNA and protein in cultured human thyrocytes. FEBS Lett. 1996, 394, 137–140.
- Kinugasa, T., Huo, Q., Higashi, D., et al. Selective up-regulation of claudin-1 and claudin-2 in colonic cancer. Anticancer Res. 2007, 27(6A), 3729.
- Lal-Nag, M. and Morin, P. J. The claudins. Genome Biol. 2009, 10(8), 235.
- Leotlela, P. D., Wade, M. S., Duray, P. H., et al. Claudin-1 overexpression in melanoma is regulated by PKC and contributes to melanoma cell motility. Oncogene. 2007, 26(26), 3846–3856.
- Markov, A. G. Claudins as tight junction proteins: the molecular element of paracellular transport. Ross Fiziol Zh Im I M Sechenova. 2013, 99(2), 175–195.
- McCartney, M. D. and Cantu-Crouch, D. Rabbit corneal epithelial wound repair: tight junction reformation. Current Eye Research. 1992, 11(1), 15–24.
- Miwa, N., Furuse, M., Tsukita, S., et al. Involvement of claudin-1 in the beta-catenin Tcf signaling pathway and its frequent upregulation in human colonic cancers. Oncol Res Feat Preclin Clin Cancer Therap. 2001, 11(12), 469–476.
- Miyamori, H., Takino, T., Kobayashi, Y., et al. Claudin promotes activation of pro-matrix metalloproteinase-2 mediated by membrane-type matrix metalloproteinases. Journal of Biological Chemistry. 2001, 276(30), 28204–28211.
- Nilsson, M., Husmark, J., Björkman, U., and Ericson, L. E. Cytokines and thyroid epithelial integrity: interleukin-1alpha induces dissociation of the junctional complex and paracellular leakage in filter-cultured human thyrocytes. J Clin Endocrinol Metab. 1998, 83(3), 945–952.
- Oliveira, S. S. and Morgado-Diaz, J. A. Claudins: multifunctional players in epithelial tight junctions and their role in cancer. Cell Mol Life Sci. 2007, 64(1), 17–28.
- Orgiazzi, J. Thyroid autoimmunity. Presse Med. 2012, 41, e611–625.
- Rapoport, B. and McLachlan, S. M. Thyroid autoimmunity. J Clin Invest. 2001, 108, 1253–1259.
- Rebuffat, S. A., Kammoun-Krichen, M., Charfeddine, I., et al. IL-1β and TSH disturb thyroid epithelium integrity in autoimmune thyroid diseases. Immunobiology. 2013, 218(3), 285–291.
- Riehl, T. E. and Stenson W. F. Mechanisms of transit of lipid mediators of inflammation and bacterial peptides across intestinal epithelia. American Journal of Physiology. 1994, 267(4), 687–695.
- Rizzo, M., Rossi, R. T., Bonaffini, O., et al. Increased annual frequency of Hashimoto’s thyroiditis between years 1988 and 2007 at a cytological unit of Sicily. Ann Endocrinol (Paris). 2010, 71, 525–534.
- Rodien, P., Madec, A. M., Ruf, J., et al. Antibody-dependent cell-mediated cytotoxicity in autoimmune thyroid disease: relationship to antithyroperoxidase antibodies. J Clin Endocrinol Metab. 1996, 81, 2595–2600.
- Runkle, E. A. and Mu, D. Tight junction proteins: From barrier to tumorigenesis. Cancer Letters. 2013, 337(1), 41–48.
- Shaw, S., Perkins, B. N., Lim Y. C., et al. Reduced expression of junctional adhesion molecule and platelet / endothelial cell adhesion molecule-1 (CD31) at human vascular endothelial junctions by cytokines tumor necrosis factor-alpha plus interferongamma does not reduce leukocyte transmigration under flow. Am. J Pathol. 2001, 159, 2281–2291.
- Shi, Y., Wang, H., Su Z., et al. Differentiation imbalance of Th1/Th17 in peripheral blood mononuclear cells might contribute to pathogenesis of Hashimoto’s thyroiditis. Scand J Immunol. 2010, 72, 250–255.
- Singh, A. B., Sharma, A. and Dhawan, P. Claudin family of proteins and cancer: An overview. Journal of Oncology. 2010, article ID 541957, 11.
- Soler, P., Mullin, J. M., Knudsen, K. A., et al. Tissue remodeling during tumor necrosis factor-induced apoptosis in LLC-PK1 renal epithelial cells. American Journal of Physiology. 1996, 270(5), 869–879.
- Staii, A., Mirocha, S., Todorova-Koteva, K., et al. Hashimoto thyroiditis is more frequent than expected when diagnosed by cytology which uncovers a pre-clinical state. Thyroid Res. 2010, 3, 11.
- Swisshelm, K., Macek, R. and Kubbies, M. Role of claudins in tumorigenesis. Adv Drug Deliv Rev. 2005, 57(6), 919–928.
- Tzelepi, V. N., Tsamandas, A. C., Vlotinou, H. D., et al. Tight junctions in thyroid carcinogenesis: diverse expression of claudin-1, claudin-4, claudin-7 and occludin in thyroid neoplasms. Mod Pathol. 2008, 21(1), 22–30.
- Zaletel, K. and Gaberšček, S. Hashimoto’s thyroiditis: From genes to the disease. Curr Genomics. 2011, 12(8), 576–588.
- Yaron, T. and Amanda, H. The etiology of autoimmune thyroid disease: A story of genes and environment. J Autoimmun. 2009, 32(3–4), 231–239.