Cilvēka pirmā tipa bokavīruss ar akūtām elpošanas ceļu slimībām hospitalizētiem bērniem Latvijā
Kopsavilkums
Ievads. Cilvēka bokavīruss (HBoV), kas pieder Parvoviridae dzimtai, pirmo reizi tika izdalīts 2005. gadā Zviedrijā nazofaringeālo aspirātu (NFA) paraugos. Kopš tā atklāšanas zināms, ka vīruss plaši izplatīts visā pasaulē. HBoV 1. tipa (HBoV1) cēloņsakarība ar akūtām elpošanas ceļu slimībām ir pierādīta pēdējo gadu veiktajos pētījumos. Ņemot vērā bērnu augsto saslimstību ar akūtām elpošanas ceļu slimībām, ir būtiski izvērtēt HBoV1 iespējamo lomu elpošanas ceļu slimību etioloģijā hospitalizētiem bērniem arī Latvijā.
Darba mērķis. Noskaidrot HBoV1 genoma secības klātbūtni DNS paraugos, kas izdalīti no Bērnu klīniskajā universitātes slimnīcā ar akūtas elpošanas ceļu slimības simptomiem hospitalizētu zīdaiņu un bērnu līdz sešu gadu vecumam NFA, un aprakstīt klīniskās īpatnības pacientiem ar HBoV1 klātbūtni.
Materiāls un metodes. Pētījums tika sākts 2012. gada novembrī. Prospektīvajā pētījuma daļā iekļauti 39 pacienti, no kuriem tika iegūts NFA. Retrospektīvajā pētījuma daļā tika izmantoti 32 NFA paraugi. No iegūtajiem NFA paraugiem, izmantojot fenola-hloroforma metodi, izdalīta DNS un, izmantojot polimerāzes ķēdes reakciju (PĶR), noteikta HBoV1 genoma secības klātbūtne.
Rezultāti. No iegūtā 71 NFA parauga izdalīta DNS un, izmantojot polimerāzes ķēdes reakciju, HBoV1 genoma secības klātbūtne konstatēta 28 no 71 (28/71) jeb 39 % paraugu. HBoV1 pozitīvo pacientu skaits prospektīvajā un retrospektīvajā pētījuma daļā bija vienāds, attiecīgi 14 pacienti. Visvairāk HBoV1 pozitīvo pacientu atrasti vecumā no 6 līdz 12 mēnešiem, attiecīgi 10/19 jeb 53 % pacientu. Otra biežākā vecuma grupa, kurā konstatēts vīruss, bija pacienti no 12 līdz 24 mēnešiem, attiecīgi 9/22 jeb 41 % pacientu. Vidējais vecums pētījumā iekļautajiem pacientiem bija 12,7 (SD ± 11,4) mēneši.
Secinājumi. Kaut gan pozitīvs kvalitatīvās polimerāzes ķēdes reakciju rezultāts neļauj izdarīt secinājumu par HBoV tiešu etioloģisko lomu saslimšanā, veicot pētījumu, esam konstatējuši vīrusa cirkulāciju Latvijā bērnu populācijā un tā saistību ar akūtām elpošanas ceļu slimībām agrīnā vecumā.
Ievads
Akūtas elpošanas ceļu slimības, īpaši dziļāko elpošanas ceļu infekcijas, joprojām ir viens no galvenajiem bērnu saslimšanas un mirstības cēloņiem visā pasaulē, īpaši bērniem līdz 5 gadu vecumam, kā arī galvenais bērnu hospitalizācijas iemesls (Williams, 2002). Ir aprēķināts, ka ik gadu visā pasaulē aptuveni 1,8 miljoni bērnu mirst no pneimonijas (WHO/UNICEF, 2009). Lai arī Pasaules Veselības organizācija (PVO) kā svarīgāko iemeslu dziļāko elpošanas ceļu infekcijām attīstības valstīs min bakteriālos ierosinātājus, pētījumos pierādīts, ka visā pasaulē nozīmīgs to ierosinātājs ir arī respiratorie vīrusi. Tomēr tikai 30–40 % gadījumu dziļāko elpošanas ceļu vīrusu ierosinātām infekcijām ir identificējams ierosinātājs, un, lai izprastu infekcijas slimības, jaunu vīrusu noteikšana ir prioritāte (Allander, 2005; Madhi, 2006).
Arī Latvijā saslimstība ar elpošanas ceļu sistēmas slimībām ir nozīmīga veselības aprūpes problēma bērnu populācijā. Slimību profilakses un kontroles centra (SPKC) jaunākie dati liecina, ka saslimstības struktūrā bērniem līdz gada vecumam elpošanas ceļu sistēmas slimības ieņem pirmo vietu un 2013. gadā bija 59,8 % no visiem saslimšanas iemesliem (SPKC, 2013).
Cilvēka bokavīruss (HBoV) tika atklāts 2005. gadā Zviedrijā nazofaringeālo aspirātu (NFA) paraugos, kas iegūti no bērniem ar akūtām elpošanas ceļu slimībām. Šajā eksperimentā vīrusu konstatēja 17 paraugos no 540 jeb 3,1 % gadījumu, turklāt 14 NFA paraugos netika konstatēta citu vīrusu klātbūtne, kas lika domāt, ka šis jaunatklātais vīruss ir autonoms un, iespējams, akūtu elpošanas ceļu slimību ierosinātājs (Allander, 2005). HBoV pieder Parvoviridae dzimtai, Parvovirinae apakšdzimtai un Bocavirus ģintij. Tas tika klasificēts kā bokavīruss, balstoties uz genoma struktūras līdzību ar liellopu (bovine) parvovīrusu un suņu (canine) parvovīrusu, kas arī pieder Bocavirus ģintij (Schildgen, 2012). Līdz šim ir izolēti četri HBoV tipi. HBoV 1. tipa (HBoV1) cēloņsakarība ar akūtām elpošanas ceļu slimībām, galvenokārt dziļāko elpošanas ceļu infekcijām, ir pierādīta pēdējos gados veiktajos pētījumos, izmantojot vīrusa slodzes noteikšanu dažādos klīniskajos paraugos un nosakot HBoV1 specifiskās IgM un IgG klases antivielas serumā (Kantola, 2008; Söderlund-Venermo, 2009; Don, 2010). Pārējie trīs HBoV tipi biežāk izdalīti no fēču paraugiem un tiek asociēti ar akūtu gastroenterītu, tomēr joprojām nav aprakstīti pētījumi, kas pārliecinoši norāda uz to lomu slimību ierosināšanā (De Sousa, 2012; Paloniemi, 2014).
HBoV noteikšana klīniskajos paraugos ir iespējama kā rutīnas izmeklējums, izmantojot polimerāzes ķēdes reakciju (PĶR), un ir zināms, ka vīruss plaši izplatīts visā pasaulē (Jartti, 2012; Peltola, 2013). Biežāk HBoV tiek identificēts bērniem līdz divu gadu vecumam, kuri hospitalizēti ar akūtu sēkšanu, un tas minēts kā ceturtais biežākais patogēns aiz respiratori sincitiālā vīrusa (RSV), adenovīrusa un rinovīrusa (Allander, 2007; Calvo, 2010).
Darba mērķis
Noskaidrot HBoV1 genoma secības klātbūtni DNS paraugos, kas izdalīti no Bērnu klīniskajā universitātes slimnīcā ar akūtas elpošanas ceļu slimības simptomiem hospitalizētu zīdaiņu un bērnu līdz sešu gadu vecumam NFA, un aprakstīt klīniskās īpatnības pacientiem ar HBoV1.
Materiāls un metodes
Pētījums tika sākts 2012. gada novembrī, un tā populācijas pacientu atlase veidota no divām daļām. Pētījuma prospektīvajā daļā septiņu mēnešu laikposmā tika iekļauti pacienti vecumā līdz sešiem gadiem, kuriem konstatēta kāda no sūdzībām, kas saistīta ar akūtu elpošanas ceļu slimību, tai skaitā dziļāko elpošanas ceļu infekciju ar vai bez drudža (t > 38 °C) klātbūtnes, un kuru vecāki piekrita piedalīties pētījumā. Šajā pētījuma daļā tika iekļauti 39 pacienti, no kuriem iegūts NFA ar tam paredzētu standartizētu sistēmu. Iegūtais materiāls nekavējoties tika iesaldēts un uzglabāts −70 °C temperatūrā.
Pētījuma retrospektīvajā daļā tika izmantoti 32 NFA paraugi, kas glabājās kohortu pētījuma (veikts laikposmā no 2009. gada jūlija līdz 2012. gada jūnijam) kolekcijā. Pētījuma retrospektīvajā daļā tika iekļauti pacienti vecumā no 2 līdz 24 mēnešiem, kuri laikposmā no 2011. gada septembra līdz 2012. gada jūnijam bijuši stacionēti Bērnu klīniskajā universitātes slimnīcā ar dziļāko elpošanas ceļu infekcijas pazīmēm un kuriem diagnostikas gaitā netika apstiprināta RSV RNS klātbūtne.
No iegūtajiem NFA paraugiem, izmantojot fenola-hloroforma metodi, tika izdalīta DNS. DNS parauga kvalitāti noteica ar PĶR, nosakot tajā β globīna gēna secības klātbūtni. Par kvalitatīvu DNS uzskatīja PĶR produktu, kurā konstatēta β globīna gēna sekvences klātbūtne ar izmēru 200 bp. β globīna gēna secības klātbūtni noteica ar šādiem praimeriem: turpejošais GS268 5’ACACAACTGTGTTCACTAGC3’ un atpakaļejošais GS269 5’TGGTCTCCTTAAACCTGTCTTG3’.
HBoV 1. tipa genoma secības noteikšanai izmantoja PĶR, veicot NP-1 gēna sekvences klātbūtnes noteikšanu ar šādu praimeru komplektu: 188F 5’ GACCTCTGTAAGTACTATTAC3’ un 542R 5’ CTCTGTGTTGACTGAATACAG3’, un NS-1 gēna sekvences noteikšanu ar praimeru komplektu: HBoV01.2 5’TATGGCCAAGGCAATCGTCCAAG3’ un HBoV02.2 5’GCCGCGTGAACATGAGAAACAGA3’. Lai izslēgtu iespējamu kontamināciju, pēc katriem pieciem paraugiem tika izmantota ūdens kontrole. Metodes adaptētas pēc literatūrā aprakstītām metodēm (Allander, 2005; Sloots, 2006). Par pozitīvo kontroli PĶR reakcijās izmantoja HBoV1 NP1 plazmīdu (Liu, 2009). Amplifikācijas produktus analizēja elektroforētiski 1,7 % agarozes gelā, lai sadalītu un identificētu DNS fragmentu. Nosakot NP-1 gēna sekvences klātbūtni, paredzamais PĶR produkta izmērs bija 354 bp. Nosakot NS-1 gēna sekvences klātbūtni, tas bija 300 bp. Iegūtos rezultātus apskatīja transiluminatora UV gaismā un vizualizēja, izmantojot vizualizācijas iekārtu BioSpectrum MultiSpectral Imaging System.
Pētījuma dati tika analizēti, veicot aprakstošo un salīdzinošo statistiku, izmantojot datorprogrammas SPSS 20.0 versiju un Excel Microsoft. Rezultāti ir izteikti skaitļos un procentos. Datu analīzē tika izmantotas matemātiskās un statistiskās metodes, piemēram, grupēšana, salīdzināšana, vidējo lielumu un proporciju aprēķināšana. Pacientu vecuma grupu un drudža raksturojuma pētāmajā populācijā statistiskai apstrādei tika izmantots hī kvadrāta tests; p vērtība, kas mazāka par 0,05, tika uzskatīta par statistiski nozīmīgu.
Rezultāti
Pētījuma populācijas demogrāfiskie dati. Kopumā pētījumā tika iekļauts 71 pacients, attiecīgi pirmajā kohortā 32, otrajā kohortā 39 pacienti. Pētījumā iekļauto pacientu populācijas analīzē pēc dzimuma tika konstatēts, ka kopumā iekļautas 29 (41 %) meitenes un 42 (59 %) zēni. Analizējot pētījumā iekļauto bērnu vecuma struktūru, noskaidrots, ka vidējais vecums pacientiem abās kohortās bija 12,7 mēneši (SD ± 11,4, robežās no 1,5 līdz 67 mēnešiem). Pētījumā iekļauto pacientu vidējais vecums pirmajā kohortā bija 8,7 mēneši (SD ± 5,8, robežās no 1 līdz 20 mēnešiem), bet, aprēķinot otrās kohortas pacientu vidējo vecumu, tas bija lielāks, attiecīgi 15,7 mēneši (SD ± 13,9, robežās no 1,5 līdz 67 mēnešiem). Lai veiktu detalizētu vecuma struktūras analīzi, pētījumā iesaistītie pacienti tika iedalīti četrās vecuma grupās. Analizējot tās, noskaidrots, ka lielākais iekļauto pacientu skaits, attiecīgi 22 (31 %), bija vecumā grupās no 0 līdz 6 un no 12 līdz 24 mēnešiem, bet vismazāk pacientu bija vecuma grupā no 24 līdz 72 mēnešiem – 8 (11 %). Vecuma grupā no 6 līdz 12 mēnešiem tika iekļauti 19 (27 %) pacienti.
HBoV1 genoma secības klātbūtne NFA paraugos. No iegūtajiem NFA paraugiem tika izdalīta cilvēka DNS, un, izmantojot PĶR, HBoV1 genoma secība konstatēta 28/71 jeb 39 % paraugu. HBoV1 pozitīvo pacientu skaits abās kohortās bija vienāds, attiecīgi katrā no tām vīrusa genoma secības klātbūtni konstatēja 14 pacientiem.
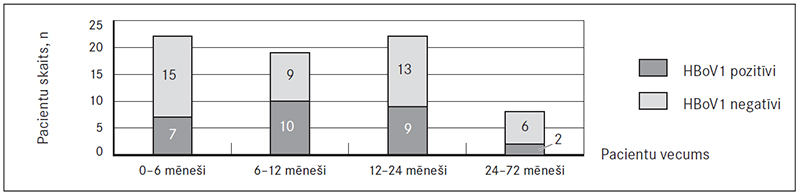
Demogrāfiskie dati HBoV1 pozitīvo pacientu grupā. Analizējot dzimuma iedalījumu HBoV1 pozitīvo pacientu grupā, vīrusa genoma secības klātbūtni konstatēja 12 (41 %) meitenēm un 16 (38 %) zēniem. Veicot vidējā vecuma aprēķinu, HBoV1 pozitīvo pacientu vidū tas bija 12,9 mēneši (SD ± 11,3, robežās no 1 līdz 31 mēnesim). Visvairāk HBoV1 pozitīvo pacientu konstatēts vecumā no 6 līdz 12 mēnešiem, attiecīgi 10 no 19 (10/19) jeb 53 % pacientu. Otra biežākā vecuma grupa, kurā konstatēts HBoV, bija no 12 līdz 24 mēnešiem, attiecīgi 9/22 jeb 41 % pacientu (sk. 1. att.). Statistiski ticamas atšķirības starp vecuma grupām HBoV pozitīvo pacientu populācijā netika novērotas.
1. attēls. Cilvēka 1. tipa bokavīrusa (HBoV) klātbūtne nazofaringeālo aspirātu paraugos dažādās vecuma grupās / HBoV1 presence in NPAs in different age groups
Klīnisko simptomu raksturojums pētījuma populācijā un HBoV1 pozitīvo pacientu grupā. Analizējot klīniskos simptomus, visiem pacientiem brīdī, kad viņi tika iekļauti pētījumā, bijis klepus, kā arī lielākajai daļai konstatēts rinīts, attiecīgi 68/71 jeb 96 % pacientu. Pacientiem ar pozitīvu HBoV1 skaitliski biežākie simptomi bija klepus 28/28 jeb 100 % gadījumu, rinīts 27/28 jeb 96 % gadījumu un rīkles mugurējās sienas hiperēmija 15/28 jeb 54 % gadījumu. Papildus HBoV1 pozitīvo pacientu populācijā tika novēroti arī tādi simptomi kā eksantēma 7/28 (25 %), konjunktivīts 4/28 (14 %) un otīts 2/28 (7 %). Vērtējot temperatūras raksturu bērniem ar pozitīvu HBoV1, konstatēts, ka kopumā tā biežāk paaugstinājusies virs 38 °C, attiecīgi 23/28 jeb 82 % pacientu, kas statistiski nozīmīgi atšķīrās no HBoV1 pozitīviem pacientiem, kuriem temperatūra bija 38 °C vai zemāka (p = 0,035).
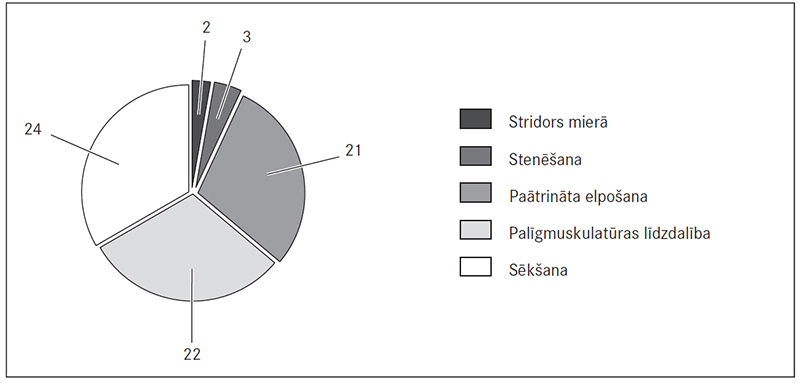
Atsevišķi analizējot dziļāko elpošanas ceļu infekciju simptomus, tika noskaidrots, ka biežākie simptomi pacientiem ar HBoV1 klātbūtni NFA paraugos bija sēkšana (24/53 jeb 45 % pacientu), palīgmuskulatūras līdzdalība elpošanas darbā (22/42 jeb 52 % pacientu) un paātrināta elpošana (21/48 jeb 44 % pacientu) (sk. 2. att.).
2. attēls. Dziļāko elpošanas ceļu infekciju klīniskie simptomi (pacientu skaits, n) cilvēka 1. tipa bokavīrusa pozitīvo pacientu grupā / The character of clinical symptoms of lower respiratory tract infection in HBoV1 positive patients
Citu respiratoro vīrusu diagnostikas rezultāti HBoV1 pozitīvo pacientu grupā. Pētījumā iekļautajiem pacientiem tika analizēta arī citu respiratoro vīrusu klātbūtne nazofaringeālajās iztriepēs, ja to bija nozīmējis ārstējošais ārsts. Kopumā rezultāti bija pieejami 23/71 jeb 32 % pacientu. Analizējot citu respiratoro vīrusu klātbūtni pacientu grupā ar pozitīvu HBoV1, tā tika konstatēta 3 jeb 11 % gadījumu, no kuriem divos bija noteikts respiratorais sincitiālais vīruss, bet vienā – cilvēka metapneimovīruss (hMPV).
Diskusija
Kopš 2005. gada, kad tika atklāts HBoV, tā klātbūtne elpošanas ceļu sekrētos konstatēta virknē pētījumu visā pasaulē, turklāt vairumā publikāciju minēta vīrusa izplatība. Tikai daži pētījuma centri, tostarp Somijā, mērķtiecīgi veic HBoV izpēti asociācijā ar akūtām elpošanas ceļu slimībām (Kantola, 2008; Söderlund-Venermo, 2009). HBoV1 klātbūtni galvenokārt konstatē bērniem vecumā no 6 līdz 24 mēnešiem (Fry, 2007; Christensen, 2010), un vīruss tiek saistīts ar šādām akūtām elpošanas ceļu slimībām: saaukstēšanās jeb gripai līdzīgs sindroms, akūta sēkšana, bronhiolīts un pneimonija (Allander, 2007; Söderlund- Venermo, 2009; Don, 2010; Meriluoto, 2012).
Apskatot ar HBoV1 asociētās infekcijas klīniskos simptomus, kā biežākie tiek minēti klepus (79 %), drudzis (67 %), rinīts (66 %), hipoksija vai saņemta skābekļa terapija (40 %), tahipnoja (35 %), sēkšana (27 %) un faringīts (13 %) (Chow, 2009). Tomēr jāuzsver, ka lielākā daļa pētījumu ir balstīti uz diagnostiskiem mērķiem, tādējādi mērķtiecīgi iegūstot klīniskos paraugus no bērniem ar akūtām elpošanas ceļu slimībām. Līdz ar to iegūtie skaitļi lielākoties atspoguļo kopējos simptomus un, iespējams, nevar tikt specifiski saistīti ar HBoV ierosinātu infekciju. Turklāt Jartti ar kolēģiem, kuri analizējuši piecos gados veikto publikāciju secinājumus, uzsver, ka lielākajai daļai pētījumu trūkst stingru diagnostisko kritēriju HBoV1 akūtas infekcijas apstiprināšanai.
Klīnisko pētījumu ziņojumi pamatā ir balstīti uz HBoV1 identifikāciju elpošanas ceļu sekrētā, veicot kvalitatīvo PĶR. Bet, kā jau tika minēts, pētnieku grupa no Somijas uzsver, ka tā nav uzskatāma par optimālu metodi akūtas infekcijas diagnostikā (Jartti, 2012). Uz to norāda vairāki fakti, tostarp HBoV klātbūtne asimptomātiskiem pētījuma indivīdiem (Manning, 2006; Fry, 2007) un ilgstošs HBoV elpošanas ceļu sekrētā. Pētījumā, ko veicis von Linstow ar kolēģiem, vairāk nekā 26 % bērnu HBoV no elpošanas ceļu sekrēta izdalīja divu mēnešu, 4 % – trīs mēnešu, bet 2 % – četru mēnešu periodā (von Linstow, 2008). Arī augstais koinfekciju skaits HBoV pozitīvajos paraugos sākotnēji radīja bažas par tā lomu slimību izcelsmē. Turklāt aprakstīti pētījumi, kuros vienlaikus ar HBoV identificēti vairāk nekā viens patogēns (Allander, 2005; Söderlund-Venermo, 2009; Wang, 2009).
Arī mūsu veiktajā pētījumā citu vīrusu klātbūtne HBoV pozitīvajos paraugos tika konstatēta trīs (11 %) gadījumos, kur vienā no paraugiem vienlaikus ar HBoV konstatēja RSV un hMPV. Jāuzsver, ka kopumā mūsu pētījumā informācija par citiem vīrusiem bija pieejama 23 gadījumos, līdz ar to, iespējams, koinfekciju skaits būtu lielāks, ja visi paraugi būtu bijuši testēti uz citiem respiratoriem vīrusiem. Kaut gan sākotnēji bija bažas par HBoV lomu, tomēr ir pētījumi, kuros tiek apstiprināta HBoV1 ierosināta dziļāko elpošanas ceļu infekcija. Šādu pētījumu aprakstījusi Söderlund-Venermo ar kolēģiem, kas diagnostikā izmantoja kvantitatīvo PĶR aspirātos un serumā, kā arī HBoV IgM un IgG klases antivielu noteikšanu 295 bērniem ar akūtu sēkšanu un bronhiolīta klīnisko diagnozi (Söderlund-Venermo, 2009).
HBoV1 sastopamība pasaulē ir 2–19 % gadījumu, vidēji ap 10 % (Jartti, 2012, Peltola, 2013). Mūsu veiktajā pētījumā HBoV1 genoma secības klātbūtni laikposmā no 2011. gada septembra līdz 2013. gada maijam konstatēja 39 % (28/71) pētījumā iekļauto pacientu. Lai arī pašlaik par HBoV1 sastopamību Latvijā nevaram izteikties, iegūtie rezultāti, salīdzinot ar pasaules datiem, ir augstāki. Citās Eiropas valstīs, piemēram, Norvēģijā, HBoV konstatēts 25 % bērnu populācijā ar akūtām elpošanas ceļu slimībām (Christensen, 2013), Spānijā pacientiem ar sadzīvē iegūtu pneimoniju vīruss noteikts 17,8 % gadījumu (García-García, 2012), bet Argentīnā un Čīlē HBoV sastopamība vidēji novērota ap 21,5 % (Flores, 2011; Ghietto, 2012). Vienīgo pētījumu, kur HBoV klātbūtne konstatēta augstāka nekā mūsu pētījumā, attiecīgi 59 % (70/119) bērnu ar akūtām elpošanas ceļu slimībām, aprakstījusi pētnieku grupa Martin vadībā Amerikas Savienotajās Valstīs, Vašingtonas štatā (Matin, 2010).
Analizējot mūsu pētījumā iekļauto pacientu vecuma grupas, tika noskaidrots, ka HBoV1 biežāk konstatēts vecuma grupā no 6 līdz 12 mēnešiem (53 % (10/19) pacientu) un vecuma grupā no 12 līdz 24 mēnešiem (41 % (9/22) pacientu). Lai arī pētījuma vecuma grupas ir nelielas un neviendabīgas, pētījuma rezultāti saskan ar literatūras datiem. Vienīgais klīniskais simptoms, kas statistiski ticami atšķiras pacientu grupā ar pozitīvu HBoV1 DNS elpošanas ceļu sekrētā, ir drudzis (t > 38 °C), attiecīgi 82 % (23/28) gadījumu. Jāuzsver, ka arī kopumā vairāk pētījumā tika iekļauti pacienti ar temperatūru, kas augstāka par 38 °C (48/71).
Tā kā HBoV1 diagnostikā tika izmantota kvalitatīvā PĶR, mūsu pētījumā iekļautajiem pacientiem nevaram apstiprināt akūtu HBoV1 infekciju, tomēr esam konstatējuši vīrusa cirkulāciju bērnu populācijā Latvijā. Šie rezultāti dod pietiekamus argumentus un pamato nepieciešamību veikt turpmāku izpēti, kam ir gan teorētiska, gan klīniska nozīme. Lai varētu padziļināti pētīt HBoV infekciju un ar to saistīto akūto elpošanas ceļu slimību klīniskās īpatnības, vadoties pēc ievērojamāko pētnieku ieteikumiem, būtu nepieciešams veikt seroloģisko diagnostiku un / vai noteikt HBoV1 DNS serumā, kā arī kvantitatīvo PĶR.
Secinājumi
- Izmantojot kvantitatīvo PĶR, HBoV1 genoma secības klātbūtni konstatē 39 % (24/71) gadījumu, kas norāda uz vīrusa cirkulāciju un klātbūtni ar akūtām elpošanas ceļu slimībām hospitalizētiem bērniem Latvijā.
- Pētījuma populācijas pacientiem biežāk HBoV1 konstatēts divās vecuma grupās: no 6 līdz 12 mēnešiem 10/19 (53 %) un no 12 līdz 24 mēnešiem 9/22 (41 %), kas norāda uz iespējamu HBoV infekcijas norisi agrīnā vecumā.
- Pacietiem ar pozitīvu HBoV1 statistiski ticami novēro temperatūru, kas augstāka par 38 °C. Citas klīniskās pazīmes šīs grupas pacientiem statistiski ticami neatšķiras.
- Padziļinātai HBoV infekcijas izpētei nepieciešams veikt literatūrā aprakstītās papildu diagnostiskās metodes.
Pateicība
Pētījums veikts Ķīnas Republikas (Taivānas) – Latvijas Republikas – Lietuvas Republikas zinātniskās sadarbības fonda apstiprinātā pētījuma “Ietvara izveidošana parvovīrusu molekulārās epidemioloģijas izsekošanai un genomu secību izmaiņu korelēšanai ar dažādām klīniskām izpausmēm” Nr. 6.2.- 25/2013/0039 (M. Murovska) laikā. Pateicamies Dr. Reinim Balmakam, Dr. Irinai Katirlo un Dr. Ditai Gaidulei-Loginai, kas palīdzēja tapt pētījumam.
Abstract
Human Bocavirus Type 1 Presence in Hospitalised Children with Acute Respiratory Tract Diseases in Latvia
Human bocavirus 1 (HBoV1), belonging to the family Parvoviridae, was discovered in 2005 in the pooled nasopharyngeal aspirates (NPAs). Since then it has been shown to circulate globally. In the latest year researches it has been shown that HBoV1 may cause acute respiratory distress in young children. Considering the high incidence of acute respiratory tract diseases in our children, it is important to assess the possible role of HBoV1 in aetiology of acute respiratory tract diseases in Latvia.
The aim of this study was to determine the presence of HBoV1 DNA in NPAs obtained from hospitalised children less than six years old with acute respiratory tract infections, and describe the clinical features of the disease.
The research was started in November 2012. Then, 39 NPAs were collected prospectively. For the retrospective part of this research, we used 32 NPAs that had been collected earlier. DNA was isolated from all NFAs using phenol-chloroform method and screened for HBoV1 genomic sequences using PCR.
Of 71 NPAs collected, HBoV1 DNA was found in 28/71 (39 %) – 14 in each season, respectively. The detection rate of HBoV1 was higher 10/19 (53%) in children 6–12 months of age and 9/22 (41 %) in children 12–24 months of age. The median age of 71 children was 12.7 months (SD ± 11.4).
In conclusion, we detected the circulation of HBoV1 in hospitalised children and assessed the possible role of HBoV1 in aetiology of acute respiratory tract diseases. However, diagnosis of acute HBoV1 infection cannot be based on qualitative PCR. To clarify the pathogenic role of HBoV, further studies are required.
Literatūra
1. Slimību profilakses un kontroles centrs. Bērnu (0–14 gadi) un pusaudžu (15–17 gadi) veselības stāvoklis // Latvijas veselības aprūpes statistikas gadagrāmata 2013. – 289.–290. lpp.
2. Allander T., Tammi M. T., Eriksson M., et al. Cloning of human parvovirus by molecular screening of respiratory tract samples // Proceedings of the National Academy of Sciences of the United States of America, 2005; 102 (36): 12891–12896.
3. Allander T., Jartti T., Gupta S., et al. Human bocavirus and acute wheezing in children // Clinical Infectious Diseases, 2007; 44 (7): 904–910.
4. Calvo C., Pozo F., García-García M. L., et al. Detection of new respiratory viruses in hospitalized infants with bronchiolitis: a three-year prospective study // Acta Paediatrica, 2010; 99 (6): 883–887.
5. Chow B. D., Esper F. P. The human bocaviruses: a review and discussion of their role in infection // Clinics in Laboratory Medicine, 2009; 29 (4): 695–713.
6. Christensen A., Nordbo S. A., Kroksta S., et al. Human bocavirus in children: mono-detection, high viral load and viraemia are associated with respiratory tract infection // Journal of Clinical Virology, 2010; 49 (3): 158–162.
7. Christensen A., Døllner H., Skanke L. H., et al. Detection of spliced mRNA from human bocavirus 1 in clinical samples from children with respiratory tract infections // Emerging Infectious Diseases, 2013; 19 (4): 574–580.
8. De Sousa T. T., Souza M., Fiaccadori F. S., et al. Human bocavirus 1 and 3 infection in children with acute gastroenteritis in Brazil // Memórias do Instituto Oswaldo Cruz, 2012; 107 (6): 800–804.
9. Don M., Söderlund-Venermo M., Valent F., et al. Serologically verified human bocavirus pneumonia in children // Pediatric Pulmonology, 2010; 45 (2): 120–126.
10. Flores J. C., Vizcaya A. C., Araos B. R., et al. Human bocavirus in Chile: clinical characteristics and epidemiological profile in children with acute respiratory tract infections // Revista Chilena de Infectologia, 2011; 28 (6): 504–511.
11. Fry A. M., Lu M., Chittaganpitch M., et al. Human Bocavirus: A novel Parvovirus epidemiologically associated with pneumonia requiring hospitalization in Thailand // Journal of Infectious Diseases, 2007; 195 (7): 1038–1045.
12. García-García M. L., Calvo C., Falcon A., et al. Role of emerging respiratory viruses in children with severe acute wheezing // Pediatric Pulmonology, 2010; 45 (6): 589–591.
13. Ghietto L. M., Camara A., Zhou Y., et al. High prevalence of human bocavirus 1 in infants with lower acute respiratory tract disease in Argentina, 2007–2009 // Brazilian Journal of Infectious Disease, 2012; 16 (1): 38–44.
14. Jartti T., Hedman K., Jartti L., et al. Human bocavirus – the first 5 years // Reviews in Medical Virology, 2012; 22 (1): 46–64.
15. Kantola K., Hedman L., Allander T., et al. Serodiagnosis of human bocavirus infection // Clinical Infectious Diseases, 2008; 46 (4): 540–546.
16. Liu J. H., Chiu S. C., Lin Y. C., et al. Clinical and genetic analysis of human bocavirus in children with lower respiratory tract infection in Taiwan // Journal of Clinical Virology, 2009; 44 (3): 219–224.
17. Madhi S. A., Klugman K. P. Acute respiratory infections // Disease and Mortality in Sub-Saharan Africa / Ed. by Jamison D. T. – 2nd ed. – Washington: World Bank, 2006.
18. Manning A., Russell V., Eastick K., et al. Epidemiological profile and clinical associations of human bocavirus and other human parvoviruses // Journal of Infectious Diseases, 2006; 194 (9): 1283–1290.
19. Martin E. T., Fairchok M. P., Kuypers J., et al. Frequent and prolonged shedding of bocavirus in young children attending daycare // Journal of Infectious Diseases, 2010; 201 (11): 1625–1632.
20. Meriluoto M., Hedman L., Tanner L., et al. Association of human bocavirus 1 infection with respiratory disease in childhood follow-up study // Emerging Infectious Diseases, 2012; 18 (2): 264–271.
21. Paloniemi M., Lappalainen S., Salminen M., et al. Human bocavirus are commonly found in stool of hospitalized children without causal association to acute gastroenteritis // European Journal of Pediatrics, 2014; 173 (8): 1051–1057.
22. Peltola V., Söderlund-Venermo M., Jartti T. Human bocavirus infections // Pediatric Infectious Diseases, 2013; 32 (2): 178–179.
23. Schildgen O., Qiu J., Söderlund-Venermo M. Genomic features of the human bocaviruses // Future Virology, 2012; 7 (1): 31–39.
24. Sloots T. P., McErlean P., Speicher D. J., et al. Evidence of human coronavirus HKU1 and human bocavirus in Australian children // Journal of Clinical Virology, 2006; 35 (1): 99–102.
25. Söderlund-Venermo M., Lahtinen A., Jartti T., et al. Clinical assessment and improved diagnosis of bocavirus-induced wheezing in children // Emerging Infectious Diseases, 2009; 15 (9): 1423–1430.
26. Von Linstow M. L., Høgh M., Høgh B. Clinical and epidemiologic characteristics of human bocavirus in Danish infants: results from a prospective birth cohort study // Pediatric Infectious Disease Journal, 2008; 27 (10): 897–902.
27. Wang K., Wang W., Yan H., et al. Correlation between bocavirus infection and humoral response, and co-infection with other respiratory viruses in children with acute respiratory infection // Journal of Clinical Virology, 2010; 47 (2): 148–155.
28. Williams B. G., Gouws E., Boschi-Pinto C., et al. Estimates of world-wide distribution of child deaths from acute respiratory infections // Lancet Infectious Diseases, 2002; 2 (1): 25–32.
29. WHO/UNICEF. Global action plan for prevention and control of pneumonia (GAPP) // www.who.int/maternal_child_ adolescent/documents/fch_cah_nch_09_04/en/ (sk. 12.06.2015).


