Embriju pirmsimplantācijas ģenētiskā skrīninga pirmo rezultātu apkopojums par pacientiem ar apgrūtinātu reproduktivitāti anamnēzē
Kopsavilkums
Neveiksmīga neauglības ārstēšana ir grūti atrisināma problēma klīniskajā reproduktoloģijā. Tās biežākais cēlonis ir embrija hromosomu skaita vai struktūras izmaiņas, kas izraisa neveiksmīgu embrija implantāciju vai grūtniecības zaudēšanu pirmā grūtniecības trimestra laikā. Embriju pirmsimplantācijas ģenētiskais skrīnings (PGS) dod iespēju veikt embrija hromosomu analīzi, ļaujot atlasīt eiploīdus embrijus (embrijus ar normālu hromosomu komplektu) pārnešanai dzemdes dobumā. Šādā veidā ir iespējams palielināt klīniskās grūtniecības iestāšanās un vesela bērna piedzimšanas varbūtību.
Darba mērķis bija novērtēt embriju pirmsimplantācijas ģenētiskā skrīninga lietošanas efektivitāti pacientiem, no kuriem anamnēzē tika iegūtas ziņas par apgrūtinātu reproduktivitāti.
Materiāls un metodes. 28 pāriem, kam anamnēzē bija informācija par negatīvu reproduktivitāti, tika veikta PGS analīze. Mākslīgās apaugļošanas rezultātā iegūtiem embrijiem tika sagatavoti bioptāti un veikta analīze ar salīdzinošās genoma hibridizācijas uz “mikročipiem” metodi (array comparative genomic hybridization – aCGH).
Rezultāti. Analīze tika veikta 111 embrijiem. No tiem 48 bija eiploīdi un derīgi embriotransfēram (ET) dzemdes dobumā. No 13 veiktiem ET, astoņi bija pozitīvi – to rezultātā iestājās progresējoša klīniska grūtniecība.
Secinājumi. Ņemot vērā šādus rezultātus, var secināt, ka PGS lietošana ievērojamai daļai pacienšu ar apgrūtinātu reproduktivitāti, pēc anamnēzes datiem, novērš vienu no galvenajiem neizdevušās implantācijas un agrīnas grūtniecības pārtraukšanās faktoriem – embrija hromosomālo nekompetenci, šādā veidā palielinot progresējošas grūtniecības iestāšanās varbūtību jau pēc pirmā PGS cikla.
Ievads
Hromosomu strukturālas un skaitliskas izmaiņas embrija šūnās ir viens no galvenajiem cēloņiem, kāpēc sekmīgi nenoris embrija implantācijas process, kā arī kāpēc notiek agrīns grūtniecības pārtraukums (Hodes-Wertz et al., 2012; Kutteh, 2015), kas klīniskajā reproduktoloģijā rada izaicinošu problēmu gan pacientiem, gan iesaistītajiem speciālistiem (Kutteh, 2015). Hromosomāla patoloģija, kuras dēļ neveidojas agrīni letālas komplikācijas, var izpausties grūtniecības otrajā un trešajā trimestrī, kā arī postnatāli – kā multiplas dažādu orgānu sistēmu strukturālas anomālijas, kas ietekmē bērna dzīves ilgumu un kvalitāti.
Hromosomālu patoloģiju auglim ir iespējams diagnosticēt grūtniecības laikā, izmantojot invazīvas (horija bārkstiņu biopsijas un diagnostiskās amniocentēzes) un neinvazīvas (placentas DNS analīzi mātes asinīs) diagnostikas metodes. Tomēr tās nesniedz iespēju ielūkoties ilgstošas neauglības patoģenēzē, kā arī ne vienmēr sniedz ģimenei pieņemamu risinājuma izvēli patoloģijas apstiprināšanas gadījumā. Tādēļ gadījumos, ja ģimenei pārmantotu hromosomālu aberāciju vai neskaidru iemeslu dēļ ir novērotas atkārtotas neizdevušās implantācijas epizodes (ārpusdzemdes apaugļošanas gadījumā) vai atkārtoti tiek zaudētas grūtniecības, ir pietiekamas indikācijas apsvērt preimplantācijas hromosomālas diagnostikas izmantošanas nepieciešamību. Pašreiz gan nav oficiālu vadlīniju PGS piemērošanai pāriem, kas piedalās ārpusdzemdes apaugļošanā.
Preimplantācijas hromosomālā diagnostika, saukta arī par preimplantācijas ģenētisko skrīningu (PGS), ir metode embrija hromosomu komplekta noteikšanai pēc mākslīgās apaugļošanas procedūras. Šobrīd par metodes standartu tiek uzskatīta embrija trofektodermas biopsija 5. dienā pēc apaugļošanās un tai sekojoša visu 23 hromosomu pāru analīze. Pēc izmeklējuma veikšanas dzemdes dobumā tiek pārnesti embriji ar normālu hromosomu komplektu, tādējādi ievērojami palielinot veiksmīgas implantācijas, klīniskas grūtniecības un veselu bērnu dzimšanas iespēju vecākiem, kuriem ir paaugstināts aneiploīdu dzimumšūnu veidošanās risks (Idowu et al., 2015; Lee et al., 2015). PGS ir nozīme arī vecuma riska izraisītas implantācijas problēmas atrisināšanā sievietēm līdz 42 gadu vecumam (Munne et al., 2015) un vecuma riska ietekmes samazināšanā arī sievietēm pēc 42 gadu vecuma.
“iVF Riga” klīnikā PGS analīze tiek veikta kopš 2014. gada septembra. Darbs turpinās, un jau pirmie iegūtie rezultāti ir pietiekami, lai novērtētu PGS izmantošanas efektivitāti pāriem ar ilgstoši apgrūtinātu reproduktivitāti, par ko uzzināts anamnēzē.
Darba mērķis
Novērtēt pirmsimplantācijas ģenētiskā skrīninga lietošanas pamatotību un efektivitāti pacientiem ar negatīvu reproduktivitāti anamnēzē medicīniskās apaugļošanas cikla ietvaros.
Materiāls un metodes
Pētījuma dizains un populācija
Embriju pirmsimplantācijas ģenētiskais skrīnings ar salīdzinošās genoma hibridizācijas metodi tika izraudzīts pāriem, kuri tika konsultēti klīnikā “iVF Riga” saistībā ar infertilitāti vai subfertilitāti, balstoties uz iepriekšējo reproduktivitātes anamnēzi. Par šīs izmeklēšanas indikācijām tika uzskatīti šādi faktori:
- ilglaicīga neizskaidrojama neauglība;
- ieraduma aborts (divi un vairāk spontānie aborti), to skaitā arī grūtniecības pārtraukums (missed abortion);
- reproduktīvais vecums, kas paaugstina hromosomālu aneiploīdiju risku pēcnācējiem (sievietei vairāk par 37 gadiem, vīrietim vairāk par 45 gadiem);
- atkārtota neizdevusies embrija implantācija pēc ārpusdzemdes apaugļošanas procedūras;
- izmaiņas partneru hromosomu komplektā, kas ir aneiploīdu dzimumšūnu veidošanās iemesls.
Kopumā PGS tika veikts 28 pāriem, no kuriem diviem anamnēzē bija atkārtots grūtniecības pārtraukums, pārējiem pāriem bija trīs un vairāk neizdevušās embrija implantācijas (diviem pāriem – astoņi neveiksmīgi mākslīgās apaugļošanas cikli). Visas sievietes bija nulliparas (sievietes, kurām grūtniecība vēl ne reizi nav pārsniegusi 20 grūtniecības nedēļas, neatkarīgi no grūtniecības iznākuma), vidējais sieviešu vecums – 37,7 ± 5,2 gadi.
Visiem iesaistītajiem indivīdiem tika noteikts kariotips (kariotipēšana tika veikta SIA “E. Gulbja laboratorija”), trim indivīdiem tika atklātas šādas kariotipa izmaiņas: 45,XX,der(13;14)(q10;q10) – Robertsona translokācija, 46,XY/47XXY – mozaīkveida kariotips un 46,XX,t(2;7)(p24.2;p15.3) – reciproka translokācija.
No katras sievietes olnīcām, izdarot punkciju, tika iegūti vidēji septiņi oocīti, kas tika apaugļoti, izmantojot ICSI (introcytoplasmatic sperm injection) metodi, visas šūnas tika ievietotas laiksprīža uzraudzības (time-lapse monitoring) inkubatorā (Embryoscope, Vitolife), apaugļošanās tika atzīta par izdevušos 2PN (no angļu val. pronucleus, dzimumšūnu kodoli, kas kļūst redzami apaugļošanās procesā pirms ģenētiskā materiāla apvienošanās) parādīšanās gadījumā. Embriji tika inkubēti līdz blastocistas stadijai (piektā attīstības diena). Dabiskās atlases rezultātā līdz piektajai dienai katram pārim izdzīvoja vidēji četri embriji (piektās dienas izdzīvošanas līmenis – 57 %), kopsummā – 111 embriji, kas arī tika pakļauti turpmākai analīzei.
Embriju biopsija tika veikta, izmantojot ar lāzeru aprīkotu mikromanipulatoru. No katra embrija tika paņemtas 1–8 trofektodermas (blastocistas ārējā šūnu slāņa – TE) šūnas, kuras ievietoja 0,2 ml stobriņos 2,0 mkl 1 % PVP 1 % PBS buferī. Biopsijā paņemtie embriji tika sasaldēti vitrifikācijas veidā.
Embrija TE šūnas tika analizētas ar aCGH metodi, izmantojot 24sure (Illumina) reaģentu kitu (ar šo metodi iespējams noteikt tikai nelīdzsvarotas hromosomu materiāla aberācijas t. s. poliploīdiju, ja dzimumhromosomas pārstāv gan X, gan Y hromosomas, mozaīcisma atklāšanas līmenis – divu dažādu šūnu līniju minimālā attiecība 1 : 3, metodes rezolūcija 2 Mb) pēc standarta protokola: DNS atbrīvošanai biopsijā iegūtās šūnas tika fermentatīvi sašķeltas, tika veikta divpakāpju visas genomiskās DNS amplifikācija, amplifikāts tika analizēts elektroforētiski 2 % agarozes gelā. Puse iegūto paraugu tika iezīmēta ar Cy3 un puse – Cy5 fluoroforiem, izmantojot nick-translation metodi.
Iegūtie paraugi tika apvienoti, koncentrēti un uzlikti uz speciāliem “mikročipiem” (BAC arrays) turpmākai hibridizācijai. No “mikročipiem” tika nomazgāti neinkorporētie fluorofori un skenēti, izmantojot InnoScan skeneri (Innopsys). Iegūtie attēli tika analizēti BlueFuse programmā (Illumina). Iegūto datu apstrādei tika izmantota datorprogramma Microsoft Office Excel 2010.
Rezultāti
Pētījumā tika analizēti 111 embriji; 63 (57 %) no tiem tika definēti kā aneiploīdie (ar hromosomu skaitu, kas nedalās ar 23). No analizētajiem aneiploīdajiem embrijiem 22 tika konstatēta parasta aneiploīdija (hromosomu skaita izmaiņas viena hromosomu pāra ietvaros, t. i., vairāk vai mazāk par divām hromosomām, piemēram, monosomija vai trisomija), 21 embrijam aneiploīdija bija divu vai trīs hromosomu pāros, bet 10 embrijiem tika konstatētas kompleksas hromosomālā materiāla izmaiņas (aneiploīdija četru un vairāk hromosomu pāros).
Pāriem ar viena indivīda izmaiņām kariotipā (ar reciproko un Robertsona translokācijām) iegūto embriju kariotipi korelēja ar vecāku kariotipu, rezultāts tika izteikts kā kariotips līdzsvarots / nelīdzsvarots pēc translokācijā iesaistītajām hromosomām; pārim ar Robertsona translokāciju tika iegūts viens eiploīds embrijs, pārim ar reciproko translokāciju visi embriji bija ar hromosomālajām aberācijām.
Septiņiem pāriem visi analizētie embriji (katram pārim 1–4 embriji) bija aneiploīdi, vidējais sieviešu vecums šajā grupā – 41,4 ± 4,4 gadi.
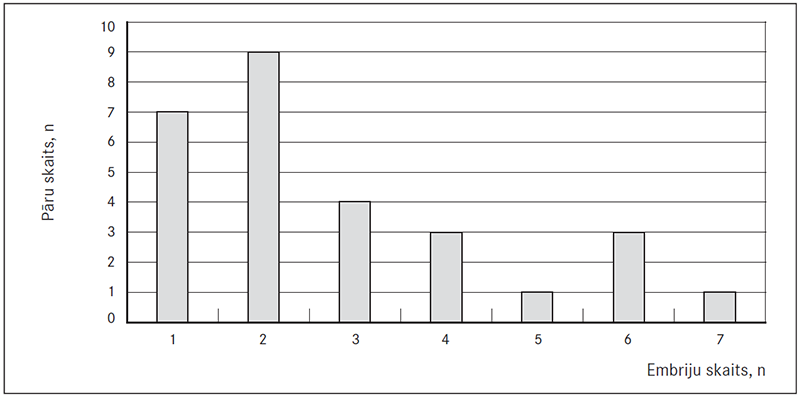
Kopumā tika atlasīti 48 normāli embriji (43 %), kas tika iegūti no 21 pāra. Katram no šiem pāriem eiploīdi un transfēra procedūrai derīgi bija no viena līdz sešiem embrijiem (vidēji divi embriji) (sk. 1. att.).
Kopumā tika veikti 13 embriotransfēri (ET), pēc atkausēšanas pārnesot dzemdes dobumā vienu eiploīdu embriju. Astoņi embriotransfēri rezultējās progresējošā klīniskā grūtniecībā, no tiem četros gadījumos bija pieejams tikai viens hromosomāli normāls embrijs, to skaitā pārim ar vīrieša kariotipu 46,XY/47XXY.
Viens ET deva pozitīvu HCG pieaugumu, bet grūtniecība pārtraucās pirms 7. grūtniecības nedēļas, liecinot par iespējamu citu neauglības etioloģiju. Četros gadījumos embrijs neimplantējās (HCG nepieaug vai ir < 50 mIU/ml). Šīs grupas vidējais sieviešu vecums bija 43,2 gadi. Astoņiem pāriem tiek plānota embriotransfēra procedūra.
1. attēls. Eiploīdu embriju daudzums pacientiem, kas iekļauti ārpusdzemdes apaugļošanas ciklā ar pirmsimplantācijas embriju skrīningu / Euploid embryo amount in patients undergoing in vitro fertilization with preimplantation embryo screening
Diskusija
Vadlīnijas neizdevušās implantācijas un atkārtotas grūtniecības neiznēsāšanas pacientu novērošanai un ārstēšanai iekļauj reproduktīvo orgānu, antifosfolipīdu antivielu, kariotipa, hormonālo anomāliju u. c. skrīningu, taču gandrīz pusei šādu pacientu neauglības cēlonis paliek nenoskaidrots (Shahine et al., 2014). Būtiski ir tas, ka pirmsimplantācijas embriju hromosomu aneiploīdiju skrīnings ļauj ne tikai atlasīt “labāko” embriju transfēram, bet arī dod unikālu iespēju ielūkoties šādu pāru neauglības patoģenēzē, brīžiem rodot gan atbildi par neauglības iemeslu, gan iespējamu neauglības problēmas efektīvu risinājumu.
Daži autori atzīst, ka pacientiem ar “smagu” anamnēzi medicīniskās apaugļošanas cikli ar PGS dod mainīgus un neviennozīmīgus rezultātus, galvenokārt dažādu lietojamo tehnoloģiju, kā arī konkrētās pacientu grupas nevienveidības dēļ (Franssen et al., 2011; Shahine et al., 2014). Pašreiz šā pētījuma PGS ciklu daudzums ir neliels, tāpēc grūti salīdzināt iegūtos datus ar citu klīniku PGS uzkrāto pieredzi, taču jāuzsver, ka visi iekļautie pāri pirms PGS procedūras bija guvuši vairākkārtēju negatīvu pieredzi gan medicīniskās apaugļošanas ietvaros (neizdevušās implantācijas), gan dabiskas grūtniecības iestāšanās gadījumā (piemēram, spontāni pārtraukusies grūtniecība).
Ir parādīts, ka pacientiem ar labu prognozi, veicot visu hromosomu aneiploīdiju skrīningu, pēc ET var iegūt 69,1 % progresējošu grūtniecību, salīdzinot ar saskaņotu kontroles grupu, kurā bez PGS rezultāts ir 41,7 % (Zhihong et al., 2012). Mūsu iegūtais rezultāts liecina, ka veiksmīgi izvēlētai PGS tehnoloģijai – aCGH –, kā arī rūpīgam klīnicistu darbam pacientu atlasē un iespēju izvērtēšanā ir visai apmierinoši rezultāti jau pirmajā PGS ciklā – astoņas progresējošas klīniskas grūtniecības no 13 ET (61,5 %) ir pārliecinošs rādītājs, ņemot vērā iekļauto pāru iepriekšējo anamnēzi par reproduktivitāti.
Hromosomālās patoloģijas risks tiek minimizēts pat salīdzinājumā ar dabiskas ieņemšanas hromosomālo patoloģiju risku (Al-Asmar et al., 2012), īpaši pāriem ar izmainītu kariotipu vai vecuma ietekmētu risku. Šie pāri biežāk piedzīvo spontāno abortu, apstājušos grūtniecību vai pat slima bērna piedzimšanu nelīdzsvarota kariotipa gadījumā (Al-Asmar et al., 2012; Alfarawati et al., 2011). Arī mūsu pieredze rāda, ka pāriem, kuri veic PGS viena vecāka izmainīta hromosomu komplekta dēļ, iegūtais embriju aneiploīdijas biežums ievērojami pārsniedz teorētiski aprēķināto, tādēļ eiploīda embrija atrašana dod augstu iespēju veiksmīgai implantācijai un grūtniecības norisei. Diagnostiski prognostiska nozīme ir situācijai, ka novēro neizdevušos implantāciju eiploīda embrija ET gadījumā, jo tad tiek novērsts embrija ģenētiskās nekompetences faktors neauglības etioloģijā. Šāda informācija paver iespēju turpmāka diagnostiskā plāna individualizētai izstrādei un īstenošanai.
Viena no PGS lietošanas papildu priekšrocībām ir tikai viena embrija transfēra iespēja, kas līdz minimumam samazina dvīņu grūtniecības iespējamību, nepieļaujot zināmos ar to saistītos sarežģījumus. Tas ir svarīgi, zinot, ka dvīņu grūtniecību apjoms pēc ārpusdzemdes apaugļošanas cikliem joprojām ir ļoti liels, sasniedzot > 40 % (Scott et al., 2014), jo viena embrija transfēra gadījumā ir mazāka grūtniecības iestāšanās varbūtība (Ming-Yih et al., 2014). PGS ar aCGH rezultāti parāda, ka “viens var būt vairāk par diviem” un ka viena embrija transfēra izvēles lietošana ir pamatota pat tiem pacientiem, kuru anamnēzē ir informācija par reproduktivitātes grūtībām.
Secinājumi
PGS lietošanas klīniskais iznākums parāda, ka visu embrija hromosomu aneiploīdiju skrīnings var palielināt veiksmīgu embrija implantāciju un klīniski noritošu grūtniecību skaitu arī tiem pacientiem, kam anamnēzē ir ziņas par reproduktivitātes grūtībām jau pēc pirmā PGS cikla.
Negatīvs rezultāts pēc hromosomāli kompetenta embrija pārnešanas dzemdes dobumā var būt diagnostisks un prognostisks rādītājs, kā arī dot iestrādnes tālākas izmeklēšanas plānam.
Pāriem, kuriem pēc veiktas PGS analīzes nav konstatēts neviens hromosomāli eiploīds embrijs, šāds rezultāts var norādīt uz donora materiāla izmantošanas nepieciešamību pozitīva rezultāta sasniegšanai, tādējādi dodot pamatojumu reproduktīvās izvēles virzienam.
Pateicība
Pateicamies SIA “iVF Riga” par pētījuma materiāli tehnisko nodrošinājumu.
Abstract
Preimplantation Genetic Screening – Summary of First Results in Patients with Complicated Reproductive History
Unsuccessful treatment of infertility is one of the pitfalls in clinical reproductology. Structural and numerical chromosomal changes remain the leading cause of embryo implantation failure or miscarriage in early pregnancy. Preimplantation genetic screening (PGS) is a method for analysing embryonic chromosomes; thus, leading to a chromosomally competent embryo selection for embryo transfer procedure. Chromosomally normal embryo transfer leads to improved chance of clinical pregnancy and birth of a healthy child.
The aim of our study was to evaluate the efficiency of PGS implementation for patients with complicated reproductive history.
PGS procedure was applied to 28 families with negative reproductive history. 5th day embryos were biopsied and analysed using array comparative genome hybridisation method (aCGH).
In summary, 111 embryos were analysed; 48 of them were found to be euploid and suitable for embryo transfer (ET) procedure. After 13 ET procedures, 8 progressed into clinical pregnancy.
Our results suggest that in patients with complicated reproductive history PGS analysis can exclude one of the leading infertility causes – chromosomal incompetence of embryo, thus improving chance of acquiring a successful implantation and progressing pregnancy even in the first PGS cycle.
Literatūra
- Al-Asmar N., Peinado V., Vera M., Remohí J., et al. Chromosomal abnormalities in embryos from couples with a previous aneuploid miscarriage. Fertil Steril, 2012 Jul; 98 (1): 145–150.
- Alfarawati S., Fragouli E., Colls P., Wells D. First births after preimplantation genetic diagnosis of structural chromosome abnormalities using comparative genomic hybridization and microarray analysis. Hum Reprod, 2011; 26 (6): 1560–1574.
- Hodes-Wertz B., Grifo J., Ghadir S., et al. Idiopathic recurrent miscarriage is caused mostly by aneuploid embryos. Fertil Steril, 2012 Sep; 98 (3): 675–680.
- Idowu D., Merrion K., Wemmer N., et al. Pregnancy outcomes following 24-chromosome preimplantation genetic diagnosis in couples with balanced reciprocal or Robertsonian translocations. Fertility and Sterility, 2015 April; Vol. 103, No. 4.
- Franssen M. T. M., Musters A. M., van der Veen F., et al. Reproductive outcome after PGD in couples with recurrent miscarriage carrying a structural chromosome abnormality: a systematic review. Hum Reprod Update, 2011 Jul–Aug; 17 (4): 467–75.
- Kutteh W. H. Novel strategies for the management of recurrent pregnancy loss. Semin Reprod Med, 2015 May; 33 (3): 161–168.
- Lee E., Illingworth P., Wilton L., et al. The clinical effectiveness of preimplantation genetic diagnosis for aneuploidy in all 24 chromosomes (PGD-A): systematic review. Hum Reprod, 2015 Feb; 30 (2): 473–483.
- Ming-Yih Wu, Kuang-Han Chao, Chin-Der Chen, et al. Current status of comprehensive chromosome screening for elective single-embryo transfer. Obstetrics and Gynecology International, Vol. 2014.
- Munne S., Colls P., Wells D., et al. 18 000 cycles of PGS with arrayCGH: abnormalities detected and pregnancy outcomes. Abstracts, 14th International conference on Preimplantation genetic diagnosis, May 2015.
- Sammya Bezerra Maia, Holanda Moura, Stefan Charles Kane, et al. Pre-implantation genetic screening and diagnosis: what doctors should know. Rev Bras Ginecol Obstet, Feb. 2015; Vol. 37, No. 2.
- Scott Morin, Katherine Melzer-Ross, David McCulloh, et al. A greater number of euploid blastocysts in a given cohort predicts excellent outcomes in single embryo transfer cycles. Journal of Assisted Reproduction and Genetics, June 2014; Vol. 31, issue 6, 667–673.
- Shahine L. K., Lathi R. B. Division of Reproductive Endocrinology and Infertility, Department of obstetrics and gynecology, University of Washington, Pacific NW Fertility and IVF specialists, Seattle, Washington. Seminars in Reproductive Medicine, 2014; 32 (2): 93–99.
- Zhihong Yang, Jiaen Liu, Gary S. Collins, et al. Selection of single blastocysts for fresh transfer via standard morphology assessment alone and with array CGH for good prognosis IVF patients: results from a randomized pilot study. Molecular Cytogenetics, 2012; 5: 24.
Atslēgvārdi
miscarriage, pregnancy loss


