MMP-2, VEGF un PGP-9,5 raksturojums psoriāzes skartos nagos
Kopsavilkums
Ievads. Psoriāze ir hroniska, iekaisīga ādas slimība, kas skar pacientu nagus dzīves laikā līdz pat 80–90 % gadījumu, ievērojami pasliktinot viņu dzīves kvalitāti.
Darba mērķis. Darba mērķis bija raksturot neirālus un vaskulārus faktorus psoriātiskos nagos, nosakot proteīna gēna produkta 9,5 (PGP-9,5), vaskulārā endoteliālā augšanas faktora (VEGF) un matrices metālproteināzes-2 (MMP-2) klātbūtni un izvietojumu psoriāzes skartā naga vienībā, kā arī salīdzinot ar veseliem kontroles grupas nagiem.
Materiāls un metodes. Pētījumā tika iekļautas astoņas naga biopsijas ar iepriekš klīniski un histoloģiski apstiprinātu nagu psoriāzes diagnozi un piecas svaigu līķu veselu nagu biopsijas. Audu materiāls tika fiksēts Stefanini šķīdumā, atūdeņots un ieguldīts parafīnā. No audu paraugiem pagatavotie griezumi tika krāsoti ar hematoksilīnu un eozīnu, kā arī imūnhistoķīmiski audos tika noteikts PGP-9,5 (Z5116; 1 : 500; Dako, Dānija), VEGF (M7273; 1 : 50; Dako, Dānija) un MMP-2 (AF902; 1 : 50; RD Systems, Anglija).
Iegūtie imūnhistoķīmijas dati tika izvērtēti puskvantitatīvi, statistiskai datu analīzei tika lietots Manna–Vitnija U tests.
Rezultāti. Vairāk PGP-9,5 imūnreaktīvu nervu šķiedru struktūru tika konstatēts psoriāzes skarta naga gultnē, salīdzinot ar kontroles grupu. Psoriātiska naga saistaudos asinsvada sieniņā VEGF pozitīvas endotēlija šūnas tika novērotas vidēji daudz, savukārt kontroles grupā VEGF pozitīvas struktūras nebija vizualizējamas (p < 0,05).
MMP-2 pozitīvas struktūras ievērojami lielākā daudzumā tika novērotas psoriāzes skarta naga gultnē, salīdzinot ar kontroles grupu, savukārt psoriātiska naga saistaudos bija vērojams vidēji liels MMP-2 pozitīvo struktūru daudzums, turpretī kontroles grupas nagos – tikai dažas MMP-2 pozitīvas struktūras.
Secinājumi. Psoriāzes skartai naga vienībai ir raksturīgs palielināts VEGF pozitīvo struktūru daudzums. Palielinātais MMP-2 pozitīvo struktūru daudzums psoriātiskos nagos liecina par matrices metālproteināžu nozīmi naga vienības remodelācijā. Palielinātais PGP-9,5 nervšķiedru daudzums psoriāzes skartā naga vienībā norāda uz pastiprinātu neirālu inervāciju psoriātiskā iekaisuma gadījumā.
Ievads
Psoriāze ir hroniska, iekaisīga ādas slimība, kas skar pacientu nagus dzīves laikā līdz pat 80–90 % gadījumu un pacientiem ievērojami pasliktina dzīves kvalitāti, turklāt nagu psoriāzes ārstēšana nereti ir mazefektīva [1; 2].
Pat izpratne par cilvēka veselas naga vienības bioloģiskajiem un imunoloģiskajiem aspektiem ir nepilnīga. Par psoriāzes skartas naga vienības imunoloģisko raksturojumu zināšanas ir ļoti fragmentāras, tās galvenokārt gūtas, novērojot atsevišķu bioloģisko medikamentu efektivitāti nagu psoriāzes ārstēšanā. Ir nepieciešama izpratne par mehānismiem, kas nosaka nagu psoriāzes attīstību, lai mērķtiecīgi izvēlētos ārstēšanas metodes.
Dažādās psoriātiska naga klīniskās un histoloģiskās pazīmes mainās atkarībā no tā, kuras naga vienības daļas tiek skartas. Kaut arī histoloģiskās pazīmes psoriāzes skartā nagā ir līdzīgas tām, kuras novērojamas psoriātiskā ādā, tomēr vērojamas arī tieši tikai šim anatomiskajam reģionam raksturīgas psoriātiskā iekaisuma radītas iezīmes.
Nagu psoriāzei raksturīga akantoze, hiperkeratoze, naga gultnes hipergranuloze un parakeratoze. Turklāt atšķirībā no psoriāzes ādā nagā bieži vērojama spongioze un serozs eksudāts, kā arī hipergranuloze [3].
Kaut arī uz lielāko daļu histoloģisko izmaiņu nagu psoriāzes gadījumā vismaz daļēji varētu tikt attiecināti tie paši patofizioloģiskie mehānismi, kas psoriāzes skartā ādā, nevajadzētu aizmirst faktu – kaut gan nags ir ādas derivāts, tam raksturīgas nozīmīgas atšķirīgas bioloģiskas un imunoloģiskas pazīmes. Tādēļ visas ādas psoriāzei raksturīgās iezīmes nevajadzētu automātiski attiecināt arī uz nagu.
Psoriātiskā iekaisumā vērojama angioģenēze un asinsvadu paplašināšanās papillārajā dermā, kā arī imūno šūnu infiltrācija epidermā, kas rada masīvu iekaisuma citokīnu sekrēciju. Tā rezultātā keratinocīti, izdalot VEGF, sekmē jaunu kapilāru veidošanos [4]. Kapilārās izmaiņas, tostarp izteikta asinsvadu lūmena paplašināšanās un palielināta kapilāru sieniņas caurlaidība papillārajā dermā, parādās agrīnā psoriātiska iekaisuma fāzē [4–5]. VEFG ir multifunkcionāls citokīns, kurš nodrošina ne tikai angioģenēzi, bet arī vaskulāro caurlaidību [6].
Psoriāzes gadījumā norit ievērojami paātrināts šūnas cikls, tiek traucēta gan keratinocītu termināla diferencēšanās, gan desmosomu degradācija [7]. Matrices metālproteināzes ir no cinka atkarīgi proteolītiski enzīmi, kam piemīt spēja degradēt visas ekstracelulārās matrices un bazālās membrānas komponentes. Tām ir nozīmīga loma homeostāzes un ādas funkciju nodrošināšanā. MMP ir svarīgas audu remodelēšanā, šūnu migrācijā, angioģenēzē un epitēlija apoptozes nodrošināšanā. Psoriāzes patoģenētiskie mehānismi skar visus fizioloģiskos procesus, kuros piedalās arī MMP [7–12].
Par psoriātiskā iekaisuma ietekmi uz neirālo inervāciju dažādu autoru darbos joprojām nav rodams vienots uzskats. Daudzas aferentās nervu šķiedras neekspresē CGRP un SP, tāpēc pētījumā izvēlējāmies vispārēju neirālu marķieri-PGP-9,5, lai novērtētu, vai nervu šķiedru daudzums ir izmainīts psoriāzes skartā naga vienībā [13]. PGP-9,5 ir neironiem specifisks proteīns, kurš tiek uzskatīts par vispārēju marķieri kā neironiem, tā difūzajai neiroendokrīnajai sistēmai. PGP-9,5 lielā daudzumā vērojams neirona citoplazmā centrālajā un perifērajā nervu sistēmā [14].
Pētījuma mērķis bija novērtēt neirālo, vaskulāro un audu degradācijas faktoru, nosakot MMP-2, VEGF un PGP-9,5 klātbūtni un izvietojumu psoriāzes skarta naga audu materiālā un salīdzinot ar kontroles grupu.
Materiāls un metodes
Pētījumā tika iekļautas astoņu pacientu vecumā no 18 līdz 70 gadiem astoņas naga vienību biopsijas, kas veiktas ar punch metodi (diametrs: 5 mm), kam atbilstoši iekļaušanas kritērijiem iepriekš bija klīniski un histoloģiski apstiprināta nagu psoriāzes diagnoze. Izslēgšanas kritēriji bija – citas ādas slimības pacienta anamnēzē, izņemot psoriāzi, tostarp onihomikoze (tika iekļauti tikai audu paraugi ar negatīvu PAS (Periodic acid-Schiff) reakciju un negatīvu sēnīšu kultūru), kas saņēmuši lokālu vai sistēmisku antibakteriālu, antimikotisku, pretiekaisuma, imunosupresīvu, D vitamīna vai ultravioletā starojuma terapiju pēdējā mēneša laikā.
Kontroles grupā tika iekļauts audu materiāls no svaigu (12 stundu laikā pēc nāves iestāšanās) līķu klīniski veselu naga vienību nekropsijām, kas histoloģiski atbilda normālai naga vienībai, ar negatīvu PAS reakciju. Mirušajiem nebija ādas slimību anamnēzē, turklāt viņi nebija saņēmuši antibakteriālu vai imūnsupresīvu terapiju pēdējo divu nedēļu laikā. Pētījuma veikšanai 26.06.2014. tika saņemta Rīgas Stradiņa universitātes Ētikas komitejas atļauja.
Nagu biopsiju audu materiāls tika fiksēts Stefanini šķīdumā, atūdeņots un ieguldīts parafīnā. No audu paraugiem tika pagatavoti 4 mikrometrus biezi griezumi, tie tika krāsoti pārskatam ar hematoksilīnu un eozīnu, tika veikta PAS reakcija.
Imūnhistoķīmiski audos tika noteikts PGP-9,5 (Z5116; 1 : 500; Dako, Dānija), VEGF (M7273; 1 : 50; Dako, Dānija) un MMP-2 (AF902; 1 : 50; RD Systems, Anglija).
Iegūto imūnhistoķīmijas datu pozitīvo struktūru relatīvais daudzums tika vērtēts ar puskvantitatīvo skaitīšanas metodi [15]. Vērtējot pozitīvās struktūras, tika lietota šāda vērtējuma gradācija: (−) netika redzēta neviena pozitīva struktūra redzes laukā, (− / +) retas pozitīvas struktūras redzes laukā, (+) maz pozitīvu struktūru redzes laukā, (++) vidēji daudz pozitīvu struktūru redzes laukā, (+++) daudz pozitīvu struktūru redzes laukā, (++++) ļoti daudz pozitīvu struktūru redzes laukā.
Statistiskai datu analīzei tika lietots Manna–Vitnija U tests.
Rezultātu vizuālai attēlošanai tika izmantota Leica DC 300F digitālā kamera un attēlu vizualizācijas programma Image Pro Plus.
Rezultāti
Histoloģiski naga gultnē bija vērojama hiperkeratoze, parakeratoze, spongioze, fokāla hipergranuloze un neitrofilo leikocītu infiltrācija, kā arī dilatēti asinsvadi papillārajā dermā.
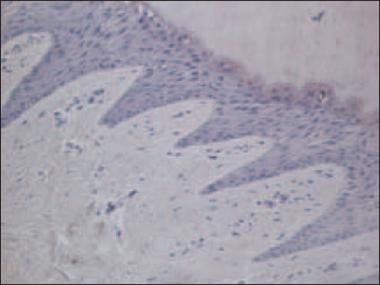
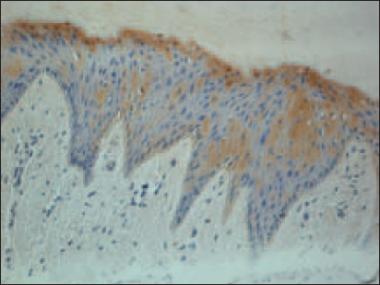
VEGF. Psoriātisko nagu audu paraugos bija vērojamas VEGF pozitīvas struktūras − asinsvadu sieniņās naga gultnei piegulošajos saistaudos bija vidēji daudz (++) VEGF pozitīvo endotēlija šūnu, turpretī kontroles grupā VEGF pozitīvas struktūras nebija atrodamas (p < 0,05) (sk. 1. tab., 1. un 2. att.).
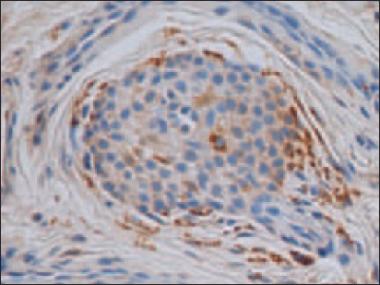
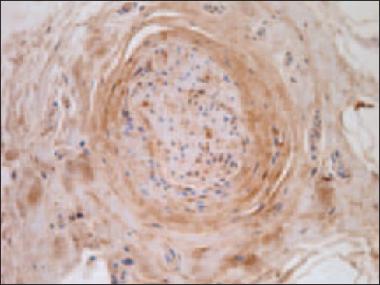
MMP-2. Ievērojami vairāk MMP-2 pozitīvu struktūru bija redzamas psoriātisko nagu gultnē, salīdzinot ar kontroles grupu (p < 0,05). Psoriātisko nagu gultnē bija daudz MMP-2 pozitīvu struktūru (sk. 3. att.), saistaudos – vidēji daudz (++), turpretī kontroles grupas nagu gultnē bija vidēji liels MMP-2 pozitīvo šūnu skaits, bet saistaudos tikai dažos redzes laukos bija vērojamas retas MMP-2 pozitīvas šūnas (sk. 4. att.).
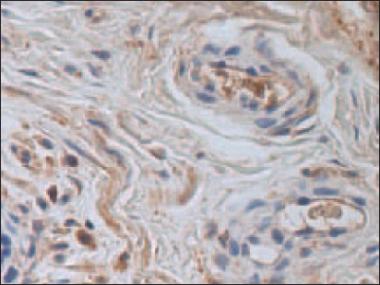
PGP-9,5 pozitīvas struktūras lielākā daudzumā bija redzamas psoriāzes skartā naga vienībā (sk. 5. att.). Nagu psoriāzes grupas nagu gultnē bija vizualizējamas daudz PGP-9,5 imūnreaktīvo nervu šķiedru, saistaudos – vidēji daudz; turpretī kontroles grupā naga gultnē bija vidēji daudz, bet saistaudos retas PGP-9,5 pozitīvas nervu šķiedras (sk. 6. att.).
1. tabula. Imūnhistoķīmiski noteikto MMP-2, VEGF un PGP-9,5 pozitīvo struktūru relatīvais daudzums psoriātisko nagu un kontroles nagu grupā / Appearance data of MMP-2, VEGF and PGP-9.5 in psoriatic and control group nails
| Psoriāzes skarti nagi | Kontroles grupas nagi | |||||||
|---|---|---|---|---|---|---|---|---|
| Metode | Naga gultne | Manna– Vitnija U tests | p vērtība | Saistaudi / asinsvadi | Manna– Vitnija U tests | p vērtība | Naga gultne | Saistaudi / asinsvadi |
| MMP-2 | +++ | 2,0 | 0,004 | ++ | 8,5 | 0,073 | ++ | − / + |
| PGP-9,5 | +++ | 11,0 | 0,139 | ++ | 8,0 | 0,056 | ++ | + |
| VEGF | − | − | − | + / ++ | 2,5 | 0,006 | − | − |
Ar puskvantitatīvo metodi imūnhistoķīmiski noteikto struktūru relatīvā biežuma apzīmēšana: − netika redzēta neviena pozitīva struktūra redzes laukā; − / + retas pozitīvas struktūras redzes laukā; + maz pozitīvu struktūru redzes laukā; + / ++ maz līdz vidēji daudz pozitīvu struktūru redzes laukā; ++ vidēji daudz pozitīvu struktūru redzes laukā; ++ / +++ vidēji daudz līdz daudz pozitīvu struktūru redzes laukā; +++ daudz pozitīvu struktūru redzes laukā; +++ / ++++ ļoti daudz pozitīvu struktūru redzes laukā.
1. attēls. Vidēji daudz VEGF pozitīvu struktūru psoriātiska naga gultnei piegulošajos saistaudos / Moderate VEGF positive structure amount in psoriatic nail bed’s connective tissue (VEGF IMH, × 250) | 2. attēls. VEGF pozitīvu struktūru trūkums kontroles grupas naga saistaudos / Absence of VEGF positive cells in control group nail (VEGF IMH, × 250) |
|
|
3. attēls. Daudz MMP-2 pozitīvu struktūru psoriātiska naga gultnes epitēlijā / Numerous MMP-2 positive structures in psoriatic nail epithelium of the nail bed (MMP-2 IMH, × 200) | 4. attēls. Vidēji daudz MMP-2 pozitīvu struktūru kontroles nagu grupas naga gultnes epitēlijā un negatīva ekspresija tai piegulošajos saistaudos / Moderate amount of MMP-2 positive structures in control group nail bed epithelia and absence in the connective tissue (MMP-2 IMH, × 200) |
|
|
5. attēls. Daudz PGP-9,5 pozitīvu struktūru psoriātiska naga saistaudos / Numerous PGP-9.5 positive structures in psoriatic nail (PGP-9.5 IMH, × 400) | 6. attēls. Vidēji daudz PGP-9,5 pozitīvu struktūru kontroles nagu grupā / Moderate number of positive structures in control group nail (PGP-9,5 IMH, × 400) |
|
|
Diskusija
Veselā ādā MMP-2 ir vērojama asinsvadu endotēlijā, fibroblastos un keratinocītos [16]. MMP-2 ādā tiek izstrādāta dzīšanas procesā, kā arī to izdala daži audzēji, un tās galvenā funkcija ādā ir ekstracelulārās matrices remodelēšanā [17; 18]. MMP-2 veic arī citas bioloģiskas funkcijas, piemēram, tai ir nozīme šūnu proliferācijā, adhēzijā un migrācijā [19; 20]. Psoriāzes gadījumā matrices metālproteināzes piedalās epidermas strukturālo izmaiņu radīšanā, modificējot starpšūnu kontaktus, ekstracelulārās matrices komponentes, veicinot angioģenēzi papillārajā dermā un imūno šūnu infiltrāciju [7]. Psoriāzes skartā epidermā matrices metālproteināzes varētu būt noteicošās starpšūnu kontaktu un ekstracelulārajā matricē vērojamo izmaiņu radīšanā. Paaugstināta MMP-2 klātbūtne ir tikusi novērota kā psoriāzes skartā ādā, tā klīniski veselā psoriāzes slimnieka ādā, kas liecina par iespējamu primāru traucējumu keratinocītos [20].
Daži autori psoriāzes gadījumā apraksta [20] paaugstinātu MMP-2 daudzumu keratinocītos suprabazālajā slānī. Kaut arī paaugstinātu MMP-2 līmeni psoriātiskā epidermā aprakstījuši arī citi autori, tas, ka publikācijā minēts divkāršs paaugstinājums, datus par MMP-2 līmeņa izmaiņām liek vērtēt pretrunīgi [21].
Turklāt arī psoriātiskā artrīta gadījumā, kas ir hroniska, iekaisīga slimība, vērojama proteolītisko enzīmu, tostarp matrices metālproteināžu, radīta skrimšļa ekstracelulārās matrices proteīnu destrukcija [22]. Trūkst datu par matrices metālproteināžu klātbūtni un izvietojumu cilvēka naga vienībā, tā nav tikusi aprakstīta darbos par nagu psoriāzes skartiem nagiem.
Mūsu pētījumā iegūtie rezultāti liecina, ka psoriātiska naga gultnē ir paaugstināta MMP-2 pozitīvu struktūru klātbūtne. Tās tika novērotas lielā daudzumā naga gultnē un vidēji daudz tai piegulošajos saistaudos, savukārt kontroles grupā bija vizualizējamas MMP-2 pozitīvas šūnas naga gultnē vidējā daudzumā un tikai retas MMP-2 pozitīvas struktūras kontroles grupas nagu saistaudos. Tas varētu norādīt, ka MMP-2 ir raksturīga nagu psoriāzei un tai ir nozīme psoriāzes ierosinātajā audu remodulācijas procesā.
Izpratnei par MMP-2 paaugstināto daudzumu nagu psoriāzes gadījumā ir nozīme ne tikai slimības patoģenēzē, bet arī tās bioloģisko funkciju noskaidrošanā veselā naga vienībā.
Pareizs līdzsvars starp dažādām matrices metālproteināzēm ir noteicošs mikrokapilāru caurlaidības nodrošināšanā. Novirzes tajā ietekmē arī jaunu neovaskularizācijas procesu. Salīdzinot ar veselu ādu, kurā parasti VEGF nav atrodams, aprakstīta tā difūza klātbūtne psoriāzes skartā ādā [21].
Daži autori uzskata, ka lielajam VEGF daudzumam psoriātiskā ādā varētu būt svarīga nozīme psoriāzes radīto vaskulāro izmaiņu noteikšanā, tādējādi ietekmējot arī iekaisuma norisi [12].
Kā jau iepriekš minēts, vaskulārās izmaiņas vērojamas agrīnā psoriāzes iekaisuma fāzē, un angioģenēzei varētu būt noteicoša loma arī turpmākā iekaisuma patoģenēzes norisē [23].
Vairāki autori aprakstījuši paaugstinātu VEGF daudzumu psoriātiskā elementā ādā, kā arī paaugstinātu VEGF līmeni asins serumā pacientiem ar psoriāzi [24], norādot arī uz ciešu korelāciju starp VEGF līmeņa pieaugumu asinīs un klīnisko slimības smaguma pakāpi [25–29].
Mūsu pētījuma mērķis bija aprakstīt vaskularizācijas komponentes psoriātiskos nagos, nosakot VEGF klātbūtni un izvietojumu psoriātiskā naga vienībā. Tika novērotas VEGF pozitīvas endotēlija šūnas asinsvadu sieniņās psoriātisku nagu saistaudos, turpretim kontroles grupā tās nebija atrodamas, kas norāda uz VEGF kā raksturīgu vaskulāro faktoru arī nagu psoriāzes gadījumā. Kaut arī labi zināms, ka kapilāri psoriātiskos elementos ir ievērojami izmainīti – paplašināti, izlocīti un ar ievērojami palielinātu caurlaidību –, VEGF nozīme bieži netiek ņemta vērā, raksturojot psoriāzes patoģenētiskos mehānismus [30].
VEGF palielināta izdalīšanās keratinocītos tiek kontrolēta ar noteiktu molekulāro mehānismu starpniecību, kur liela nozīme ir arī hipoksijas inducētiem un dažādiem augšanas faktoriem, kas nosaka epidermas hiperplāziju, ierosinot parakrīnu angioģenēzes indukciju [31], tādējādi nodrošinot papildu pierādījumu tam, ka VEGF radītajai vaskulārā endotēlija aktivēšanai ir nozīmīga loma arī psoriāzes patoģenēzē [32–35].
Kopumā mūsu pētījumā gūtie novērojumi liecina par paaugstinātu VEGF pozitīvu šūnu daudzumu nagu psoriāzes gadījumā, kas apstiprina angioģenēzi kā raksturīgu pazīmi psoriātiskā naga vienībā.
Mūsu pētījumā neirālās inervācijas komponentes tika analizētas, imūnhistoķīmiski nosakot neirālo faktoru PGP-9,5 un salīdzinot PGP-9,5 pozitīvo šķiedru daudzumu psoriāzes skarto nagu un veselo nagu kontroles grupā. Izteiktāka epidermālo un dermālo nervu šķiedru intensitāte bija vērojama psoriātisko nagu grupā.
Citu autoru datu par PGP-9,5 daudzumu psoriātiskos nagos trūkst, bet novērojumi par PGP-9,5 psoriāzes skartā ādā ir pretrunīgi. Daži autori apraksta palielinātu PGP-9,5 imūnreaktīvo šķiedru daudzumu psoriāzes gadījumā, turpretim citi – pazeminātu to daudzumu [14; 36]. Citā pētījumā novērota arī vidējā intraepidermālo nervu šķiedru daudzuma samazināšanās psoriāzes skartā ādā, salīdzinot ar veselu ādu [37]. Pētījumos minēts arī par samazinātu PGP-9,5 imūnreaktīvo epidermālo nervu šķiedru daudzumu psoriātiskā ādā slimības saasinājuma laikā, salīdzinot ar psoriātisku ādu remisijas laikā un neskartu ādu psoriāzes saasinājuma laikā, norādot uz psoriāzes iekaisuma noteiktu traucētu inervāciju [38]. Turpretim daži autori novērojuši ievērojami palielinātu PGP-9,5 pozitīvu nervu šķiedru daudzumu papillārajā dermā psoriāzes skartā ādā, salīdzinot ar veselu ādu kontroles grupā [39]. Turklāt PGP-9,5 imūnreaktīvās šķiedras palielinātā daudzumā tika konstatētas arī epidermā, dermoepidermālajā robežjoslā un ekrīnajos sviedru dziedzeros [40].
Mūsu novērojumi liecina, ka psoriātisks iekaisums palielina PGP-9,5 pozitīvo nervu šķiedru daudzumu psoriāzes skartā naga vienībā.
Secinājumi
Palielināts VEGF pozitīvo struktūru daudzums naga vienībā varētu būt raksturīga vaskulāra komponente nagu psoriāzes gadījumā.
Palielināts MMP-2 pozitīvo struktūru daudzums psoriāzes skartos nagos varētu liecināt, ka MMP-2 ir raksturīga nagu psoriāzei un ka tai ir nozīme psoriāzes ierosinātajā audu remodulācijas procesā.
Palielinātais PGP-9,5 pozitīvo nervu šķiedru daudzums psoriātiskos nagos varētu norādīt uz pastiprinātu neirālu inervāciju nagā psoriātiska iekaisuma dēļ.
Pateicība
Īpaša pateicība Olgai Zaikovskai par palīdzību audu materiāla iegūšanā.
Abstract
Expression of MMP-2, VEGF and PGP-9.5 in Psoriatic Nails
Psoriasis is a chronic inflammatory skin disease where the lifetime incidence of nail involvement in psoriatic patients is estimated to be 80–90 %, causing severe distress. The aim of the study was to determine the neuronal and vascular contribution in psoriasis affected nails by examining the presence and distribution of protein gene product 9.5 (PGP 9.5), VEGF (vascular endothelial growth factor) and MMP-2 (matrix metalloproteinase-2) in psoriatic nail apparatus biopsies comparing with control group nails.
Eight biopsies of nail psoriasis were obtained and a control group with a material of five healthy nail apparatus from fresh cadavers with a punch biopsy and fixed in Stefanini’s solution, dehydrated and embedded in paraffin. Subsequently routine staining with haematoxylin and eosin and immunohistochemistry for PGP 9.5 (Z5116; 1:500; Dako, Denmark), VEGF (M7273; 1:50; Dako, Denmark) and MMP-2 (AF902; 1:50; RD Systems, United Kingdom) were performed.
The positively stained structures in the visual field were evaluated semiquantitatively. For statistical analysis non-parametric statistics with Mann–Whitney U-test was used.
PGP 9.5 positive structures were detected predominantly in psoriatic nails. Increased number of PGP 9.5 immunoreactive nerve fibres were observed in the nail bed of psoriatic nails compared with the control group. Moderate number of VEGF positive endothelial cells were seen in blood vessels of psoriatic nail beds whereas it was absent in control group nails (p < 0.05). Significantly higher amount of MMP-2 positive structures could be observed in psoriatic nail bed compared to the control group. Connective tissue of psoriatic nails revealed moderate MMP-2 expression, whereas in control group nails only few MMP-2 positive structures could be observed.
The increased VEGF expression is a characteristic vascular component observed in nail unit affected by psoriatic inflammation. The increased expression of MMP-2 in psoriatic nails contributes to remodulation process provided by matrix metalloproteinases in psoriatic nails. The increased PGP 9.5 positive nerve fibres in psoriatic nails highlight the contribution of increased neural innervation to psoriatic inflammation.
Literatūra
- Jiaravuthisan M. M., Sasseville D., Vender R. D., et al. Psoriasis of the nail: anatomy, pathology, clinical presentation, and a review of the literature on therapy. Journal of the American Academy of Dermatology, 2007; 57; 1: 1–27.
- Augustin M., Krüger K., Radtke M. A., et al. Disease severity, quality of life and health care in plaque-type psoriasis: a multicenter cross-sectional study in Germany. Dermatology, 2008; 216, 4: 366–372.
- Martin B. Nail Histopathology. Actas Dermosifiliogr, 2013; 104: 564–578.
- Mordovtsev V. N., Albanova V. I. Morphology of skin microvasculature in psoriasis. Am Dermatopathol, 1989; 11: 33–42.
- Creamer D., Sullivan D., Bicknell R., Barker J. Angiogenesis in psoriasis. Angiogenesis, 2002; 5: 231–236.
- Detmar M., Yeo K. T., Nagy J. A. Keratinocyte derived vascular permeability factor (vascular endothelial growth factor) is a potent mitogen for dermal micro-vascular endothelial cells. J Invest Dermatol, 1995; 105: 44–45.
- Mezentsev A., Nikolaev A., Bruskin S. Matrix metalloproteinases and their role in psoriasis. J. GENE, 2014; 01: 068.
- Birkedal-Hansen. Proteolytic remodeling of extracellular matrix. Curr Opin Cell Biol., 1995; 7 (5): 728–735.
- Jin M., Yang F., Zhu J., Xiao Q., et al. Matrix metalloproteinases: inflammatory regulators of cell behaviors in vascular formation and remodelling. Mediators Inflamm, 2013: 928315.
- Visse R., Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry. Circulation Research, 2003; 92; 8: 827–839.
- Sternlicht M. D., Werb Z. How matrix metalloproteinases regulate cell behaviour. Annual Review of Cell and Developmental Biology, 2001; 17: 463–516.
- Raffetto J. D., Khalil R. A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochemical Pharmacology, 2008; 75: 2: 346–359.
- Ostlere L. S., Cowen T., Rustin M. H. Neuropeptides in the skin of patients with atopic dermatitis. Clin Exp Dermatol, 1995; 20 (6): 462–467.
- Thompson R. J., Doran J. F., Jackson P., et al. PGP 9.5 – a new marker for vertebrate neurons and neuroendocrine cells. Brain Res, 1983; 278: 224–228.
- Pilmane M., Luts A., Sundler F. Changes in neuroendocrine elements in bronchial mucosa in chronic lung disease in adults. Thorax, 1995; 50: 551.
- Kahari V. M., Saarialho-Kere U. Matrix metalloproteinases in skin. Exp. Dermatol, 1997; 6: 199–213.
- Salo T., Makela M., Kylmaniemi M., et al. Expression of metalloproteinase-2 and -9 during early human wound healing. Lab Invest, 1994; 70: 176–182.
- Pyke C., Ralfkiaer F., Huhtala P., Hurskainen T., et al. Localization of messenger RNA for Mr 72,000 and 92,000 type IV collagenases in human skin cancers by in situ hybridization. Cancer Res, 1992; 52: 1336–1341.
- Yu A. E., Murphy A. N., Stetler-Stevenson W. G. 72-kDa gelatinase (gelatinase A): structure, activation regulation and substrate specificity. Matrix Metalloproteinases. Ed. by W. C. Parks, R. P. Mecham. New York: Academic Press, 1998; 85–113.
- Fleischmajer R., Kuroda K., Hazan R., et al. Basement Membrane Alterations in Psoriasis are Accompanied by Epidermal Overexpression of MMP-2 and its Inhibitor TIMP-2. J Invest Dermatol, 2000 Nov; 115 (5): 771–777.
- VEGF is likely a key factor in the link between inflammation and angiogenesis in psoriasis: results of an immunohistochemical study. Int. J. Immunopathol. Pharmacol., 2006; 19; 4: 751–760.
- Giannelli G., Erriquez R., Iannone F., et al. MMP-2, MMP-9, TIMP-1 and TIMP-2 levels in patients with rheumatoid arthritis and psoriatic arthritis. Clin Exp Rheumatol, 2004; 22 (3): 335–338.
- Vegfors J., Bivik C., Ekman A., et al. Psoriasin contributes to stress-induced angiogenesis in psoriasis. Journal of Investigative Dermatology, 2014; 134: 98–102.
- Young H. S., Summers A. M., Bhushan M., Brenchley P. E., et al. Single-nucleotide polymorphisms of vascular endothelial growth factor in psoriasis of early onset. J Invest Dermatol, 2004; 122: 209–215.
- Carvalho J. F., Blank M., Shoenfeld Y. Vascular endothelial growth factor (VEGF) in autoimmune diseases. J Clin Immunol, 2007; 27: 246–256.
- Creamer D., Allen M. H., Groves R. W., Barker J. N. Circulating vascular permeability factor/vascular endothelial growth factor in erythroderma. Lancet, 1996; 348: 1101.
- Bhushan M., McLaughlin B., Weiss J. B., Griffiths C. E. Levels of endothelial cell stimulating angiogenesis factor and vascular endothelial growth factor are elevated in psoriasis. Br. J. Dermatol., 1999; 141: 1054–1060.
- Creamer D., Sullivan D., Bicknell R., Barker J. Angiogenesis in psoriasis. Angiogenesis, 2002; 5: 231–236.
- Nielsen H. J., Christensen I. J., Svendsen M. N., Hansen U., et al. Elevated plasma levels of vascular endothelial growth factor and plasminogen activator inhibitor-1 decrease during improvement of psoriasis. Inflamm. Res., 2002; 51: 563–567.
- Braverman I. M., Sibley J. Role of the microcirculation in the treatment and pathogenesis of psoriasis. J. Invest. Dermatol., 1982; 78: 12–17.
- Detmar M., Brown L. F., Claffey K. P., Yeo K. T., et al. Overexpression of vascular permeability factor/vascular endothelial growth factor and its receptors in psoriasis. J Exp Med, 1994; 180: 1141–1146.
- Awata T., Inoue K., Kurihara S., Ohkubo T., et al. A common polymorphism in the 5’-untranslated region of the VEGF gene is associated with diabetic retinopathy in type 2 diabetes. Diabetes, 2002; 51: 1635–1639.
- Lambrechts D., Storkebaum E., Morimoto M., Del-Favero J., et al. VEGF is a modifier of amyotrophic lateral sclerosis in mice and humans and protects motoneurons against ischemic death. Nat Genet, 2003: 383–394.
- Detmar M. Evidence for vascular endothelial growth factor (VEGF) as a modifier gene in psoriasis. J Invest Dermatol, 2004: 122 (1): 14–15.
- Suzuki T., Hirakawa S., Shimauchi T., Ito T., et al. VEGF-A promotes IL-17A-producing γδ T cell accumulation in mouse skin and serves as a chemotactic factor for plasmacytoid dendritic cells. J Dermatol Sci, 2014; 74 (2): 116–124.
- Saraceno R., Kleyn C. E., Terenghi G., Griffith C. E. M. The role of neuropeptides in psoriasis. British Journal of Dermatology, 2006 154: 876–882.
- Johansson O., Han S. W., Enhamre A. Altered cutaneous innervation in psoriatic skin as revealed by PGP 9.5 immunohistochemistry. Arch Dermatol Res, 1991; 283: 519–523.
- El-Nour H., Santos A., Nordin M., Jonsson P., Svensson M., Nordlind K., Berg M. Neuronal changes in psoriasis exacerbation. J Eur Acad Dermatol Venereol, 2009 Nov; 23 (11):1240–1245
- Al’Abadie M. S., Senior H. J., Bleehen S. S., Gawkrodger D. J. Neuropeptides and general neuronal marker in psoriasis – an immunohistochemical study. Clin Exp Dermatol, 1995; 20: 384–389.
- Pergolizzi S., Vaccaro M., Magaudda L., et al. Immunohistochemical study of epidermal nerve fibers in involved and uninvolved psoriatic skin using confocal laser scanning microscopy. Arch Dermatol Res, 1998; 290: 483–489.