Riska faktori gastrointestinālā trakta kolonizācijai ar paplašināta spektra beta-laktamāzi producējošām enterobaktērijām ambulatoriem pacientiem ar čūlaino kolītu
Kopsavilkums
Multirezistentie mikroorganismi, kuri visbiežāk kolonizē iekaisīgo zarnu slimību (IZS) pacientu zarnu traktu, ir paplašināta spektra beta-laktamāzi producējošas enterobaktērijas (EPE). Bieža hospitalizācija, ambulatoro medicīnas iestāžu apmeklēšana, antibakteriālu un imūnmodulējošu līdzekļu lietošana var veicināt IZS pacientu kolonizāciju ar multirezistentiem mikroorganismiem.
Pētījuma mērķis bija noteikt iespējamos riska faktorus zarnu trakta kolonizācijai ar EPE ambulatoriem čūlainā kolīta (ČK) pacientiem.
Šķērsgriezuma pētījumā iekļauti ambulatorie pacienti, kas stacionēti Rīgas Austrumu klīniskajā universitātes slimnīcā (RAKUS) un Paula Stradiņa Klīniskajā universitātes slimnīcā no 2010. līdz 2015. gadam. Vizītes laikā veikta pacientu aptauja, paņemtas rektālās iztriepes. RAKUS Mikrobioloģijas laboratorijā identificētas EPE.
Pētījumā iekļauti 92 pacienti ar ČK, no tiem 43,5 % (n = 40) sievietes un 56,5 % (n = 52) vīrieši. Zarnu trakta kolonizācija ar EPE veidoja 12 % (n = 11). Tika izdalītas deviņas E. coli, viena K. oxytoca, viena E. hermannii EPE. No visiem ČK pacientiem 5 (5,4 %) lietoja antibiotikas rektālās iztriepes paņemšanas dienā, bet 40,2 % tās lietoja pēdējo 12 mēnešu laikā. 27,3 % pacientu, kuri bija kolonizēti ar EPE, lietoja antibiotikas, un 2,5 % pacientu, kuri nebija kolonizēti ar EPE, lietoja antibiotikas (p = 0,011). Ksenobiotiķu imūnsupresantus (budenozīdu, metilprednizolonu, azatioprīnu) lietoja 26,1 % (n = 24), un konstatēts, ka tie, kuri lietoja šos medikamentus pēdējo 12 mēnešu laikā, bija daudz biežāk kolonizēti ar EPE – 25 % (n = 6) nekā tie pacienti, kuri nelietoja šos medikamentus – 7,4 % (n = 5), (p = 0,032).
Pētījumā konstatēta augsta (12 %) ambulatoro ČK pacientu zarnu trakta kolonizācija ar EPE, visbiežāk izdalītā baktērija – E. coli. Pašreizēja antibiotiku lietošana un ksenobiotiķu imūnsupresantu lietošana pēdējo 12 mēnešu laikā konstatēti kā iespējami riska faktori ambulatoro ČK pacientu zarnu trakta kolonizācijai ar EPE. Nepieciešami papildu pētījumi, lai konstatētu, vai šīs izmaiņas ir pastāvīgas vai pārejošas, un vai tās saistītas ar zarnu mikrobiotas sastāvu.
Ievads
Iekaisīgās zarnu slimības (IZS) skar nozīmīgu pasaules iedzīvotāju daļu – vairāk nekā 2,2 miljonus iedzīvotāju Eiropā un vairāk nekā 5 miljonus iedzīvotāju visā pasaulē. Viena no biežāk sastopamajām IZS ir čūlainais kolīts (ČK), ko raksturo hronisks iekaisums resnajā zarnā un kas galvenokārt skar pieaugušos 30–40 gadu vecumā. Katru gadu tiek diagnosticēti 1–20 jauni gadījumi uz 100 000 iedzīvotāju, un sastopamība vēl joprojām turpina pieaugt. Vislielākā ČK sastopamība tiek novērota Ziemeļeiropā (24,3 / 100 000), Kanādā (19,2 / 100 000) un Austrālijā (14,4 / 100 000) (ClinicalKey, n. d.; Conrad et al., 2014; Harlan et al., 2016; Burisch and Munkholm, 2013 (Tham, n. d.; Ordás et al. 2012).
Salīdzinot ar vispārējo populāciju, ČK pacienti tiek biežāk stacionēti, un tiem biežāk nepieciešams saņemt imūnsupresīvos medikamentus. Apmēram 20 % hospitalizēto ČK pacientu gada laikā būs nepieciešama atkārtota stacionēšana. Bieža hospitalizācija, ambulatoro medicīnas iestāžu apmeklēšana, antibakteriālu un imūnmodulējošo līdzekļu lietošana var veicināt IZS pacientu kolonizāciju ar multirezistentiem mikroorganismiem (Leung et al., 2012). Pēc literatūras datiem multirezistentie mikroorganismi, kuri visbiežāk kolonizē IZS pacientu zarnu traktu, ir paplašināta spektra beta-laktamāzi (extended spectrum beta-lactamase – ESBL) producējošas enterobaktērijas (EPE) (Vaisman et al., 2013).
Sakarā ar biežu antibakteriālo līdzekļu lietošanu gan slimnīcās, gan ambulatori pasaulē katru gadu pieaug infekciju un kolonizāciju skaits ar EPE. Tā ir milzīga problēma, jo infekcijas ar EPE palielina pacientu saslimstību un mirstību (Brolund, 2014; Coque et al., 2008; Peralta et al., 2012; Pfeifer et al., 2010; Shaikh et al., 2015; Skippen et al., 2006). Infekcijas un kolonizācijas ar EPE riska faktori vispārējā populācijā ir bieža un ilgstoša hospitalizācija, smagas slimības, antibakteriālu un imūnsupresīvu medikamentu lietošana, atrašanās intensīvās terapijas nodaļā, venozo un arteriālo katetru ievietošana, urīnpūšļa katetra ievietošana un atrašanās aprūpes iestādē (NEJM, n. d.; Cordery et al., 2008; Laupland et al., 2008; Ministry of Health Malaysia, 2001; Skippen et al., 2006; Tham et al., 2013). Aizvien biežāk tiek ziņots par ceļotāju kolonizāciju ar EPE, īpaši ceļojot uz Austrumu valstīm. Ceļošana ir identificēta kā viens no nozīmīgākajiem riska faktoriem EPE iegūšanai (Lübbert et al., 2015; Tham et al., 2013; Woerther et al., 2013). Faktori, kas paaugstina kolonizācijas risku ar EPE: ceļojuma galamērķis EPE izplatības riska zonā, diareja un antibiotiku lietošana ceļojuma laikā (Barreto Miranda et al., 2016; Kantele et al., 2016; Reuland et al., 2016). Pacienta kolonizācija ar multirezistentiem mikroorganismiem ir infekcijas attīstības riska faktors, savukārt infekcijas ar multirezistentiem mikroorganismiem ir saistītas ar ilgāku hospitalizācijas laiku, lielākām izmaksām un augstāku mirstību (Brolund, 2014; Vaisman et al., 2013; Wehkamp et al., 2016).
Lai identificētu IZS pacientu riska faktorus gastrointestinālā trakta kolonizācijai ar EPE, pasaulē veikti vien divi pētījumi, kuros kā riska faktori konstatēti hospitalizācija pēdējo 12 mēnešu laikā, ārstēšana ar antibiotikām pēdējo trīs vai 12 mēnešu laikā un ārstēšana ar vankomicīnu vai cefalosporīniem. Šajos pētījumos atklājās, ka visus vispārējās populācijas riska faktorus nevar attiecināt uz IZS pacientu populāciju un nepieciešami papildu pētījumi tieši IZS jomā (Leung et al., 2012; Vaisman et al., 2013).
Tāpat ČK un EPE sastopamība dažādos pasaules reģionos un valstīs ir ļoti atšķirīga. Mainīgi un reģionam specifiski ir arī EPE kolonizācijas riska faktori. Lai noteiktu problēmas aktualitāti un nozīmi konkrētā reģionā, būtu svarīgi noskaidrot ČK pacientu kolonizācijas ar EPE izplatību un iespējamos ar kolonizāciju saistītos riska faktorus atsevišķi katrā valstī un reģionā. Līdz šim pētījumi veikti tikai Kanādā un ASV. Līdzīgi pētījumi nav veikti Eiropas valstīs, tai skaitā arī Latvijā.
Pēc jaunākajiem literatūras datiem ČK etiopatoģenēzē liela nozīme ir normālās mikrobiotas izmaiņām un epitēlija barjeras defektiem. ČK pacientiem veidojas neadekvāta imūnsistēmas atbilde pret endogēno normālo mikrobiotu (Bamias et al., 2005; Conrad et al., 2014; Guarner et al., 2003; Ohkusa and Koido, 2015; Wehkamp et al., 2016). EPE kolonizācijas faktoram varētu būt liela nozīme arī slimības patoģenēzē – attīstības un slimības smaguma noteikšanā.
Darba mērķis
Noteikt iespējamos riska faktorus zarnu trakta kolonizācijai ar paplašināta spektra beta-laktamāzi producējošām enterobaktērijām (EPE) ambulatoriem ČK pacientiem.
Materiāls un metodes
Pētījuma dizains. Šķērsgriezuma pētījums veikts Rīgas Austrumu klīniskās universitātes slimnīcas (RAKUS) stacionāra “Gaiļezers” Gastroenteroloģijas, hepatoloģijas un nutrīcijas klīnikā laikā no 2015. gada septembra līdz 2016. gada septembrim.
Pacientu atlase. Slimnīcas medicīniskās dokumentācijas arhīvā tika identificēti pacienti ar čūlainā kolīta diagnozi, kas stacionēti RAKUS un Paula Stradiņa Klīniskajā universitātes slimnīcā (PSKUS) pēdējo sešu gadu laikā – no 2010. līdz 2015. gadam.
Pacienti tika izvērtēti pēc ieslēgšanas un izslēgšanas kritērijiem. Atlasītie pacienti tika aicināti uz pētījuma vizīti RAKUS stacionāra “Gaiļezers” Gastroenteroloģijas, hepatoloģijas un nutrīcijas klīnikā.
Iekļaušanas kritēriji:
- ambulatori pacienti ar klīniski, endoskopiski un histoloģiski pierādītu ČK diagnozi;
- pacienta vecums – 18–80 gadi;
- pacients brīvprātīgi piekrīt piedalīties pētījumā un paraksta piekrišanas veidlapu.
Izslēgšanas kritēriji:
- pacients ir jaunāks par 18 gadiem vai vecāks par 80 gadiem;
- pacients ar nediferencētu kolītu;
- pacients ar mikroskopisku kolītu;
- pacients ar Krona slimību;
- pacienti pēc kolektomijas – ar stomu vai ileālo maisiņu (angļu val. pouch);
- pacients, kuram ČK diagnoze nav apstiprināta klīniski, endoskopiski vai histoloģiski.
Pētījuma vizīte RAKUS stacionārā “Gaiļezers”. Vizītes laikā tika veikta pacientu aptauja, iekļaujot informāciju par demogrāfiskajiem datiem, slimības ilgumu, smaguma pakāpi un iespējamiem riska faktoriem zarnu trakta kolonizācijai ar EPE. Pēc aptaujas transporta barotnē tika iegūts rektālās iztriepes materiāls un nogādāts RAKUS Laboratoriskās medicīnas centra Mikrobioloģijas laboratorijā.
Riska faktori kuņģa un zarnu trakta kolonizācijai ar EPE. Pētījumā tika noteikti šādi ČK zarnu trakta kolonizācijas ar EPE riska faktori: dzimums, vecums, smēķēšana, antibiotiku lietošana rektālās iztriepes paņemšanas dienā, antibiotiku lietošana pēdējo 12 mēnešu laikā, hospitalizācija, autoimūnās slimības, imūnsupresīvo medikamentu, protonu sūkņu inhibitoru lietošana pēdējo 12 mēnešu laikā, operācijas un ceļošana uz ārzemēm pēdējo 12 mēnešu laikā.
EPE bakterioloģiskā analīze. Rektālās iztriepes bakterioloģiskajai analīzei tika iegūtas Amies (Oxoid, UK) transporta barotnē un 24 stundu laikā nogādātas RAKUS Laboratoriskās medicīnas centra Mikrobioloģijas laboratorijā. Mikrobioloģiskā testēšana tika veikta divos soļos – selektīva EPE kultivēšana un izdalīto baktēriju identifikācija. Fēču biomateriāla primārai kultivēšanai, selektīvi izolējot EPE, izmantotas Brilliance TM ESBL (Oxoid, UK) skrīninga plates. Visas izolētās baktērijas tika identificētas ar Vitek 2 Compact system (bioMerieux, Francija). ESBL izdalīšana tika apstiprināta, izmantojot sinerģijas testu ESBL un Amp-C inhibējošos diskus (Rosco, Dānija), vadoties pēc EUCAST vadlīnijām (EUCAST, n. d.).
Datu apstrāde. Pēc oriģināla pētījuma protokola izveidota datu bāze Microsoft Office Excel programmā. Datu statistiskā apstrāde veikta IBM SPSS Statistics programmā, izmantojot neparametriskos statistikas testus – Manna–Vitnija (Mann–Whitney) U testu un Fišera (Fisher) tiešo testu. Par statistiski nozīmīgu tika pieņemts p < 0,05.
Rezultāti
Pētījumā tika iekļauti 92 pacienti ar ČK, no kuriem 43,5 % (n = 40) bija sievietes un 56,5 % (n = 52) bija vīrieši. Pacientu vidējais vecums bija 44,28 (SD = 15,52) gadi. Pacientu vidējais ČK slimības anamnēzes ilgums bija 6,55 (SD = 5,77) gadi. Pēc Monreālas klasifikācijas 66,3 % (n = 61) pacientu bija remisija, 18,5 % (n = 17) bija viegla slimības gaita, 14,1 % (n = 13) bija vidēji smaga un 1,1 % (n = 1) – smaga slimības gaita.
Pēc aptaujas datiem noskaidrots, ka 41,3 % (n = 38) pacientu nekad nav smēķējuši, 37 % (n = 34) smēķēja agrāk, bet tagad to ir atmetuši, un 21,7 % (n = 20) pacientu ir aktīvi smēķētāji.
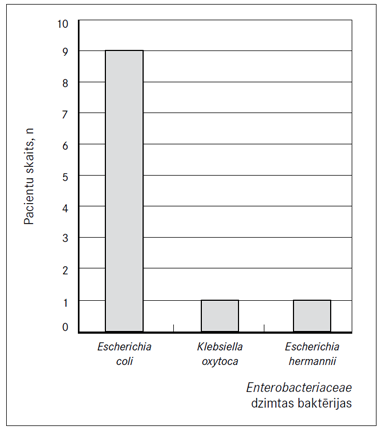
Pētījumā tika konstatēts, ka ESBL producējošās enterobaktērijas kolonizē ČK pacientu zarnu traktu 12 % (n = 11) gadījumu. Izolētās ESBL producējošās enterobaktērijas galvenokārt iekļāva Escherichia coli (n = 9; 81,80 %) (1. attēls).
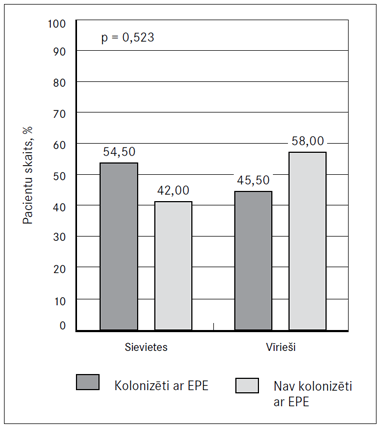
Netika atrasta statistiski ticama (p = 0,523) atšķirība starp pacienta dzimumu un zarnu trakta kolonizāciju ar EPE (2. attēls).
1. attēls. Izolētās ESBL producējošās Enterobacteriaceae dzimtas baktērijas | 2. attēls. Čūlainā kolīta pacientu dzimums un kolonizācija ar enterobaktērijām (EPE) |
|
|
Pētījumā netika atrasta statistiski nozīmīga sakarība starp vidējo vecumu pacientiem, kuru zarnu trakts bija (44,95 (SD = 15,14) gadi) un nebija (39,36 (SD = 18,10) gadi) kolonizēts ar EPE (p = 0,145). Statistiskā datu apstrāde neuzrādīja statistiski nozīmīgu saistību (p = 0,939) starp smēķēšanu un pacientu kolonizāciju ar EPE (3. attēls).
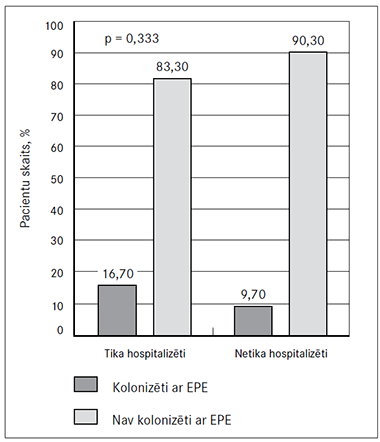
Pēdējo 12 mēnešu laikā tika hospitalizēti 32,6 % (n = 30) pacientu. Netika atrasta (p = 0,333) statistiski nozīmīga saistība starp hospitalizāciju pēdējo 12 mēnešu laikā un pacientu kolonizāciju ar EPE (4. attēls).
3. attēls. Čūlainā kolīta pacientu smēķēšanas ieradumi un kolonizācija ar enterobaktērijām (EPE)
Ulcerative colitis patients smoking habits and gut colonization with EPE

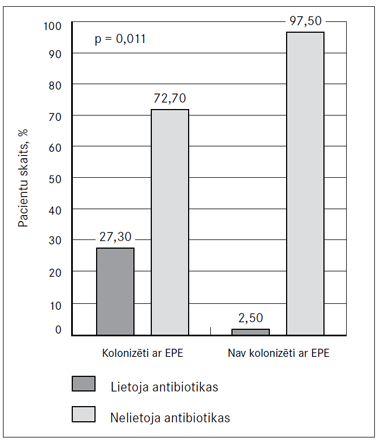
Pētījumā konstatēts, ka no visiem ČK pacientiem 87 (94,6 %) intervijas dienā nelietoja antibakteriālos līdzekļus, bet 5 (5,4 %) – lietoja. Pastāv statistiski nozīmīga atšķirība (p = 0,011) starp zarnu trakta kolonizāciju ar EPE pacientiem, kas lietoja antibakteriālos līdzekļus rektālās iztriepes paņemšanas dienā, un pacientiem, kas nelietoja (5. attēls).
4. attēls. Pacientu hospitalizācija pēdējo 12 mēnešu laikā un kolonizācija ar enterobaktērijām (EPE) | 5. attēls. Antibakteriālo līdzekļu lietošana rektālās iztriepes paņemšanas dienā un kolonizācija ar enterobaktērijām (EPE) |
|
|
6. attēls. Antibakteriālo līdzekļu lietošana pēdējo 12 mēnešu laikā un kolonizācija ar enterobaktērijām (EPE) | 7. attēls. Ksenobiotiķu imūnsupresīvo medikamentu lietošana un kolonizācija ar enterobaktērijām (EPE) |
|
|
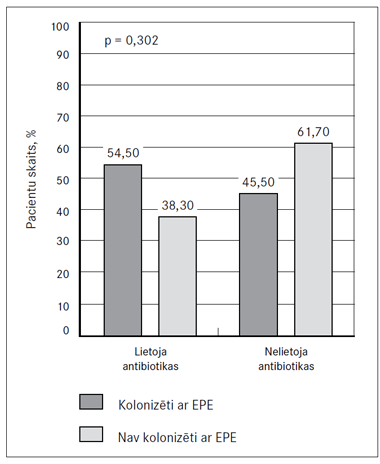
Antibakteriālos līdzekļus pēdējo 12 mēnešu laikā lietoja 40,2 % (n = 37) pacientu. Netika atrasta statistiski nozīmīga saistība (p = 0,302) starp antibakteriālo līdzekļu lietošanu pēdējo 12 mēnešu laikā un pacientu kolonizāciju ar EPE (6. attēls).
Autoimūnās slimības tika konstatētas 10,9 % (n = 10) pacientu un 2. tipa cukura diabēts – 3,3 % (n = 3) pacientu. Nevienam pacientam, kura zarnu trakts bija kolonizēts ar EPE, netika noteiktas šīs slimības, tādēļ tās nevar uzskatīt par iespējamu riska faktoru zarnu trakta kolonizācijai ar EPE.
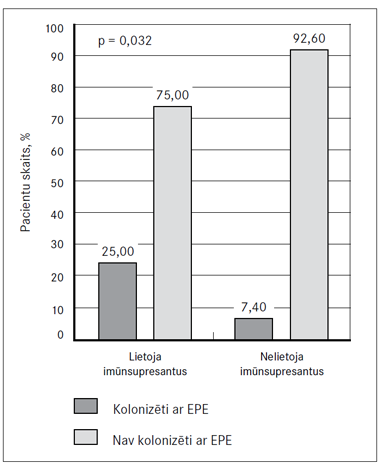
Imūnsupresīvo terapiju, iekļaujot budenozīdu, metilprednizolonu, azatioprīnu un infliksimabu, pēdējo 12 mēnešu laikā lietoja 28,3 % (n = 26) pacientu. No tiem ksenobiotiķu imūnsupresīvos medikamentus (budenozīdu, metilprednizolonu, azatioprīnu) lietoja 26,1 % (n = 24) pacientu (7. attēls). Pastāv statistiski nozīmīga sakarība (p = 0,032) starp ksenobiotiķu imūnsupresantu lietošanu un zarnu trakta kolonizāciju ar EPE. Šādas atšķirības netika novērotas starp pacientiem, kuri lietoja un nelietoja bioloģiskos imūnsupresantus (infliksimabu) (p = 0,226).
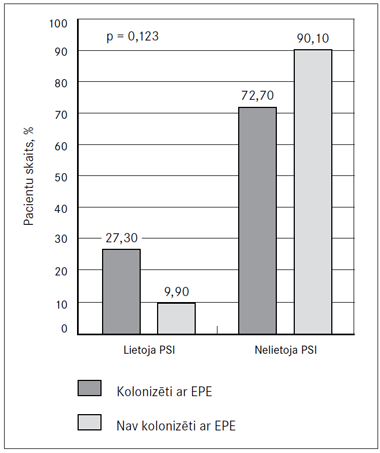
Protonu sūkņu inhibitorus (PSI) lietoja 12 % (n = 11) ČK pacientu. Netika atrasta savstarpēja saistība (p = 0,123) starp protonu sūkņu inhibitoru lietošanu un pacientu kolonizāciju ar EPE (sk. 8. att.).
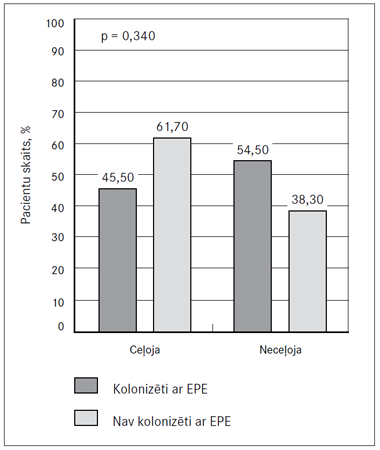
Pēdējo 12 mēnešu laikā uz ārvalstīm ceļoja 59,8 % pacientu (n = 55). Starp starptautisku ceļošanu pēdējo 12 mēnešu laikā un pacientu kolonizāciju ar ESBL producējošām enterobaktērijām nepastāv statistiski ticama (p = 0,34) sakarība (9. attēls).
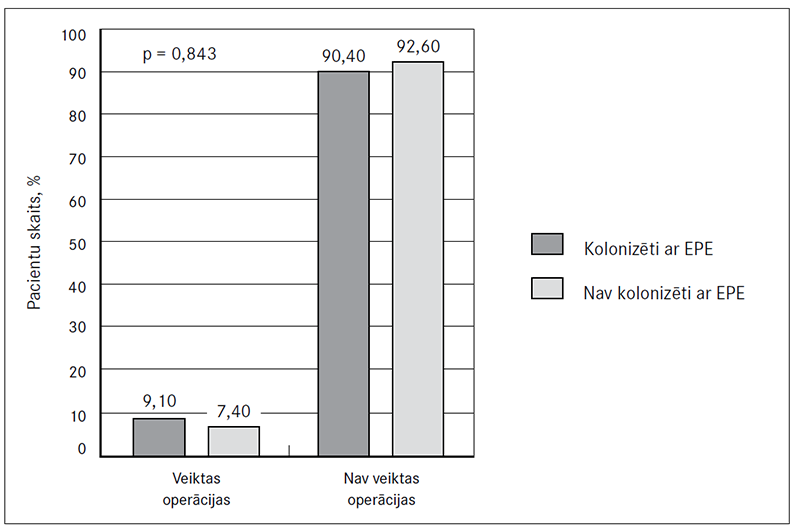
Pēdējo 12 mēnešu laikā operācijas tika veiktas 7,6 % (n = 7) pacientu. Netika atrastas statistiski ticamas (p = 0,843) sakarības starp veiktajām operācijām pēdējo 12 mēnešu laikā un pacientu kolonizāciju ar EPE (10. attēls).
8. attēls. Protonu sūkņu inhibitoru (PSI) lietošana pēdējo 12 mēnešu laikā un kolonizācija ar enterobaktērijām (EPE) | 9. attēls. Ceļojumi uz ārzemēm pēdējo 12 mēnešu laikā un kolonizācija ar enterobaktērijām (EPE) |
|
|
10. attēls. Operācijas pēdējo 12 mēnešu laikā un kolonizācija ar enterobaktērijām (EPE)
Surgical procedures during the past 12 months and gut colonization with EPE
Diskusija
Infekcija un kolonizācija ar EPE ir aktuāla un nozīmīga problēma visā pasaulē, kas turpina pieaugt. Skaidri zināms, ka infekcija un kolonizācija ar EPE paildzina hospitalizāciju, paaugstina izmaksas, palielina komplikāciju skaitu un mirstību (Brolund, 2014; Kassakian and Mermel, 2014; Vaisman et al., 2013; Wehkamp et al., 2016). Problēmu rada tas, ka šie mikroorganismi ir multirezistenti pret vairākām antibiotiku grupām un ir grūti izvēlēties efektīvāko empīrisko antibakteriālo terapiju EPE infekciju ārstēšanai (Kassakian and Mermel, 2014; Tham, 2013).
Zinātnisko pētījumu datu bāzēs nav atrodami ziņojumi par ČK kolonizāciju ar EPE Eiropas valstīs, bet līdzīgi rezultāti iegūti Kanādas un ASV pētījumā par ambulatoriem ČK pacientiem. Tajā kolonizācija konstatēta 11,1 % gadījumu, savukārt pētījumā par kolonizācijas izplatību hospitalizētu ČK pacientu vidū tā konstatēta tikai 4,1 % gadījumu (Leung et al., 2012; Vaisman et al., 2013). Šajā Latvijā veiktajā pētījumā konstatēts, ka 12 % ambulatoro čūlainā kolīta pacientu kolonizēti ar EPE. Vispārējās populācijas kolonizācija Eiropā ir vien 4 %, kas iezīmē problēmas aktualitāti un iespējamo nozīmi slimības attīstībā tieši ČK pacientu populācijā. Var teikt, ka pētījumā iekļautajiem pacientiem, salīdzinot ar literatūras datiem un vispārējo populāciju, ir augsta kolonizācijas izplatība, un tas liecina, ka arī Latvijā ČK pacientu kolonizācija ar EPE ir nozīmīga un aktuāla problēma.
Vispārējā populācijā visbiežāk izdalītās baktērijas ambulatoriem pacientiem ir E. coli un K. pneumoniae (Coque et al., 2008; Kassakian and Mermel, 2014). Vienā no pētījumiem par ČK pacientu kolonizāciju ar EPE tika aprakstīts, ka 82 % gadījumu tika izdalītas E. coli, 9 % – K. pneumoniae un 9 % – P. mirabilis baktērijas (Leung et al., 2012). Līdzīgi rezultāti ir atrodami mūsu pētījumā – E. coli bija visbiežāk izdalītā baktērija un bija 81,8 %. Pārējās baktērijas (K. oxytoca un E. hermannii) citos līdzīgos pētījumos netika izdalītas. Tas, iespējams, ir saistīts ar reģionālām atšķirībām, jo izdalītie baktēriju celmi katrā valstī un reģionā atšķiras (Brolund, 2014; Coque et al., 2008).
Citu slimību populācijās ir veikti vairāki pētījumi, lai noskaidrotu kolonizācijas un infekcijas izplatību kā arī lai identificētu izdalītās baktērijas un noskaidrotu šo baktēriju iegūšanas riska faktorus (Cordery et al., 2008; Mehrgan and Rahbar, 2008; Spanu et al., 2002). EPE kolonizācija IZS pacientu populācijā ir maz pētīta, un šai pacientu grupai nav arī skaidri definētu kolonizācijas riska faktoru. Svarīgi ir noskaidrot iespējamos riska faktorus un laicīgi apzināt kolonizāciju, jo tā palielina infekcijas attīstības risku un, iespējams, arī ietekmē ČK slimības smagumu.
Pētījumā tika analizēti vairāki iespējamie EPE kolonizācijas riska faktori, t. sk. vecums, dzimums, smēķēšana, antibiotiku lietošana aptaujas dienā, autoimūnās slimības, antibiotiku, imūnsupresīvo medikamentu un protonu sūkņu inhibitoru lietošana pēdējo 12 mēnešu laikā, hospitalizācija, starptautiska ceļošana un operācijas pēdējo 12 mēnešu laikā, bet statistiski nozīmīga sakarība kolonizācijai ar EPE tika novērota tikai tiem pacientiem, kuri pēdējo 12 mēnešu laikā lietoja ksenobiotiķu imūnsupresantus (budenozīdu, metilprednizolonu, azatioprīnu), un tiem, kuri rektālās iztriepes paņemšanas dienā lietoja antibakteriālos līdzekļus. Citos pētījumos ar IZS pacientiem kā iespējamie zarnu trakta kolonizācijas riska faktori ar EPE tika identificēti: hospitalizācija pēdējo 12 mēnešu laikā, antibakteriālu līdzekļu lietošana pēdējo trīs vai 12 mēnešu laikā, iepriekšēja ārstēšana ar vankomicīnu vai cefalosporīniem, kā arī antibakteriālu līdzekļu lietošana hospitalizācijas dienā (Leung et al., 2012; Vaisman et al., 2013).
Pārējie iespējamie zarnu trakta kolonizācijas riska faktori ar EPE ņemti no vispārējās populācijas datiem. Piemēram, vispārējās populācijas pacientiem, kuriem pirms stacionēšanas slimnīcā veikts skrīnings, lai pārbaudītu kolonizāciju ar EPE, noteikts, ka antibiotiku lietošana, hroniska nieru mazspēja un aknu slimība ir riska faktori kolonizācijai (Ben-Ami et al., 2006). Amsterdamas pētījumā ar vispārējās populācijas pacientiem konstatēts, ka antibiotiku lietošana pēdējo 12 mēnešu laikā ir riska faktors kolonizācijai ar EPE (Reuland et al., 2016).
Salīdzinot šajā pētījumā apskatītos iespējamos riska faktorus ar statistiski nozīmīgiem riska faktoriem citos līdzīgos pētījumos, atklājās, ka kopīgs riska faktors ir tikai antibakteriālo līdzekļu lietošana rektālās iztriepes paņemšanas dienā. Imūnsupresantu terapija IZS pacientiem ir pētīta iepriekš, bet nav apstiprinājusies kā riska faktors (Leung et al., 2012). Savukārt šajā pētījumā atrasta statistiski ticama sakarība starp ČK pacientu zarnu trakta kolonizāciju ar EPE un ksenobiotiķu imūnsupresantu lietošanu, bet tā neuzrāda, ka bioloģisko preparātu lietošana varētu veicināt kolonizāciju. Šādas rezultātu atšķirības varētu būt iespējamas, jo Kanādas pētījumos bija aprakstīta lielāka IZS populācija un konstatēts lielāks pacientu skaits, kuru zarnu trakts kolonizēts ar EPE.
Vispārējā populācijā noteikts, ka vīrieša dzimums vērtējams kā riska faktors infekcijai un kolonizācijai ar EPE (Ben-Ami et al., 2006; Nakai et al., 2016). Šajā pētījumā kolonizācija ar EPE bija vienlīdz bieži sastopama gan sievietēm, gan vīriešiem, kas liecina, ka ČK pacientu kolonizācijai ar EPE un dzimumam nav saistības.
Ļoti plaši tiek aprakstīta cilvēku zarnu trakta kolonizācija ar EPE pēc atgriešanās no starptautiskiem ceļojumiem (Barreto Miranda et al., 2016; Kantele et al., 2016; Reuland et al., 2016). Kolonizācija ir atkarīga no ceļojuma galamērķa un uzturēšanās ilguma. Āzijas valstīs EPE izplatība sasniedz 70 %, savukārt Eiropā tā ir zem 10 % (Barreto Miranda et al., 2016). Ziņots, ka visbiežāk tiek kolonizēti cilvēki, kuri atgriežas no Āzijas valstīm un Indijas, un nēsāšana zarnu traktā ilgst līdz sešiem mēnešiem un pat ilgāk (Barreto Miranda et al., 2016; Reuland et al., 2016). Šajā pētījumā kā iespējamais riska faktors iekļauta ceļošana uz ārvalstīm, bet tas netika pierādīts kā viens no kolonizācijas ar EPE veicinātājiem. Iespējams, šis faktors nav predisponējošs, jo EPE nēsāšanas ilgums zarnu traktā pēc atgriešanās no ceļojuma katram cilvēkam ir individuāls un visiem ceļotājiem rektālās iztriepes netika ņemtas vienā laikā pēc ceļojumiem.
Ziņots, ka protonu sūkņu inhibitoru lietošana IZS pacientiem veicina zarnu trakta kolonizāciju ar Methicillin-resistant Staphylococcus aureus (MRSA) (Leung et al., 2012; Vaisman et al., 2013). Pētījumā, kurā pacientiem pirms stāšanās slimnīcā tika veikts skrīnings, lai izmeklētu EPE nēsāšanu fēcēs, noteikts, ka histamīna otrā tipa receptoru blokatoru (H2RB) lietošana ir nozīmīgs kolonizācijas un nēsāšanas riska faktors. Amsterdamā vispārējās populācijas pieaugušiem cilvēkiem tika veikts skrīnings, lai pārbaudītu kolonizāciju ar EPE, un pētījuma ietvaros tika konstatēts, ka PSI vai H2RB lietošana veicina šo kolonizāciju (Reuland et al., 2016a). Kā potenciāls riska faktors tika pētīta arī PSI lietošana pēdējā gada laikā, tomēr netika atrasta sakarība starp PSI lietošanu un zarnu trakta kolonizāciju ar EPE. Šie dati liecina, ka ČK pacientiem kuri lieto PSI, iespējams, varētu būt vēl kāds nenoskaidrots faktors vai mehānisms, kas novērš vai veicina kolonizāciju ar EPE.
Šo pētījumu būtu svarīgi turpināt un palielināt pētāmo pacientu grupu, lai, izmantojot relatīvā riska aprēķināšanu, precīzi pierādītu jau pētītos kolonizācijas riska faktorus un, veidojot kontroles grupu, atklātu jaunus potenciālos riska faktorus zarnu trakta kolonizācijai ar EPE. Nepieciešams noskaidrot, vai konstatētie riska faktori nosaka pastāvīgu vai pārejošu zarnu trakta kolonizāciju ar EPE un vai pastāv kādas pārmaiņas mikrobiomā. Tas ļautu veikt turpmākus pētījumus, lai rastu risinājumus kolonizācijas novēršanai, tā mazinot EPE infekcijas pārnešanas un attīstības risku.
Secinājumi
- Pētījumā konstatēta augsta (12 %) ambulatoro čūlainā kolīta pacientu zarnu trakta kolonizācija ar paplašināta spektra beta-laktamāzi producējošām enterobaktērijām, salīdzinot ar hospitalizētiem čūlainā kolīta pacientiem un vispārējo populāciju, ko raksturo literatūrā pieejamie dati.
- Čūlainā kolīta pacientu zarnu traktu visbiežāk kolonizē paplašināta spektra beta-laktamāzi producējošas Escherichia coli ģints baktērijas, kas atbilst literatūras datiem, iezīmējot kopīgas īpašības ar citiem EPE kolonizāciju gadījumiem.
- Antibiotiku lietošana rektālās iztriepes paņemšanas dienā un ksenobiotiķu imūnsupresantu (budenozīda, metilprednizolona, azatioprīna) lietošana pēdējo 12 mēnešu laikā konstatēti kā iespējamie riska faktori ambulatoro čūlainā kolīta pacientu zarnu trakta kolonizācijai ar EPE.
- Pētījumu nepieciešams turpināt un paplašināt, iekļaujot lielāku čūlainā kolīta pacientu skaitu un kontroles grupu, lai apstiprinātu esošos un apzinātu jaunus kolonizācijas riska faktorus. Nepieciešams noskaidrot, vai konstatētie riska faktori nosaka pastāvīgu vai pārejošu zarnu trakta kolonizāciju ar EPE un vai pastāv kādas pārmaiņas mikrobiomā. Turpmāki pētījumi ļautu identificēt labākās novēršanas metodes mikroorganismu tālākai izplatībai un EPE infekcijas attīstības novēršanai.
Abstract
Risk Factors for Gut Colonisation with Extended-Spectrum Beta-Lactamase Producing Enterobacteriaceae in Ambulatory Ulcerative Colitis Patients
The most common multiresistant microorganisms that colonise gastrointestinal tract of inflammatory bowel disease (IBD) patients are extended spectrum beta lactamase producing Enterobacteriaceae (EPE). Frequent hospitalisations, visits to out-patient institutions and usage of antibacterial and immunosuppressive medications can promote IBD patient colonisation with multiresistant microorganisms.
The aim of the study was to determine possible risk factors for gut colonisation with EPE in ambulatory ulcerative colitis (UC) patients.
A cross-sectional study was conducted in Riga East Clinical University Hospital (RECUH) analysing patients that were previously hospitalised in RECUH and Pauls Stradiņš Clinical University Hospital during a 6-year period (2010–2015). Patients were asked to participate in outpatient interviews, rectal swabs were obtained, bacteria were cultured and analysed for ESBL presence.
A total of 92 patients with confirmed UC diagnosis, 56.5 % (n = 52) male and 43.5 % (n = 40) female patients, were included in the study. EPE colonisation was found in 12 % (n = 11) of the cases. Isolated EPE included nine E. coli, one K. oxytoca and one E. hermannii. We found that 5.4 % (n = 5) of the patients used antibiotics at the time of testing and 40.2 % (n = 37) of the patients had used antibiotics during the past 12 months. From patients who were taking antibiotics at the time of testing, 27.3 % were colonised with EPE, but 2.5 % were not colonised (p = 0.011). Patients who were taking xenobiotic immunosuppressant (budesonide, methylprednisolone, azathioprine) during the past 12 months were more frequently colonised with EPE – 25 % (n = 6), comparing to patients who were not taking these medications 7.4 % (n = 5), (p = 0.032).
The study shows a high prevalence of EPE in UC patients – 12 %. Most frequently isolated EPE was E. coli. Current antibiotic use and xenobiotic immunosuppressant administration in the past 12 months might be risk factors for gut colonisation with EPE in ambulatory UC patients. The study should be continued to evaluate whether colonisation is permanent or temporary and if it has an association with the gut microbiota.
Literatūra
- Bamias, G., Nyce, M. R., De La Rue, S. and Cominelli, F. 2005. New concepts in the pathophysiology of inflammatory bowel disease. Review. Ann Intern Med. 143, 895–904. Iegūts no: doi:10.7326/0003-4819-143-12-200512200-00007
- Barreto Miranda, I. D. M., Ignatius, R. P. D. M., Pfuller, R. D. M. et al. 2016. High carriage rate of ESBL-producing Enterobacteriaceae at presentation and follow-up among travellers with gastrointestinal complaints returning from India and Southeast Asia. J Travel Med. 23, 1–7. Iegūts no: doi:10.1093/jtm/tav024
- Ben-Ami, R., Schwaber, M. J., Navon-Venezia, S. et al. 2006. Influx of extended-spectrum beta-lactamase-producing Enterobacteriaceae into the hospital. Clin. Infect. Dis. 42, 925–934. Iegūts no: doi:10.1086/500936
- Brolund, A. 2014. Overview of ESBL-producing Enterobacteriaceae from a Nordic perspective. Infect. Ecol. Epidemiol. 4. Iegūts no: doi:10.3402/iee.v4.24555
- Burisch, J. and Munkholm, P. 2013. Inflammatory bowel disease epidemiology. Curr. Opin. Gastroenterol. 29, 357–62. Iegūts no: doi:10.1097/MOG.0b013e32836229fb
- ClinicalKey. 2012. Ulcerative colitis and ulcerative proctitis. Iegūts no: https://www-clinicalkey-com.db.rsu.lv/#!/content/medical_topic/21-s2.0-1017692?scrollTo=%23heading3 (sk. 02.26.2017.).
- Conrad, K., Roggenbuck, D. and Laass, M. W. 2014. Diagnosis and classification of ulcerative colitis. Autoimmun. Rev. 13, 463–466. Iegūts no: doi:10.1016/j.autrev.2014.01.028
- Coque, T. M., Baquero, F. and Canton, R. 2008. Increasing prevalence of ESBL-producing Enterobacteriaceae in Europe. Euro Surveill. 13, 1–11. Iegūts no: doi:10.1128/AAC.49.7.2693-2700.2005
- Cordery, R. J., Roberts, C. H., Cooper, S. J. et al. 2008. Evaluation of risk factors for the acquisition of bloodstream infections with extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella species in the intensive care unit; antibiotic management and clinical outcome. J. Hosp. Infect. 68, 108–115. Iegūts no: doi:10.1016/j.jhin.2007.10.011
- EUCAST. n. d. Resistance mechanisms. Iegūts no: http://www.eucast.org/resistance_mechanisms/ (sk. 12.02.2015.).
- Guarner, F., Malagelada, J-R., Simon, G. et al. 2003. Gut flora in health and disease. Lancet. 361, 512–519. Iegūts no: doi:10.1016/S0140-6736(03)12489-0
- Harlan, W. R., Meyer, A. and Fisher, J. 2016. Inflammatory bowel disease: Epidemiology, evaluation, treatment, and health maintenance. N. C. Med. J. 77, 198–201. Iegūts no: doi:10.18043/ncm.77.3.198
- Jacoby, G. A., Munoz-Price L. S. 2005. The new beta-lactamases. N Engl J Med. Iegūts no: doi:10.1056/NEJMra041359
- Kantele, A., Mero, S., Kirveskari, J. and Lääveri, T. 2016. Increased risk for ESBL-producing bacteria from co-administration of loperamide and antimicrobial drugs for travelers’ diarrhea. Emerg. Infect. Dis. 22, 117–120. Iegūts no: doi:10.3201/eid2201.151272
- Kassakian, S. Z. and Mermel, L. A. 2014. Changing epidemiology of infections due to extended spectrum beta-lactamase producing bacteria. Antimicrob. Resist. Infect. Control. 3, 9. Iegūts no: doi:10.1186/2047-2994-3-9
- Laupland, K. B., Gregson, D. B., Church, D. L. et al. 2008. Incidence, risk factors and outcomes of Escherichia coli bloodstream infections in a large Canadian region. Clin. Microbiol. Infect. 14, 1041–1047. Iegūts no: doi:10.1111/j.1469-0691.2008.02089.x
- Leung, W., Malhi, G., Willey, B. M. et al. 2012. Prevalence and predictors of MRSA, ESBL, and VRE colonization in the ambulatory IBD population. J. Crohns Colitis. 6, 743–9. Iegūts no: doi:10.1016/j.crohns.2011.12.005
- Lübbert, C., Straube, L., Stein, C. et al. 2015. Colonization with extended-spectrum beta-lactamase-producing and carbapenemase-producing Enterobacteriaceae in international travelers returning to Germany. Int. J. Med. Microbiol. 305, 148–156. Iegūts no: doi:10.1016/j.ijmm.2014.12.001
- Mehrgan, H. and Rahbar, M. 2008. Prevalence of extended-spectrum beta-lactamase-producing Escherichia coli in a tertiary care hospital in Tehran, Iran. Int. J. Antimicrob. Agents. 31, 147–151. Iegūts no: doi:10.1016/j.ijantimicag.2007.09.008
- Ministry of Health Malaysia. 2001. Consensus guidelines for the management of infections by ESBL-producing bacteria. Minist. Heal. Malaysia. 1–35.
- Nakai, H., Hagihara, M., Kato, H. et al. 2016. Prevalence and risk factors of infections caused by extended-spectrum betalactamase (ESBL)-producing Enterobacteriaceae. J. Infect. Chemother. 22, 319–326. Iegūts no: doi:10.1016/j.jiac.2016.02.004
- Ohkusa, T. and Koido, S. 2015. Intestinal microbiota and ulcerative colitis. J. Infect. Chemother. 21, 761–768. Iegūts no: doi:10.1016/j.jiac.2015.07.010
- Ordás, I., Eckmann, L., Talamini, M. et al. 2012. Ulcerative colitis. Lancet. 380, 1606–1619. Iegūts no: doi:10.1016/S0140-6736(12)60150-0
- Peralta, G., Lamelo, M., Alvarez-García, P. et al. 2012. Impact of empirical treatment in extended-spectrum betalactamase-producing Escherichia coli and Klebsiella spp. bacteremia. A multicentric cohort study. BMC Infect. Dis. 12, 245. Iegūts no: doi:10.1186/1471-2334-12-245
- Pfeifer, Y., Cullik, A. and Witte, W. 2010. Resistance to cephalosporins and carbapenems in Gram-negative bacterial pathogens. Int. J. Med. Microbiol. 300, 371–379. Iegūts no: doi:10.1016/j.ijmm.2010.04.005
- Reuland, E. A., Al Naiemi, N., Kaiser, A. M. et al. 2016a. Prevalence and risk factors for carriage of ESBL-producing Enterobacteriaceae in Amsterdam. J. Antimicrob. Chemother. 71, 1076–1082. Iegūts no: doi:10.1093/jac/dkv441
- Reuland, E. A., Sonder, G. J. B., Stolte, I. et al. 2016b. Travel to Asia and traveller’s diarrhoea with antibiotic treatment are independent risk factors for acquiring ciprofloxacin-resistant and extended spectrum beta-lactamase-producing Enterobacteriaceae-a prospective cohort study. Clin. Microbiol. Infect. 22, 731.e1–731.e7. Iegūts no: doi:10.1016/j.cmi.2016.05.003
- Shaikh, S., Fatima, J., Shakil, S. et al. 2015. Antibiotic resistance and extended spectrum beta-lactamases: Types, epidemiology and treatment. Saudi J. Biol. Sci. 22, 90–101. Iegūts no: doi:10.1016/j.sjbs.2014.08.002
- Skippen, I., Shemko, M., Turton, J. et al. 2006. Epidemiology of infections caused by extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella spp.: a nested case-control study from a tertiary hospital in London. J. Hosp. Infect. 64, 115–123. Iegūts no: doi:10.1016/j.jhin.2006.05.010
- Spanu, T., Luzzaro, F., Perilli, M. et al. 2002. Occurrence of extended-spectrum beta-lactamases in members of the family Enterobacteriaceae in Italy: implications for resistance to beta-lactams and other antimicrobial drugs. Antimicrob Agents Chemother. 46, 196–202. Iegūts no: 10.1128/AAC.46.1.196-202.2002
- Tham, J. 2012. Extended-spectrum beta-lactamase-producing Enterobacteriaceae: epidemiology, risk factors, and duration of carriage. Doctoral thesis. Lund: Lund University.
- Tham, J., Odenholt, I., Walder, M. et al. 2013. Risk factors for infections with extended-spectrum beta-lactamaseproducing Escherichia coli in a county of southern Sweden. Infect. Drug Resist. 6, 93–97. Iegūts no: doi:10.2147/IDR. S46290
- Vaisman, A., Pivovarov, K., McGeer, A. et al. 2013. Prevalence and incidence of antimicrobial-resistant organisms among hospitalized inflammatory bowel disease patients. Can. J. Infect. Dis. Med. Microbiol. 24, e117–21.
- Wehkamp, J., Götz, M., Herrlinger, K. et al. 2016. Inflammatory bowel disease. Dtsch. Arztebl. Int. 113, 72–82. Iegūts no: doi:10.3238/arztebl.2016.0072
- Woerther, P-L., Burdet, C., Chachaty, E. and Andremont, A. 2013. Trends in human fecal carriage of extended-spectrum β-lactamases in the community: toward the globalization of CTX-M. Clin. Microbiol. Rev. 26, 744–58. Iegūts no: doi:10.1128/CMR.00023-13