Hroniskas trombemboliskas plaušu hipertensijas Latvijas pacientu reģistra septiņu gadu dati
Kopsavilkums
Ievads. Hroniska trombemboliska plaušu hipertensija (HTEPH) ir persistējošas plaušu artēriju obstrukcijas gala rezultāts, kas izveidojies pēc vienas vai vairākām plaušu embolijas (PE) epizodēm, un tam raksturīga ir fibrozes veidošanās plaušu artēriju sieniņās un plaušu vaskulāra remodelācija.
Tiek uzskatīts, ka HTEPH netiek pietiekami bieži diagnosticēta, tāpēc ir nepieciešams noteikt HTEPH izplatību Latvijā.
Darba mērķis ir novērtēt dažādus HTEPH pacientus raksturojošus rādītājus: dzimumu, vecumu, ķermeņa masas indeksu (ĶMI), asins grupu, NYHA funkcionālo klasi u. c. Aprēķināt HTEPH izplatību Latvijas populācijā 2014. gadā.
Materiāls un metodes. Šajā prospektīvajā pētījumā tika izmantoti Latvijas HTEPH reģistra dati, kā arī iekļauti 26 pacienti ar nesen (≤ 6 mēnešus) diagnosticētu HTEPH laikā no 2008. gada marta līdz 2014. gada decembrim. HTEPH diagnoze tika apstiprināta ar sirds labo daļu katetrizāciju (RHC), kurā vidējais plaušu artērijas spiediens (mPAP) miera stāvoklī visiem pacientiem bija ≥ 25 mm Hg.
Rezultāti. Pētījumā iekļauto 26 pacientu (38 % vīrieši, 62 % sievietes, vecuma mediāna – 60 gadi) vidējais mPAP bija 53,4 mm Hg (95 % ticamības intervāls (CI), 28,3–78,5) un pirms RHC noteikts vidējais labā kambara sistoliskais spiediens – 82,8 mm Hg (95 % CI, 43,4–122,1). Diagnostikas brīdī lielākajai pacientu daļai (84,6 %) bija III funkcionālā klase (pēc NYHA klasifikācijas). Vidējais ĶMI – 27,3 kg/m2 (95 % CI, 13,7–40,9).
Aprēķinātā HTEPH izplatība Latvijā 2014. gadā bija 1,3/100 000 iedzīvotāju. Novērošanas perioda beigās astoņi pacienti bija miruši.
Secinājumi. Latvijā visbiežāk HTEPH slimnieks ir sieviete, kuras vidējais vecums – 59 gadi. Pusei pacientu ķermeņa masas indekss atbilda normālam. Lielākajai daļai pacientu diagnostikas brīdī bija III NYHA funkcionālā klase, kas liecināja par slimības smagumu.
Aprēķinātā HTEPH izplatība Latvijā ir zema, tomēr precīzi HTEPH sastopamība un izplatība nav nosakāma, tāpēc patiesie epidemioloģiskie rādītāji varētu būt krietni lielāki.
Ievads
Plaušu hipertensija (PH) ir smaga un progresējoša slimība ar nelabvēlīgu prognozi. Atbilstīgi plaušu hipertensijas klīniskajai klasifikācijai PH tiek iedalīta piecās grupās [19, 35]. Tikai divu šo grupu pacientiem ir pieejama specifiska medikamentozā terapija: 1. grupai – pulmonālai arteriālai hipertensijai (PAH) un 4. grupai – hroniskai trombemboliskai plaušu hipertensijai (HTEPH).
HTEPH ir persistējošas plaušu artēriju obstrukcijas gala rezultāts, kas izveidojies pēc vienas vai vairākām plaušu embolijas (PE) epizodēm, un tā tiek definēta kā palielināts vidējais spiediens plaušu artērijās (mPAP) ≥ 25 mm Hg, kas turpinās ilgāk nekā sešus mēnešus pēc (PE) diagnosticēšanas, lai gan pacients saņem adekvātu antikoagulantu terapiju [18, 351].
Slimības patoģenētiskais mehānisms ir saistīts ar palielinātu pretestību asins plūsmai plaušu artērijās, kur sākotnēji pretestība veidojas plaušu artēriju obstrukcijas (galveno līdz subsegmentālo artēriju līmenī) ar trombemboliem dēļ, un sekojošu asinsvadu remodelāciju mazajos nenosprostotajos asinsvados [18, 351; 15, 687]. Trombemboliskais materiāls cieši piesaistās plaušu elastīgo artēriju iekšējam slānim, nomainot normālo intīma slāni. Asinsvada lūmens var tikt pilnībā okludēts vai var veidoties dažādas pakāpes fibrozas stenozes, tīkli un gredzeni. Jāatzīmē, ka neokludētajos apgabalos veidojas pulmonāla arteriopātija, kas nav atšķirama no PAH radītās. Lielā asinsrites loka kolaterālie asinsvadi (bronhu, ribu, diafragmas un koronārās artērijas) var ieaugt un daļēji apasiņot apgabalus, kas atrodas distāli no pilnīgas obstrukcijas [6, 2499].
Balstoties uz liela mēroga pētījumiem, PE sastopamība tiek novērtēta kā 60 līdz 70 gadījumi uz 100 000 iedzīvotāju ik gadu, savukārt dziļo vēnu trombozes (DVT) incidence – 124 gadījumi uz 100 000 iedzīvotāju no kopējās populācijas gadā [3, 129]. Vairākos dažāda mēroga pētījumos ir atklāts, ka HTEPH attīstās 1–4,8 % pacientu mēnešu līdz gadu laikā pēc akūtas PE epizodes [2, 174; 17, 2260; 8, 598].
Tomēr šie skaitļi precīzi nenorāda patieso saslimstības ar HTEPH biežumu. Tā varētu būt ievērojami lielāka, jo pacientiem ar DVT asimptomātiska PE var attīstīties līdz pat 27–37 % gadījumu, savukārt HTEPH incidences aprēķināšanā pētījumos tika iekļauti pacienti ar akūtu simptomātisku PE [2, 173; 17, 2258; 8, 598; 20, 427]. Vīnes Universitātes klīnikā noritēja pētījums, kurā 90 no 142, kā turpmāk tika konstatēts – HTEPH pacientiem (63 %), anamnēzē nebija novērota plaušu embolija, kas liecina, ka sākotnējais trombemboliskais notikums lielākajai daļai HTEPH pacientu bijis asimptomātisks [13, 2236].
Turklāt pētījumi apstiprina, ka HTEPH var attīstīties arī bez iepriekšējas PE. Šādos gadījumos slimību, iespējams, izraisa sākotnējs trombotisks vai iekaisīgs process plaušu vaskulatūrā. Kad asinsvads ir nosprostojies tiktāl, ka spiediens plaušu artērijā pieaug, sākas vaskulāra remodelācija, kas pakāpeniski progresē un ir PH attīstības iemesls, pat ja turpmāk trombemboliskus procesus nenovēro [6, 2528]. Vēl aizvien nav atklāts, kāpēc nelielai daļai pacientu pēc akūtas PE attīstās HTEPH un daļai ne [4, 325].
Lai precīzi novērtētu HTEPH sastopamības biežumu, būtu jāveic liela mēroga prospektīvi multicentru pētījumi, kuros apsekotu pacientus pēc akūtas plaušu embolijas vienlaikus ar to gadījumu izpēti, kuros pacientiem anamnēzē neparādās akūta PE, bet HTEPH diagnoze tika noteikta neskaidras izcelsmes plaušu hipertensijas diagnostisko izmeklējumu laikā [10, 2017].
Hroniskas trombemboliskas plaušu hipertensijas attīstību ir grūti noteikt, jo, kā jau minēts, daļai pacientu plaušu embolija ir noritējusi nepamanīta un norādes uz diagnozi kļūst saredzamas tikai retrospekcijā. Pacientiem ar HTEPH pēc akūtas plaušu embolijas tipiska ir “medusmēneša fāze”, kuras laikā nav simptomu, lai gan noris plaušu hipertensijas attīstība. Kaut arī ievērojamai pacientu daļai attīstās simptomātiska saslimšana, asimptomātiskas HTEPH klīniskā nozīme aizvien nav viennozīmīga [9, 6].
Slimība parasti tiek diagnosticēta, ja plaušu hipertensija palielinās un izraisa nespecifiskus simptomus: progresējošu elpas trūkumu, nogurumu, samazinātu slodzes toleranci. Daļa pacientu ignorē iepriekš minētos simptomus un nevēršas pie ārsta. Slimībai progresējot, pievienojas sūdzības, kas saistītas ar sirds labā kambara disfunkciju: perifēras tūskas, slodzes stenokardija, ģīboņi. Nāve visbiežāk iestājas, plaušu hipertensijai progresējot un izraisot labā kambara mazspēju [18, 351]. Pacientu izmeklējot, novēro labā kambara hipertrofijas pazīmes (pulsāciju epigastrijā), akcentētu otro toni, auskultējot virs plaušu artērijas, ir tipiska elektrokardiogrāfijas un ehokardiogrāfijas atrade [3, 132].
Standarta laboratorijas izmeklējumu rezultāti HTEPH gadījumā ir nespecifiski un neatšķiras no tiem, ko iegūst citas etioloģijas PH gadījumā. Galvenā izmeklēšanas metode ir radioloģiskā diagnostika. Gadījumos, ja ir ticami hroniskas plaušu trombembolijas pierādījumi, plaša pacientu izmeklēšana ar mērķi izslēgt citas etioloģijas plaušu hipertensiju nav nepieciešama. Transtorakāla ehokardiogrāfija (EhoKG) ir pamata izmeklēšanas metode PH gadījumā, un visbiežākā ehokardiogrāfiskā atrade ir labā kambara dilatācija, hipertrofija un hipokinēzija, labā priekškambara palielināšanās, labā kambara spiediena pārslodze un trikuspidāla regurgitācija. Pacientiem, kam pēc akūtas PE stacionēšanas laikā parādās labā kambara disfunkcijas vai PH simptomi, pēc izrakstīšanās (parasti pēc 3–6 mēnešiem) būtu jāveic kontroles EhoKG. Savukārt pozitīva EhoKG atrade pacientiem, kas pārcietuši plaušu emboliju, varētu norādīt uz HTEPH attīstību. Tomēr EhoKG nav specifiska metode HTEPH diagnosticēšanai. Ventilācijas / perfūzijas scintigrāfija tiek ieteikta kā sijājošās atlases metode, jo negatīva atrade PH gadījumā gandrīz izslēdz HTEPH iespējamību. Tomēr Latvijā šī metode vēl nav pieejama. Otrā biežākā attēldiagnostikas metode ir plaušu datortomogrāfija. Plaušu angiogrāfiju var veikt labā sirds kambara katetrizācijas laikā, HTEPH gadījumā būs novērojamas tipiskas atrades. Konvencionālu plaušu angiogrāfiju izmanto arī tad, kad lemj par ķirurģisku ārstēšanu [1, 13].
HTEPH ir diezgan grūti diagnosticēt, tāpēc svarīgi definēt pacientu grupu, kam ir lielāks risks, ka pēc akūtas PE var attīstīties HTEPH. Atklāti ir šādi HTEPH attīstības riska faktori: vecums (vairāk par 70 gadiem) un iepriekšēja PE; jaunākiem – lielāks perfūzijas defekts un idiopātiska PE, veikta splenektomija, implantēts kardioverters vai kardiodefibrilators, anamnēzē – hroniskas iekaisīgas slimības (osteomielīts vai iekaisīgās zarnu slimības); vairogdziedzera hormonu aizstājterapija, malignitāte, pozitīvas antifosfolipīdu antivielas vai lupus antikoagulants.
Pacientiem ar šiem riska faktoriem būtu rekomendējams veikt kontroles izmeklējumus vismaz divus gadus pēc akūtas PE [1, 13].
HTEPH pacientus var iedalīt divās grupās: operējamie un neoperējamie.
Ķirurģiska terapija (neoperējami pacienti) nav iespējama trombu klātbūtnes dēļ distālajos asinsvados, smagu blakusslimību gadījumos, kā arī, ja pacients atsakās no operācijas vai nav pieejami specializētie ķirurģiskie centri.
Ja trombi atrodas galvenajās, daivu vai segmentālajās artērijās, tos iespējams izņemt, veicot ķirurģisku procedūru pulmonālo endarterektomiju (PEA) [14, 703]. HTEPH operējamība būtu jānosaka ar augstas kvalitātes attēldiagnostikas metodēm, katru pacientu izvērtējot individuāli specializētos pulmonālās endarterektomijas centros [6, 2529].
PEA ir izvēles terapija HTEPH operējama pacienta gadījumā, un tā ir vienīgā potenciāli ārstējošā metode, kuras rezultātā novērojama izteikta hemodinamisko rādītāju, funkcionālās klases un dzīvildzes uzlabošanās, un pacientam nav nepieciešama plaušu transplantācija. Tā ir sarežģīta procedūra, kuru veic tikai pieredzējuši speciālisti. Pēcoperācijas mirstība sasniedz pat 5 % [14, 707].
Liela nozīme ir pacientu atlasei un prognozētajam pēcoperācijas hemodinamikas uzlabojumam. Daži autori uzskata, ka PEA būtu jāveic tikai tādā gadījumā, ja paredzamā pulmonālās vaskulārās rezistences samazināšanās pēc procedūras ir lielāka par 50 % [5, 645].
HTEPH medikamentozai ārstēšanai ir pieejams tikai viens specifisks medikaments – šķīstošs guanilātciklāzes stimulators riociguats [7, 327]. Tomēr HTEPH terapijā izmanto arī PAH paredzētos preparātus: specifiskos prostaciklīnu analogus, fosfodiesterāzes-5 inhibitorus un endotelīna receptoru antagonistus [6, 2529].
Darba mērķis
Analizēt un novērtēt dažādus HTEPH pacientus raksturojošus rādītājus: dzimumu, vecumu, ĶMI, asins grupu, NYHA funkcionālo klasi slimības diagnozes brīdī u. c. Aprēķināt HTEPH izplatību Latvijas populācijā 2014. gadā.
Materiāls un metodes
Šajā prospektīvajā pētījumā izmantoti dati no Latvijas Kardioloģijas centrā 2007. gadā izveidotā vienīgā PH pacientu reģistra Latvijā. Pacienti ar HTEPH iekļauti PH reģistra 4. grupā. HTEPH reģistrā tika ietverti 26 pacienti ar nesen (≤ 6 mēnešus) diagnosticētu HTEPH laikā no 2008. gada marta līdz 2014. gada decembrim.
Visiem pacientiem plaušu trombembolijas apstiprināšanai tika veikta datortomogrāfija plaušām ar kontrastvielu. HTEPH diagnoze tika apstiprināta ar sirds labo daļu kateterizāciju (RHC), ar ko tika noteikts vidējais spiediens plaušu artērijā (mPAP), pulmonālā vaskulārā rezistence (PVR), sirds indekss (CI), sirds izsviede (CO) un plaušu kapilāru ķīlēšanās spiediens (PCWP). Pirms RHC tika veikta EhoKG un noteikts labā kambara sistoliskais spiediens (LKSS).
Statistiskā analīze tika veikta, izmantojot IBM SPSS 20.0. un Microsoft Excel 2011. Vidējās kvantitatīvo parametru mainīgās vērtības parādītas kā vidējā vērtība ar ticamības intervālu 95% (Confidence Interval = CI).
HTEPH prevalence tika aprēķināta uz 100 000 Latvijas iedzīvotāju, ņemot vērā Centrālās statistikas pārvaldes datus par Latvijas iedzīvotāju skaitu līdz 2014. gada maijam (n = 1 997 500) un HTEPH reģistra ziņas par dzīvajiem pacientiem līdz 2014. gada beigām.
Rezultāti
Vidējās parametru vērtības visiem pacientiem parādītas 1. tabulā.
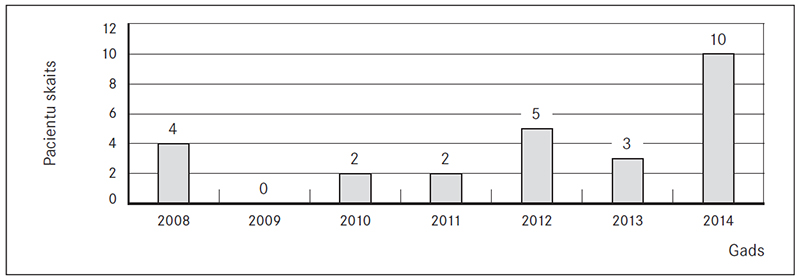
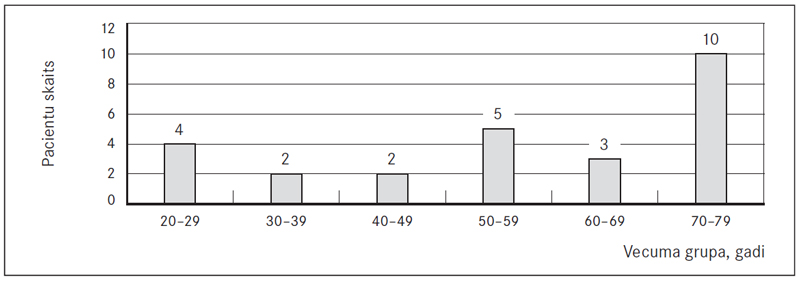
No 26 HTEPH pacientiem 38 % (n = 10) bija vīrieši un 62 % (n = 16) – sievietes. Vidējais vecums HTEPH diagnosticēšanas brīdī sievietēm bija 59 gadi (95 % CI, 42–76), vīriešiem – 51 gads (95 % CI, 35–86). Novērošanas perioda beigās (septiņos gados) astoņi pacienti bija miruši. Visvairāk pacientu HTEPH reģistrā tika iekļauti 2014. gadā, salīdzinājumā ar pārējiem gadiem, – 38,46 % (n = 10) (sk. 1. att.). Pacientu skaits vecuma grupā 70–79 gadi bija vislielākais – desmit (38 %) pacienti (sk. 2. att.). Vidējais ĶMI starp pacientiem bija 27,3 kg/m2 (95 % CI, 13,7–40,9). Trīspadsmit (50 %) pacientiem bija normāls ĶMI (intervālā 18,5–24,5 kg/m2).
HTEPH diagnosticēšanas brīdī NYHA (New York Heart Association – Ņujorkas Sirds asociācija) II funkcionālā klase bija 8 % (n = 2) pacientu, III funkcionālā klase – 84 % (n = 22), IV funkcionālā klase – 8 % (n = 2) (sk. 3. att.).
Pacientu sadalījums pēc asins grupas: 0 (I) Rh(+) bija 23 % (n = 6) pacientiem, 0 (I) Rh(–) 4 % (n = 1), A (II) Rh(+) 34 % (n = 9), B (III) Rh(+) 31 % (n = 8), B (III) Rh(–) 4 % (n = 1), AB (IV) Rh(+) 4 % (n = 1) pacientiem.
1. tabula. Vidējā rādītāju vērtība ar standartnovirzi starp HTEPH pacientiem / Mean patient parameter values and standard deviations
| Rādītājs | Vidējā vērtība | Standartnovirze | |
|---|---|---|---|
| Vecums (gadi) | Vīrieši (n = 10) | 51 | 15 |
| Sievietes (n = 16) | 59 | 17 | |
| ĶMI, kg/m2 | 27,3 | 6,8 | |
| LKSS, mm Hg | 82,8 | 19,7 | |
| mPAP, mm Hg | 53,4 | 12,5 | |
| PVR, HRU | 11,7 | 4,0 | |
| CI, l/min/m2 | 1,98 | 0,38 | |
| CO, l/min | 3,81 | 0,75 | |
| PCWP, mm Hg | 12,0 | 4,5 | |
ĶMI – ķermeņa masas indekss, LKSS – labā kambara sistoliskais spiediens, mPAP (mean pulmonary artery pressure) – vidējais spiediens plaušu artērijā, PVR (pulmonary vascular resistence) – pulmonālā vaskulārā rezistence, HRU – Vuda vienības (hybrid reference units), CI (cardiac index) – sirds indekss, CO (cardiac output) – sirds izsviede, PCWP (pulmonary capillary wedge pressure) – plaušu kapilāru ķīlēšanās spiediens.
1. attēls. Hroniskas trombemboliskas plaušu hipertensijas reģistra pacientu sadalījums pēc iekļaušanas gada reģistrā / Patient distribution depending on the year of inclusion in CTEPH registry
2. attēls. Hroniskas trombemboliskas plaušu hipertensijas reģistra pacientu sadalījums pēc vecuma / Patient distribution depending on age
3. attēls. Pacientu skaits un procentuālais sadalījums pēc NYHA funkcionālās klases / Number of patients and their distribution depending on NYHA functional class

EhoKG noteikts vidējais LKSS – 82,8 mm Hg (95 % CI, 43,4–122,1). Veicot labo sirds daļu katetrizāciju, vidējais spiediens plaušu artērijā (mPAP) bija 53,4 mm Hg (95 % CI, 28,3–78,5), vidējā pulmonālā vaskulārā rezistence (PVR) bija 11,7 HRU jeb Wood vienības (95 % CI, 3,6–19,7), vidējais sirds indekss (CI) – 1,98 l/min/m2 (95 % CI, 1,21–2,75), vidējā sirds izsviede (CO) – 3,81 l/min (95 % CI, 2,30–5,31), vidējais plaušu kapilāru ķīlēšanās spiediens (PCWP) – 12,0 mm Hg (95 % CI, 2,9–21,0).
Visi 26 pacienti saņēma antikoagulantu terapiju – 20 (77 %) pacienti lietoja orfarīnu, seši (23 %) – rivaroksabānu.
Aprēķinātā HTEPH izplatība Latvijā 2014. gadā bija 1,3/100 000 iedzīvotāju.
Diskusija
Aprēķinātā HTEPH izplatība Latvijā ir zema, jo, pēc ekspertu uzskatiem, tā ir 1–9 gadījumi uz 100 000 iedzīvotāju [11]. Tomēr patiesais HTEPH biežums un izplatība nav zināma, tāpēc Latvijas epidemioloģiskie rādītāji varētu būt krietni lielāki. Pēc pasaules datiem arī patiesā HTEPH sastopamība nav īsti skaidra, bet vairākos pētījumos tiek aprakstīts, ka starp pacientiem, kas pārcietuši akūtu PE, tā varētu sasniegt 1–4,8 % [2, 174; 17, 2260; 8, 598; 12, 972]. Lai precīzi apzinātu patieso pacientu skaitu reģionā, būtu nepieciešams izveidot Baltijas vai Baltijas–Ziemeļvalstu HTEPH reģistru.
Visā pasaulē HTEPH diagnostikā priekšroka tiek dota ventilācijas / perfūzijas plaušu skenēšanai (V/Q scan), kas Latvijā nav pieejama. V/Q scan salīdzinājumā ar CT angiogrāfiju ir augstāka jutība, tāpēc HTEPH pacientiem, domājams, mainīsies V/Q scan rezultāti, nevis CT angiogrāfija. Kādā pētījumā, novērojot 277 pacientus pēc akūtas PE, V/Q scan jutība, salīdzinot ar CT angiogrāfijas jutību, bija 96% pret 51% [21, 682].
Visiem HTEPH pacientiem rekomendē antikoagulantu terapiju mūža garumā, parasti ar K vitamīna antagonistiem, uzturot INR līmeni robežās no 2 līdz 3 [6, 2529].
Mūsdienās HTEPH pacientiem, kurus drīkst operēt, efektīvākā ārstēšanas metode ir pulmonālā endarterektomija PEA [14, 707]. Līdz 2014. gadam Latvijā tika veiktas trīs PEA procedūras. Latvijā šī procedūra būtu jāievieš kā rutīnas metode.
Dažām HTEPH pacientu grupām, kurus nevar operēt, jo trombu lokalizēšanās ir plaušu artēriju perifērijā, pasaulē ir pieejama jauna, mazinvazīva ārstēšanas metode – plaušu artēriju balonangioplastija [16, 2]. Sadarbībā ar Austrijas kolēģiem vienam Latvijas CTEPH pacientam šī procedūra jau ir veikta, nākotnē plaušu artēriju balonangioplastiju paredzēts veikt arī Latvijā. Neoperējama HTEPH gadījumā būtu jālieto medikamentozā terapija, tajā skaitā jauns specifisks HTEPH medikaments riociguats [7, 327; 16, 1].
No reģistra datiem redzams, ka (sk. 1. tabulu) “vidējais” HTEPH pacients Latvijā ir sieviete, vecāka par 50 gadiem, kura cieš no liekā svara un sirds mazspējas un kurai ir augsts vidējais spiediens plaušu artērijās, kā arī palielināta vaskulārā rezistence plaušu asinsvados.
Lielākajai daļai pacientu diagnostikas brīdī bija augsta NYHA funkcionālā klase (sk. 3. att.), kas noteica slimības smagumu, liecinot, ka HTEPH diagnostika Latvijā notiek novēloti. Lai laikus diagnosticētu HTEPH attīstību un diferencētu to no citām PH formām, Latvijā būtu jāizveido specializēts PH centrs, kurā tiktu īstenota skrīningprogramma visiem pacientiem, kuri pārcietuši akūtu PE.
Pašlaik HTEPH tiek uzskatīta par vienu no PH formām, tomēr, pēc reto slimību ekspertu uzskatiem, nākotnē tā būtu jāizdala kā atsevišķa slimība ar savu starptautiskās slimību klasifikācijas (SSK) kodu.
Secinājumi
- Aprēķinātā HTEPH izplatība Latvijā ir zema, tomēr precīzs HTEPH saslimstības biežums un izplatība nav nosakāma, tāpēc patiesie epidemioloģiskie rādītāji varētu būt krietni lielāki.
- Lai precīzāk noteiktu HTEPH epidemioloģiskos rādītājus, būtu nepieciešams izveidot Baltijas vai Baltijas–Ziemeļvalstu HTEPH reģistru.
- Latvijas HTEPH pacients visbiežāk ir sieviete, kuras vidējais vecums 59 gadi, biežāk ar asinsgrupu, kas nav 0 (I). Pusei pacientu ķermeņa masas indekss atbilda normālam.
- Vidējais LKSS spiediens pirms HTEPH diagnozes apstiprināšanas ar sirds labo daļu katetrizāciju jau norādīja uz iespējamu plaušu hipertensiju, turklāt smagas pakāpes.
- Lielākajai pacientu daļai diagnostikas brīdī bija augsta NYHA funkcionālā klase, kas noteica slimības smagumu un norādīja, ka HTEPH diagnostika Latvijā notiek novēloti.
- Ikvienam neskaidras ģenēzes plaušu hipertensijas pacientam būtu jāizvērtē HTEPH iespējamība.
- Lai uzlabotu HTEPH diagnostiku, Latvijā būtu nepieciešams ieviest ventilācijas / perfūzijas plaušu skenēšanu.
- HTEPH diagnostikas uzlabošanai Latvijā būtu nepieciešams izveidot specializētu plaušu hipertensijas centru, kurā īstenotu skrīningprogramma visiem pacientiem, kuri pārcietuši akūtu PE.
- Pulmonālā endarterektomija ir izvēles terapijas metode, ja operējamas HTEPH pacients ir operējams, šī procedūra Latvijā būtu jāievieš kā rutīnas metode.
- HTEPH pacientiem, kas nav operējami, ir iespējama gan mazinvazīva, gan medikamentoza terapija.
Abstract
Chronic Thromboembolic Pulmonary Hypertension Patient Registry of Latvia – What Have We Learned in 7 Years?
Chronic thromboembolic pulmonary hypertension (CTEPH) is the end result of persistent obstruction of the pulmonary arteries following episodes of acute and / or recurrent pulmonary emboli when mean pulmonary arterial pressure (mPAP) rises to ≥ 25 mm Hg and persists longer than 6 months. CTEPH is commonly underdiagnosed, and it is significant to determine CTEPH prevalence in Latvia.
This prospective study of the Latvian CTEPH registry included 26 patients with recently (≤ 6 months) diagnosed CTEPH in the time period from March, 2008 until December, 2014. Diagnosis was confirmed by right heart catheterisation (RHC). Long-term follow-up is still in progress.
In 7 years, 26 patients (38% male, 62% female, median age – 60 years) were included in registry with mean mPAP – 53.4 mm Hg (95 % Confidence Interval (CI), 28.3–78.5) and mean right ventricle systolic pressure – 82.8 mm Hg (95 % CI, 43.4–122.1) before RHC. At the time of diagnosis, the majority of patients (84.61 %) were in NYHA functional class III. Overall, blood groups other than 0 were more frequent. Mean body mass index (BMI) was 27.3 kg/m2 (95 % CI, 13.7–40.9). Calculated prevalence of CTEPH in Latvia in 2014 was 1.3/100,000. At the end of the observation period, 8 patients were deceased.
Latvian HTEPH patient most likely is a female, with an average age of 59 years, more often with non-0 (I) blood group. Body mass index in half of the patients was in accordance with the norm (between 18.5–24.5 kg/m2).
High values of average right ventricular systolic pressure (measured before HTEPH diagnosis was confirmed with the RHC) already pointed to a possible severe pulmonary hypertension. The NYHA functional class at the time of diagnosis was high, which determined the severity of symptoms.
Calculated CTEPH prevalence in Latvia is low, although the incidence and prevalence of CTEPH are yet to be accurately determined and may be significantly underestimated.
Literatūra
1. Skride A., Rudzītis A., Akermane R. u. c. Hroniska trombemboliska plaušu hipertensija // Doctus, 2013; Nr. 12: 12.–14. lpp.
2. Becattini C., Agnelli G., Pesavento R., et al. Incidence of chronic thromboembolic pulmonary hypertension after a first episode of pulmonary embolism // Chest, 2006; 130: 172–175.
3. Bĕlohlávek J., Dytrych V., Linhart A. Pulmonary embolism, part I. Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis and nonthrombotic pulmonary embolism // Exp Clin Cardiol, 2013; 18 (2): 129–138.
4. Bonderman D., Wilkens H., Wakounig S., et al. Risk factors for chronic thromboembolic pulmonary hypertension // Eur Respir J, 2009; 33: 325–331.
5. Dartevelle P., Fadel E., Mussot S., et al. Chronic thromboembolic pulmonary hypertension // ERJ, 2004; 23: 637–648.
6. Galiè N., Hoeper M. M., Humbert M., et al. Guidelines for the diagnosis and treatment of pulmonary hypertension: the task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT) // European Heart Journal, 2009; 30: 2493–2537.
7. Ghofrani H. A., D’ Armini A. M., Grimminger F., et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension // N Engl J Med, 2013; 369: 319–329.
8. Guérin L., Couturaud F., Parent F., et al. Prevalence of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism. Prevalence of CTEPH after pulmonary embolism // Thromb Haemost, 2014 Sep 2; 112 (3): 598–605.
9. Held M., Hesse A., Gött F., et al. A symptom-related monitoring program following pulmonary embolism for the early detection of CTEPH: a prospective observational registry study // BMC Pulmonary Medicine, 2014, 14: 141: 1–8.
10. Hoeper M. M., Mayer E., Simonneau G., Rubin L. J. Chronic thromboembolic pulmonary hypertension // Circulation, 2006; 113: 2011–2020.
11. Jais X., Simmoneau G. Chronic thromboembolic pulmonary hypertension // http://www.orpha.net/consor/cgi-bin/ OC_Exp.php?lng=EN&Expert=70591 (sk. 27.06.2015.).
12. Klok F. A., van Kralingen K. W., van Dijk A. P., et al. Prospective cardiopulmonary screening program to detect thromboembolic pulmonary hypertension in patients after acute pulmonary embolism // Haemotologica, 2010; 95: 970–975.
13. Lang I. M. Chronic thromboembolic pulmonary hypertension – Not so rare after all // N Engl J Med, 2004; 350: 2236–2238.
14. Mayer E., Jenkins D., Lindner J., et al. Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension: results from an international prospective registry // J Thorac Cardiovasc Surg, 2011; 141: 702–710.
15. Moser K. M., Bloor C. M. Pulmonary vascular lesions occurring in patients with chronic major vessel thromboembolic pulmonary hypertension // Chest, 1993 Mar; 103 (3): 685–692.
16. Ogawa A., Matsubara H. Balloon pulmonary angioplasty: a treatment option for inoperable patients with chronic thromboembolic pulmonary hypertension // Front. Cardiovasc. Med., 17th February 2015; 1–7.
17. Pengo V., Lensing A. W., Prins M. H., et al. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism // N Engl J Med, 2004; 350: 2257–2264.
18. Piazza G., Goldhaber S. Z. Chronic thromboembolic pulmonary hypertension // N Engl J Med, 2011 Jan 27th; 364 (4): 351–360.
19. Simonneau G., Gatzoulis M. A., Adatia I., et al. Updated clinical classification of pulmonary hypertension // J Am Coll Cardiol, 2013 Dec 24th; 62 (25 Suppl): 34–41.
20. Stein P. D., Matta F, Musani M. H. Diaczok B. Silent pulmonary embolism in patients with deep venous thrombosis: a systematic review // The American Journal of Medicine, 2010; 123: 426–431.
21. Tunariu N., Gibbs S. J., Win Z., et al. Ventilation–perfusion scintigraphy is more sensitive than multidetector CTPA in detecting chronic thromboembolic pulmonary disease as a treatable cause of pulmonary hypertension // J Nucl Med, 2007; 48: 680–684.


