Kardiovaskulāro notikumu risks pacientiem ar ātriju fibrilāciju pēc elektriskās kardioversijas
Kopsavilkums
Ātriju fibrilācija (ĀFib) ir visplašāk izplatītais aritmijas veids, kas ir saistīts ar daudzām bīstamām komplikācijām: insultu, sistēmisku emboliju, sirds mazspējas attīstību un paaugstinātu asiņošanas risku tiem pacientiem, kas lieto antikoagulantus.
Darba mērķis. Izvērtēt klīniskos notikumus pacientiem pēc elektriskās kardioversijas, pamatojoties uz kardiovaskulārajiem riska faktoriem, CHA2DS2-VASc skalu un lietoto farmakoterapiju, tostarp antikoagulantu lietošanas ilgumu.
Materiāls un metodes. Pētījumā tika iekļauti 260 prospektīvie un 225 retrospektīvie pacienti ar ĀFib, kam 2013. gadā Paula Stradiņa Klīniskajā universitātes slimnīcā, Latvijas Kardioloģijas centra 11. nodaļā tika veikta elektriskā kardioversija (EKV). Dati, kas iegūti no medicīniskā arhīva dokumentācijas, intervijas ar pacientu un kontroles aptaujas pa tālruni, tika statistiski apstrādāti ar IBM SPSS Statistics 20 (ASV) datorprogrammu.
Rezultāti. No kardiovaskulāriem riskiem visbiežāk tika konstatēta arteriāla hipertensija (83,1 %), hroniska sirds mazspēja (66,6 %) un metabolais sindroms (16,1 %). Nedaudz retāk tika novērots cukura diabēts (12,6 %), veci miokarda infarkti (12,2 %), insulti (5,6 %) un transitīva išēmiska lēkme (3,9 %). Aprēķinot trombembolijas risku ar CHA2DS2-VASc skalu, viens punkts bija 38 (7,8 %) pacientiem, ≥ 2 punkti – 447 (92,2 %) pacientiem. Vidējais punktu skaits ir 3,8.
Mēnesi pēc EKV tika novēroti šādi kardiovaskulārie notikumi: akūts koronārais sindroms (0,9 %), ASM/HSM dekompensācija (0,4 %) PATE/DVT (0,4 %), ĀFib recidīvi (20,5 %). Trīs mēnešu kontrolē tika reģistrēti AKS (0,5 %), ASM/HSM dekompensācijas (0,5 %), PATE/DVT (0,5 %) un ĀFib recidīvi (26,3 %). Sešus mēnešu pēc EKV ir bijuši AKS (0,7 %), AKS/HSM dekompensācija (2,0 %), PATE/DVT (0,7 %), cerebrālie insulti (1,4 %) un ĀFib recidīvi (36,4 %). Asiņošanas biežums atkarībā no kontroles laika varfarīnam bija robežās no 4,62 % (p = 0,013) līdz 6,62 % (p = 0,067), aspirīnam – no 3,13 % (p = 0,119) līdz 3,31 % (p = 0,067). Dabigatrānam (Pradaxa) un rivaroksabānam (Xarelto) asiņošanu novēroja tikai viena mēneša kontrolē – Pradaxa 1,2 % un Xarelto 7,1 % (p = 0,016).
Secinājumi. Kardiovaskulāro risku biežums atbilst literatūras datiem, izņemot AH un HSM, kas šajā pētījumā ir augstāks. Tādu kardiovaskulāro notikumu kā AKS, ASM/ HSM dekompensācija, PATE/DVT un cerebrālie infarkti sastopamība šajā pētījumā ir retāka, salīdzinot ar literatūras datiem. Noteiktais klīniskais notikumu risks ar CHA2DS2-VASc skalu ir augstāks nekā citos pētījumos. Vislielākais asiņošanas biežums bijis, lietojot varfarīnu pirmā mēneša laikā pēc EKV. Jauno perorālo antikoagulantu lietošana atbilstoši vadlīnijām pirms un pēc EKV ir drošāka, salīdzinot ar varfarīnu, gan mēnesi ilgā, gan arī ilgākā laikposmā.
Izmantotie saīsinājumi
ABL – augsta blīvuma lipoproteīni
AH – arteriāla hipertensija
AKS – akūts koronārais sindroms
ASM – akūta sirds mazspēja
ĀFib – ātriju fibrilācija
CD – cukura diabēts
DVT – dziļo vēnu tromboze
EKV – elektriskā kardioversija
HNS – hroniska nieru slimība
HOPS – hroniska obstruktīva plaušu slimība
HSM – hroniska sirds mazspēja
INR – international normalized ratio – starptautiskā normalizētā attiecība
JPOAK – jaunie perorālie antikoagulanti
KP – kreisais priekškambaris
KPA – kreisā priekškambara austiņa
KV – kardioversija
ĶMI – ķermeņa masas indekss
MI – miokarda infarkts
PATE – plaušu artēriju trombembolija
POAK – perorālie antikoagulanti
TEE – transezofageāla ehokardiogrāfija
TIL – transitīva išēmiska lēkme
ZBL – zema blīvuma lipoproteīni
Ievads
Ātriju fibrilācija ir visplašāk izplatītais aritmijas veids pasaulē. Cilvēkiem ar ĀFib mirstība ir divreiz lielāka nekā cilvēkiem ar sinusa ritmu. Vairāk nekā viena trešdaļa hospitalizācijas gadījumu, kas saistīti ar sirds ritma traucējumiem, ir ĀFib dēļ [Jirgensons, Kalējs, 2010].
ĀFib izplatība ir robežās no 0,4 % līdz 1 %, turklāt saslimšanas biežums tieši korelē ar slimnieka vecumu. Pacientiem, kas jaunāki par 40 gadiem, to sastop 0,1 % gadījumu, jaunākiem par 60 gadiem – 1 %, 65 gadu vecumā – 5 %, bet vecākiem par 80 gadiem – 10 % gadījumu [Jirgensons, Kalējs, 2010; Ērglis, 2010].
Tiek prognozēts, ka laikposmā no 2010. līdz 2060. gadam Eiropas Savienībā pacientu skaits ar ĀFib, kas vecāki par 55 gadiem, dubultosies [Lip, 2013].
ĀFib ir saistīta ar daudzām smagām un bīstamām komplikācijām: išēmiskiem insultiem, sistēmiskām embolijām, sirds mazspējas attīstību vai jau esošas sirds mazspējas negatīvu dinamiku [Jirgensons, Kalējs, 2010; Ērglis, 2010]. Aptuveni 20–25 % cerebrālo infarktu ir kardioemboliski galvenokārt saistībā ar ātriju fibrilāciju. Latvijā kardioemboliski insulti sastopami biežāk un veido 44 % no visu cerebrāla infarkta slimnieku īpatsvara [Ērglis, 2013].
Lai novērstu smagas un dzīvībai bīstamas ĀFib komplikācijas, šiem pacientiem ir nepieciešama kompleksa ārstēšana, kas ietver arī sinusa ritma atjaunošanu ar kardioversiju. Nezināma ilguma vai ieilgušas lēkmes ārstēšanā lietotā elektriskā kardioversija ir saistīta ar zināmu risku [Boriani, 2007; Tavernier, 2012]. Pēc EKV insultu biežums ir augsts – 6–7 %, bet, lietojot profilaktisku antikoagulantu terapiju, šis risks ir mazāks par 1 % [Kim, 2009; Dagres, 2013].
Trombembolijas profilaksei 60 gadu garumā tika lietots varfarīns. Tomēr pēdējās vadlīnijās insulta profilaksei rekomendē lietot ne tikai varfarīnu, bet arī jaunos perorālos antikoagulantus, piemēram, dabigatrānu, rivaroksabānu un apiksabānu. Jebkura antikoagulanta lietošana saistīta ar paaugstinātu asiņošanas risku, tomēr JPOAK lietot ir ērtāk un drošāk nekā varfarīnu, jo nav vajadzīga regulāra INR kontrole un ir pierādīts zemāks asiņošanas risks [Tendera, 2012; Camm, 2012].
Šī darba mērķis ir izvērtēt klīniskos notikumus pacientiem pēc elektriskās kardioversijas, pamatojoties uz kardiovaskulārajiem riska faktoriem, CHADS2 skalu un lietoto farmakoterapiju, tostarp antikoagulantu lietošanas ilgumu.
Darba hipotēze, mērķis un uzdevumi
Hipotēze. Klīniskie notikumi pacientiem pēc elektriskās kardioversijas ir saistāmi ar kardiovaskulārajiem riska faktoriem, CHA2DS2-VASc skalu un lietoto farmakoterapiju, tostarp antikoagulantu lietošanas ilgumu.
Mērķis. Izvērtēt klīniskos notikumus pacientiem pēc elektriskās kardioversijas, pamatojoties uz kardiovaskulārajiem riska faktoriem, CHA2DS2-VASc skalu un lietoto farmakoterapiju, tostarp antikoagulantu lietošanas ilgumu.
Uzdevumi.
- Noteikt kopējo kardiovaskulāro risku sastopamību pacientiem ar ĀFib, kuru ārstēšanā tiek lietota EKV.
- Noteikt biežākos kardiovaskulāros notikumus pacientiem pēc EKV.
- Noteikt klīnisko notikumu risku ar CHA2DS2-VASc riska skalu.
- Noteikt klīnisko notikumu risku, kas saistīts ar antikoagulantu lietošanas ilgumu un konkrētiem medikamentiem.
Literatūras apskats
Ātriju fibrilācijas vispārīgs raksturojums un tās riska faktori. Priekškambaru fibrilācija ir supraventrikulāra aritmija, kam raksturīga nekoordinēta priekškambaru aktivācija ar konsekventu priekškambaru mehāniskās funkcijas pasliktināšanos [Camm, 2012].
2010. un 2012. gada ACC/AHA/ESC/HRS (American College of Cardiology, American Heart Association, European Heart Society, Heart Rhythm Society) klasifikācijās izšķir šādas ĀFib formas:
- pirmreizēja (pirmo reizi fiksēta ĀFib, kas ir dokumentāli vai klīniski pierādīta);
- recidivējoša (vairāk nekā divas fiksētas ĀFib epizodes);
- paroksismāla (spontāni izbeidzas bez ārēju faktoru ietekmes);
- persistējoša (ilgāka par septiņām diennaktīm un spontāni nebeidzas, nepieciešama farmakoloģiskā vai elektriskā kardioversija);
- permanenta (sinusa ritma atjaunošana nav iespējama vai ir iespējama uz īsu laiku, bet nav iespējama tā stabilizācija) [Jirgensons, Kalējs, 2010; Camm, 2010].
ĀFib ir zināma saistība ar daudziem kardiovaskulāriem stāvokļiem, kas var radīt labvēlīgu vidi ĀFib attīstībai un norisei. Turklāt šo stāvokļu kombinācijai ar ĀFib ir lielāks kardiovaskulāro notikumu risks nekā bez ĀFib [Kirchhof, 2014].
Par ĀFib pamatiemesliem uzskata šādas slimības: arteriālā hipertensija, KSS, sirds mazspēja, dilatācijas kardiomiopātija, sirdskaites, hipertireoze, cukura diabēts, HOPS, miega apnoja un hroniska nieru slimība. Lielāks ĀFib attīstību risks ir vecākiem pacientiem un pacientiem ar aptaukošanos un palielinātu ķermeņa masas indeksu [Camm, 2012; Kirchhof, 2014].
Visbiežāk pacientiem ar ĀFib tiek konstatēta arteriāla hipertensija (~50–70 %), sirds mazspēja (30–40 %), sirdskaites (~ 30 %), KSS (~ 20 %) un cukura diabēts (13–20 %) [Jirgensons, Kalējs, 2010; Lip, 2010; Connolly, 2013]. Nedaudz retāk sastop HNS – 10–15 % gadījumu, insults / TIL – 7–15 % gadījumu un vecus MI – 2–12 % gadījumu [Pisters, 2012].
Viens no ĀFib ārstēšanas mērķiem ir sinusa ritma atjaunošana jeb kardioversija, ko iespējams panākt divējādi: ar farmakoterapiju un nefarmakoloģiskām metodēm, no kurām visbiežāk tiek lietota elektriskā kardioversija [Kim, 2009; Ērglis, 2010; Camm, 2012].
Farmakoterapijai priekšroka tiek dota, ja ĀFib lēkme ilgst mazāk nekā 48 stundas, un elektrisko kardioversiju lieto, ja ir nezināma ilguma ĀFib lēkme vai lēkme ilgst mazāk nekā 48 stundas. Šajā gadījuma ir nepieciešama iepriekšēja profilaktiska antikoagulantu terapija vai transezofageāla ehokardiogrāfija īsi pirms procedūras, lai nepieļautu trombozi [Kim, 2009; Tavernier, 2012]. ĀFib ir saistīta ar nopietnām komplikācijām. Biežākās no tām ir išēmiskie insulti (ap 5 % gadā), sistēmiska embolija, sirds mazspējas pieaugums, samazinot sirds izsviedi par vidēji 20 %. Turklāt pacientiem ar ĀFib ir divreiz lielāka mirstība. ĀFib pasliktina dzīves kvalitāti un korelē ar demences attīstību [Camm, 2012].
Trombembolijas un asiņošanas risku izvērtējums pacientiem ar ĀFib. Trombembolijas risks visiem pacientiem ar ĀFib nav vienāds, tāpēc ir ļoti svarīgi katram pacientam to individuāli izvērtēt, lemt par antitrombotiskās terapijas nepieciešamību un noteikt ar to lietošanu saistītu asiņošanas risku [Lip, 2013]. Trombembolijas risku pacientiem ar ĀFib var izvērtēt, izmantojot vairākas skalas. 2012. gadā Eiropas Kardiologu biedrības atjaunotajās vadlīnijās šim nolūkam rekomendē izmantot CHA2DS2-VASc skalu, ar to aizstājot CHADS2 riska skalu [Jirgensons, Kalējs, 2010; Lip, 2010; Camm, 2012].
CHADS2 skalas apvieno tādus riska faktorus kā hroniska sirds mazspēja, arteriāla hipertensija, vecums, kas lielāks par 75 gadiem, cukura diabēts, insults un TIL. Par katru riska faktoru, izņemot insultu un TIL, tiek piešķirts viens punkts. TIL vai insults anamnēzē dod divus punktus. Maksimālais punktu skaits šajā skalā ir seši.
Antikoagulantu lietošana tiek parakstīta atkarībā no kopējā punktu skaita. Ja iegūti divi un vairāki punkti, perorālo antikoagulantu (POAK) lietošana ir absolūti indicēta. Pacientiem ar vienu punktu POAK lietošana ir apsverama. Savukārt, ja punktu skaits ir nulle, nekāda antitrombotiska terapija nav nepieciešama [Yarmohammadi, 2013].
Pasaulē ir bijuši vairāki pētījumi, kuros tika izvērtēts CHADS2 riska skalas izmantošanas drošums un pamatotība. Tika rasta korelācija starp CHADS2 riska skalā aprēķināto punktu skaitu un transezofageālajā ehokardiogrāfijā (TEE) konstatētajiem trombiem kreisajā priekškambarī (KP) vai kreisā priekškambara austiņā (KPA) pacientiem ar ĀFib pirms EKV. Trombu prevalence KP vai KPA auga līdz ar CHADS2 riska skalas punktu pieaugumu (2,3 %, 7 %, 8,5 %, 9,9 %, 12,3 % un 14,1 % atbilst 0, 1, 2, 3, 4, 5 un 6 punktiem, p = 0,01). Tomēr nozīmīgam pacientu skaitam ar CHADS2 riska skalas punktu skaitu nulle vai viens TEE tika konstatēti trombi KP vai KPA. Turklāt šī pētījuma laikā tika statistiski pierādīta divu riska faktoru – hroniskās sirds mazspējas un arteriālās hipertensijas – veicinošā iedarbība uz trombu veidošanos KP vai KPA [Camm, 2012; Yarmohammadi, 2013].
ACUTE Trial Substudy pētījumā CHADS2 skala tika izmantota ne tikai insulta riska izvērtēšanai, bet arī mirstības noteikšanai. Pacientiem ar CHADS2 riska skalā iegūto punktu skaitu ≤ 2 bija zema insultu (0,3 %) un nāves (0,5 %) incidence sešus mēnešus pēc EKV. Taču pacientiem ar CHADS2 punktu skaitu no trīs līdz seši mirstība ir lielāka pretstatā pacientu grupai ar CHADS2 punktu skaitu no nulles līdz diviem (4,3 % pret 0,5 %, p = 0,004).
Tādējādi CHADS2 riska skala var būt noderīga ne tikai trombembolijas riska izvērtēšanai, bet arī īstermiņa mirstības noteikšanai pacientiem ar ĀFib pēc EKV. Taču CHADS2 riska skalas izmantošana trombembolijas riska paredzēšanai pacientiem ar zemu risku nav attaisnojusies, jo tās nepilnības dēļ pacientiem, kam tika noteikts zems insulta risks (nulle punktu), insultu biežums ir lielāks par 1,5 % gadā [Olesen, 2012].
2012. gadā atjaunotajās Eiropas Kardiologu biedrības vadlīnijās tiek rekomendēta CHA2DS2-VASc skala. Šī skala tika papildināta ar vairākiem neatkarīgiem insulta riska faktoriem, kuri ļauj precīzāk un drošāk noteikt insulta risku arī ĀFib pacientiem. Bez CHADS2 skalā aplūkotajiem faktoriem CHA2DS2-VASc skalā tika iekļauti šādi būtiski riska faktori: dzimums, vaskulāras slimības un lielāka uzmanība pievērsta vecumam. Ir ļoti svarīgi izvērtēt visus nozīmīgos riska faktorus, jo katrs no tiem būtiski maina trombembolijas varbūtību. Tā, piemēram, pacientam ar sirds mazspēju un cukura diabētu trombembolijas risks ir 9,8 %, savukārt pacientam vecumā līdz 60 gadiem un bez sirds mazspējas – tikai 0,2 % [Boriani, 2007; Camm, 2012].
CHA2DS2-VASc skalā maksimālais punktu skaits ir deviņi. Turpmāk minētie riska faktori: sirds mazspēja, arteriāla hipertensija, cukura diabēts, vaskulāras slimības (miokarda infarkts, perifēro artēriju slimība, aortas ateroskleroze, koronāro artēriju un miega artēriju ateroskleroze), vecums no 65 līdz 74 gadiem, sieviešu dzimums dod pa vienam punktam. Divi punkti tiek piešķirti par vecumu, kas ir mazāks vai vienāds ar 75 gadiem, un insultu, TIL vai trombemboliju.
Lēmums par antikoagulantu lietošanu, līdzīgi kā ar CHADS2 skalu, tiek pieņemts, izvērtējot kopējo punktu skaitu. Ja ir viens punkts, antikoagulantu terapija ir individuāli apsverama, ja ir divi un vairāk punktu, absolūti indicēta, ja punktu skaits ir nulle, indikāciju antitrombotiskai terapijai nav [Ērglis, 2013].
CHA2DS2-VASc skalas efektivitāte, salīdzinot ar CHADS2 skalu, tika pierādīta pētījumā, kurā tika konstatēts, ka pacienti, kam CHADS2 punktu skaits ir nulle, ne vienmēr atbilst zema riska grupai. Insultu / trombemboliju skaits šiem pacientiem pēc gada ir robežās no 0,84 % (CHA2DS2-VASc = 0) līdz 3,2 % (CHA2DS2-VASc = 3) [Lip, 2013].
Pašlaik Eiropā lielākajā daļā klīniku (93,2 %) trombembolijas riska izvērtēšanai lieto CHA2DS2-VASc skalu, savukārt CHADS2 skala joprojām tiek izmantota 6,6 % klīniku [Connolly, 2013].
Antikoagulantu lietošana ir saistīta ar paaugstinātu asiņošanas risku, tāpēc pacientiem, kam jālieto POAK, ir jāizvērtē arī asiņošanas risks. Šim nolūkam parasti izmanto divas skalas: HAS-BLED un HEMORR2HAGES. Praksē visbiežāk priekšroka tiek dota HAS-BLED skalai tās vienkāršās un ērtās lietošanas dēļ. Šīs skalas nav domātas, lai atceltu POAK, bet gan lai pēc iespējas novērstu ietekmējamos asiņošanas riska faktorus un pievērstu pacientam īpašu uzmanību [Camm, 2012; Ērglis, 2013; Connolly, 2013].
Trombembolijas profilakse pacientiem ar ātriju fibrilāciju un tās efektivitāte. Viens no būtiskiem ārstēšanas mērķiem un paņēmieniem ĀFib gadījumā ir trombembolijas prevencija, ko iespējams panākt, lietojot antikoagulantus. Jaunākajās vadlīnijās ir ieteikts lietot ne tikai K vitamīna antagonistu varfarīnu, bet arī jaunos perorālos antikoagulantus to augstās efektivitātes, drošības un ērtās lietošanas dēļ [Connolly, 2013; Gallego, 2014].
ĀFib pacientiem trombembolijas profilaksē ir svarīgi izšķirt regulāro un ilgstošo perorālo antikoagulantu lietošanu un īslaicīgu POAK lietošanu pirms un pēc plānveida EKV [Camm, 2012; Ērglis, 2013].
2012. gada atjaunotajās Eiropas Kardiologu biedrības vadlīnijās ilgstošas trombembolijas profilaksei ĀFib pacientiem iesaka lietot šādus POAK: varfarīnu, dabigatrānu, rivaroksabānu un apiksabānu. Pēdējie trīs tiek dēvēti par jaunajiem perorālajiem antikoagulantiem (JPOAK) [Camm, 2012].
Aspirīna un / vai klopidogrēla lietošana trombembolijas profilaksē ir pieļaujama tikai gadījumos, ja kādu iemeslu dēļ nav iespējams lietot POAK [Yarmohammadi, 2013].
Vairākos pētījumos tika pierādīts, ka varfarīnam, salīdzinot ar aspirīnu, ir lielāka efektivitāte insulta riska mazināšanā. Varfarīns samazina insulta risku par 64 %, bet aspirīns – tikai par 22 %. Mirstība, lietojot varfarīnu, samazinās par 26 %, bet aspirīna lietotājiem tā samazinās tikai par 14 %. Savukārt asiņošanas, tostarp arī intrakraniālas asiņošanas, risks abiem preparātiem ir līdzīgs [Lip, 2013; Gallego, 2014].
Eiropā priekšroka joprojām tiek dota varfarīnam, no JPOAK visbiežāk lietotais preparāts ir dabigatrāns, kā nākamais ir rivaroksabāns. Vismazāk lietots ir apiksabāns [Kirchhof, 2014; Camm, Savelieva, 2014]. Lietojot varfarīnu, ir nepieciešama regulāra INR kontrole. Pacientiem ar nevalvulāru ĀFib optimālais INR ir robežās starp 2,0 un 3,0, kas nodrošina labu trombembolijas profilaksi un ir ar nelielu asiņošanas risku. Tomēr šāda INR uzturēšana bieži sagādā grūtības, jo varfarīns mijiedarbojas ar daudziem medikamentiem, pārtikas produktiem un alkoholu. Klīniskie pētījumi rāda, ka 60–65 % pacientu, kas lieto varfarīnu, ir ārpus terapeitiskā INR intervāla [Kirchhof, 2014].
Antikoagulantu izvēlē svarīga nozīme ir arī pacienta vēlmēm. 84,3 % pacientu, kas lieto JPOAK, ir izvēlējušies šīs grupas preparātus, zinot par to priekšrocībām. Savukārt tie pacienti, kas lieto varfarīnu, būtu ar mieru pāriet uz JPOAK tikai komplikāciju vai nekontrolēta INR dēļ [Lip, 2013].
Pacientiem ar ĀFib, kam paredzēta plānveida EKV, sinusa ritma atjaunošanai vismaz trīs nedēļas pirms EKV jālieto POAK – varfarīns – ar nosacījumu, ka INR nepārtraukti būs robežās starp 2,0 un 3,0, savukārt, parakstot dabigatrānu 150 mg divas reizes dienā, ir jāpārliecinās par pacienta līdzestību. Pēc sekmīgas EKV attiecīgais POAK jāturpina lietot vismaz četras nedēļas (vēlams trīs mēnešus), ja nav indikāciju ilgstošai POAK lietošanai. Citus JPOAK pirms EKV iespējams lietot, tikai veicot transezofageālo ehokardiogrāfiju īsi pirms EKV, jo par minēto preparātu drošumu nav publicētu pētījumu [Camm, 2012; Ērglis, 2013].
Eiropā dažādiem medicīnas centriem ir atšķirīga trombembolijas profilakse pirms plānveida EKV. Trīs nedēļu kursu ar POAK pacientiem ar ĀFib, kas ilgāka par 48 stundām, lieto tikai 71,7 % slimnīcu. Savukārt 28,3 % medicīnas centru pirms EKV veic transezofageālo ehokardiogrāfiju [Tavernier, 2012].
RE-LY pētījumā dabigatrāns 110 mg devā insulta un sistēmiskas embolijas riska samazināšanā ir izrādījies tikpat efektīvs kā varfarīns (1,53 % pret 1,69 % gadā). Dabigatrānam, salīdzinot ar varfarīnu, ir mazāks asiņošanas risks (nozīmīga asiņošana 2,71 % pret 3,36 %, intrakraniāla asiņošana 0,23 % pret 0,74 %, ekstrakraniāla asiņošana 2,51 % pret 2,67 % gadā). Taču, lietojot dabigatrānu, ir lielāks gastrointestinālā trakta asiņošanas un miokarda infarkta risks, salīdzinot ar varfarīnu (1,12 % pret 1,02 % un 0,82 % pret 0,64 % gadā). Dabigatrānam, salīdzinot ar varfarīnu, ir arī zemāka mirstība (3,75 % pret 4,13 % gadā) [Camm, 2012; Connolly, 2013].
Dabigatrānam, kura deva ir 150 mg, salīdzinot ar varfarīnu, insulta un sistēmiskās embolijas novēršanā efektivitāte ir vēl lielāka (1,11 % pret 1,69 % gadā). Dabigatrānam ir zemāks klīniski nozīmīgas (3,11 % pret 3,36 %) un intrakraniālas asiņošanas risks (0,30 % pret 0,74 %), bet ir biežāka gastrointestinālā trakta (1,51 % pret 1,02 %) un ekstrakraniāla asiņošana (2,84 % pret 2.67 %). Mirstība ir lielāka, lietojot varfarīnu, taču MI relatīvi biežāks ir, lietojot dabigatrānu (0,81 % pret 0,64 %). Dabigatrāns statistiski ticami samazina vaskulāro mirstību un vienīgais no JPOAK (deva – 150 mg) statistiski ticami samazina išēmisko insultu skaitu, salīdzinot ar varfarīnu.
ROCKET-AF pētījumā tika analizēta rivaroksabāna efektivitāte, salīdzinot ar varfarīnu. Insultu un sistēmiskas trombembolijas risks abiem preparātiem ir līdzīgs: rivaroksabānam – 2,1 % gadā un varfarīnam – 2,4 % gadā. Gastrointestinālā trakta un nozīmīgas asiņošanas risks ir lielāks, lietojot rivaroksabānu (3,2 % pret 2,2 % un 3,6 % pret 3,4 % gadā), taču intrakraniālas asiņošanas risks, lietojot šo preparātu, ir zemāks nekā varfarīnam (0,5 % pret 0,7 % gadā). Rivaroksabānam ir relatīvi mazāks MI risks nekā varfarīnam (1,9 % gadā pret 2,2 % gadā) [Camm, 2012; Pattel, 2011].
Līdzīgi kā citiem JPOAK, arī apiksabānam ir pierādīta efektivitāte insulta un sistēmiskas embolijas profilaksē. ARISTOTLE pētījumā apiksabāns bija pārāks par varfarīnu (1,27 % pret 1,6 % gadā). Savukārt visa veida asiņošanu (nozīmīga asiņošana 2,13 % pret 3,09 %, intrakraniāla asiņošana 0,33 % pret 0,8 %, gastrointestinālā trakta asiņošana 0,76 % pret 0,86 %) un MI (0,53 % pret 0,61 %) risks apiksabānam ir zemāks, salīdzinot ar varfarīnu. Apiksabānam ir zemāka visa veida mirstība – 3,52 % gadā pret 3,94 % varfarīnam, taču nav statistiski ticamas ietekmes uz kardiovaskulāro mirstību [Tendera, 2012; Camm, Savelieva, 2014].
Kardiovaskulārie notikumi ĀFib pacientiem pēc elektriskās kardioversijas. Pasaulē ir veikti vairāki pētījumi, kuros noteikti kardiovaskulārie notikumi pacientiem ar ĀFib pēc kardioversijas. Apsekojot ĀFib pacientus vienu gadu pēc elektriskās kardioversijas, 2 % no pētījumā iekļautajiem slimniekiem bija miruši. Kardiovaskulārie notikumi pēc EKV kopumā tika reģistrēti 5,7 % gadījumu, AKS tika konstatēts 2,4 % gadījumu un trombembolijas tika novērotas 1,7 % gadījumu. Asiņošanas biežums pacientiem ir bijis 1,8 % gadījumu. ĀFib simptomus šajā laikā ir jutuši 30 % pacientu [Apostolakis, 2013].
Turpretī Flec-SL pētījumā iekļautajiem pacientiem sešus mēnešus pēc KV cerebrovaskulārie notikumi un asiņošanas tika konstatētas daudz retāk: insults / TIL – 0,9 % un asiņošana – 0,8 % gadījumu. Turklāt insulta risks ĀFib pacientiem nebija atkarīgs no trombembolijas profilakses veida – antikoagulantu lietošana vai TEE [Camm, 2010].
Apsekojot pacientus no ROCKET-AF pētījuma, kas trombembolijas profilaksē saņēma rivaroksabānu un kam ritma atjaunošanai izmantoja KV vai katetrablāciju, tika noteikts šāds kardiovaskulāro notikumu risks pēc procedūras: pirmajās 30 dienās insults un sistēmiska embolija tika konstatēta 0,93 % pacientu, mirstība kardiovaskulāru iemeslu dēļ – 1,25 % pacientu neatkarīgi no tā, vai anamnēzē bija insults vai sistēmiskā embolija. Klīniski nozīmīga asiņošana tika reģistrēta 2,08 % pacientu bez sistēmiskas embolijas un insultiem pirms procedūras, savukārt ar pozitīvu anamnēzi – 2,18 % pacientu. Hospitalizācijas biežums bija lielāks tiem, kam pirms KV vai ablācijas ir bijušas trombembolijas epizodes, – 6,0 % pret 6,85 %.
Ilgtermiņa (ilgāk par 30 dienām) iznākums bija šāds: insults un sistēmiskā embolija – 0,93 % gadījumu, mirstība no kardiovaskulāriem iemesliem – 0,62 % gadījumu. Atšķirības starp klīniski nozīmīgu asiņošanu pacientiem, kam bijusi vai nav bijusi pozitīva anamnēze, bijušas nelielas – 13,49 % pret 13,71 %. Savukārt hospitalizācijas biežuma atšķirības ir lielākas – 19,0 % pret 23,68 % [Camm, 2012; Pisters, 2012; Lip, 2013].
Materiāls un metodes
Pētījums tika klasificēts kā prospektīvi retrospektīvs longitudināls pētījums. Tajā tika iekļauti 260 retrospektīvie un 225 prospektīvie Paula Stradiņa Klīniskās universitātes slimnīcas Latvijas Kardioloģijas centra 11. nodaļas pacienti ar ĀFib, kam 2013. gada laikā sinusa ritma atjaunošanai tika veikta elektriskā kardioversija. Vienu, trīs un sešus mēnešus pēc EKV tika veiktas aptaujas pa tālruni. Pacienti tika novēroti vidēji 80 dienu.
Pirms pētījuma sākšanas tika izstrādātas divas anketas. Ar vienu no tām bija paredzēts iegūt anamnestiskus un objektīvus datus, kā arī informāciju par lietotajiem antikoagulantiem. Otrā anketa tika izstrādāta kā aptauja pa tālruni pacientu kontrolei pēc viena, trim un sešiem mēnešiem.
Stājoties nodaļā EKV veikšanai, pacients tika intervēts. Šīs sarunas laikā tika iegūta šāda informācija:
- pamatinformācija: vārds, uzvārds, kontakttālruņa numurs, vecums, dzimums, svars;
- ĀFib anamnēze: ĀFib ilgums, iepriekšējas ĀFib epizodes – medikamentozās vai elektriskās kardioversijas lietojums;
- slimību anamnēze: AH, smēķēšana, CD, metabolais sindroms, HSM, vecs MI, insults, TIL, HNS;
- ambulatori lietotie antikoagulanti / antiagreganti: aspirīns, varfarīns, dabigatrāns, rivaroksabāns, apiksabāns.
No pacientu medicīniskajām kartēm, izmantojot Paula Stradiņa Klīniskās universitātes slimnīcas arhīva resursus, tika iegūti šādi dati:
- asins analīžu rezultāti (glikoze, triglicerīdi, ABL, ZBL, INR);
- EKV datums, rezultāts;
- antikoagulantu rekomendācijas pēc EKV: varfarīns, dabigatrāns, rivaroksabāns, apiksabāns.
Pēc viena, trim un sešiem mēnešiem visiem pētījumā iekļautajiem pacientiem tika veikta kontrole, aptaujājot pa tālruni. Tie pacienti, ar kuriem neizdevās sazināties pa tālruni, zvanot trīs dažādās nedēļas dienās dažādā laikā, netika iekļauti pētījumā.
Aptauja tika veikta saskaņā ar iepriekš izstrādātu anketu. To izmantojot, no pacientiem tika iegūta šāda informācija:
- sinusa ritms aptaujas dienā, paroksisma biežums konkrētā laikposmā (viena, trīs vai sešu mēnešu laikā);
- hospitalizācijas iemesli kontroles laikā: AKS, ASM / HSM dekompensācija, PATE / DVT, citu artēriju trombembolijas, cerebrāls infarkts, hemorāģisks insults, atkārtotas ĀFib, kopējais hospitalizāciju skaits;
- asiņošanas: dentālas, nazofaringeālas, gastrointestinālā trakta, ģenitouretrālās sistēmas, mīksto audu brūces, intracerebrālās; asiņošanas tika novērtētas atbilstoši žurnālā Journal of Society of Thrombosis and Haemostasis 2005. un 2011. gadā publicētajām klasifikācijām [Schulmann, 2005; Liew, Douketis, 2013];
- lietotie antikoagulanti.
Datu iegūšanai un apstrādei tika saņemta Rīgas Stradiņa universitātes Ētikas komitejas atļauja.
Visiem pacientiem pirms iekļaušanas pētījumā tika izdalīti informatīvie materiāli divās valodās (latviešu un krievu), kuros tika izskaidrota pētījuma būtība. Savu vēlmi piedalīties šajā pētījumā pacienti apliecināja ar parakstu.
Visi pētījumā iegūtie dati tika ievadīti un apstrādāti datorprogrammā IBM SPSS Statistics 20 (ASV), un palīgaprēķini tika veikti, izmantojot Microsoft Excel 2010 datorprogrammu.
SPSS aprakstošajā daļā tika izmantoti kopsavilkumi tabulu veidā, vidējais aritmētiskais un standartnovirze. Statistiski izvērtējot kvalitatīvus datus, izmantoja Fišera testu. Par statistiski ticamu uzskatāma p vērtība, kas mazāka par 0,05. Efektivitātes izvērtējumam laikposmā izmantoja Kaplana-Maijera metodi.
Pētījuma rezultāti
Kopumā pētījumā tika iekļauti 485 pacienti, no tiem viena mēneša kontrolē piedalījās 225 pacienti (46 %), triju mēnešu kontrolē 192 (39,6 %) un sešu mēnešu kontrolē 151 (31,1 %) pacients.
Pacienti bija vecumā no 31 līdz 92 gadiem, vidējais vecums – 64,72 ± 9,5 gadi. Pēc dzimuma pacientu iedalījums bija šāds: 205 sievietes (42,3 %) un 280 vīrieši (57,7 %). ĀFib ilgums, kas mazāks par 30 dienām, ir bijis 163 (33,6 %) pacientiem, no 30 līdz 90 dienām – 114 (23,5 %) pacientiem, vairāk nekā 90 dienu – 63 (13 %) pacientiem, vairāk nekā 180 dienu – 141 (29,1 %) pacientam, nezināma ilguma – četriem (0,8 %) pacientiem. Paroksisma ilgums mazāks par 24 stundām bija 48 (9,9 %) pacientiem, no 24 līdz 48 stundām – 34 (7 %) pacientiem, no 48 stundām līdz 7 dienām – 30 (6,2 %) pacientiem, vairāk nekā septiņas dienas – 373 (76,9 %) pacientiem. Iepriekš medikamentozā kardioversija tika lietota 302 (62,3 %) pacientiem un EKV tika veikta 205 (42 %) pacientiem.
Četrsimt trīs pacientiem (83,1%) anamnēzē bija arteriāla hipertensija, 323 (66,6 %) – hroniska sirds mazspēja, 61 (12,6 %) – cukura diabēts, 59 (12,2 %) – vecs miokarda infarkts, 27 (5,6 %) – insults, 19 (3,9 %) – TIL, 78 (16,1 %) – metabolais sindroms, 44 (9,1 %) – smēķēšana, 58 (12 %) – hroniska nieru slimība.
Visiem pētījumā iekļautajiem pacientiem tika aprēķināts trombembolijas risks ar CHA2DS2-VASc skalu (sk. 1. tab.). Viens punkts bija 38 (7,8 %) pacientiem, ≥ 2 punkti – 447 (92,2 %) pacientiem. Vidējais punktu skaits ir 3,8.
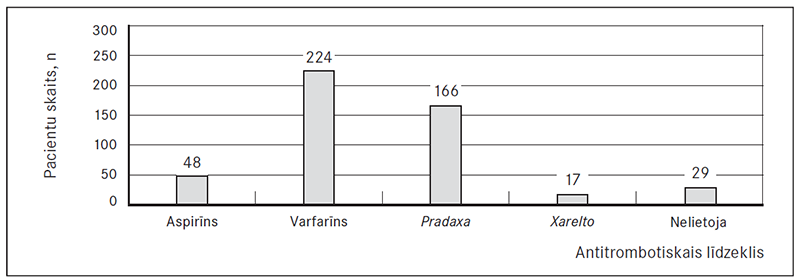
Ambulatori pacientiem tika parakstīti šādi antiagreganti un antikoagulanti: 48 (9,9 %) pacienti ir lietojuši aspirīnu, 224 (46,2 %) – varfarīnu, Pradaxa (dabigatrāna eteksilāts) – 166 (34,2 %), Xarelto (rivaroksabāns) – 17 (3,5 %), citus – viens (0,5 %) pacients. Nekādu antitrombotisku terapiju pirms EKV nav saņēmuši 29 (6 %) pacienti (sk. 1. att.).
Lietojot varfarīnu, vidējais INR ir bijis 2,15 ± 1,2. Minimālais INR bija 0,8 un maksimālais – 6,2.
1. tabula. Pacientu trombembolijas riska novērtējums ar CHA2DS2-VASc skalu / Tromboembolic risk stratification in patients according CHA2DS2-VASc scale
| Punktu skaits | Pacientu skaits, n | Pacientu skaits, % |
|---|---|---|
| 1 | 38 | 7,8 |
| 2 | 51 | 10,7 |
| 3 | 125 | 25,8 |
| 4 | 148 | 30,5 |
| 5 | 49 | 10,0 |
| 6 | 37 | 7,6 |
| 7 | 24 | 4,9 |
| 8 | 13 | 2,7 |
| 9 | 0 | 0 |
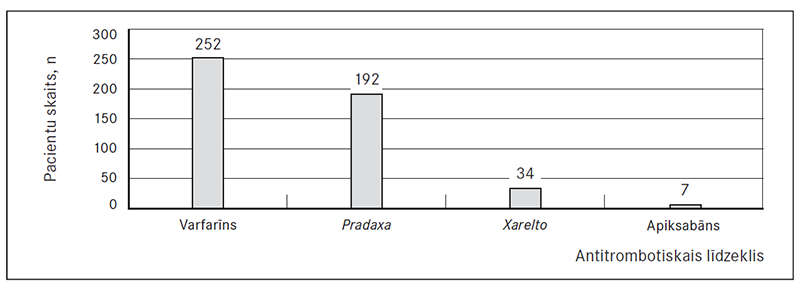
Pēc EKV pacientiem tika ieteikts lietot šādus antikoagulantus: varfarīnu 252 (52 %) pacientiem, Pradaxa – 192 (39,6 %) pacientiem, Xarelto – 34 (7 %) un Eliquis (apiksabānu) – septiņiem (1,4 %) pacientiem (sk. 2. att.). Pirmā mēneša laikā pēc EKV tika reģistrēti divi (0,9 %) akūtie koronārie sindromi, viena (0,4 %) HSM dekompensācija, viena (0,4 %) PATE / DVT un 42 (19,4 %) ĀFib recidīvi. Neviens cerebrāls infarkts un hemorāģisks insults šajā laikā netika novērots. Pirmā mēneša laikā pēc EKV pavisam bija 38 hospitalizācijas gadījumi.
Mēnesi pēc EKV aspirīnu lietoja 20 (8,8 %) pacienti, varfarīnu – 101 (44,7 %) pacients, Pradaxa – 85 (37,6 %), Xarelto – 14 (6,2 %), citus – divi (0,9 %) pacienti. Nekādus antitrombotiskus medikamentus nav lietojuši četri (1,8 %) pacienti.
Šajā laikā tika konstatētas piecas dentālas (31,25 %), viena nazofaringeāla (6,25 %), viena gastrointestinālā trakta (6,25 %) un deviņas mīksto audu brūču asiņošanas (56,25 %) (sk. 2. tab.).
No visiem pacientiem, kas saņēma varfarīnu pirmā mēneša laikā pēc EKV, asiņošanas komplikācija attīstījās 6,2 % pacientu. Pradaxa lietotājiem asiņošanas tika konstatēta 1,2 % gadījumu, savukārt, lietojot Xarelto, 7,1 % gadījumu.
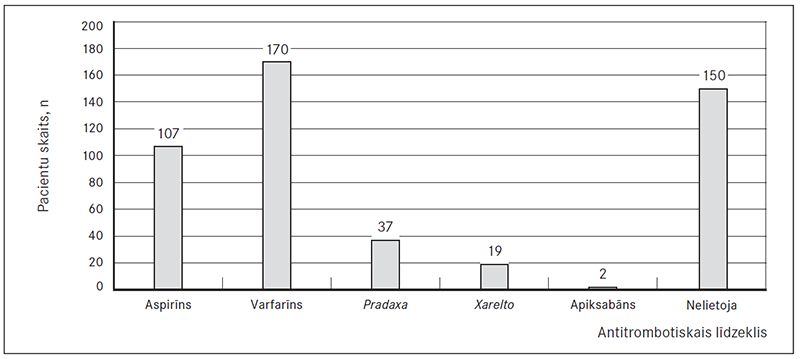
Triju mēnešu kontrolē tika reģistrēts viens (0,5 %) AKS, viena (0,5 %) HSM dekompensācija, viena (0,5 %) PATE / DVT, 30 (25,6 %) ĀFib recidīvi. Neviens cerebrāls infarkts un hemorāģisks insults šajā laikā netika novērots. Kopumā triju mēnešu kontrolē tika reģistrētas 44 hospitalizācijas. Trīs mēnešus pēc EKV aspirīnu lietoja 107 (22 %) pacienti, varfarīnu – 170 (35 %), Pradaxa – 37 (7,6 %), Xarelto – 19 (3,9 %), apiksabānu – 2 (0,4 %) pacienti. Nekādus antitrombotiskus medikamentus nav lietojuši 150 (31,1 %) pacienti (sk. 3. att.).
Šīs kontroles laikā tika novērotas piecas (2,3 %) dentālas asiņošanas, viena (0,5 %) nazofaringeāla, viena (0,5 %) uroģenitāla un astoņas (3,7 %) mīksto audu brūču asiņošanas. Neviena gastrointestināla un intracerebrāla asiņošana nav bijusi (sk. 3. tab.).
Trīs mēnešus pēc EKV 3,13 % pacientu, kas lietoja aspirīnu, bija reģistrētas asiņošanas. Lietojot varfarīnu, šī komplikācija attīstījās 4,69 % pacientu. Pradaxa un Xarelto lietotājiem šajā laikā neviena asiņošanas epizode netika reģistrēta.
1. attēls. Dažādu antitrombotisko līdzekļu lietošana pirms elektriskās kardioversijas / Usage of different antitrombotic drugs before electrical cardioversion
2. attēls. Dažādu antitrombotisko līdzekļu lietošana pēc elektriskās kardioversijas / Usage of different antitrombotic drugs after electrical cardioversion
2. tabula. Asiņošanas biežums, lietojot dažādus antitrombotiskos līdzekļus vienu mēnesi pēc elektriskās kardioversijas / Rate of bleeding one month after cardioversion with different anticoagulants
| Asiņošanas veids | Antikoagulants | Kopā | p vērtība | |||
|---|---|---|---|---|---|---|
| Aspirīns | Varfarīns | Pradaxa | Xarelto | |||
| Dentāla, n | 0 | 4 | 1 | 0 | 5 | 0,692 |
| Nazofaringeāla, n | 0 | 1 | 0 | 0 | 1 | 1,00 |
| Gastrointestinālā trakta, n | 0 | 0 | 0 | 1 | 1 | 0,089 |
| Uroģenitālās sistēmas, n | 0 | 0 | 0 | 0 | 0 | — |
| Mīksto audu brūces, n | 0 | 9 | 0 | 0 | 9 | 0,045 |
| Intracerebrāla, n | 0 | 0 | 0 | 0 | 0 | — |
| Kopā | 0 | 14 | 1 | 1 | 16 | 0,016 |
3. attēls. Dažādu antitrombotisko līdzekļu lietošana trīs mēnešus pēc elektriskās kardioversijas / Usage of different antitrombotic drugs three months after electrical cardioversion
3. tabula. Asiņošanas biežums, lietojot dažādus antitrombotiskos līdzekļus trīs mēnešus pēc elektriskās kardioversijas / Rate of bleeding three month after cardioversion with different anticoagulants
| Asiņošanas veids | Antikoagulants | Kopā | p vērtība | |||
|---|---|---|---|---|---|---|
| Aspirīns | Varfarīns | Pradaxa | Xarelto | |||
| Dentāla, n | 2 | 3 | 0 | 0 | 5 | 0,764 |
| Nazofaringeāla, n | 1 | 0 | 0 | 0 | 1 | 0,635 |
| Gastrointestinālā trakta, n | 0 | 0 | 0 | 0 | 0 | — |
| Uroģenitālās sistēmas, n | 0 | 1 | 0 | 0 | 1 | 0,557 |
| Mīksto audu brūces, n | 3 | 5 | 0 | 0 | 8 | 0,571 |
| Intracerebrāla, n | 0 | 0 | 0 | 0 | 0 | — |
| Kopā | 6 | 9 | 0 | 0 | 15 | 0,119 |
Sešu mēnešu kontrolē bija konstatēts viens (0,7 %) AKS, trīs (2,1 %) HSM, viena (0,7 %) PATE / DVT, divi (0,9 %) cerebrāli infarkti, 53 (36,3 %) ĀFib recidīvi. Viens (0,7 %) pacients ir miris. Šīs kontroles laikā kopumā bija 58 hospitalizācijas.
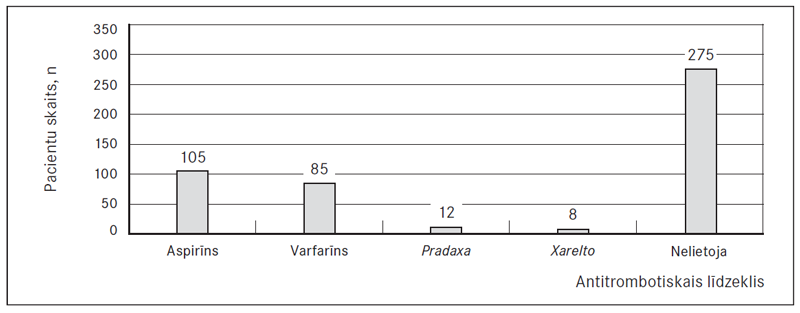
Antikoagulantus un antiagregantus lietoja šādi: aspirīnu – 105 (21,7 %) pacienti, varfarīnu – 85 (17,5 %), Pradaxa – 12 (2,5 %), Xarelto – 8 (1,6 %) pacienti. Divsimt septiņdesmit pieci (56,7 %) nelietoja nekādus minēto grupu preparātus (sk. 4. att.).
Sešus mēnešus pēc EKV bija četras (2,7 %) dentālas asiņošanas, trīs (2,1 %) nazofaringeālas, viena (0,7 %) uroģenitālās sistēmas un septiņas (4,8 %) mīksto audu brūču asiņošanas. Nav bijusi neviena gastrointestinālā trakta un intracerebrāla asiņošana (sk. 4. tab.).
Sešu mēnešu kontrolē 3,31 % pacientu, kas saņēma aspirīnu, bija konstatētas asiņošanas epizodes. Lietojot varfarīnu, asiņošanas novēroja 6,62 % pacientu.
4. attēls. Dažādu antitrombotisko līdzekļu lietošana sešus mēnešus pēc elektriskās kardioversijas / Usage of different antitrombotic drugs six months after electrical cardioversion
4. tabula. Asiņošanas biežums, lietojot dažādus antitrombotiskos līdzekļus sešus mēnešus pēc elektriskās kardioversijas / Rate of bleeding three month after cardioversion with different anticoagulants
| Asiņošanas veids | Antikoagulants | Kopā | p vērtība | |||
|---|---|---|---|---|---|---|
| Aspirīns | Varfarīns | Pradaxa | Xarelto | |||
| Dentāla, n | 1 | 3 | 0 | 0 | 4 | 0,637 |
| Nazofaringeāla, n | 1 | 2 | 0 | 0 | 3 | 0,855 |
| Gastrointestinālā trakta, n | 0 | 0 | 0 | 0 | 0 | — |
| Uroģenitālās sistēmas, n | 0 | 1 | 0 | 0 | 1 | 0,629 |
| Mīksto audu brūces, n | 3 | 4 | 0 | 0 | 7 | 0,842 |
| Intracerebrāla, n | 0 | 0 | 0 | 0 | 0 | — |
| Kopā | 5 | 10 | 0 | 0 | 15 | 0,067 |
Diskusija
Pētījumā iekļautajiem pacientiem tādus kardiovaskulārus riskus kā CD, HNS, vecs MI un insulta / TIL sastopamība atbilst literatūrā aprakstītajiem datiem. Analizējot atsevišķi insultu biežumu, šajā pētījumā tas tika konstatēts zemāks nekā citos pētījumos – 5,6 % pret 8,4 % [Pisters, 2012; Camm, Savelieva, 2014]. Daudz biežāk tika konstatēta AH (83,1 %) un HSM (66 %). Pēc literatūras datiem AH tiek konstatēta 50–70 % pacientu ar ĀFib [Jirgensons, Kalējs, 2010; Camm, 2010; Pisters, 2012], 30–40 % pacientu – ar HSM [19; 21]. AH un HSM pieder pie ĀFib pamatcēloņiem [Jirgensons, Kalējs, 2010; Camm, 2012], ar ko varētu skaidrot to biežāko sastopamību pacientiem ar ĀFib.
Aprēķinot klīnisko notikumu risku ar CHA2DS2-VASc skalu, viens punkts bija 7,8 % (38) pacientu un ≤ 2 punkti – 92 % (447) pacientu. Līdzīgos pētījumos aprēķinātais trombembolijas risks, izmantojot minēto skalu, bija zemāks: nulle punktu konstatēja 7,8 % [Kirchhof, 2014] un ≤ 2 punkti bija 92,2 % pacientu, ko var izskaidrot ar zemāku HSM un AH sastopamību – HSM tika konstatēta 29 % un AH – 71 % gadījumu [Kirchhof, 2014].
Analizējot antikoagulantu un antiagregantu lietošanu pirms EKV, varfarīna lietošanas biežums saskanēja ar literatūrā aprakstītajiem datiem. Jauniem perorāliem antikoagulantiem priekšroka tiek dota daudz biežāk nekā citiem pasaulē: 37,7 % (no tiem Pradaxa bija 34,2 % un Xarelto 3,5 % pacientu) pret 21,9 % [Kirchhof, 2014]. Sešos procentos gadījumu pacienti ir lietojuši aspirīnu, un 6 % pacientu antitrombotisko terapiju vispār nav saņēmuši. Pēc literatūras datiem antitrombotiskās terapijas trūkums pirms EKV ir daudz biežāks – 32,3 % gadījumu [Pisters, 2012; Kirchhof, 2014].
16,9 % pacientu, kam tika veikta EKV, ĀFib paroksisma ilgums bija mazāks par 48 stundām, ar ko varētu skaidrot tos 12 % gadījumu, kad pacienti pirms EKV nav saņēmuši antikoagulantus.
Profilaktiskās antitrombotiskās terapijas lietojums pēc EKV ir augsts. Visiem pacientiem pēc EKV tika rekomendēts lietot antikoagulantus (52 % – varfarīns, 33,2 % – Pradaxa, 4,9 % – Xarelto un 1,4 % – Eliquis). Literatūrā ir norādīts, ka šāda terapija pēc EKV pasaulē tiek rekomendēta 93 % pacientu [Pisters, 2012; Kirchhof, 2014]. Lietotā antitrombotiskā terapija ne vienmēr atbilda vadlīnijās minētajām rekomendācijām, jo Xarelto un Eliquis lietošanas efektivitāte pacientiem pēc EKV nav pierādīta, tāpēc Eiropas Kardiologu biedrība 2012. gada vadlīnijās šim nolūkam iesaka lietot tikai varfarīnu un dabigatrānu [Camm, 2012; Ērglis, 2013].
Vienu mēnesi pēc EKV antikoagulantu terapiju saņēma 88,5 % pacientu (44,7 % – varfarīnu, 43,8 % – JPOAK), savukārt 8,8 % pacientu lietoja aspirīnu. Pēc trim mēnešiem antikoagulantus lietoja 50,6 % pacientu (36,5 % – varfarīnu, 18,3 % – JPOAK), 29,2 % gadījumu tika lietots aspirīns. Pēc sešiem mēnešiem pēc EKV antikoagulantu terapiju turpinājuši 46,3 % pacientu, JPOAK no tiem bija 11,2 % gadījumu. Aspirīna lietošana pieauga līdz 37,1 %.
Ņemot vērā trombembolijas risku, kas tika aprēķināts ar CHA2DS2-VASc riska skalu, antikoagulantu pielietojumam trīs un sešus mēnešus pēc EKV bija jābūt lielākam, jo 92,2 % pacientu bija ≥ 2 punkti.
Analizējot antikoagulantu lietošanu pacientiem pirms un pēc EKV, varfarīnu lietoja retāk un JPOAK lietoja biežāk, salīdzinot ar literatūras datiem [Camm, 2010; Kirchhof, 2014].
Kardiovaskulārie notikumi tika noteikti vienu, trīs un sešus mēnešus pēc EKV. Tomēr ne visiem pacientiem, kas tika iekļauti pētījumā, datu apstrādes un analīzes brīdī bija pagājis trīs vai sešu mēnešu kontroles laikposms, kas tādējādi samazināja pacientu skaitu konkrētajās kontroles grupās.
Salīdzinot ar literatūras datiem, iegūtais kardiovaskulāro notikumu biežums ir zems. Pēc literatūras datiem pacientiem pēc EKV AKS tika konstatēts 2,4 % gadījumu, trombembolijas epizodes – 1,7 % un cerebrovaskulārie notikumi – 5,7 % gadījumu [20]. Šī pētījuma laikā atkarībā no kontroles laika AKS tika konstatēts 0,5–0,9 % gadījumu, PATE / DVT – 0,4–0,7 % un cerebrovaskulārie notikumi – 1,4 % gadījumu, turklāt abi insulti tika reģistrēti sešus mēnešus pēc EKV. ĀFib recidīvu biežums atkarībā no kontroles laika novērots 20,5–36,4 % pacientu un literatūrā minētais biežums ir 30–35 % [Tielemann, 1998; Pisters, 2012].
Neliels kardiovaskulāro notikumu skaits var būt saistīts ar augstu antikoagulantu lietošanu pēc EKV (100 % pret 93 %) un lielu JPOAK īpatsvaru [Pisters, 2012].
Tomēr iegūtos rezultātus zināmā mērā var skaidrot ar dažiem šī pētījuma ierobežojumiem. Pirmkārt, ne visi pētījumā iekļautie pacienti tika apsekoti trīs un sešus mēnešus pēc EKV, jo ne visiem šis laikposms ir pagājis. Tādēļ pēc visu pacientu apsekošanas kardiovaskulāro notikumu skaits varētu mainīties. Otrkārt, rezultāti tika iegūti, veicot aptauju pa tālruni, tāpēc šie notikumi nav dokumentāri pierādīti.
Viens no reģistrētajiem insultiem ir noticis aspirīna lietošanas laikā, savukārt otrs – lietojot varfarīnu. Abiem pacientiem bija augsts trombembolijas risks (CHA2DS2-VASc riska skalā ≥ 2 punktiem). Kaut gan bija augsts trombembolijas risks, pirmajā gadījumā trīs mēnešus pēc EKV pacients antikoagulantu vietā saņēmis aspirīnu. Pirms EKV un trīs mēnešus pēc tās pacients lietojis varfarīnu. No anamnēzes pacientam bija šādi trombembolijas riska faktori: AH, HNS un 68 gadi.
Otrs insults bija pacientei, kas lietojusi varfarīnu. Viņai pirms EKV tika konstatēti vairāki kardiovaskulārie riski: AH, HSM, CD, HNS, metabolais sindroms un sievietes dzimums. Turklāt nav datu par pacientes līdzestību un INR kontroli. Stājoties nodaļā, INR bija ārpus terapeitiskā intervāla – 1,4.
Abi pacienti sešu mēnešu kontrolē pēc EKV atzīmējuši ĀFib recidīvus. Tādēļ var domāt, ka minēto insultu pamatā ir neadekvāta antikoagulantu terapija vai to trūkums un ĀFib atjaunošanās.
Analizējot asiņošanas biežumu pacientiem pēc EKV, kas saņēma antitrombotisko terapiju, lielāks asiņošanas biežums, salīdzinot ar literatūras datiem, tika konstatēts pacientiem, kas lietoja varfarīnu, – dažādos kontroles laikos tās biežums bija robežās no 4,62 % (p = 0,013) līdz 6,62 % (p = 0,067). Literatūrā aprakstītais asiņošanas biežums, lietojot varfarīnu, ir no 3,09 līdz 3,36 % [Lip, 2013; Camm, Savelieva, 2014].
Lietojot Pradaxa, asiņošanas tika novērotas tikai pirmā mēneša laikā 1,2 % (p = 0,016) pacientu. Pēc literatūras datiem atkarībā no dabigatrāna devas asiņošanas novēro 2,71–3,11 % gadījumu [Connolly, 2013; Camm, Savelieva, 2014].
Pacientiem, kas lietoja Xarelto, asiņošanas novēroja 7,1 % gadījumu. Līdzīgā pētījumā šī komplikācija Xarelto lietotājiem novērota 3,6 % gadījumu [Pattel, 2011; Camm, Savelieva, 2014]. Tomēr, ņemot vērā minētā pētījuma datus, nevar spriest par Xarelto efektivitāti šī preparāta zemās lietošanas intensitātes dēļ – tikai 6,2 % gadījumu. Turklāt Xarelto lietošana trombembolijas profilaksei pacientiem pēc EKV neatbilst ESC vadlīnijām un Latvijas multidisciplinārā zinātniskā nolēmuma rekomendācijām [Camm, 2012; Ērglis, 2013]. Trīs un sešu mēnešu kontroles laikā tiem pacientiem, kas sākuši lietot aspirīnu, asiņošanu novēroja 3,13–3,31 % gadījumu.
Asiņošanas biežums pacientiem, kas lietoja varfarīnu, ir augstāks nekā literatūrā aprakstītais, savukārt JPOAK lietošanai ir zemāks asiņošanas risks, salīdzinot ar literatūras datiem. Šīs atšķirības varētu būt saistītas ar dažādām asiņošanas definīcijām [Liew, 2013; Camm, Savelieva, 2014]. Līdzīgos pētījumos tika ņemtas vērā tikai tās asiņošanas, kas atbilda noteiktiem kritērijiem. Savukārt šajā pētījumā tika ņemtas vēra visas asiņošanas epizodes. Turklāt dati tika iegūti, aptaujājot pa tālruni, un minētie klīniskie notikumi netika dokumentāri pierādīti.
Analizējot asiņošanas biežumu pacientiem pēc ĀFib, kas lietoja dažādus antitrombotiskus preparātus, statistiska ticamība tika sasniegta, tikai analizējot kopējo asiņošanu biežumu atkarībā no lietotā preparāta vienu mēnesi pēc EKV. Iedalot asiņošanas atkarībā no to lokalizācijas, statistiska ticamība tika sasniegta tikai mīksto audu brūču asiņošanas gadījumā vienu mēnesi pēc EKV.
Lai izvērtētu preparātu efektivitāti laikposmā, pētījuma dalībnieki mēģināja izmantot Kaplana-Maijera metodi, tomēr šo metodi lietot izrādījās neiespējami grupu neviendabīguma dēļ, jo pacienti pētījuma laikā mainīja antikoagulantus.
Secinājumi
- Kardiovaskulāro risku biežums pacientiem ar ātriju fibrilācija atbilst literatūras datiem, izņemot arteriālo hipertensiju un hronisko sirds mazspēju, kas šajā pētījumā ir konstatēts kā augstāks risks.
- Biežākie kardiovaskulārie notikumi pacientiem ar ātriju fibrilācija ir akūts koronārais sindroms, ASM vai HSM dekompensācija, plaušu artēriju trombembolija / dziļo vēnu tromboze un cerebrālie infarkti. Salīdzinot ar literatūras datiem, mūsu pētījumā tika konstatēts, ka tie sastopami retāk.
- Noteiktais klīniskais notikumu risks ar CHA2DS2-VASc skalu ir augstāks nekā citos pētījumos.
- Vislielākais asiņošanu biežums bijis, lietojot varfarīnu pirmā mēneša laikā pēc elektriskās kardioversijas. Jauno perorālo antikoagulantu lietošana atbilstoši vadlīnijām pirms un pēc elektriskās kardioversijas, salīdzinot ar varfarīnu, ir drošāka gan mēnesi ilgā, gan arī ilgākā laikposmā.
Abstract
Risk of Cardiovascular Events in Patients with Atrial Fibrillation after Electrical Cardioversion
Atrial fibrillation (AF) is the most common type of arrhythmia, which may be connected with many dangerous complications: cerebrovascular insults, systemic embolism, cardiac insufficiency and an increased risk of bleeding in patients who take anticoagulants.
The aim of the study was to evaluate clinical episodes in patients after electrical cardioversion according to the cardiovascular risk factors, CHA2DS2-VASc scale and pharmacotherapeutical methods used, with the use of anticoagulants included.
The study included 260 prospective and 225 retrospective patients with atrial fibrillation who had an ECV in 2013 in the 11th department of Latvian Cardiology Centre (LCC) in PSCUH. The data acquired in medical archive, interviews with patients and control telephone queries were statistically processed using IBM SPSS Statistics 20 (US).
The most common cardiovascular risk factor was found to be arterial hypertension (AHT) (83.1 %), chronic cardiac insufficiency (CHF) (66.6 %) and metabolical syndrome (16.1 %). Diabetes is a bit less common (12.6 %), old myocardial infarction, cerebral insults (5.6 %) and TIA (3.9 %). Trombembolism risk calculating with CHA2DS2-VASc scale 38 (7.8 %) patients had one point and 447 (92.2 %) ≤ 2 points. The mean number of points is 3.8. A month after ECV, the following cardiovascular episodes were present: ACS (0.9 %), ADHF/CHF decompensated (0.4 %), PATE/DVT (0.4 %), AF recidivism (20.5 %). During three months ACS (0.5 %) were documented, ADHF/ HCF decompensation (0.5 %), PATE/DVT (0.5 %) and AF recidivism (26.3 %). Six months after ECV, 0.7 % of patients had ACS, 2 % had ACI/HCI decompensation, 0.7 % had PATE/DVT, 1.4 % had cerebral insults and 36.4 % had AF recidivism. The occurrence of bleeding depending of control time for Warfarin started from 4.62 % (p = 0.013) to 6.62 % (p = 0.067), for Aspirin from 3.13 % (p = 0.119) to 3.31 (p = 0.067). The occurrence of bleeding during one month of control for Dabigatran (Pradaxa) 1.2 % and for Rivaroxaban (Xarelto) 7.1 % (p = 0.016).
The occurrence of cardiovascular risks is similar with the data in other papers, except for AHT and CHF, which is higher in this study. The occurrence of cardiovascular episodes in this study was less often than that in other publications. The risk of clinical episodes using CHA2DS2-VASc scale is higher than in other studies. Most often bleeding occurred while using Warfarin during the first month after ECV. Using novel oral anticoagulants according to the guidelines before and after ECV is much safer with Warfarin during the first month and in longer periods.
Literatūra
- Apostolakis S., Haesler K., Oeff M., et al. Low stroke risk after elective cardioversion of atrial fibrillation: An analysis of the Flec-Sl trial // International Journal of Cardiology, 2013; 4 (168): 3977–3981.
- Boriani G., Diemberger I., et al. Electrical cardioversion for persistent atrial fibrillation or atrial flutter in clinical practice: predictors of long- term outcome // International Journal of Clinical Practice, 2007; 5 (61): 748–756.
- Camm A. J., Lip G. Y. H., De Caterina R., et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation. An update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association // Europace, 2012: 10 (14): 1385–1413.
- Camm A. J., Savelieva I. Practical considerations for using novel oral anticoagulants in patients with atrial fibrillation // Clinical Cardiology, 2014; vol. 37: issue 1: 32–47.
- Camm A., Kirchhof P., Lip G. Y. H., et al. Guidelines for the management of atrial fibrillation: the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC) // European Heart Journal, 2010: 19 (31): 2369–2429.
- Connolly S. J., Wallentin L., Ezekowitz M. D., et al. The long-term multicenter observational study of dabigatran treatment in patients with atrial fibrillation (RELY - ABLE) study //Circulation, 2013; 3 (128): 237–243.
- Dagres N., Kornej J., Hindricks G. Prevention of tromboembolism after cardioversion of recent-onset atrial fibrillation: brief is not always safe // Journal of the American College of Cardiology, 2013; 13 (62): 1193–1194.
- Ērglis A., Kalvelis A., Kalējs O. u. c. Latvijas Kardiologu biedrības 2010. gada pavasara konsensus dokuments ātriju mirgošanas ārstēšanā. Rīga: LKB, 2010, 3.–7. lpp.
- Ērglis A., Latkovskis G., Kalējs O. u. c. Antikoagulantu lietošana pacientiem ar ātriju fibrilāciju kardioemboliskā insulta novēršanai. Rīga, 2013, 5., 7.–9., 15., 18. lpp.
- Gallego P., Roldan V., Lip G. Y. H. Novel oral anticoagulants in cardiovascular disease // Journal of Cardiovascular Pharmacology and Therapeutics, 2014; 1 (19): 34–44.
- Jirgensons J., Kalējs O. Sirds un asinsrites sistēmas saslimšanas. Klīniskā medicīna. Pirmā grāmata / A. Lejnieka red. Rīga: Medicīnas apgāds, 2010. – 143.,145. lpp.
- Kim S., Knight B. Electrical and pharmacologic cardioversion for atrial fibrillation // Cardiology Clinics, 2009; 1 (27): 95–107.
- Kirchhof P., Ammentorp B., Darius H., et al. Management of atrial fibrillation in seven European countries after the publication of the 2010 ESC Guidelines on atrial fibrillation: primary results of the prevention of thromboembolic events – European Registry in Atrial Fibrillation (PREFER in AF) // Europace, 2014; 1 (16): 6–14.
- Liew A., Douketis J. Perioperative management of patients who are receiving a novel oral anticoagulant // Intern Emerg Med, 2013; 8: 477–484.
- Lip G. Y. H. Stroke and bleeding risk assessment in atrial fibrillation: when, how, and why? // European Heart Journal, 2013; 14 (34): 1041–1049.
- Lip G. Y. H., Bongiorni M. G., Dobreanu D. Novel oral anticoagulants for stroke prevention in atrial fibrillation: results of the European Heart Rhythm Association survey // Europace, 2013; 10 (15): 1526–1532.
- Lip G. Y. H., Laroche C., Dan G. A prospective survey in European Society of Cardiology member countries of atrial fibrillation management: Baseline Results of Euro Observational Research Programme Atrial Fibrillation (EORP-AF). Pilot General Registry // Europace, 2013; 5 (14): 666–674.
- Olesen J. B., Torp-Pedersen C., Hansen M. L., et al. The value of the CHA2DS2-VASc score for refining stroke risk stratification in patients with atrial fibrillation with a CHADS2 score 0–1: A nationwide cohort study // Thrombosis and Haemostasis, 2012; 6 (106): 1172–1179.
- Patel M. R., Mahaffey K. W., Garg J., et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation // The NEW England Journal of Medicine, 2011; 10 (365): 883–891.
- Pisters R., Nieuwlaat, R., Prins M. H., et al. Clinical correlates of immediate success and outcome at 1-year follow-up of real-world cardioversion of atrial fibrillation: the Euro Heart Survey // Europace, 2012; 5 (14): 666–674.
- Schulman S., Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients // J Thromb Haemost, 2005; vol. 3: 692–694.
- Tavernie R., Duytschaever M. Cardioversion for atrial fibrillation in the real world: there is room for improvement // Europace, 2012; 5 (14): 617–618.
- Tendera M., Syzdół M., Parma Z. ARISTOTLE RE-LY on the ROCKET. What’s new in stoke prevention in patients with atrial fibrillation? // Cardiology Journal, 2012; 1 (19): 4–10.
- Tieleman R. G., Gelder I. V., Crijis H. J. G., et al. Early recurrences of atrial fibrillation after electrical cardioversion: A result of fibrillation – induced electrical remodeling of the atria? // Journal of the American College of Cardiology, 1998; 1 (31): 167–173.
- Yarmohammadi H., Klosterman T., Grewal G., et al. Efficacy of the CHADS2 scoring system to assess left atrial thrombogenic milieu risk before cardioversion of non-valvular atrial fibrillation // The American Journal of Cardiology, 2013; 5 (112): 678–683.
- Yarmohammadi H., Varr B. C., Puwanant S., et al. Role of CHADS2 score in evaluation of thromboembolic risk and mortality in patients with atrial fibrillation undergoing direct current cardioversion (from the ACUTE Trial Substudy) // The American Journal of Cardiology, 2012; 2 (110): 222–226.