P viļņa morfoloģijas prognostiskā vērtība ātriju fibrilācijas recidīva riska novērtēšanā pēc elektriskās kardioversijas
Kopsavilkums
Ātriju fibrilācija ir visbiežāk sastopamā sirds aritmija cilvēkiem, ko raksturo pieaugoša incidence un prevalence, tā ir arī viens no galvenajiem insulta, sirds mazspējas, pēkšņas kardiālas nāves un kardiovaskulāru slimību iemesliem pasaulē.
Darba mērķis ir novērtēt P viļņa morfoloģiju pēc elektriskās kardioversijas pacientiem ar persistējošu ātriju fibrilāciju un noteikt tās saistību ar ātriju fibrilācijas recidīvu risku.
Prospektīvā pētījumā tika iekļauti 150 pacienti ar dažāda ilguma ātriju fibrilāciju, kuriem 2016. gadā tika veikta elektriskā kardioversija Paula Stradiņa Klīniskās universitātes slimnīcas (PSKUS) Latvijas Kardioloģijas centra (LKC) 11. nodaļā. Dati tika iegūti no pacientu stacionāra medicīniskajām kartēm, intervijām ar pacientiem stacionēšanas laikā un telefoniskām kontroles aptaujām pēc viena, trīs un sešiem mēnešiem. Statistiskā analīze tika veikta ar IBM SPSS Statistics programmu.
Vidējais P viļņa garums pēc elektriskās kardioversijas bija 117,82 ms (SD = 25,78). Ļoti īss P vilnis (≤ 89 ms) bija 16 pacientiem (10,7 %), īss (90–111 ms) bija 32 (21,3 %) pacientiem, vidēji garš (112–119 ms) – diviem (1,3 %) pacientiem, garš (120–129 ms) bija 43 (28,7 %) pacientiem un ļoti garš (≥ 130 ms) P vilnis bija 42 (28 %) pacientiem. Vidējais PR intervāla garums bija 198,62 ms (SD = 38,20). P mitrale bija 6 (4 %) pacientiem, savukārt vienam pacientam (0,7 %) bija P pulmonale. Pēc pirmā mēneša ātriju fibrilācijas recidīvs bijis 53 (42 %) pacientiem, pēc trīs mēnešiem – 44 (29,4 %) pacientiem, savukārt pēc 6 mēnešiem – 37 (24,6 %) pacientiem. Statistiski nozīmīgas atšķirības P viļņa garumam pacientiem ar ātriju fibrilāciju recidīvu pēc viena, trīs un sešiem mēnešiem un pacientiem ar sinusa ritmu netika atrastas (p > 0,05).
Secinājumi: P viļņa garuma un morfoloģijas izmaiņas nevar pārliecinoši izmantot kā prognostiskus faktorus ātriju fibrilācijas attīstības riskam; arī literatūras dati par to, cik spēcīga ir saistība starp P vilni un risku attīstīties ātriju fibrilācijai, ir pretrunīgi.
Ievads
Ātriju fibrilācija (Lejnieks, 2010) ir supraventrikulāra aritmija, kam raksturīga nekoordinēta priekškambaru aktivācija ar konsekventu priekškambaru mehāniskās funkcijas pasliktināšanos. Tā ir visbiežāk sastopamā aritmijas forma. Vairāk nekā trešdaļa hospitalizācijas gadījumu, kas ir saistīti ar sirds ritma traucējumiem, notiek ātriju fibrilācijas dēļ. Pēc 66 gadu vecuma šī slimība sastopama vairāk nekā 6 % gadījumu, bet pēc 80 gadu vecuma – 8–9 % gadījumu.
Ātriju fibrilācija tiek neatkarīgi asociēta ar divreiz lielāku dažādu nāves iemeslu risku sievietēm un pusotru reizi lielāku risku vīriešiem (Stewart, 2002). Lai arī ātriju fibrilācijas patofizioloģija nav pilnīgi izprasta (Iwasaki, 2011), ir noskaidrots, ka lielākoties indivīdiem aritmija sākas kontekstā ar ātriju elektroanatomiskā substrāta nelabvēlīgu remodelāciju, kā arī ar patoloģiski ierosinātu aktivitāti.
Elektrokardiogramma var būt noderīga profilakses pasākumos (German, 2016), jo tā spēj raksturot elektrofizioloģiskās izmaiņas, kas noved līdz ātriju fibrilācijai.
P viļņa analīzes nozīmīgums pacientiem ar ātriju fibrilāciju ir pieņemts visā pasaulē. Mūsdienās tiek atzīta ne tikai P viļņa garuma nozīme (Baranchuk, 2014), bet arī fakts, ka P viļņa morfoloģijai ir potenciāls informācijas sniegšanā par anatomiskā substrāta predisponēšanu uz ātriju fibrilāciju.
Kopenhāgenā tika veikts pētījums par P viļņa garumu un ātriju fibrilācijas attīstības risku (Nielsen, 2015). Indivīdiem ar ļoti īsu (≤ 89 ms; HR 1,60, 95 % CI 1,41–1,81), vidēju (112–119 ms; HR 1,22, 95 % CI 1,13–1,31), garu (120–129 ms; HR 1,50, 95 % CI 1,39–1,62) un ļoti garu P vilni (≥ 130 ms; HR 2,06, 95 % CI 1,89–2,23) bija paaugstināts risks ātriju fibrilācijas attīstībai. Kardiovaskulāras nāves riskam bija zināma saistība ar ļoti īsu (≤ 89 ms; HR 1,20, 95 % CI 1,06–1,34), garu (120–129 ms; HR 1,11, 95 % CI 1,04–1,19) un ļoti garu P vilni (≥ 130 ms; HR 1,30, 95 % CI 1,21–1,40). Līdzīgas, bet vājākas asociācijas tika atrastas starp P viļņa garumu un išēmiska insulta risku.
Līdzīgs pētījums tika veikts Kopenhāgenā 2013. gadā (Nielsen, 2013), kurā tika atrasta saistība starp P viļņa garumu un ātriju fibrilācijas attīstības risku. Par 89 ms īsāks P vilnis paaugstināja ātriju fibrilācijas attīstības risku (HR 1,55, 95 % CI 1,38–1,75, p < 0,001). Savukārt šķērsgriezuma kohortas tipa Framinghama sirds pētījumā (Framingham Heart Study – FHS) un pētījumā par aterosklerozes risku sabiedrībā (Atherosclerosis Risk in Communities – ARIC) (Magnani, 2015) tika secināts, ka P vilnim un ātriju fibrilācijas attīstības riskam ir saistība, bet tā sniedz minimālu prognostisku riska vērtību. P viļņa ilgums > 120 ms tika saistīts ar ātriju fibrilāciju (HR 1,55, 95 % CI 1,29–1,85), salīdzinot ar ≤ 120 ms. P viļņa morfoloģija netika statistiski nozīmīgi saistīta ar ātriju fibrilāciju (HR 1,31, 95 % CI 0,95–1,80).
2014. gadā Šveicē tika publicēts pētījums (Blanche, 2014) , kas noliedz P viļņa kā prognostiska faktora izmantošanas iespējas ātriju fibrilācijas attīstībā. Aritmijas atgriešanās tika retāk novērota pacientiem ar P viļņa garumu < 150 ms, bet atšķirības nebija statistiski nozīmīgas (p = 0,07). Tika atrasta korelācija starp P viļņa garumu un pacientu vecumu (r = 0,32, p < 0,001) un kreisā ātrija diametru (r = 0,19, p = 0,02). Šajā pētījumā tika secināts, ka pēc P viļņa garuma nevar prognozēt ātriju fibrilācijas attīstības risku.
Darba mērķis
Pētījuma mērķis ir novērtēt P viļņa morfoloģiju pēc elektriskās kardioversijas pacientiem ar persistējošu ātriju fibrilāciju un noteikt tās saistību ar ātriju fibrilācijas recidīvu risku.
Materiāls un metodes
Pētījuma dizaina veids ir prospektīvs pētījums. Tajā tika iekļauti 150 pacienti ar dažāda ilguma ātriju fibrilāciju, kuri bija stacionēti Paula Stradiņa Klīniskās universitātes slimnīcas Latvijas Kardioloģijas centra 11. nodaļā, lai tiktu veikta sinusa ritma atjaunošana ar elektrisko kardioversiju. Pacienti tika intervēti stacionārā, kā arī papildus gūti laboratorisko un instrumentālo izmeklējumu dati no pacientu medicīniskajām kartēm. Telefonintervijas tika veiktas vienu, trīs un sešus mēnešus pēc elektriskās kardioversijas.
Pētījumu sākot, tika izveidots pacientu aptaujas protokols datu ieguvei par slimības, citu slimību un dzīves anamnēzi, kā arī par lietotajiem antiaritmiskajiem medikamentiem un beta adrenoblokatoriem. Papildus tika izveidots pacientu telefoniskās aptaujas protokols, kas tika aizpildīts vienu, trīs un sešus mēnešus pēc sinusa ritma atjaunošanas.
Pirmreizēja pacientu intervēšana notika stacionārā pirms elektriskās kardioversijas veikšanas. Visi pacienti pirms intervijas parakstīja veidlapu par informētu piekrišanu dalībai pētījumā. Intervijas laikā tika iegūta šāda informācija: personas dati, ātriju fibrilācijas anamnēze, slimību anamnēze, ambulatori lietotie medikamenti (antiaritmiskie medikamenti un beta adrenoblokatori).
Izmantojot pieeju Paula Stradiņa Klīniskās universitātes slimnīcas arhīvam, tika iegūti dati no pacientu slimības vēsturēm:
- asins analīžu rezultāti (pilna asinsaina, lipidogramma, bioķīmiskie rādītāji);
- elektriskās kardioversijas veikšanas datums, izmantotā jauda, izlāžu skaits un rezultāts;
- elektrokardiogrammās tika analizēts P viļņa garums, PR intervāla garums, P mitrale un P pulmonale esamība;
- antiaritmisko medikamentu un beta adrenoblokatoru rekomendācijas pēc elektriskās kardio- versijas.
Pētījumā iekļautajiem pacientiem elektrokardiogrammas pieraksts tika veikts 24 stundu laikā pēc elektriskās kardioversijas. Visi mērījumi tika veikti manuāli.
Telefonintervija tika veikta pēc viena mēneša ar visiem pētījumā iekļautajiem pacientiem. Pēc trīs un sešiem mēnešiem veiktā telefonintervija neaptver visus sākotnēji pētījumā iekļautos pacientus, jo daļu no viņiem neizdevās atkārtoti sazvanīt. Pacientu telefoniskās aptaujas protokolā tika iekļauta šāda informācija:
- sinusa ritms telefoniskās aptaujas dienā, paroksismu biežums viena, trīs un sešu mēnešu laikā un nedēļa, kurā ir sākusies aritmija;
- veselības problēmas kontroles laikā: hospitalizācija hipertensīvās krīzes, akūta koronāra sidroma, hroniskas sirds mazspējas dekompensācijas, plaušu artēriju trombembolijas, hemorāģiska insulta, ventrikulāras aritmijas vai atkārtotas ātriju fibrilācijas dēļ, kopējais hospitalizāciju skaits, asiņošanas;
- lietotie antiaritmiskie medikamenti un beta adrenoblokatori.
Pētījuma veikšanai tika iegūta Rīgas Stradiņa universitātes Ētikas komitejas atļauja un Paula Stradiņa Klīniskās universitātes slimnīcas Zinātnes daļas atļauja.
Dati tika ievadīti un apstrādāti IBM SPSS Statistics datorprogrammā. Datu grafiskā apstrāde tika veikta Microsoft Excel datorprogrammā. Datorprogrammā IBM SPSS Statistics tika izveidota datu aprakstošā statistika, tika izmantots Manna–Vitnija (Mann–Whitney) U tests. Par statistiski nozīmīgu uzskatāms p < 0,05.
Rezultāti
Pētījumā tika iekļauti 150 pacienti, no kuriem visi tika kontrolēti vienu mēnesi (100 %), savukārt trīs mēnešus tika kontrolēti 139 (92,6 %), bet sešus mēnešus – 125 (83,3 %) pacienti. Minimālais pacientu vecums bija 33 gadi, maksimālais – 84 gadi, vidējais vecums – 65,31 gadi (SD = 9,3).
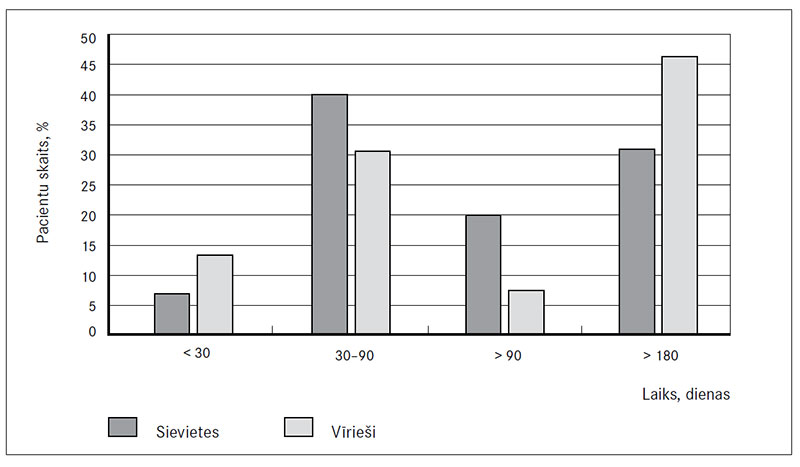
Ātriju fibrilācija, kas ilgusi mazāk nekā 30 dienas, bija 17 (11,3 %) pacientiem, savukārt 50 (33,3 %) pacientiem ātriju fibrilācija ilga no 30 līdz 90 dienām, bet 17 (11,3 %) pacientiem vairāk par 90 dienām un 65 (43,4 %) pacientiem vairāk par 180 dienām (1. attēls).
Pirmreizēja elektriskā kardioversija tika veikta 75 (50 %) pacientiem, otrreizēja – 34 (22,7 %) pacientiem, savukārt 41 (27,3 %) pacients šo procedūru saņēma trīs reizes un vairāk.
Radiofrekvences katetra ablācija tika veikta 11 (7,3 %) pacientiem.
Pēc anamnēzes datiem 1. pakāpes arteriāla hipertensija bija 45 (30 %) pacientiem, 2. pakāpes arteriāla hipertensija – 99 (66 %) pacientiem, bet 3. pakāpes – 6 (4 %) pacientiem. Cukura diabēts bija 26 (17,3 %) pacientiem, smēķētāji bija 76 (50,7 %) pacienti, metabolais sindroms anamnēzē bija 56 (37,3 %), sirds operācijas – 13 (8,7 %), vecs miokarda infarkts – 23 (15,3 %), perkutāna koronāra intervence – 15 (10 %), hroniska obstruktīva plaušu slimība – 5 (3,3 %), bronhiālā astma – 12 (8 %), insults – 8 (5,3 %), miega apnoja – 10 (6,7 %), plaušu artēriju trombembolija – 3 (2 %), hipotireoze – 9 (6 %), hipertireoze – 5 (3,3 %) pacientiem. Hroniskas nieru slimības pirmā stadija bija 80 (53,3 %) pacientiem, otrā stadija bija 26 (17,3 %), bet trešā stadija bija 2 (1,3 %) pacientiem.
1. attēls. Ātriju fibrilācijas ilgums
Duration of atrial fibrillation
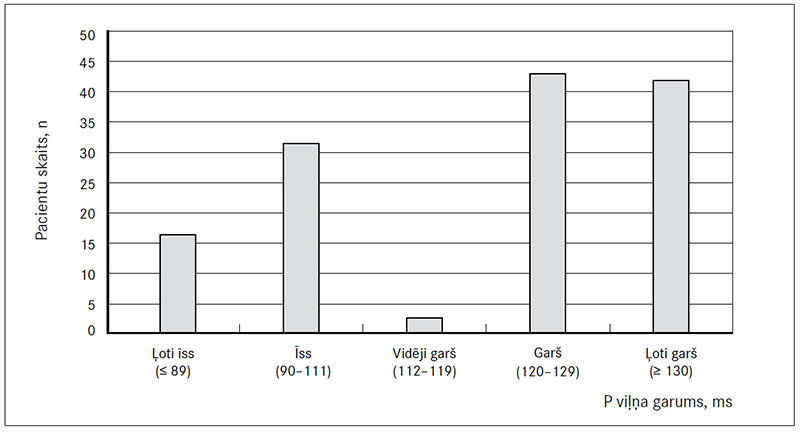
Vidējais P viļņa garums pēc elektriskās kardioversijas bija 117,82 ms (SD = 25,78). Ļoti īss P vilnis (≤ 89 ms) bija 16 pacientiem (10,7 %), īss (90–111 ms) – 32 (21,3 %) pacientiem, vidēji garš (112–119 ms) – diviem (1,3 %) pacientiem, garš (120–129 ms) – 43 (28,7 %) pacientiem un ļoti garš (≥ 130 ms) P vilnis bija 42 (28 %) pacientiem (2. attēls).
2. attēls. Pacientu iedalījums grupās pēc P viļņa garuma
Patients distribution in groups by P wave length
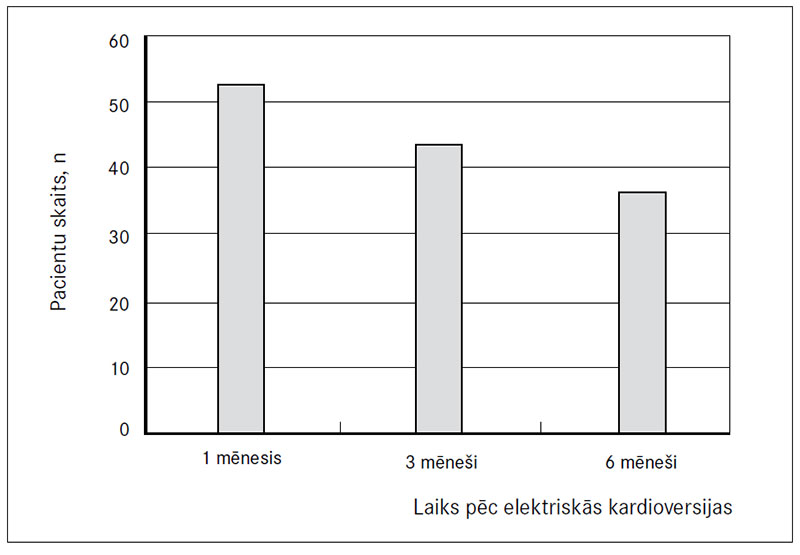
Telefoniskās kontroles laikā pēc viena mēneša tika secināts, ka ātriju fibrilācijas recidīvs bijis 53 (35,3 %) pacientiem (3. attēls). P viļņa garumam pacientiem ar ātriju fibrilācijas recidīvu pēc viena mēneša un pacientiem ar sinusa ritmu statistiski nozīmīgas atšķirības netika atrastas (p = 0,313).
Pēc trim mēnešiem telefoniskās kontroles laikā tika secināts, ka ātriju fibrilācijas recidīvs bijis 44 (31,7 %) pacientiem. P viļņa garumam pacientiem ar ātriju fibrilācijas recidīvu pēc viena mēneša un pacientiem ar sinusa ritmu statistiski nozīmīgas atšķirības netika atrastas (p = 0,106).
Pēc sešiem mēnešiem telefoniskās kontroles laikā tika secināts, ka ātriju fibrilācijas recidīvs bijis 37 (29,6 %) pacientiem. P viļņa garumam pacientiem ar ātriju fibrilācijas recidīvu pēc viena mēneša un pacientiem ar sinusa ritmu statistiski nozīmīgas PR intervāla garuma atšķirības netika atrastas (p = 0,344).
Vidējais PR intervāla garums bija 198,62 ms (SD = 38,20). Pacientiem ar ātriju fibrilācijas recidīvu pēc viena, trīs un sešiem mēnešiem un pacientiem ar sinusa ritmu statistiski nozīmīgas atšķirības netika atrastas (p > 0,05).
P mitrale bija 6 (4 %) pacientiem, savukārt vienam pacientam (0,7 %) bija P pulmonale. Statistiski nozīmīgas atšķirības pacientiem ar normālu P viļņa morfoloģiju, P pulmonale un P mitrale pacientiem ar sinusa ritmu vai ātriju fibrilācijas recidīvu vienu, trīs un sešus mēnešus pēc elektriskās kardioversijas netika atrastas (p > 0,05).
3. attēls. Ātriju fibrilācijas recidīvi pacientu apsekošanas laikā
Recurrency of atrial fibrillation during survey time
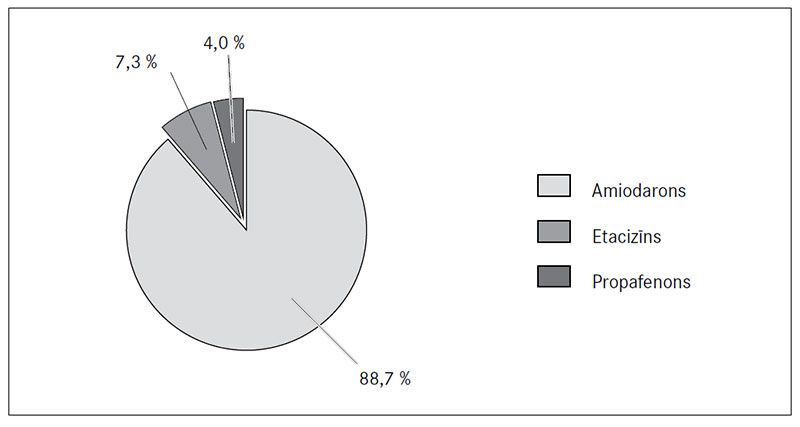
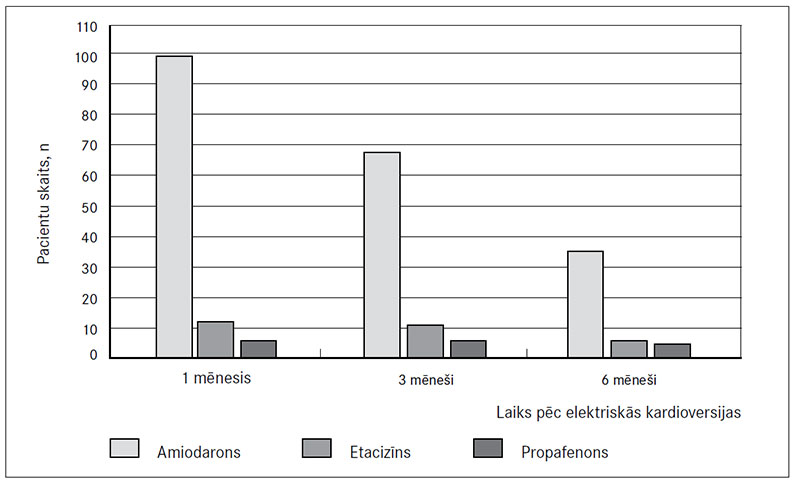
Pacienti premedikācijā bija lietojuši šādus antiaritmiskos medikamentus: amiodaronu – 133 (88,7 %), etacizīnu – 11 (7,3 %), propafenonu – 6 (4 %). Starp premedikācijā saņemtajiem antiaritmiskajiem līdzekļiem un P viļņa garumu pēc elektriskās kardioversijas statistiski nozīmīgas atšķirības netika atrastas (p > 0,05) (4. attēls).
Vienu mēnesi pēc elektriskās kardioversijas 98 (65,3 %) pacienti lietoja amiodaronu, 12 (8 %) – etacizīnu, 6 (4 %) – propafenonu, savukārt 34 (22,7 %) pacienti nelietoja antiaritmiskos medikamentus (5. attēls).
Trīs mēnešus pēc elektriskās kardioversijas 67 (44,7 %) pacienti lietoja amiodaronu, 11 (7,3 %) – etacizīnu, 6 (4 %) – propafenonu. 66 (44 %) pacienti nelietoja antiaritmiskos medikamentus.
Sešus mēnešus pēc elektriskās kardioversijas 35 (23,3 %) pacienti lietoja amiodaronu, 6 (4 %) – etacizīnu, 5 (3,3 %) – propafenonu, bet 104 (69,4 %) pacienti nelietoja antiaritmiskos medikamentus. Statistiski nozīmīgas atšķirības starp pacientiem, kuri lietoja antiaritmiskos medikamentus, un recidīvu biežumu pēc viena, trīs un sešiem mēnešiem netika atrastas (p > 0,05).
4. attēls. Antiaritmisko medikamentu lietojums premedikācijā
Usage of antiarrhytmic drugs in pre-treatment
5. attēls. Antiaritmisko līdzekļu lietojums apsekošanas laikā
Usage of antiarrhytmic drugs during survey time
Frekvences kontrolei pacienti lietoja beta adrenoblokatorus. Premedikācijā pirms elektriskās kardioversijas 48 (32 %) pacienti lietoja metoprololu, 55 (36,7 %) – bisoprololu, 11 (7,3 %) – betaksololu, 9 (6,1 %) – sotalolu un 8 (5,3 %) pacienti – nebivololu.
Vienu mēnesi pēc elektriskās kardioversijas 49 (32,7 %) pacienti lietoja bisoprololu, 48 (32 %) – metoprololu, 12 (8 %) – betaksololu un 9 (6 %) pacienti – sotalolu (6. attēls). Statistiski nozīmīgas atšķirības starp beta adrenoblokatoru lietošanu un recidīvu biežumu vienu mēnesi pēc elektriskās kardioversijas netika atrastas.
6. attēls. Beta adrenoblokatoru lietojums pēc elektriskās kardioversijas
Usage of beta blockers after electrical cardioversion
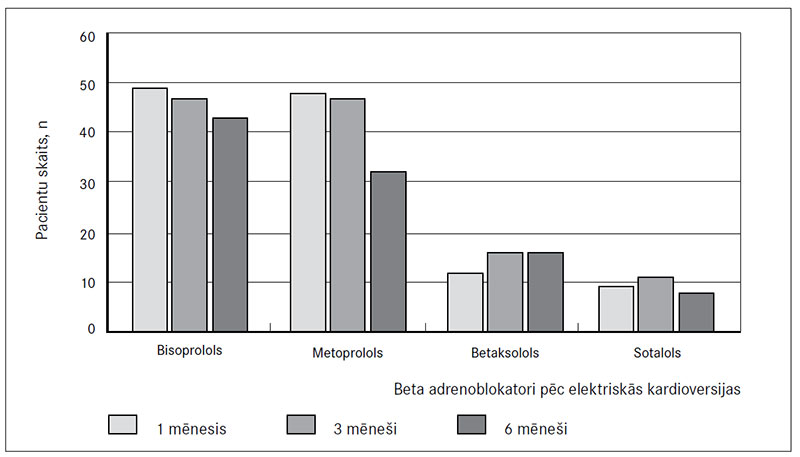
Trīs mēnešus pēc elektriskās kardioversijas 47 (31,3 %) pacienti lietoja bisoprololu, 47 (31,3 %) – metoprololu, 16 (10,7 %) – betaksololu un 11 (7,3 %) – sotalolu. Statistiski nozīmīgas atšķirības starp beta adrenoblokatoru lietošanu un recidīvu biežumu trīs mēnešus pēc elektriskās kardioversijas netika atrastas.
Sešus mēnešus pēc elektriskās kardioversijas 43 (28,7 %) pacienti lietoja bisoprololu, 32 (21,3 %) – metoprololu, 16 (10,7 %) – betaksololu un 8 (5,3 %) – sotalolu. Statistiski nozīmīgas atšķirības starp beta adrenoblokatoru lietošanu un recidīvu biežumu sešus mēnešus pēc elektriskās kardioversijas netika atrastas.
Diskusija
Pētījumā iekļautajiem pacientiem tika vērtētas elektrokardiogrammas pirms un pēc elektriskās kardioversijas. Analizējot P viļņa garumu pēc ritma atjaunošanas, vidējais garums pēc elektriskās kardioversijas bija 117,82 ms (SD = 25,78). Pacienti tika iedalīti grupās atkarībā no P viļņa garuma. Ļoti īss P vilnis (≤ 89 ms) bija 16 (10,7 %) pacientiem, īss (90–111 ms) – 32 (21,3 %) pacientiem, vidēji garš (112–119 ms) – diviem (1,3 %) pacientiem, garš (120–129 ms) – 43 (28,7 %) pacientiem, un ļoti garš (≥ 130 ms) P vilnis bija 42 (28 %) pacientiem. Šāds sadalījums tika izmantots Kopenhāgenas pētījumā 2015. gadā. Vidējais apsekošanas periods bija 6,7 gadi, un tika secināts, ka indivīdiem ar ļoti īsu, vidēju, garu un ļoti garu P vilni bija paaugstināts risks ātriju fibrilācijas attīstībai. Kardiovaskulāras nāves riskam bija zināma saistība ar ļoti īsu, garu un ļoti garu P vilni (Nielsen, 2015). Līdz ar to literatūras dati nesakrīt ar pētījuma rezultātiem, jo statistiski nozīmīgas atšķirības P viļņa garumam pacientiem ar ātriju fibrilācijas recidīvu pēc viena, trim un sešiem mēnešiem un pacientiem ar sinusa ritmu netika atrastas (p > 0,05).
Iepriekš minētajos FHS un ARIC pētījumos (Magnani, 2015) apsekošanas periods bija 10 gadi un tika secināts, ka pacientiem, kuriem P viļņa garums bija > 120 ms, bija lielāka saistība ar ātriju fibrilācijas attīstību, salīdzinot ar P viļņa garumu, kas bija ≤ 120 ms. Tika secināts, ka, salīdzinot ar tradicionālajiem riska faktoriem un marķieriem, spēja prognozēt risku ar P viļņa raksturojumu ir ierobežota.
Šveicē veiktā pētījumā (Blanche, 2014) arī tika secināts, ka P vilni nevar izmantot kā prognostisku faktoru ātriju fibrilācijas attīstības riskam. Vidējais apsekošanas laiks bija 8,9 ± 5,2 mēneši, un 54 (40,6 %) pacientiem bija ātriju fibrilācijas recidīvs. Aritmijas atgriešanās retāk tika novērota pacientiem ar P viļņa garumu < 150 ms, bet atšķirības nebija statistiski nozīmīgas (p = 0,07). Pacientiem bez recidīviem anamnēzē bija īsāks ātriju fibrilācijas ilgums (p = 0,001) un iepriekš biežāk bija veikta ablācija (p = 0,027). Arī šis pētījums tāpat kā FHS un ARIC pētījumi pierāda, ka P viļņa izmaiņas nav tik izteiktas, lai tās varētu izmantot ātriju fibrilācijas prognozēšanā.
Nākamais lielums, ko rutīnā nosaka, pierakstot elektrokardiogrammu, un kas varētu kalpot kā izdevīgs ātriju impulsu vadīšanas sistēmas slimību indikators, ir PR intervāls. Salimana pētījumā (Soliman, 2009) statistiski nozīmīgas atšķirības PR intervāla garumam pacientiem ar ātriju fibrilācijas recidīvu pēc viena, trīs un sešiem mēnešiem un pacientiem ar sinusa ritmu netika atrastas (p > 0,05), kas sakrīt ar citiem literatūras datiem, ka saistība starp PR intervāla pagarināšanos un nelabvēlīgu iznākumu netiek apstiprināta.
Pacienti premedikācijā bija lietojuši šādus antiaritmiskos medikamentus: amiodaronu – 133 (88,7 %), etacizīnu – 11 (7,3 %), propafenonu – 6 (4 %). Statistiski nozīmīgas atšķirības starp premedikācijā saņemtajiem antiaritmiskajiem līdzekļiem un P viļņa garumu pēc elektriskās kardioversijas netika atrastas (p > 0,05). Gandrīz visi šajā pētījumā iekļautie pacienti lietoja amiodaronu, bet netika atrasta saistība starp šo antiaritmisko medikamentu un P viļņa garuma izmaiņām. Netika atrastas arī statistiski nozīmīgas atšķirības starp beta adrenoblokatoru lietošanu un recidīvu biežumu vienu, trīs un sešus mēnešus pēc elektriskās kardioversijas. Literatūras datos (Yenihan, 2003; Thoma, 2004) tiek minēts, ka antiaritmisko medikamentu un beta adrenoblokatoru lietošana pēc elektriskās kardioversijas samazina persistējošas ātriju fibrilācijas recidīvu biežumu. Tomēr šie pētījumi publicēti pirms vairāk nekā 10 gadiem, kuru laikā medikamentozajā terapijā ir ieviestas izmaiņas, kā arī pacientu skaits šajos pētījumos nav pietiekami liels, lai spriestu par populāciju.
Secinājumi
- P viļņa morfoloģijas izmaiņas nevar tikt izmantotas ātriju fibrilācijas attīstības prognozēšanai, kas daļēji sakrīt ar literatūrā pausto, jo dati par tām ir pretrunīgi. Pasaulē nav viennozīmīga uzskata par P viļņa prognostisko vērtību.
- PR intervālu nevar izmantot kā prognostisku faktoru ātriju fibrilācijas attīstībai, jo gan šajā, gan citos pētījumos nav atrasta nozīmīga saistība starp PR intervāla garumu un ātriju fibrilācijas attīstības risku.
- Šajā pētījumā netika atrasta statistiski nozīmīga antiaritmisko un ritma kontroles medikamentu atšķirīga lietošanas ietekme uz recidīvu attīstības risku, tomēr literatūrā tiek atzīmēta medikamentu pozitīvā ietekme uz sinusa ritma saglabāšanu pēc elektriskās kardioversijas. Šajā pētījumā tas daļēji varētu tikt saistīts ar datu iegūšanas metodi – telefonisku aptauju, kas ne vienmēr sniedz iespēju gūt objektīvus datus.
- Lai prognozētu ātriju fibrilācijas attīstības risku, ir izveidotas vairākas riska noteikšanas skalas. Jaunākā ir CHARGE-AF, bet līdzīgi visām iepriekšējām arī šī skala nav sevi apliecinājusi kā statistiski nozīmīga un stabila ātriju fibrilācijas riska aprēķināšanai. Ir jāturpina izstrādāt un uzlabot riska noteikšanas skalas, lai nākotnē veselības aprūpes speciālisti tās varētu izmantot tikpat viegli kā SCORE, CHA2DS2-VASc un citas skalas, līdz ar to mazinot pacientu saslimstību un mirstību.
Abstract
Prognostic Value of P Wave for Atrial Fibrillation Recurrence after Electrical Cardioversion
Atrial fibrillation is the most frequent cardiac arrhythmia in humans, which is characterised by an increasing incidence and prevalence, as well as it is one of the main causes of stroke, heart failure, sudden cardiac death and cardiovascular morbidity worldwide.
The aim of the study was to evaluate P wave morphology after electrical cardioversion and determine the risk of atrial fibrillation recurrence in 30 days, three months and six months of follow-up.
In this prospective study, data from 150 patients undergoing electrical cardioversion were collected in Cardiology Centre of Latvia in 2016. The data were obtained from patients’ records, interviews with patients during hospitalisation and telephone control survey after one, three and six months. The data were processed using SPSS 20.0 software, p < 0.05 was considered statistically significant.
The average P wave duration after electrical cardioversion was 117.82 ms (SD = 25.78). Very short P wave (≤ 89 ms) was detected in 16 (10.7 %) patients, short (90–111 ms) in 32 (21.3 %) patients, moderate (112–119 ms) in two (1.3 %) patients, long (120–129 ms) in 43 (28.7 %) patients and very long (≥ 130 ms) in 42 (28 %) patients. Six (4 %) patients had P mitrale, while one (0.7 %) patient had P pulmonale. The follow-up after the first month showed that 53 (42 %) patients had a recurrent atrial fibrillation, after three months 44 (29.4 %) patients had a recurrent atrial fibrillation, while recurrence after six months was detected in 37 (24.6 %) patients. No statistically significant difference was found in P wave duration in patients with recurrent atrial fibrillation after one, three and six months compared with patients who had sinus rhythm (p > 0.05).
P wave duration and morphological changes cannot be confidently used as predictive factors for atrial fibrillation development risk. Literature data are controversial about how strong the relationship between P wave and the risk of developing atrial fibrillation is.
Literatūra
- Aro, A. L., Anttonen, O., Kerola, T. et al. 2014. Prognostic significance of prolonged PR interval in the general population. European Heart Journal. 35(2), 123–129.
- Baranchuk, A., Conde, D., Enriquez, A. and de Luna, A. B. 2014. P-wave duration or P-wave morphology? Interatrial block: seeking for the holy grail to predict AF recurrence. Annals of Noninvasive Electrocardiology. 19(3), 406–408.
- Blanche, C., Tran, N., Carballo, D. et al. 2014. Usefulness of P-wave signal averaging to predict atrial fibrillation recurrences after electrical cardioversion. Annals of Noninvasive Electrocardiology. 19(3), 266–272.
- Budeus, M., Hennersdorf, M., Perings, C. et al. 2005. Prediction of the recurrence of atrial fibrillation after successful cardioversion with P wave signal-averaged ECG. Annals of Noninvasive Electrocardiology. 10(4), 414–419.
- Camsari, A., Pekdemir, H., Akkus, M. N., Yenihan, S., Döven, O. and Cin, V. G. 2003. Long-term effects of beta blocker therapy on P-wave duration and dispersion in congestive heart failure patients: a new effect? Journal of Electrocardiology. 36(2), 111–116.
- German, D. M., Kabir, M. M., Dewland, T. A. et al. 2016. Atrial fibrillation predictors: importance of the electrocardiogram. Annals of Noninvasive Electrocardiology. 21(1), 20–29.
- Iwasaki, Y. K., Nishida, K., Kato, T., Nattel, S. 2011. Atrial fibrillation pathophysiology: implications for management. Circulation. 124(20), 2264–2274.
- Knuiman, M., Briffa, T., Divitini, M. et al. 2014. A cohort study examination of established and emerging risk factors for atrial fibrillation: the Busselton Health Study. European Journal of Epidemiology. 29(3), 181–190.
- Krijthe, B. P., Kunst, A., Benjamin, E. J. et al. 2013. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. European Heart Journal. 34(35), 2746–2751.
- Lejnieks, A. red. 2010. Klīniskā medicīna. Pirmā grāmata. Rīga: Medicīnas apgāds, 143–145.
- Magnani, J. W., Zhu, L., Lopez, F. et al. 2015. P-wave indices and atrial fibrillation: cross-cohort assessments from the Framingham Heart Study (FHS) and Atherosclerosis Risk in Communities (ARIC) study. American Heart Journal. 169(1), 53–61.
- Nielsen, J. B., Graff, C., Pietersen, A. et al. 2013. Predicting onset of atrial fibrillation based on ECG P-wave duration: results from the Copenhagen ECG Study. European Heart Journal. 34, 1887–1895.
- Nielsen, J. B., Kühl, J. T., Pietersen, A. et al. 2015. P-wave duration and the risk of atrial fibrillation: Results from the Copenhagen ECG Study. Heart Rhythm. 12(9), 1887–1895.
- Soliman, E. Z., Cammarata, M. and Li, Y. 2014. Explaining the inconsistent associations of PR interval with mortality: the role of P-duration contribution to the length of PR interval. Heart Rhythm. 11(1), 93–98.
- Soliman, E. Z., Prineas, R. J., Case, L. D. et al. 2009. Ethnic distribution of ECG predictors of atrial fibrillation and its impact on understanding the ethnic distribution of ischemic stroke in the Atherosclerosis Risk in Communities (ARIC) study. Stroke. 40(4), 1204–1211.
- Stewart, S., Hart, C. L., Hole, D. J. and McMurray, J. J. 2002. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew / Paisley study. American Heart Journal. 113, 359–364.
- Thomas, F., Peter, B., Rolf, E. et al. 2004. Prevention of atrial fibrillation after cardioversion: results of the PAFAC trial. European Heart Journal. 25(16), 1385–1394.


