Obstruktīvas miega apnojas riska novērtēšana pacientiem ar akūtu miokarda infarktu
Kopsavilkums
Obstruktīva miega apnoja (OMA) ir visizplatītākais elpošanas traucējums miegā, kas sastopams 14 % vīriešu un 5 % sieviešu. Neārstētas miega apnojas gadījumā paaugstinās kardiovaskulāro slimību risks, biežāk novērojama koronāro artēriju slimība, arteriālā hipertensija, hroniska sirds mazspēja un aritmija. Lai noteiktu iespējamu paaugstinātu OMA risku, ir nepieciešama plašāka gan pacientu, gan speciālistu informētība par elpošanas traucējumu nozīmi un pacientu skrīnings.
Darba mērķis ir analizēt un izvērtēt OMA risku pacientiem ar akūtu miokarda infarktu (MI), kā arī noteikt iespējamās išēmisko sāpju sākšanās diennakts variācijas saistībā ar OMA risku.
Pētījumā tika iekļauti pacienti ar akūta MI diagnozi, kuri stacionēti Rīgas Austrumu klīniskās universitātes slimnīcā no 2016. gada decembra līdz 2017. gada jūnijam. OMA risks tika noteikts, izmantojot STOP-Bang aptaujas anketu.
Pētījumā tika iekļauti 60 pacienti, no kuriem 45 (75 %) bija vīrieši un 15 (25 %) – sievietes. Vidējais pacientu vecums bija 63,9 ± 11,7 gadi. Pēc STOP-Bang aptaujas datiem augstu OMA risku noteica 33 (55 %) pacientiem.
Pacientiem augsta OMA riska grupā bija lielāks kakla apkārtmērs (p < 0,0001), svars (p < 0,0001), ķermeņa masas indekss (p = 0,001), augstāks glikozes līmenis tukšā dūšā (p = 0,03) un kopējais holesterīns (p = 0,01).
MI sākšanās nakts stundās bija nozīmīgi biežāka pacientiem ar augstu OMA risku (28,3 % pret 10 %; p = 0,020), savukārt rīta stundās ir novērojama tendence izteiktākai MI izpausmei pacientiem ar zemu OMA risku (15 % pret 23 %; p = 0,051).
Secinājumi: OMA ir izplatīta saslimšana pacientiem ar akūtu MI; MI sākšanās laikam OMA gadījumā ir raksturīga diennakts variabilitāte.
Ievads
Obstruktīva miega apnoja (OMA) ir visbiežāk sastopamie elpošanas traucējumi miegā, ko raksturo atkārtotas elpošanas apstāšanās epizodes elpceļu mehāniska nosprostojuma dēļ. Tā sastopama 14 % vīriešu un 5 % sieviešu vecuma grupā no 30 līdz 70 gadiem (Peppard et al., 2013).
OMA pacientiem sadrumstalota miega, intermitējošas hipoksijas un hiperkapnijas, intratorakālā spiediena svārstību, kā arī paaugstinātas simpātiskās nervu sistēmas aktivitātes dēļ rodas pārmērīga miegainība dienas laikā, garastāvokļa un kognitīvo funkciju izmaiņas (Jackson et al., 2011). OMA ir atpazīts, neatkarīgs kardiovaskulāro slimību riska faktors. Ar šo patoloģiju tiek saistīta hipertensija, koronāro artēriju slimība, sirds ritma un vadīšanas traucējumi, sirds mazspēja, kā arī cerebrovaskulārās slimības (Cepeda-Valery et al., 2014). OMA gadījumā ir raksturīgas arī metabolas pārmaiņas, kas ietekmē glikozes līmeņa kontroli un palielina cukura diabēta attīstības risku (Lam et al., 2012).
Mehānismi, kas OMA gadījumā veicina aterosklerozes attīstību, ir multipli un sarežģīti. Ar katru apnojas epizodi un sekojošu reoksigenāciju tiek paaugstināta simpātiskās nervu sistēmas aktivitāte, veicināta vazokonstrikcija, oksidatīvā stresa un iekaisuma stimulēšana, kas sekmē endoteliālo disfunkciju un agrīnu aterosklerozi (Somers et al., 2008). Pastāv uzskats, ka ilgtermiņā šis mehānisms veicina koronāro artēriju bojājumu. Apnojas epizožu laikā tiek radīts negatīvs intratorakālais spiediens, kas izraisa labā kambara transmurālā spiediena pieaugumu un paaugstinātu miokarda pieprasījumu pēc skābekļa. Skābekļa pievadi miokardam vienlaikus mazina arī koronārajās artērijās reducēta asins plūsma un apnojas izraisīta hipoksija. Šie efekti var pastiprināt miokarda išēmiju, pavājināt sirds kontraktilitāti un diastolisko relaksāciju (Cepeda-Valery et al., 2014).
Klīniski aizdomas par OMA rodas, kad pacients vai viņa radinieki (visbiežāk dzīvesbiedri) sūdzas par izteikti skaļu krākšanu, elpošanas apstāšanos miegā, nogurumu dienas laikā, neraugoties uz adekvātu miega ilgumu (Grippi et al., 2015). OMA risks paaugstinās cilvēkiem ar palielinātu ķermeņa masas indeksu, aktīvu smēķēšanu, cukura diabētu, līdz ar vecumu un alkohola, sedatīvo medikamentu un muskuļu relaksantu lietošanu (Somers et al., 2008).
Nediagnosticēta un neārstēta OMA ir ievērojams slogs veselības aprūpes sistēmai. Ir svarīgi atpazīt un ārstēt šo patoloģiju vairāku iemeslu dēļ. OMA ārstēšana uzlabo dzīves kvalitāti, samazina ceļu satiksmes negadījumu daudzumu un samazina šīs patoloģijas veicināto hronisko slimību konsekvences (Kakkar & Berry, 2007). Pēc OMA diagnosticēšanas un ārstēšanas samazinās veselības aprūpes izmaksas (Kapur, 2010).
Polisomnogrāfija ir zelta standarts OMA diagnostikā (Grippi et al., 2015), taču tā ir dārga un laikietilpīga metode, līdz ar to ir izstrādātas un apstiprinātas vairākas aptaujas OMA riska novērtēšanai. Viena no tām ir STOP-Bang anketa, kas tika izstrādāta 2008. gadā un palīdz klasificēt pacientus augsta un zema OMA riska grupās. Ja pacients STOP-Bang aptaujā iegūst no nulles līdz diviem punktiem, tiek uzskatīts, ka viņam viegla vai vidēji smaga OMA ir maz ticama, savukārt, ja tiek iegūti pieci līdz astoņi punkti, tad ir liela vidēji smagas un smagas OMA iespējamība (Chung et al., 2016).
Ar OMA saistītas kardiovaskulārās slimības biežāk novērojamas pacientiem ar smagu OMA (pēc polisomnogrāfijas datiem ar apnojas–hipopnojas indeksu virs 30 stundā) (Schulz et al., 2006), līdz ar to šajā pētījumā par augstu OMA risku tika uzskatīti pacienti ar STOP-Bang aptaujā iegūtiem pieciem vai vairāk punktiem.
Neraugoties uz augsto OMA prevalenci un tās ietekmi uz kardiovaskulāriem notikumiem un to sekām, šī patoloģija joprojām netiek pietiekami atpazīta un diagnosticēta, līdz ar to pacienti komplikāciju dēļ bieži vien vispirms nonāk nevis pie miega speciālista, bet kāda cita ārsta, visbiežāk kardiologa. Lai noteiktu paaugstinātu OMA risku, ir nepieciešams plašāk informēt gan pacientus, gan speciālistus par elpošanas traucējumu nozīmi, kā arī veikt pacientu skrīningu.
Darba mērķis
Analizēt un izvērtēt OMA risku pacientiem, kuri stacionēti Rīgas Austrumu klīniskajā universitātes slimnīcā un kuriem noteikta akūta miokarda infarkta (MI) diagnoze, kā arī noteikt iespējamās išēmisko sāpju sākšanās diennakts variācijas saistībā ar OMA risku.
Materiāls un metodes
No 2016. gada decembra līdz 2017. gada jūnijam Rīgas Austrumu klīniskās universitātes slimnīcas “Gaiļezers” Neatliekamās kardioloģijas nodaļā tika veikts šķērsgriezuma pētījums.
Akūta MI diagnozi noteica kardiologs. Lai arī secīgi pacienti bija piemēroti, tomēr pētījumā netika iekļauti tie, kuriem nebija skaidri zināms išēmisko sāpju sākšanās laiks, novērotas tipiskas sāpes krūtīs, pacienti ar jau iepriekš diagnosticētu OMA vai ar pastāvīgu pozitīvā elpceļu spiediena terapiju (continuous positive airway pressure treatment – CPAP).
OMA risks tika noteikts, izmantojot STOP-Bang aptaujas anketu. Tā sastāv no astoņiem jautājumiem, ar kuriem novērtē miega apnojas klīnisko komponenti – krākšanu, pastiprinātu nogurumu dienas laikā, novērotas elpošanas apstāšanās epizodes miegā, paaugstinātu asinsspiedienu, ķermeņa masas indeksu virs 35 kg/m2, vecumu virs 50 gadiem, kakla apkārtmēru virs 40 cm un vīriešu dzimumu. Katra pozitīva “jā” atbilde dod vienu punktu, savukārt “nē” – nulle punktus, līdz ar to kopējais rādītājs ir no nulles līdz astoņiem punktiem. Pacienti ar rezultātu virs pieciem punktiem tika klasificēti augsta OMA riska grupā.
Papildus tika mērīts pacienta kakla apkārtmērs, analizēts sistoliskais un diastoliskais spiediens, troponīna, C reaktīvā olbaltuma un glikozes līmenis tukšā dūšā. No slimības vēstures datiem tika izmantots kopējā holesterīna, augsta un zema blīvuma holesterīna un seruma triglicerīdu līmenis. Sarunā ar pacientu tika noskaidroti anamnēzes dati par smēķēšanu, iepriekš diagnosticētu cukura diabētu, primāru arteriālu hipertensiju, MI un cerebrālu insultu.
Datu apstrāde tika veikta, izmantojot Microsoft Excel un IBM SPSS Statistics programmu. Datu kopas tika pārbaudītas normāla sadalījuma atbilstībai, lietojot Šapiro–Vilka (Shapiro–Wilk) testu. Pacientu raksturojošie dati tika izteikti ar vidējiem lielumiem (± SD) vai procentos. Kvantitatīvo mainīgo datu salīdzināšanai tikai izmantots Stjūdenta t tests (independent samples t-test) neatkarīgām paraugkopām. Datu atšķirības un MI sastopamības biežuma analīzei četros diennakts sešu stundu intervālos starp augsta un zema OMA riska grupām tika izmantots Pīrsona hī kvadrāta statistiskais tests (chi squared test). Rezultāti tika uzskatīti par ticamiem, ja p vērtība bija mazāka par 0,05.
Rezultāti
Pētījumā tika iekļauti 60 pacienti, kuri laika posmā no 2016. gada decembra līdz 2017. gada jūnijam tika stacionēti Rīgas Austrumu klīniskās universitātes slimnīcas “Gaiļezers” Neatliekamās kardioloģijas nodaļā un kuriem noteikta akūta MI diagnoze. No tiem 45 (75 %) bija vīrieši un 15 (25 %) – sievietes. Vidējais pacientu vecums bija 63,9 ± 11,7 gadi, vīriešiem – 61,8 ± 11, 7 gadi, sievietēm – 70 ± 9,7 gadi. Pēc STOP-Bang aptaujas datiem augstu OMA risku noteica 33 (55 %) pacientiem.
Sadalot pētāmo populāciju atkarībā no OMA riska, tika apskatītas iespējamās antropometrisko, laboratorisko un anamnēzes datu atšķirības (1. tabula). Pacientiem augstas OMA riska grupā bija lielāks kakla apkārtmērs (p < 0,0001), svars (p < 0,0001), kā arī ķermeņa masas indekss (p = 0,001). No laboratorajiem datiem augsta OMA riska grupā tika novērots augstāks glikozes līmenis tukšā dūšā (p = 0,03) un kopējais holesterīns (p = 0,01). Abās grupās proporcionāli līdzīgi bija novērojams anamnēzes datu – MI, arteriālās hipertensijas, cukura diabēta, hroniskas sirds mazspējas un cerebrāla insulta – sadalījums. No pētāmās populācijas 41,7 % bija smēķētāji, un to sadalījums abās riska grupās bija līdzīgs (39 % pret 44 %; p = 0,79).
1. tabula. Pētījuma populācijas raksturlielumi akūta miokarda infarkta diagnosticēšanas brīdī atkarībā no obstruktīvās miega apnojas (OMA) riska
Characteristics of the study population at the time of myocardial infarction, according to the risk of obstructive sleep apnea
| Raksturlielums | Augsts OMA risks (n = 33) | Zems OMA risks (n = 27) | p vērtība |
|---|---|---|---|
| Vecums (gadi) | 63 ± 9 | 64 ± 14 | 0,62 |
| Garums (cm) | 173 ± 8 | 172 ± 6 | 0,66 |
| Svars (kg) | 93 ± 11 | 82 ± 10 | < 0,0001 |
| ĶMI* (kg/m2) | 31,2 ± 3,2 | 27,8 ± 4,1 | 0,001 |
| Kakla apkārtmērs (cm) | 45 ± 3 | 41 ± 3 | < 0,0001 |
| Sistoliskais asinsspiediens (mm Hg) | 149,7 ± 22,5 | 146,7 ± 24,6 | 0,63 |
| Diastoliskais asinsspiediens (mm Hg) | 89 ± 17 | 86 ± 17 | 0,56 |
| Troponīns T-Hs (ng/L) | 2720 ± 1610 | 2535 ± 2058 | 0,23 |
| Kopējais holesterīns (mmol/L) | 5,48 ± 1,1 | 4,69 ± 1,1 | 0,01 |
| ZBLH** (mmol/L) | 3,7 ± 1,0 | 3,3 ± 1,0 | 0,17 |
| ABLH*** (mmol/L) | 1,1 ± 0,3 | 1,2 ± 0,3 | 0,58 |
| Triglicerīdi (mmol/L) | 2,1 ± 1,2 | 1,7 ± 0,9 | 0,26 |
| Glikoze (mmol/L) | 9,2 ± 3,7 | 7,5 ± 2,2 | 0,03 |
| CRO**** (mg/L) | 17,8 ± 32,3 | 11,3 ± 22,3 | 0,36 |
| Smēķēšana (%) | 39 | 44 | 0,79 |
Amanēzē: Cukura diabēts (%) |
27 |
11 |
0,19 |
| Hipertensija (%) | 82 | 59 | 0,08 |
| Miokarda infarkts (%) | 18 | 25 | 0,54 |
| Hroniska sirds mazspēja (%) | 67 | 44 | 0,11 |
| Cerebrāls insults (%) | 6 | 11 | 0,65 |
* ĶMI – ķermeņa masas indekss;
** ZBLH – zema blīvuma holesterīns;
*** ABLH – augsta blīvuma holesterīns;
**** CRO – c reaktīvais olbaltums.
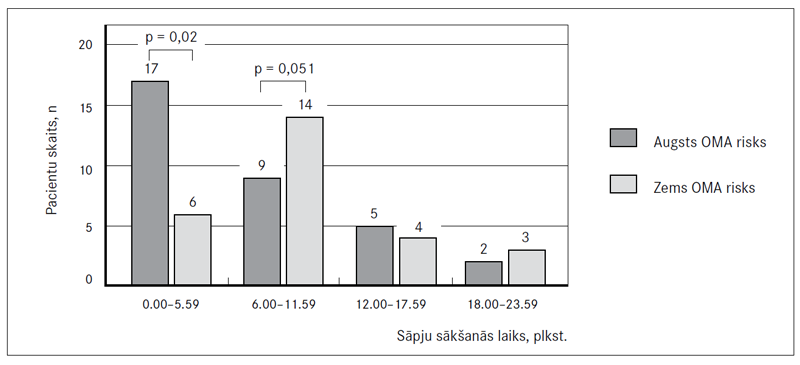
Nodalot pacientus četrās sešu stundu intervāla grupās atkarībā no OMA riska un išēmisko sāpju sākšanās momenta, ir redzams, ka akūta MI manifestācija visbiežāk notiek nakts un rīta stundās (no pusnakts līdz 5.59 rītā un no 6.00 līdz 11.59), ko novēro 46 (77 %) gadījumos. No 23 pacientiem, kuriem MI sākās rīta stundās, 17 (74 %) novēroja augstu OMA risku (1. attēls). MI sākšanās nakts stundās bija nozīmīgi izteiktāka pacientiem ar augstu OMA risku (28,3 % pret 10 %; p = 0,020), savukārt rīta stundās novērota biežāka MI izpausme pacientiem ar zemu OMA risku (15 % pret 23 %; p = 0,051).
1. attēls. Miokarda infarkta manifestācijas diennakts variācijas atkarībā no obstruktīvas miega apnojas (OMA) riska
Day-night pattern of the onset of myocardial infarction in six hour time interval according to the risk of obstructive sleep apnea
Diskusija
Ņemot vērā pieaugošo OMA sastopamību, veiktais šķērsgriezuma pētījums tiecas noskaidrot iespējamo OMA prevalenci un ar to saistītos riska faktorus pacientiem ar MI.
Pacientiem ar augstu MI risku bija lielāks svars, ķermeņa masas indekss un kakla apkārtmērs. Visiem iepriekš minētajiem faktoriem ir liela nozīme OMA attīstībā. Primārā anomālija pacientiem ar OMA ir anatomiski šauri faringeālie elpceļi saistībā ar aptaukošanos, kaulu un mīksto audu struktūru iespējamām variācijām, kas rada palielinātu gaisa plūsmas rezistenci un izteiktāku negatīvu spiedienu rīklē ieelpas laikā. Mehanoreceptori, kas atrodas balsenē, reaģējot uz šīm izmaiņām, aktivē rīkles paplašinātājmuskuļus, nodrošinot pilnvērtīgu elpceļu caurlaidību. Savukārt miegā rīkles muskuļu aktivitātes refleksi ir samazināti vai pat zuduši, kā rezultātā mazinās paplašinātājmuskuļu aktivitāte un sašaurinās elpceļi līdz pat pilnīgai to nosprostošanai (Somers et al., 2008).
Pacientiem ar augstu OMA risku novēroja arī ticami augstāku glikozes līmeni tukšā dūšā. Tas atbilst arī citu avotu datiem, piemēram, 2004. gadā publicētajā The Sleep Heart Health pētījumā tika secināts, ka elpošanas traucējumi miegā ir saistīti ar glikozes tolerances traucējumiem un insulīna rezistenci neatkarīgi no citiem mainīgajiem – vecuma, dzimuma, smēķēšanas, ķermeņa masas indeksa, aptaukošanās un pašu pacientu ziņām par miega ilgumu (Punjabi et al., 2004).
Cieša saistība starp OMA un kardiovaskulārajām slimībām, īpaši rezistentu hipertensiju, hronisku sirds mazspēju, aritmiju un akūtu koronāru sindromu ir pierādīta vairākos pētījumos (Kuniyoshi et al., 2009; Leung, Bradley, 2001), tāpat pēdējās dekādēs ir konstatētas išēmisko sāpju sākšanās diennakts variācijas akūta MI gadījumā ar maksimumu tieši rīta stundās, kā arī citu kardiovaskulāro slimību un aritmiju cikardiānie ritmi (Carson et al., 2000; Delle et al., 2003; Muller et al., 1997).
Autoru veiktais pētījums parādīja, ka OMA ir bieži sastopama patoloģija pacientiem ar akūtu MI. Izmantojot STOP-Bang aptaujas anketu, 55 % pacientu atbilda augsta riska grupai. Vairāki pētījumi liecina par OMA prevalenci MI pacientiem, izmantojot gan STOP-Bang aptaujas anketu kā pirmo skrīninga soli (Kuniyoshi et al., 2009), gan apnojas–hipapnojas indeksu (AHI) pēc polisomnogrāfijas datiem. Piemēram, Amerikas Savienotajās Valstīs 2008. gadā veiktā pētījumā, par robežvērtību ņemot AHI ≥ 5, 70 % pacientu ar akūtu MI tika konstatēta OMA. Tāpat ir sastopami ziņojumi, kuros pieņemta konservatīvāka AHI robeža, piemēram, 2009. gadā Singapūrā veiktā pētījumā MI pacienti tika iedalīti grupās atkarībā no AHI, un rezultātā secināts, ka AHI ≥ 15, kas atbilst vidēji smagai OMA, sastopams 65,7 % gadījumu (Lee et al., 2009).
Iespējamie mehānismi OMA un MI diennakts variācijām varētu būt skaidrojami ar akūtiem patofizioloģiskiem atbildes mehānismiem uz OMA, kas ietver hipoksiju, cikliskas sirds ritma un asinsspiediena svārstības, simpātiskās nervu sistēmas aktivitāti un iekaisumu, kas veicina aterosklerotisko plātnīšu ruptūru, koronāro trombozi un akūta koronāra sindroma attīstību (Cepeda-Valery et al., 2014; Lattimore et al., 2003).
2009. gadā Austrālijā veiktā pētījuma autori ziņoja par pārejošu neatbilstību starp asins plūsmu koronārajās artērijās un miokarda metaboliskām vajadzībām pacientiem ar OMA nakts stundās saistībā ar palielinātu miokarda darbu un kardiovaskulāro reaktivitāti (Hamilton et al., 2009).
Galvenais šī pētījuma ierobežojums ir STOP-Bang aptaujas izmantošana OMA riska grupu stratificēšanai, neveicot polisomnogrāfiju, kas ir zelta standarts OMA diagnostikā. Tālāki pētījumi ir nepieciešami, lai novērtētu OMA terapijas ietekmi un spēju modificēt MI diennakts variabilitāti, kopējo akūta koronāra sindroma un pēkšņas kardiālas nāves risku, jo potenciālais OMA terapijas efekts uz kardiovaskulāro notikumu mazināšanu ir pierādīts atsevišķu centru īstermiņa pētījumos, taču pietrūkst ilgtermiņa randomizētu pētījumu datu.
Secinājumi
- Pacientiem ar akūtu miokarda infarktu ir augsts obstruktīvas miega apnojas sastopamības risks.
- Miokarda infarkta sākšanās laikam ir novērojama diennakts variabilitāte – augsta obstruktīvas miega apnojas riska gadījumā tas visbiežāk noris nakts stundās, savukārt zema riska gadījumā ir vērojama tendence biežāk izpausties rīta stundās.
- Glikozes tolerances traucējumi, palielināts kakla apkārtmērs, ķermeņa masas indekss un kopējā holesterīna līmenis ir augsta obstruktīvas miega apnojas riska faktori.
Abstract
Risk of Obstructive Sleep Apnea in Patients with Acute Myocardial Infarction
Obstructive sleep apnea (OSA) is the most common sleep disorder that affects 14 % of men and 5 % of women. Untreated OSA leads to increased prevalence of cardiovascular disease, coronary artery disease, hypertension, heart failure and arrhythmias. Because of its high prevalence, it is important for patients and health care professionals to be aware of sleep-disordered breathing and its importance, as well as a screening of patients to determine the possibility of OSA.
The aim of the study was to analyse and evaluate the risk of obstructive sleep apnea in patients admitted for acute myocardial infarction (MI), and to identify a possible day-night variation of acute myocardial infarction based on the risk of OSA.
A cross-sectional study was performed and involved patients who were admitted to Riga East Clinical University Hospital with diagnosis of acute myocardial infarction in a time period between December 2016 and June 2017. The risk of OSA was determined by STOP-Bang questionnaire.
60 patients were enrolled in the study, 45 (75 %) men and 15 (25 %) women. The mean patient age was 63.9 ± 11.7 years. Based on STOP-Bang questionnaire 33 (55 %) patients were at high risk for OSA. Patients with high OSA risk had a bigger neck circumference (p < 0.0001), weight (p < 0.0001), body mass index (p = 0.001), fasting blood glucose level (p = 0.03) and cholesterol (p = 0.01).
In patients with high OSA, compared to those with low risks, the frequency of onset of myocardial infarction was higher from midnight to 5:59 in the morning (28.3 % vs. 10 %; p = 0.020), whereas in the morning hours (between 6 and 12 AM) there is a tendency of more frequent onset of MI in patients with low risk (15 % vs. 23 %; p = 0.051).
Obstructive sleep apnea is a prevalent disorder in patients with acute myocardial infarction and diurnal variability can be seen in the onset of MI.
Literatūra
- Carson, P. A., O’Connor, C. M., Miller, A. B. et al. 2000. Circadian rhythm and sudden death in heart failure: Results from prospective randomized amlodipine survival trial. Journal of Americal College of Cardiology. 36(2), 541–546. Iegūts no: https://doi.org/10.1016/S0735-1097(00)00728-2 (sk. 04.06.2017.).
- Cepeda-Valery, B., Acharjee, S., Romero-Corral, A. et al. 2014. Obstructive sleep apnea and acute coronary syndromes: etiology, risk and management. Current Cardiology Reports. 16:535. Iegūts no: https://doi.org/10.1007/s11886-014-0535-y
- Chung, F., Abdullah, H. R. and Liao, P. 2016. STOP-Bang questionnaire: A Practical approach to screen for Obstructive Sleep apnea. Chest. 149(3), 631–638. Iegūts no: https://doi.org/10.1378/chest.15-0903 (sk. 29.05.2017.).
- Delle, K. G., Reinelt, P., Buberl, A. et al. 2003. Circadian variation in ventricular tachycardia and atrial fibrillation in a medical-cardiological ICU. Intensive Care Medicine. 29(6), 963–968. Iegūts no: https://doi.org/10.1007/s00134-003-1735-x (sk. 04.06.2017.).
- Grippi, M., Elias, J., Fishman, J. et al. 2015. Fishman’s Pulmonary diseases and disorders. 2-Volume set, 5th edition. McGraw-Hill Education, 1510–1518.
- Hamilton, G. S., Meredith, I. T., Walker, A. M. and Solin, P. 2009. Obstructive sleep apnea leads to transient uncoupling of coronary blood flow and myocardial work in humans. Sleep. 32(3), 263–270.
- Jackson, M. L., Howard, M. E. and Barnes, M. 2011. Cognition and daytime functioning in sleep related breathing disorders. Progress in Brain Research. 190, 53–68.
- Kakkar, R. K. and Berry, R. B. 2007. Positive airway pressure treatment for obstructive sleep apnea. Chest. 132(3), 1057–1072. Iegūts no: https://doi.org/10.1378/chest.06-2432 (sk. 03.06.2017.).
- Kapur, V. K. 2010. Obstructive sleep apnea: diagnosis, epidemiology, and economics. Respiratory Care. 55(9), 1155–1167.
- Kuniyoshi, F. S., Garcia-Touchard, A., Gami, A. S. et al. 2009. Day-night variation of acute myocardial infarction in obstructive sleep apnea. Journal of the American College of Cardiology. 52(5), 343–346. Iegūts no: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2598735/ (sk. 05.06.2017.).
- Lam, J. C., Mak, J. C. and Ip, M. S. 2012. Obesity, obstructive sleep apnea and metabolic syndrome. Respirology. 17(2), 223–236. Iegūts no: http://onlinelibrary.wiley.com/doi/10.1111/j.1440-1843.2011… (sk. 02.06.2017.).
- Lattimore, D. L., Celermajer, D. S. and Wilcox, I. 2003. Obstructive sleep apnea and cardiovascular disease. Journal of the American College of Cardiology. 41(9), 1429–1437. Iegūts no: https://doi.org/10.1016/S0735-1097(03)00184-0 (sk. 05.06.2017.).
- Lee, C. H., Khoo, S. M., Tai, B. C. et al. 2009. Obstructive sleep apnea in patients admitted for acute myocardial infarction. Prevalence, predictors, and effect on microvascular perfusion. Chest. 135(6), 1488–1495.
- Leung, R. S. and Bradley, D. T. 2001. Sleep apnea and cardiovascular disease. American Journal of Respiratory and Critical Care Medicine. 164(12), 2147–2165. Iegūts no: https://doi.org/10.1164/ajrccm.164.12.2107045 (sk. 28.10.2017.).
- Muller, J. E., Kaufmann, P. G., Luepker, R. V. et al. 1997. Mechanisms precipitating acute cardiac events: review and recommendations of an NHLBI workshop. National Heart, Lung, and Blood Institute. Mechanisms Precipitating Acute Cardiac Events Participants. Circulation. 96(9), 3233–3239. Iegūts no: https://doi.org/10.1161/01.CIR.96.9.3233 (sk. 04.06.2017.).
- Peppard, P. E., Young, T., Barnet, J. H. et al. Increased prevalence of sleep disordered breathing in adults. American Journal of Epidemiology. 2013 May 1; 177(9): 1006-1014. Iegūts no: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3639722 (sk. 28.10.2016.).
- Punjabi, N. M., Shahar, E., Redline, S. et al. 2004. Sleep-Disordered Breathing, Glucose Intolerance, and Insulin Resistance: The Sleep Heart Health study. American Journal of epidemiology. 160(6), 521–530. Iegūts no: https://doi.org/10.1093/aje/kwh261 (sk. 06.06.2017.).
- Shulz, R., Grebe, M., Eisele, H. J. et al. 2006. Vaskuläre Folgeerkrankungen bei obstruktiver Schlafapnoe. Medizinische Klinik. 101(4), 321–327.
- Somers, V. K., Amin, R., Culebras, A. et al. 2008. Sleep Apnea and Cardiovascular Disease. An American Heart Association / American College of cardiology Foundation Scientific Statement From the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing. Circulation. 118(10), 1080–1111. Iegūts no: https://doi.org/10.1161/circulationaha.107.189420 (sk. 06.06.2017.).


