Sirds magnētiskās rezonanses prognostiskā nozīme pēc ST elevācijas miokarda infarkta
Kopsavilkums
Ievads. Sirds un asinsvadu slimības nemainīgi ir galvenais nāves cēlonis Latvijā, kas izraisa 54–56 % visu nāves gadījumu. Kardiovaskulāro mirstību vidēji par 20–30 % samazina koronāro sirds slimību pacientu rehabilitācija un sekundārā profilakse pēc pārciesta miokarda infarkta.
Darba mērķis, materiāls un uzdevumi. Noteikt magnētiskās rezonanses (MR) izmeklējuma prognostisko lomu pacientiem pēc ST elevācijas miokarda infarkta (STEMI). Pētījumā iekļauti 18 pacienti ar nozīmīgu sirds bojājumu pēc miokarda infarkta, kam tika izdarīta savlaicīga ārstēšana ar perkutāno koronāro intervenci ar / bez stenta implantācijas koronārajā artērijā. Lai novērtētu miokarda bojājuma pakāpi, pacientiem vidēji astoņus mēnešus pēc akūta notikuma tika veikts miokarda MR izmeklējums. Nepieciešamie dati par pacientiem iegūti no slimības vēsturēm, MR mērījuma protokoliem, kā arī no aptaujām pa tālruni. Tika analizēti vēlīnie notikumi (progresējoša sirds mazspēja, atkārtots miokarda infarkts, progresējoša stenokardija, ventrikulāras aritmijas epizode, ātriju fibrilācija, kardioverteradefibrilatora izlāde, insults un kardiovaskulāra nāve) vidēji pēc gada, kad tika piedzīvots akūts miokarda infarkts.
Rezultāti. Desmit pacienti (56 %) tika atkārtoti stacionēti kardiālu notikumu dēļ. Pieci pacienti (28 %) atzīmē nozīmīgus veselības traucējumus pēc miokarda infarkta, kas izteikti pasliktina dzīves kvalitāti. Pēc MR mērījumu datiem vidējais infarkta plašums ir 29 % no kreisā kambara masas, sieniņas kustības izmaiņas novēro 15 pacientiem (83%), aneirismas izveidojas 9 pacientiem (50 %) un vidēja kreisā kambara izsviedes frakcija ir 41 %.
Secinājumi. MR ir efektīva izmeklēšanas metode pacientiem pēc miokarda infarkta, kas novērtē rētas remodelācijas procesus, atklāj aritmogēno substrātu, parāda kreisā kambara funkcionālos rādītājus. Magnētiskās rezonanses vēlīnās gadolīnija uzkrāšanās metode ir labs prognozes rādītājs smagiem kardiāliem notikumiem. Iegūtie dati ļauj pamatoti izvēlēties turpmāku invazīvu izmeklēšanu, optimizēt terapiju ar medikamentiem, veikt kardiovertera-defibrilatora implantāciju un pievērst uzmanību riska faktoru modificēšanai.
Ievads
Sirds un asinsvadu slimības nemainīgi ir galvenais nāves cēlonis Latvijā, kas izraisa 54–56 % visu nāves gadījumu. Standartizētās mirstības rādītāji sirds un asinsvadu slimību dēļ Latvijas iedzīvotājiem ir divas reizes augstāki nekā Eiropas Savienības valstu vidējie rādītāji. Kopējais standartizētais mirstības rādītājs 2010. gadā Latvijā no sirds un asinsvadu slimībām uz 100 000 iedzīvotāju bija 478, Lietuvā – 495, Somijā – 214, savukārt ES valstīs tas bija vidēji 222.
Kardiovaskulāro mirstību vidēji par 20–30 % samazina koronāro sirds slimību pacientu rehabilitācija un sekundārā profilakse galvenokārt pēc pārciesta miokarda infarkta. Miokarda magnētiskā rezonanse (MR) ir apstiprināta un plaši izmantojama neinvazīva metode miokarda dzīvotspējas, funkcijas un perfūzijas novērtēšanai, riska stratifikācijai pacientiem ar zināmu vai prognozējamu koronāro sirds slimību, pacientu noteikšanai, kuriem būtu ieguvums no implantējamā kardiovertera-defibrilatora.
Izmantojot vēlīno kontrastvielas uzkrāšanas MR metodi, ir iespējams novērtēt miokarda rētu pēc nozīmīga ST elevācijas miokarda infarkta (STEMI). Novērtējot kardiovaskulāro notikumu risku (pēkšņa kardiālā nāve, nefatāls miokarda infarkts), metaanalīze (39 recenzēto publikāciju dati, pacientu skaits – 69 655) parāda pārliecinošu atšķirību starp pacientu grupām pēc perfūzijas defekta apjoma un bojājuma dziļuma. Pacientiem ar plašiem perfūzijas defektiem MR vidējais notikumu risks gadā (kardiālā nāve un nefatāls miokarda infarkts) ir 5,9 %, pacientiem ar normālu perfūziju (n = 39 173) – 0,6 %. Pēkšņās kardiālās nāves risks saistīts ar dziļākiem bojājumiem, ja ir diagnosticēti rētaudi miokardā. Rētaudi ar laiku samazinās, tie kontrahējas un rada kambara sieniņas stīvumu un diastolisko disfunkciju. Tas viss var sekmēt sirds mazspējas, ventrikulāras aritmijas, pēkšņas kardiālās nāves un citu nelabvēlīgu kardiālo notikumu attīstību nākotnē.
Ar MR izvērtē miokarda apasiņošanu, kreisā kambara beigu sistoles un diastoles tilpumu, miokarda sieniņas kustības, sieniņas sabiezināšanos, kā arī mēra kreisā kambara izsviedes frakciju. Piemēram, ar MR izmeklējuma metodi ir iespējams noteikt išēmiska un neišēmiska rakstura miokarda fibrozi, savukārt ar T1 izmeklējuma sekvenci var redzēt taukaudus, kas var būt substrāts dzīvībai bīstamai aritmijai. Ar vēlīnās gadolīnija uzkrāšanās (VGU) metodi tiek novērtēts miokarda rētas izmērs, heterogenitāte, skaits, kas ir prognostiski nozīmīgi rādītāji ventrikulāras tahikardijas un pēkšņas kardiālas nāves notikumiem.
MR ir atzīta par efektīvu izmeklējumu pēcinfarkta pacientiem, kas novērtē terapijas efektivitāti, remodelācijas procesu un kreisā kambara funkcionālo rādītāju izmaiņas dinamikā, kā arī prognozē smagus kardiālus notikumus.
Darba mērķis un uzdevumi
Izvērtēt miokarda magnētiskās rezonanses informatīvo lomu pacientiem prognozes noteikšanai ar nozīmīgu miokarda bojājumu pēc ST elevācijas miokarda infarkta.
Prognozēt dzīvībai bīstamus kardiovaskulārus notikumus (pēkšņa kardiāla nāve, ventrikulāra tahikardija, ventrikulāra fibrilācija, miokarda infarkts, rehospitalizācija dekompensētas sirds mazspējas, progresējošas stenokardijas dēļ utt.) pacientiem pēc nozīmīga miokarda bojājuma ar magnētiskās rezonanses izmeklēšanas metodi, lai laikus varētu veikt profilaktiskus un ārstnieciskus pasākumus.
Pētījuma aktualitāte
Akūta koronārā sindroma (AKS) reģistra dati parāda, ka no 2005. līdz 2011. gadam AKS gadījumu skaits samazinājās par 41 % (tika reģistrēti 3727 saslimšanas gadījumi). Miokarda infarkts ar ST elevāciju (STEMI) procentuāli palielinājās no 20 % (2005. gadā) līdz 30 % (2011. gadā), taču absolūtos skaitļos kopumā samazinājās tikai par 219 cilvēkiem [Apinis, 2013]. Šie dati liecina, ka STEMI joprojām ir aktuāla problēma mūsu valstī un pacientu skaits ar nozīmīgu sirds bojājumu ar katru gadu palielinās.
Laikus veikta koronārā revaskularizācija ar stenta implantāciju spēj samazināt miokarda išēmijas rajonu un uzlabot pacienta dzīves kvalitāti, tomēr jāpiebilst, ka diemžēl ne visi pacienti ir pasargāti no pēkšņiem kardiāliem notikumiem, tostarp no pēkšņas kardiālās nāves (PKN). Pēkšņa kardiālā nāve ir dabiska kardiālas ģenēzes nāve ar pēkšņu samaņas zudumu vienas stundas laikā kopš akūto simptomu sākuma. Tās incidence rietumu valstīs ir 0,36–1,28 uz tūkstoš iedzīvotājiem gadā. Viens no galvenajiem PKN cēloņiem pasaules attīstītajās valstīs ir koronārā sirds slimība. 70–80 % gadījumu to izraisa kambaru fibrilācija, savukārt 15–20 % – bradiaritmijas. Augstam pēkšņas kardiālās nāves riskam ir pakļauti pacienti ar dažādiem sirds ritma traucējumiem, pārciestu sirdsdarbības apstāšanos un pārciestu plašu miokarda infarktu [Karpovs, 2004].
Pēkšņas kardiālās nāves risku ir iespējams novērst, izmantojot profilaktisko kardiovertera-defibrilatora implantāciju riska grupas pacientiem. Augsta riska grupai pieder pacienti ar kambaru tahikardiju (PKN cēlonis aptuveni 80 % gadījumu), pacienti ar III–IV pakāpes sirds mazspēju pēc NYHA klasifikācijas (NYHA – New York Heart Association), pacienti ar kambaru tahikardiju vai kambaru fibrilāciju, kas parādījusies pirmajās trīs dienās pēc akūta miokarda infarkta un atkārtojusies divu mēnešu laikā pēc tā, kā arī pacienti ar kreisā kambara disfunkciju [Šipačovs, 2010]. Minētie dati parāda, ka pacienti pēc STEMI ir pakļauti augstam pēkšņas nāves riskam, kā arī citiem smagiem kardiāliem notikumiem, kam pamatā ir strukturāls sirds bojājums.
Miokarda pēcinfarkta remodelācijas un reparācijas procesi
Pēc miokarda infarkta miokardā aktīvi notiek reparatīvie procesi, kas ļauj saglabāt strukturālo integritāti nekrotisko audu zonās. Pēcinfarkta remodelācija ir miokarda atjaunošanās process. Agrākos morfoloģiskos pētījumos tika aprakstīts, ka pēcinfarkta audi dzīst 6–8 nedēļu laikā. Tādā veidā rodas acelulāri rētaudi, kas sastāv no kolagēna šķiedrām. Tagad, izmantojot jaunākās molekulārās un bioloģiskās izmeklēšanās metodes, ir iegūts citāds priekšstats. Sākotnēji bojājuma vietā migrē iekaisuma šūnas un piesaistās bojātajam miokardam. Tās izdala regulatorus – peptīdus, aktivizējot angioģenēzi, kā arī fibroblastiem līdzīgo šūnu migrāciju un replikāciju. Šīs agrīnās iekaisuma fāzes dēļ rodas granulācijas audi, pēc tam sākas miokarda fibrinoģenēzes fāze.
Pēcinfarkta rētu veido fenotipiski transformētas fibroblastiem līdzīgas šūnas – miofibroblasti. Tie ekspresē gludās muskulatūras α-aktīna mikrofilamentu receptorus un spēj reaģēt uz dažādu peptīdu un amīnu signāliem. Miofibroblasti infarkta vietā ir metaboli aktīvi un ekspresē angiotenzīnam līdzīgus peptīdus, konvertāzes enzīmus, angiotenzīna II receptorus un TGF-β1 (transformēto augšanas faktoru β1). Miofibroblastu ekspresētie peptīdi rada I un III tipa kolagēna šķiedru apgrozījumu pēcinfarkta rētaudos. Ar mikroskopiskām metodēm tika novērota kolagēna šķiedru uzkrāšanās infarkta zonā jau 7. dienā. Šķiedru organizētā pārkārtošanās notiek 14. dienā un turpinās vēl dažas nedēļas. Visi šie novērojumi liecina, ka pēcinfarkta rētaudos kolagēna šķiedru sintēze un pārkārtošanās norit nepārtraukti. Pretēji tradicionāliem uzskatiem tika secināts, ka fibrotisko šķiedru veidošanās ir nevis īslaicīgs, bet gan ilgstošs process.
Plaša transmurāla miokarda infarkta gadījumā reparācijas procesos tiek iesaistīta visa sirds, pastiprināti veidojas fibrozie audi un remodelācijas procesi arī infarkta neskartajā miokardā. Miofibroblastu ekspresētie peptīdi rada intersticiālu kolagēnu, kas remodelē neskarto miokardu no 14. dienas līdz dažām nedēļām. Fibrozi infarkta neskartajos audos pirmoreiz novēroja žurkām pēc plaša priekšēja transmurāla miokarda infrakta, kad aptuveni pēc 8 nedēļām radās izteikts labā kambara stīvums [Sun, 2000]. Ar laiku rētaudi kontrahējas, un tas var negatīvi ietekmēt kambaru tonusu, radot stīvumu un diastolisko disfunkciju.
Miokarda magnētiskās rezonanses informatīvā loma
Jaunākie tehniskie sasniegumi un gadu gaitā uzkrātā pieredze darbā ar MR strauji palielinājusi tās lomu diagnostikā. Ir izstrādātas rekomendācijas magnētiskās rezonanses pielietojumam. Ierobežojumi MR veikšanai vairāk ir finansiāla nekā tehniska rakstura, jo pēdējos gados Eiropā un arī Latvijā ir strauji audzis magnētiskās rezonanses aparātu skaits. Sirds MR pašlaik ir pieejama tikai Paula Stradiņa Klīniskajā universitātes slimnīcā Latvijā. Pēc 2008. gada diagnostiskās radioloģijas izmeklējumu vadlīnijām miokarda infarkta attīstības un komplikāciju izvērtēšanai ir indicēta ehokardiogrāfija (EhoKG). Savukārt nukleārā medicīna ir visatzītākā metode miokarda perfūzijas izvērtēšanai [Zabunova, 2013].
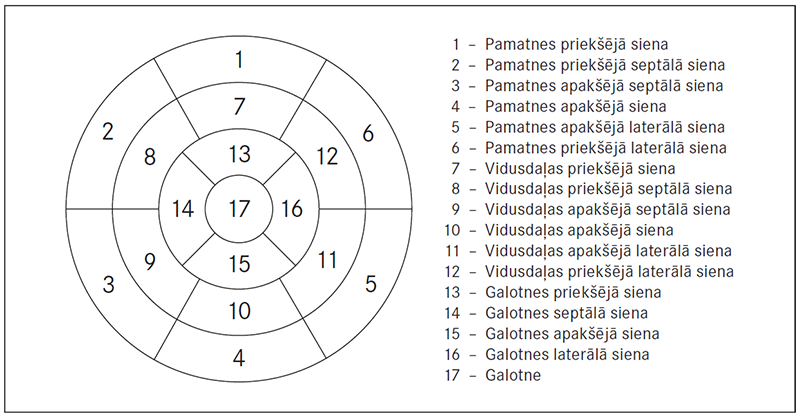
Mūsdienās magnētiskā rezonanse ir zelta standarts precīzai sirds tilpumu, sirds masas un miokarda sieniņu kustību mērīšanai. Izmeklējot miokardu ar paramagnētisku kontrastvielu (gadolīniju), var diagnosticēt rētu, infiltrātu, iekaisumu, apstiprināt infarktu, miokardītu, perikardītu, kardiomiopātiju. Ar jaunāko aprīkojumu iespējams novērtēt miokarda perfūziju, dzīvotspēju, kā arī koronāro artēriju anatomiju. Latvijas Kardioloģijas centrā pēc NYHA norādījumiem ir izstrādāts oriģināls rezultātu apkopojums par miokarda zonu iedalīšanu segmentos – segmentāciju (sk. 1. att.) [Ashikaga, 2007].
1. attēls. Miokarda iedalījums segmentos / Myocardial segments
MR izmeklējuma indikācijas ir šādas [Kadish, 2009]:
- novērtēt vispārēju un reģionālu kambara funkciju, miokarda infarkta plašumu, sirds mazspēju;
- noteikt miokarda infarktu, tā lokalizāciju un platību;
- noteikt funkcionālās atjaunošanas varbūtību un kreisā kambara remodelāciju pēc akūta miokarda infarkta;
- noteikt miokarda dzīvotspēju pirms revaskularizācijas;
- identificēt miokarda infarkta komplikācijas (mikrovaskulāra obstrukcija, perikarda tamponāde, kambara trombs, papillārā muskuļa infarkts, aneirisma, pseidoaneirisma);
- raksturot mitrālas regurgitācijas mehānismu (kreisā kambara ģeometrija, papillārā muskuļa infarkts, papillārā muskuļa un kreisā kambara apakšējās sienas išēmija);
- novērtēt miokarda nekrozi pirms un pēc perkutānas koronārās intervences vai aortokoronārās šuntēšanas;
- diferencēt sirds mazspējas išēmisko vai neišēmisko etioloģiju.
Absolūtas kontrindikācijas ir aktīvas ierīces (kardiostimulators, implantējamais kardiovertersdefibrilators, insulīna pumpis), metālisks svešķermenis acī, kā arī nieru mazspēja, ja tiek izmantota gadolīnija kontrastviela. Par nosacītām kontrindikācijām tiek minētas klaustrofobija, vairāki nesen implantēti stenti, sirds vārstuļi, krūškaula stieples, v. cava filtri, sirds slēgšanas ierīces, embolizācijas gredzens. Šajos gadījumos ieteicams izmantot magnētisko lauku vismaz līdz 1,5 T.
Lai iegūtu precīzāku attēlu, izmeklējuma laikā var lietot papildu izvērtēšanas metodes. Piemēram, lai atšķirtu akūtu miokarda infarktu no hroniska, lieto T2 (melnas asinis sekvencēs) izmeklēšanu, kas akūta miokarda infarkta gadījumā parāda iekaisuma tūskas apvidu ar augstas intensitātes signālu. Izvērtējot ar T1 metodi, var redzēt abnormālus miokarda taukaudus, kas asociējas ar aritmiskiem notikumiem un parāda reversiblo miokarda bojājumu un miokarda funkcionālo atjaunošanos pēc akūta MI [Goldberger, 2008].
Veicot izmeklējumu ar kontrastvielu (0,1 mmol/kg ar ātrumu 5 ml/s), primāras perfūzijas dati atspoguļo miokarda rajonu ar samazinātu asinsplūsmu (hipoperfūziju). Ievadot kontrastvielas devu (0,1 mmol/kg atšķaidītu ar 20 ml fizioloģiskā šķīduma), pēc 10 minūtēm parādās vēlīnā kontrastvielas uzkrāšanās. Šo desmit minūšu laikā ir iespējams novērtēt plūsmu (kambaru starpsienas defektu, pseidoaneirismas). Ar vēlīnas kontrastēšanas fāzes izmeklējumu var novērtēt perfūzijas deficīta iemeslu, vai tas radies koronārās artērijas stenozes dēļ, vai arī rētaudi nospiež konkrēto artēriju [Kadish, 2009].
Stresa dobutamīna MR izmeklējumu lieto zināmas koronāro artēriju slimības gadījumā, lai izvērtētu revaskularizācijas nepieciešamību, hibernēta miokarda novērtēšanai pacientiem, kam nav transmurālu rētaudu. Nozīmīgas koronārās artērijas stenozes gadījumā šī metode ir efektīvāka par dobutamīna EhoKG izmeklēšanu (dobutamīna MR jutība ir 86 %, specifiskums – 86 %, bet dobutamīna EhoKG jutība ir 76 %, specifiskums – 78 %). Pacientiem ar negatīviem stresa dobutamīna MR testa rezultātiem ir ļoti laba prognoze, ja notikumu skaits pirmā gada laikā ir vidēji 1,2 %, bet pozitīva testa gadījumā notikumu skaits ir 7,3 % [Kadish, 2009; Zabunova, 2013].
Datus par dzīvotspējīgu miokardu iegūst miera periodā un pēc lēnas dobutamīna devas ievadīšanas (10 un 20 mkg/kg/min ik pēc 3 minūtēm). Par dzīvotspējīgu miokardu sauc segmentus, kur ir atjaunojusies sieniņas funkcija pēc anormālas vai bifāziskas atbildes. Miokarda segments tiek novērtēts kā normokinētisks, hipokinētisks, izteikti hipokinētisks, akinētisks vai diskinētisks. Ar hipokinēziju apzīmē sieniņas kustības samazināšanos, ar diskinēziju – miokarda sieniņas nevienmērīgu saraušanos, savukārt akinēzija ir sieniņas kustības trūkums.
Miokarda perfūzijas MR ir neinvazīva izmeklēšanas metode, kas ļauj noteikt reģionālo asinsplūsmu miokardā un izvērtēt gadolīnija kontrastvielas uzkrāšanos miokardā. Klīniska nozīme ir miokarda perfūzijas, dzīvotspējas un funkcijas novērtēšanai, riska stratifikācijai pacientiem ar zināmu koronāro sirds slimību, kā arī koronārās intervences (koronogrāfija un perkutānā koronārā intervence) izvērtēšanai. Iegūtie dati ļauj pamatoti izvēlēties detalizētāku izmeklēšanu un izvērtēt revaskularizācijas nepieciešamību, medikamentozas terapijas optimizēšanu, riska faktoru modifikāciju.
Izvērtējot pacientu pēc MI ar MR, par paaugstinātu koronārās sirds slimības risku un turpmāko prognozi varētu liecināt šādi izmeklējuma dati:
- KK izsviedes frakcija (IF) < 30–36 %;
- rētas izmērs ≥ 5% no kreisā kambara masas; rētas izmērs > 5 % un KKIF > 30 % palielina risku 6,3 reizes;
- miokarda rēta > 23,5 g/m2 ir risks agrīniem kardiovaskulāriem notikumiem;
- miokarda sieniņu kustību traucējumi plašākā reģionā ar / bez perfūzijas defekta;
- perfūzijas defekts vairāk nekā vienā koronārās artērijas apasiņošanas reģionā;
- samazināta perfūzijas zona, kas ir lielāka par 0,5 % no kreisā kambara masas [Schwitter, 2008; James, 2012; Jacobson, 2012].
MR ir salīdzinoši dārga metode, tāpēc dažos pētījumos zinātnieki mēģināja noskaidrot tās lietderību, salīdzinot ar lētākām un ikdienā plaši izmantotām metodēm. Džeimss Vaits (James White) un līdzautori 2012. gadā veica pētījumu, kurā iekļāva 82 pacientus ar polimorfu ventrikulāru tahikardiju un / vai pēkšņu kardiālu nāvi. Pacienti tika izmeklēti ar MR un / vai transtorakālu ehokardiogrāfiju, invazīvo koronāro angiogrāfiju, datortomogrāfijas angiogrāfiju, vienfotona emisijas tomogrāfiju (SPECT) [Klem, 2012]. Izmantojot magnētiskās rezonanses izmeklējumu, nopietna miokarda patoloģija tika atklāta 74 % pacientu, ar citām izmeklēšanas metodēm – 51 % pacientu (p = 0,002). Divdesmit pacientiem (24 %) netika atklātas kardiālas patoloģijas, bet ar MR šiem pašiem pacientiem tika diagnosticēts klīniski nozīmīgs miokarda bojājums. Pētījums parādīja, ka MR ir klīniski svarīga izmeklēšanas metode pacientiem ar PKN vai polimorfu ventrikulāru tahikardiju, jo akūta miokarda patoloģiju bieži nav iespējams diagnosticēt ar citām izmeklēšanas metodēm.
Eiropas un ASV kardiologu profesionālo asociāciju vadlīnijas rekomendē lietot transtorakālo ehokardiogrāfiju un koronāro angiogrāfiju kā rutīnas izmeklēšanas metodes pacientiem ar ventrikulāro aritmiju. Savukārt citas izmeklēšanas metodes, tostarp MR, ir rekomendētas tikai pēc speciālistu norādījumiem [Zabunova, 2013]. MR diagnostiskā loma ir plaša, izmeklējums papildus sniedz informāciju par išēmisko un neišēmisko miokarda fibrozi, miokardītu, pēcinfarkta rētu analīzi, spēj atklāt polimorfas ventrikulāras tahikardijas substrātu. Šī izmeklēšanas metode jāizmanto agrīnai diagnostikai pacientiem pēc plaša miokarda infarkta, lai laikus varētu atklāt ventrikulāras tahikardijas substrātu un sākt PKN un polimorfas ventrikulāras tahikardijas profilaksi.
MR izmeklējums spēj prognozēt ne tikai aritmogēnus notikumus, bet arī kreisā kambara disfunkciju. Rubensteins ar līdzautoriem savā pētījumā izmeklēja 73 pacientus pēc STEMI ar MR un vēroja, kā izmainījās KKIF nedēļu un trīs mēnešus pēc infarkta. Rezultāti parādīja, ka infarkta rētas izmēri sniedza precīzākas prognozes par vēlīno KKIF samazināšanos līdz ≤ 35 % nekā agrīni KKIF mērījuma dati [Sun, 2000].
Pacientu vēlīnās prognozes pēc ST elevācijas miokarda infarkta
Pacientiem pēc miokarda infarkta var rasties dažādi sirds bojājumi (sk. 1. tab.).
1. tabula. Tipiskākās pēcinfarkta komplikācijas / Typical omplications after myocardial infarction
| Komplikāciju veids | Klīniskā izpausme |
|---|---|
| Išēmiskas | Pēcinfarkta stenokardija vai t. s. mēmā išēmija, atkārtoti infarkti, infarkta izplatīšanās (tās pašas artērijas apasiņošanas zonā) |
| Mehāniskas, saistāmas ar funkcijas traucējumiem | Sirds mazspēja, kambaru aneirisma, mitrāla regurgitācija, miokarda ruptūra, kardiogēns šoks, papillāra muskuļa disfunkcija |
| Aritmiskas | Ātriju vai ventrikulāra aritmija, sinusa vai atrioventrikulāra mezgla disfunkcija |
| Emboliskas | Centrālās nervu sistēmas, perifērijas (kājas, nieres, zarnas) embolijas, biežāk priekšējā miokarda infarkta gadījumā |
| Iekaisīgas | Perikardīts |
Ļoti bīstama komplikācija ir sirds muskuļa plīsums, no kā var iestāties kardiogēns šoks. Bieži sastopama ir kreisā kambara disfunkcija, kas palielina mirstību 3–4 reizes. Epidemioloģiskos pētījumos tika atklāts, ka tikai 25 % pacientu pēc MI rodas sirds mazspējas simptomātika. Aptuveni 40 % gadījumu kambaru sistoliskā disfunkcija rodas tieši pēc MI [Perez-David, 2011].
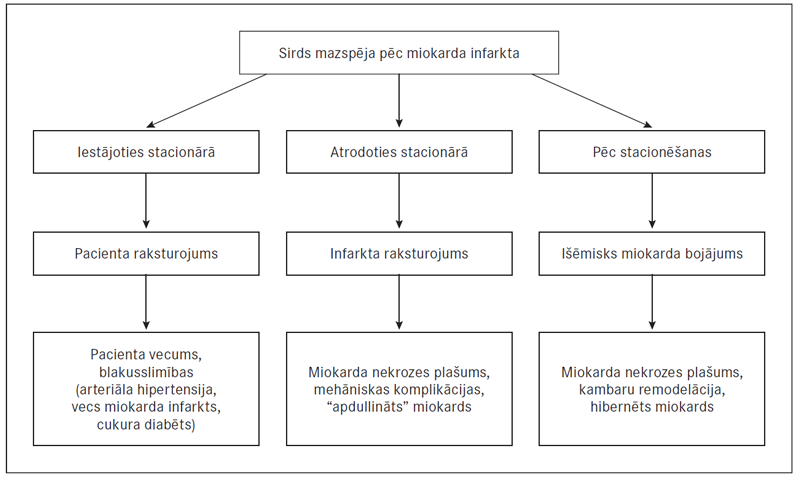
Ja sirds mazspēja rodas, jau iestājoties stacionārā, tas biežāk vērojams vecākiem pacientiem ar blakusslimībām, kas samazina organisma pielāgošanās spējas išēmiskam bojājumam. Savukārt, atrodoties stacionārā, sirds mazspēja parasti attīstās tiem pacientiem, kam bija plaša nekrozes zona, mehāniskās komplikācijas, miokarda postišēmiskā disfunkcija (“apdullums”). Pēc izrakstīšanas galvenie riska faktori, kas var veicināt sirds mazspējas rašanos vai progresēšanu, ir rētas izmēri, kambaru remodelācijas process, hibernēts miokards. Hibernācija ir hroniska, atgriezeniska miokarda disfunkcija ar samazinātu asinsplūsmu miera stāvoklī. No visiem minētajiem faktoriem par visnopietnāko tiek uzskatīts miokarda remodelācijas process (sk. 2. att.) [Jirgensons, Kalējs, 2010; Perez-David, 2011].
Mitrālā vārstuļa disfunkcija un smaga kambaru diastoliskā disfunkcija sastopama 10 % pacientu ar saglabātu KKIF, un tā ir saistīta ar sliktāku prognozi. Pēc miokarda infarkta pacienti, kam nav bijusi sirds mazspēja un kreisā kambara disfunkcija, salīdzinot ar pacientiem, kam ir attīstījusies sirds mazspēja un kambaru disfunkcija, ir augsta riska grupas pacienti, kuriem var būt bīstami kardiāli notikumi, piemēram, sirds ruptūra, sirdsdarbības apstāšanās, insults, ilgāka hospitalizācija, kambaru aritmijas, atkārtoti miokarda infarkti, pēkšņa kardiāla nāve [De Vaha, 2013].
2. attēls. Sirds mazspējas veidošanās mehānismi / Mechanisms on development of heart failure
Sirds mazspējas diagnostikai var lietot Killipa (Killip) klasifikāciju, NYHA (New York Heart Association) klasifikāciju, bioķīmiskus marķierus (BNP, NT-proBNP), vizuālas metodes (EhoKG, DT, SPECT, MR) [Minicucci, 2011]. Analizējot rētas disfunkcionālā miokarda zonu ar MR sirds mazspējas slimniekiem, tika secināts, ka šīs zonas plašums ir neatkarīgs riska radītājs KKIF samazināšanai (p = 0,01), sieniņas kustības izmaiņām (p = 0,0007), kreisā kambara beigu diastoliskā tilpuma (p = 0,007) un kreisā kambara beigu sistoliskā tilpuma indeksa izmaiņām (p ≤ 0,0001) [Dall’Armellina, 2012].
Otra biežākā miokarda infarkta komplikācija ir dažādi sirds ritma un vadīšanas traucējumi [White, 2013]. Tie var izpausties gan kā īslaicīgas sirdsklauves (ekstrasistoles), gan būt par nāves cēloni (sirds kambaru mirgošana). 2011. gada reģistra dati par Paula Stradiņa Klīniskās universitātes slimnīcas 32. nodaļu, kur tika analizēts 5301 akūta koronārā sindroma (AKS) slimnieks, atspoguļo, ka dzīvībai bīstamas aritmijas tika dokumentētas 225 pacientiem. Kopējā ventrikulāras aritmijas (VA) incidence bija 4,2 % gadījumu. Tomēr biežāk VA tika novērota STEMI grupā – 151 pacientam (9,5 %), salīdzinot ar Ne-STEMI grupu – 74 pacientiem (2 %).
Analizējot ventrikulāras tahiaritmijas biežumu STEMI grupā (11,2 %), tika secināts, ka biežāk rodas kambaru fibrilācija (66 %), stabila kambaru tahikardija (17 %) un pārejoša kambaru tahikardija (17 %) [Mača, 2013]. Tas apstiprina, ka pacientiem pēc STEMI ir paaugstināts bīstamu kardiālu notikumu risks. Kambaru aritmijas STEMI pacientiem biežāk konstatē divas stundas pēc AKS, ko varētu skaidrot ar agrīnas reperfūzijas ietekmi uz miokarda šūnām un elektrisko nestabilitāti [Mača, 2013; Dawson, 2013].
Novērtējot pacientus pēc STEMI, ir būtiski noskaidrot, vai tika veikta PKI un cik stundu pagāja no klīnisko simptomu sākuma pirms revaskularizācijas. Reperfūzijas terapijas plašā pielietojuma laikā akūtu aritmisko kardiālo notikumu (pēkšņa kardiāla nāve, atgriezeniska kambaru tahikardija, kambaru fibrilācija) skaits pacientiem pēc STEMI ir samazināts. Ārzemju zinātnieku [M. Izquierdo, et al.] pētījumā tika novēroti 440 STEMI pacienti, kam tika agrīni veikta PKI un MR. Pēc diviem gadiem tikai 2,5 % tika novēroti kardiālie notikumi, no kuriem 1,1 % bija pēkšņa kardiāla nāve, bet pārējiem pacientiem bija ventrikulāras aritmijas epizodes. Analizējot šo pacientu MR datus, tika novērots, ka samazināta KKIF ≤ 36 % un palielināts infarkta izmērs > 23,5 g/m2 paaugstināja risku agrīniem kardiāliem notikumiem [Schwitter, 2008; Izquerdo, 2013]. Vēlīns MR izmeklējums varētu būt noderīgāks vēlīno aritmogēno notikumu riska pakāpes noteikšanai.
Kopā 489 STEMI pacientiem ar PKI agrīna MR ar vēlīnās gadolīnija uzkrāšanās (VGU) metodi parādīja samazinātu perfūziju 61 % pacientu, kam bojājums bija 9 ± 7 % no kreisā kambara masas (KKM). Pēc gada 16 pacientiem novēroja pēkšņus kardiālus notikumus: vienā gadījumā – kardiālā nāve, vienā – atkārtots miokarda infarkts un 14 gadījumos – rehospitalizācijas ar sirds mazspējas, nestabilas stenokardijas simptomiem. Atkārtoti veicot MR izmeklējumu, pacientiem ar kardiāliem notikumiem tika diagnosticēta plašāka infarkta zona (14 ± 10 %, salīdzinot ar agrīnas MR datiem, kur fibroze 8 ± 6 % no KKM) un mazāka KKIF (44 ± 17 % pret 48 ± 14 %). Samazināta perfūzijas zona, kas ir lielāka par 0,5 % no KKM, tika pierādīta kā labs neatkarīgs prognostisks rādītājs pacientiem pēc akūta MI ar agrīni veiktu PKI, jo tas korelē ar mikrovaskulāras obstrukcijas pakāpi.
O. Hussers ar līdzautoriem ir veicis līdzīgu pētījumu, kur salīdzināja MR datus pēc vienas nedēļas un pēc sešiem mēnešiem pacientiem pēc STEMI. Rezultātā par vēlīno kardiālo notikumu liecināja infarkta izmērs pirmajā nedēļā, kas bija lielāks par 6 % no KKM, un rētas izmērs, kas pēc sešiem mēnešiem bija lielāks par 5 % no KKM. Analizējot vēlīno kardiālo notikumu saistību ar MR VGU rezultātiem, visticamākā prognoze bija agrīnai MR [21]. Miokarda infarkta izmēri ar laiku samazinās, tie kontrahējas un var negatīvi ietekmēt kambaru tonusu, radot sieniņas stīvumu un diastolisko disfunkciju. Tas viss var sekmēt sirds mazspēju, ventrikulāru aritmiju, pēkšņu kardiālo nāvi un citus kardiālus notikumus nākotnē.
Būtisks faktors, kas pacientiem ar strukturālu sirds slimību var radīt dzīvībai draudošu aritmiju, ir substrāta esamība. Aritmijas substrāts ir pēcinfarkta rētaudi, kam ir izmainīta gan mehāniskā funkcija, gan elektrofizioloģiskās īpašības. Pēcinfarkta rētaudos var saglabāties dzīvotspējīgi miocīti, kas arī veido aritmogēno substrātu, jo tie pēc miokarda infarkta spēj vadīt un veidot elektriskus impulsus. Taču atšķirībā no veseliem kardiomiocītiem, kurus infarkts nav skāris, radītais impulss izplatās lēnāk. Mehāniskas funkcijas izmaiņas ir saistītas ar to, ka rodas fibroze. Šie saistaudi rada pārejas zonu starp izmainītiem un veseliem kardiomiocītiem. Vesels miokards ar ātru impulsa pārvadi, dzīvotspējīgi kardiomiocīti rētaudos, kas vada impulsu lēnāk, un saistaudi starp tiem, kas ir elektriski neitrāla vide, – tas viss veido nepieciešamos apstākļus re-entry cilpas izveidošanai un pastāvēšanai.
Precīzāk aritmogēno substrātu spēj vizualizēt magnētiskās rezonanses vēlīnās gadolīnija uzkrāšanās metode [Gorgels, 2003; Heusch, 2004]. Hiroši Ašikaga (Hiroshi Ashikaga) un līdzautori uz 11 cūku modeļiem, kam bija hronisks miokarda infarkts, mēģināja atrast aritmogēnu substrātu un vadīšanas ceļus, izmantojot MR VGU 3D izmeklēšanas metodi sešām cūkām un endokardiālus katetrus piecām cūkām. Iznākumā re-entry cilpas izveidojās robežzonā starp rētaudiem un veselajiem audiem, kur atradās nelieli lauki ar dzīvotspējīgu miokardu [Ashikaga, 2007]. Līdzīgā pētījumā ārzemju zinātnieku grupa [Ng, et al., 2012], inducējot kambaru tahikardiju uz pēcinfarkta cūku modeļiem un izmantojot virtuālo elektrofizioloģisko MR izmeklēšanas metodi, secināja, ka re-entry cilpas vietas atbilst rezultātiem, kurus ieguva ar tiešo elektrofizioloģisko metodi. Tas parāda precīzu MR kreisā kambara rekonstrukcijas spēju, kas ļauj prognozēt kambaru tahikardijas cilpas vietas [Rubenstein, 2008].
Elektrisku remodelāciju veicina arī Na / Ca apmaiņas traucējumi bojātā miokardā. Elektrolītu līdzsvara traucējumi bieži veicina kambara tahikardijas un kambaru fibrilācijas attīstību miokarda infarkta akūtajā periodā. Savukārt arī hipoksija un reaktīvo skābekļa savienojumu palielināšanās var inducēt agrīnu pēcdepolarizāciju un trigera aktivitāti. Šīs izmaiņas saistītas ar pēkšņu kardiālo nāvi pirmajās stundās pēc miokarda infarkta [Jirgensons, Kalējs, 2010; Izquierdo, 2013]. Palielināta heterogēno audu masa var norādīt, ka virtuālā elektrofizioloģiskā izmeklējuma laikā var inducēt kambaru aritmiju, ir nepieciešama implantējamā kardiovertera-defibrilatora terapija (ICD) un ir paaugstināts PKN risks.
Elektrofizioloģiskā izmeklēšana (EFI) ir invazīva izmeklēšana, ko veic specializētos centros, tās laikā pacientam mēģina provocēt aritmiju un noteikt tās rašanās vietu un iespējamo ārstēšanas taktiku. Perezs-Deivids (Perez-David) un līdzautori apraksta, ka, veicot virtuālo elektrofizioloģisko izmeklēšanu pacientiem ar stabilu monomorfu kambara tahikardiju, identificēti heterogēnas zonas vadīšanas kanāli, kas atbilda ar MR VGU 3D izmeklējumā endokardiāli kartētiem sprieguma impulsiem. Tas nozīmē, ka stabilas monomorfas kambaru tahikardijas substrāts atbilst MR VGU vizualizētiem heterogēniem audiem rētas rajonā. Šis izmeklējums palīdz pacientiem pēc infarkta identificēt kambaru tahikardijas risku un atvieglot ablācijas veikšanu [Perez-David, 2011].
Dana Davsone un līdzautori publicēja pētījumu, kas apstiprināja MR vēlīnās gadolīnija uzkrāšanās metodes prognostisko lomu pacientiem ar kambaru tahikardiju. Šis pētījums bija pirmais, kas prospektīvi izanalizēja pacientus ar diagnosticētu kambaru tahikardiju, kuriem tika nozīmēts MR izmeklējums. Pētījumā iekļautie 373 pacienti tika novēroti vidēji 2,6 gadus, līdz pacientiem tika konstatēta pēkšņa kardiālā nāve, sirds apstāšanās, jauna stabilas kambaru tahikardijas epizode vai implantējamā kardiovertera- defibrilatora izlāde. Pacientiem bija saglabāta KKIF, kas vidēji bija 60 ± 13 %, un tikai nelielai daļai bija diagnosticēta koronāro artēriju slimība. Tas var likt aizdomāties par MR lietderību pacientiem ar KT bez diagnosticētas strukturālas sirds slimības.
Izanalizējot iegūtus datus, D. Davsones pētījumā tika secināts, ka vēlīnās gadolīnija uzkrāšanās metode ir vienīgais neatkarīgais prognostiskais riska rādītājs abās pacientu grupās. Savukārt pacientu grupā, kam tika diagnosticēta pārejoša kambaru tahikardija, MR vizualizēta fibroze bija vienīgais neatkarīgais prognostiskais riska rādītājs. Pacientu grupā ar stabilu kambara tahikardiju gan kreisā kambara fibroze, gan samazināta kreisā kambara funkcija (KKIF < 35 %) bija nozīmīgi riska rādītāji. Šis pētījums apliecina MR VGU metodes pārākumu pār KKIF rezultātiem, kas dod iespēju prognozēt pēkšņus kardiālus notikumus pacientiem ar kambaru aritmiju [Perez-David, 2011; Dawson, 2013].
Citos pētījumos, izmantojot MR vēlīnās gadolīnija uzkrāšanās metodi, tika iegūta pārliecinoša sakarība starp miokarda rētas izmēru un kardiovaskulāru notikumu risku.
Igors Klems un līdzautori 2012. gadā publicētā pētījumā demonstrē palielinātu aritmijas risku pacientiem, kam, izmantojot MR VGU, bija vizualizēts bojājums, kas pārsniedz 5 % no kreisā kambara tilpuma. Pētījumā iekļautie 137 pacienti tika novēroti 24 mēnešus, 104 pacientiem tika implantēts ICD. Pēc izmeklējuma ar MR tika secināts, ka kardiālā nāve vai ICD izlāde novērota biežāk pacientiem ar diagnosticētu samazinātu KKIF (30 ± 14 %, p = 0,002), palielinātu kreisā kambara beigu-diastolisko tilpumu (246 ± 156 ml, p = 0,048) un lielāku kreisā kambara rētu (12,9 %, p = 0,002), salīdzinot ar pacientiem, kam nebija pēkšņa kardiāla notikuma.
I. Klema pētījumā pacientiem, kam miokarda infarkta rēta sasniedza 5 % un vairāk no kreisā kambara masas, mirstības risks bija paaugstināts 5,9 reizes. Savukārt pacientiem ar rētas plašumu, kas lielāks par 5 %, un KKIF > 30 % risks palielinājās 6,3 reizes, salīdzinot ar pacientiem, kam bija līdzīga KKIF, bet rēta nepārsniedza 5 %. Jāpiebilst, ka pacientiem ar rētas plašumu, kas lielāks par 5 %, bet atšķirīgu KKIF (vai nu lielāku par 30 %, vai mazāku par 30 %) rezultāti saskanēja. Šī pētījuma dati apliecina arī to, ka ar MR diagnosticēta rēta ir neatkarīgs KKIF riska rādītājs. Šiem pacientiem ir indicēta ICD implantācija, neņemot vērā KKIF vērtību [Bello, 2003].
Daudzos ziņojumos tika ieteikts pacientus reklasificēt un veikt riska grupas atlasi. Piemēram, I. Klems un līdzautori pētījumā demonstrēja, ka MR VGK metode ievērojami uzlaboja prognostisko rādītāju, kas iepriekš tika noteikts, izmantojot KKIF un NYHA funkcionālo klasi [Ng, 2012]. Tika izteikts paradokss, ka daudzi pacienti ar mazāku kreisā kambara disfunkcijas rādītāju nomiruši no pēkšņas kardiālās nāves. Piemēram, Māstrihtas prospektīvā reģistrā atzīmēti 81 % pacientu ar KKIF > 30 %, savukārt Oregonas reģistrā – 70 % pacientu ar KKIF > 35 %, kas miruši no pēkšņas kardiālās nāves. Tas nav plašs pētījums, tomēr ir pārliecinoši dati, ka no 72 pacientiem ar zemu risku (KKIF > 30 %) 14 pacientiem reģistrēta nāve vai ICD izlāde. Svarīgi, ka, analizējot šo 14 pacientu MR datus, rētas izmērs > 5 % novērots 12 pacientiem, un tie tika novērtēti kā augsta riska grupas pacienti. Jāuzsver, ka no 14–18 augsta riska grupas pacientiem ar KKIF ≤ 30–35 %, kuriem implantēja ICD, labums no veiktās terapijas bija tikai vienam [Husser, 2013]. Rezultāti parāda, ka lielāks labums no ICD terapijas būtu pacientiem pēc MR izmeklējuma datiem, kas varētu samazināt ne tikai šīs terapijas izmaksas, bet arī pasargāt pacientu no procedūras komplikācijām, proaritmijas riska un invazīvas ārstēšanas, kurai nav rezultātu.
Kā beigu posms, kas pierādītu riska marķiera klīnisko nozīmīgumu, ir randomizēts klīnisks pētījums. Pētījums DETERMINE (DEfibrillators To REduce Risk by Magnetic ResoNance Imaging Evaluation) tika veikts, lai noteiktu ICD terapijas efektivitāti pacientiem ar koronāro artēriju slimību, kam diagnosticēta vidēja kreisā kambara disfunkcija un infarkta rēta pēc MR mērījuma datiem ≥ 10 % no kreisā kambara masas. Tika izteikta hipotēze, ka mērķa grupas pacientiem ICD implantācija un attiecīga medikamentozā terapija spēj samazināt mirstību par 28 %, salīdzinot ar kontroles grupas pacientiem, kas lieto tikai medikamentozo terapiju. Pētījumā tika plānots iekļaut 10 000 pacientu ar KKIF ≥ 35 % un infarkta rētu ≥ 10 %, kā arī 1500 kontroles grupas pacientu. Ekonomisku apsvērumu dēļ pētījumā reģistrēti 655 mērķa grupas pacienti un 81 kontroles grupas pacients [Dawson, 2013].
MR prognostisko lomu analizēja līdzīgā pētījumā, kas veikts astoņos medicīnas centros Vācijā. Pētījumā iekļauti 1217 pacienti pēc STEMI ar primāru PKI un MR. Tika pētīta MR vizualizētas infarkta rētas, mikrovaskulāras obstrukcijas un miokarda izskalošanās indeksa prognostiskā loma, salīdzinot ar tradicionāliem riska marķieriem (vecums, dzimums, cukura diabēts, ST segmenta izmaiņas, KKIF un plūsmas mērījums pirms un pēc PKI). Pēc 12 mēnešiem tika analizēti klīniskie notikumi (nāve, atkārtoti miokarda infarkti, sirds mazspēja). Gūtie rezultāti parāda, ka miokarda rēta un mikrovaskulāra obstrukcija ir labi prognostiskie rādītāji (p < 0,001) vēlīniem notikumiem. Salīdzinājumā ar tradicionāliem riska marķieriem miokarda izskalošanās indekss bija neatkarīgs riska rādītājs vēlīniem kardiāliem notikumiem.
Materiāls un metodes
Pētījumā tika iekļauti 18 Paula Stradiņa klīniskā universitātes slimnīcas pacienti, kuriem diagnosticēts nozīmīgs miokarda bojājums pēc ST elevācijas miokarda infarkta (STEMI), laikus tika izdarīta ārstēšana ar perkutāno koronāro intervenci ar / bez stenta implantācijas koronārajās artērijās un kuriem pēc ārstēšanas tika veikta miokarda magnētiskās rezonanses izmeklēšana, lai izvērtētu miokarda bojājuma pakāpi. Nepieciešamie dati par pacientu tika iegūti no slimības vēstures, MR mērījuma protokola, kā arī no aptaujas pa tālruni.
Pētījumā iekļauti pacienti ir nozīmīgu miokarda infarktu (ar ST segmenta elevāciju), kam tika izdarīta magnētiskās rezonanses izmeklēšana atbilstoši protokolam. Pēc 12 mēnešiem (2012.–2013. gada laikā) pa tālruni veiktā aptauja ļāva noteikt veselības stāvokli pēc miokarda infarkta.
Pēc organizācijas veida pētījums ir analītisks, kurā aprakstīta diagnostikas metodes loma prognozes noteikšanai pacientiem pēc nozīmīga miokarda infarkta. Pētījums ir kvalitatīvs (tiek novērota pacientu dzīves kvalitāte pēc nozīmīga miokarda bojājuma), eksperimentāls klīnisks pētījums (orientēts uz pacientiem, kam novērtē MR informatīvo lomu komplikāciju attīstībā pēc miokarda infarkta).
Pētījuma apskats
Latvijā sirds MR veic kopš 2011. gada Paula Stradiņa Klīniskās universitātes slimnīcas Diagnostiskās radioloģijas institūtā. Pašlaik MR pēc miokarda infarkta rekomendē veikt tikai pēc speciālistu norādījumiem vai arī šo izmeklējumu veic pētījuma laikā. Tomēr pasaulē šo izmeklēšanas metodi plaši lieto diagnostikā, prognozes noteikšanā un terapijas izvēlē pacientiem pēc miokarda infarkta.
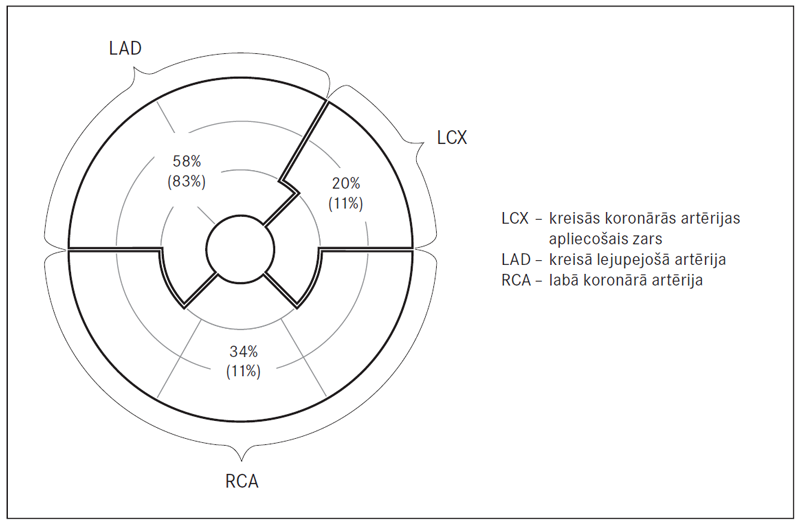
Paula Stradiņa Klīniskajā universitātes slimnīcā no 2012. līdz 2013. gadam izdarītas 18 MR izmeklēšanas pacientiem pēc STEMI ar veikto PKI ar / bez stenta implantācijas. Pacienti hospitalizēti nekavējoties pēc akūta notikuma, un 24 stundu laikā tiem veikta PKI. Stents koronārajās artērijās implantēts 16 (89 %) pacientiem. Pēc PKI datiem 15 (83 %) pacientiem bija skarta kreisā lejupejošā artērija (LAD, left anterior descending artery), tostarp bija arī viens kreisās koronārās artērijas stumbra bojājums (LM, left main artery). Diviem pacientiem (11 %) bojāts kreisās koronārās artērijas apliecošais zars (LCX, left circumflex artery) un diviem pacientiem (11 %) – labā koronārā artērija (RCA, right coronary artery). Nosacītas koronāro artēriju apasiņošanas zonas var attēlot uz MR protokolā izmantotā miokarda segmentārā iedalījuma (sk. 3. att.). Pēc MR vēlīnās gadolīnija uzkrāšanās metodes rezultātiem LAD apasiņošanas baseina segmenti skarti 58 %, LCX – 20 % un RCA – 34 % gadījumu.
Sirds izmeklēšana ar MR veikta 2012. gadā vidēji pēc astoņiem mēnešiem no pārciestā miokarda infarkta (no 5 līdz 792 dienām). Agrīna MR (9,5 ± 4,5 dienas pēc STEMI) veikta septiņiem pacientiem, no tiem vēlīnā prognoze pozitīva bija pieciem (71 %) pacientiem. Savukārt vēlīna MR (424,5 ± 367,5 dienas) veikta 11 pacientiem, no tiem pozitīva prognoze novērota septiņos (64 %) gadījumos. Pozitīva prognoze ir tiem pacientiem, kam ar plašu miokarda rētu bija vēlīni kardiālie notikumi, un pacientam, kam rēta netika diagnosticēta un vēlīno notikumu nebija. Par vēlīniem notikumiem uzskatāma rehospitalizācija sakarā ar progresējošu sirds mazspēju, atkārtotu miokarda infarktu, progresējošu stenokardiju, ventrikulāras aritmijas epizodi, ātriju fibrilāciju, kā arī ICD izlādi, insultu un kardiovaskulāro nāvi.
3. attēls. Nosacīts pēcinfarkta rētas skarto segmentu iedalījums pēc apasiņotās artērijas baseina teritorijas / Post-MI Myocardial scar and segmentar localization by coronary artery sites
No analizētajiem 18 pacientiem 10 pacientiem (56 %) bija atkārtoti kardiāli notikumi. Deviņi pacienti tika atkārtoti stacionēti ar progresējošu sirds mazspēju (n = 8), atkārtotu miokarda infarktu (n = 3), progresējošu stenokardiju (n = 4), ātriju fibrilāciju (n = 1), un vienam pacientam kambaru tahikardija tika diagnosticēta pirmajā stacionēšanas reizē pēc STEMI.
Aptaujājot pa tālruni, tika izvērtēta pacientu subjektīvā dzīves kvalitāte 5 ballu sistēmā, salīdzinot veselības stāvokli pirms un pēc kardiālā notikuma. Tika noskaidrots, ka pieciem (28 %) pacientiem pašsajūta ir tikpat laba kā pirms primāra kardiālā notikuma. Apmierinoša pašsajūta ir vienam (5 %) pacientam, maznozīmīgas izmaiņas ir četriem (22 %) pacientiem, būtiskus ierobežojumus ikdienas dzīvē izjūt trīs (17 %) pacienti un nozīmīgus veselības traucējumus, kas izteikti pasliktina dzīves kvalitāti, norāda pieci (28 %) pacienti. Apmierināti ar dzīves kvalitāti (3–5 balles) ir trīs (30 %) pacienti ar vēlīniem kardiāliem notikumiem un septiņi (88 %) pacienti bez atkārtotiem notikumiem. Savukārt ierobežojumus ikdienas dzīvē izjūt septiņi (70 %) pacienti ar vēlīniem notikumiem un viens (13 %) pacients bez atkārtota notikuma, salīdzinot ar pašsajūtu pirms primāra STEMI.
Tradicionālie riska faktori (vīriešu dzimums, aptaukošanās, arteriālā hipertensija, cukura diabēts, dislipidēmija u. c.) palielina prognostisko lomu vēlīniem kardiāliem notikumiem pēc MI. Analizējot pacientu nemodificējamos riska faktorus, var atzīmēt, ka pacientu grupā ir 17 (94 %) vīrieši un tikai viena sieviete. Vidējais vecums ir 54 ± 11,3 gadi, turklāt četri pacienti ir jaunāki par 45 gadiem. Ģimenes anamnēzē deviņiem (50 %) pacientiem bija kardiovaskulāra slimība (miokarda infarkts, insults, stenokardija). No modificējamiem nelipīdu riska faktoriem astoņiem (44 %) pacientiem ir arteriālā hipertensija, pieciem (28 %) – 2. tipa cukura diabēts, astoņi (44 %) pacienti smēķē. Vidējais ĶMI ir 30 ± 5,7 kg/m2, aptaukošanās ir 10 pacientiem (ĶMI ≥ 30 kg/m2). Analizējot lipīdu riska faktorus, paaugstināts kopējais holesterīns un zema blīvuma lipoproteīnu holesterīns ir deviņiem pacientiem, dislipidēmija diagnosticēta 13 (76 %) pacientiem. Slimības anamnēzē vecs miokarda infarkts bija trīs (17 %) pacientiem, PKI ar stentu bija trīs (17 %) pacientiem, hipertrofiskā kardiomiopātija – vienam pacientam un hroniskā sirds slimība – diviem pacientiem. Četriem pacientiem no pieciem BNP (B tipa nātrijurētiskais peptīds) analīze bija lielāka par 200 pg/ml. Vienam pacientam, kam analīze bija > 1000 pg/ml, tika diagnosticēta rēta 57 % no KK masas un pēc miokarda infarkta attīstījās sirds mazspēja ar KKIF 31 %.
Pēcinfarkta bojājuma plašums un kreisā kambara funkcijas izmaiņas pacientiem tika novērtētas ar MR. Aplūkotajiem pacientiem vidējais rētas plašums ir 30,4 ± 14,8 (% no KK masas). Pacientiem ar vēlīniem notikumiem (progresējošā sirds mazspēja, atkārtots miokarda infarkts, progresējošā stenokardija, ventrikulāras aritmijas epizodes, ātriju fibrilācija) rētas plašums vidēji ir 32,7 %, bet pacientiem bez atkārtotiem notikumiem – vidēji 25,4 %.
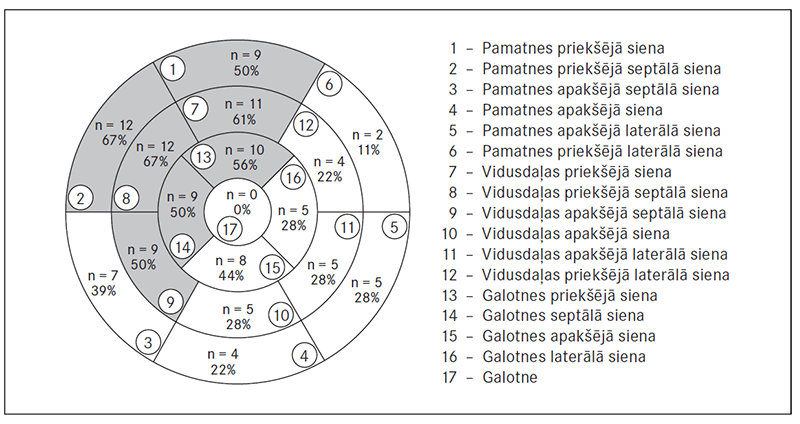
Bojāto segmentu biežums pēc MR VGU metodes datiem parāda, ka biežāk (≥ 50 % gadījumu) skarts LAD apasiņošanas baseins (sk. 4. att.).
4. attēls. Miokarda segmenti, kurus biežāk skar pēcinfarkta rētas / Proportion of myocardial scar in segments
Kreisā kambara masa (KKM) aplūkotajiem 18 pacientiem ir vidēji 186,7 ± 47,3 g (norma – 120 ± 23 g), 10 pacientiem ar vēlīniem notikumiem, salīdzinot ar astoņiem pacientiem bez tiem, KKM ir attiecīgi 206,7 ± 47,4 g un 161,7 ± 35,6 g. Pēcinfarkta kreisā kambara aneirisma vērojama deviņiem pacientiem (50 %) ar vidēji 12 cm2 laukumu, pacientiem ar vēlīniem notikumiem aneirismas bija septiņos gadījumos ar vidējo laukumu 14,7 cm2. Kreisā kambara sieniņas kustības izmaiņas bija 15 pacientiem, biežāk novērota hipokinēzija bojātā miokarda apvidū. Pacientiem ar atkārtotiem kardiāliem notikumiem biežāk novērota akinēzija četros gadījumos (40 %) un diskinēzija četros gadījumos (40 %), salīdzinot ar pacientiem bez atkārtotiem notikumiem. Vidējā kreisā kambara izsviedes frakcija (KKIF) aplūkotajiem pacientiem bija 40,8 ± 7,5 %, un līdzīgi dati ir pēc EhoKG izmeklējuma, kur KKIF ir 41,6 ± 6,1 %.
Desmit pacientiem ar vēlīniem notikumiem KKIF vidēji ir 37,6 ± 4,9 %, savukārt astoņiem pacientiem bez atkārtotiem notikumiem vidēji 46,5 ± 3,3 %. Analizējot funkcionālos rādītājus 18 pacientiem, kreisā kambara beigu sistoliskais tilpums (KKBST) vidēji ir 111,7 ± 40,3 ml (norma – 43 ± 13 ml), kreisā kambara beigu diastoliskais tilpums (KKBDT) vidēji ir 178,5 ± 50,9 ml (norma – 149 ± 25 ml). Pacientiem ar vēlīniem notikumiem KKBST un KKBDT attiecīgi ir 133,6 ± 39,7 ml un 204,4 ± 50,4 ml, bet astoņiem pacientiem bez kardiāliem notikumiem – 84,4 ± 20 ml un 146,1 ± 29,4 ml. Izvērtējot pacientu pēcinfarkta stāvokli pēc MR datiem, tika secināts, ka tiem ir smaga strukturāla sirds slimība ar mēreni samazinātu KKIF, plašu miokarda rētu un kreisā kambara funkcijas traucējumiem (paaugstināts KKBDT, KKBST, sieniņas kustības traucējumi).
Pacientu vēlīno prognozi pēc miokarda infarkta ietekmē arī ārsta rekomendāciju izpildīšana (diētas izmaiņas, smēķēšanas pārtraukšana, mērena alkohola lietošana, fiziskās aktivitātes) un medikamentu lietošana. Aptaujā pa tālruni tika konstatēts, ka ģimenes ārstu un kardiologu regulāri apmeklē 16 (94 %) pacienti. Visas ārstēšanas rekomendācijas izpilda tikai seši (35 %) pacienti, no kuriem pieciem (63 %) nebija vēlīno kardiālo notikumu. No medikamentiem biežāk izrakstīti antiagreganti un statīni, ko lieto 15 (88 %) pacienti. AKE-inhibitorus un beta blokatorus lieto 13 (76 %) pacienti, diurētiskos līdzekļus un spironolaktonu – četri (24 %) pacienti, angiotenzīna receptoru blokatorus – viens (6 %) pacients. Vienam pacientam veikta arī kardiovertera-defibrilatora implantācija. Visiem pacientiem tika veikta cilmes šūnu transplantācija, tieši šī pētījuma laikā STEMI pacienti tika izmeklēti ar MR.
Diskusija
Pētījumā iekļautajiem pacientiem biežāk skarta ir kreisā lejupejošā artērija (LAD). Arī pēc MR mērījuma datiem biežāk skarta ir priekšējā un sānu siena, kas atbilst LAD apasiņošanas zonai. Ar MR vēlīnās gadolīnija uzkrāšanās metodi varēja vizualizēt arī akūta notikuma tūskas zonu, remodelācijas procesa plašumu un dziļumu, veca miokarda infarkta rajonu, kreisā kambara sieniņas kustību un struktūru, izvērtēt funkcionālus rādītājus, tātad precīzāk novērtēt pēcinfarkta bojājuma pakāpi. Pacientiem pēc STEMI sirds bojājums ir izteikts, kā arī ir izmainīta kambara struktūra un funkcijas. Literatūras dati liecina, ka sirds mazspēja rodas 25 % gadījumu pēc MI.
Pētījumā iesaistītajiem pacientiem vidējais rētas plašums ir 30 %, un sirds mazspējas rašanos vai progresēšanu novēroja astoņiem (44 %) pacientiem. Novērtējot pacientu stāvokli pēc pārciesta STEMI, var secināt, ka tas pasliktina dzīves kvalitāti, rada ierobežojumus ikdienas aktivitātēs un ar laiku – lielākas sūdzības par sirds un asinsvadu sistēmas slimībām. Vairāk nekā pusei pacientu bija atkārtota hospitalizācija sirds slimības progresēšanas dēļ, kaut gan tika regulāri lietotas zāles un vidēji reizi mēnesī apmeklēts ārsts.
Visticamāko prognozi var iegūt, veicot agrīnu (līdz vienai nedēļai) MR pacientiem pēc MI. MR rezultāti parāda, ka nav būtiskas atšķirības pacientu prognozē starp agrīni (līdz divām nedēļām) un vēlīni (vidēji pēc 14 mēnešiem) iegūtiem rezultātiem. To varētu skaidrot ar rētas izmēriem, kas ievērojami pārsniedz 5–6 % vērtību. Vēlīns MR izmeklējums (pēc 6 mēnešiem) labāk nosaka ventrikulāras aritmijas riska pakāpi. Pēc pētījumā iegūtajiem datiem ir grūti spriest par vēlīniem aritmogēniem notikumiem, jo nevar iegūt apstiprinājumu par ventrikulāras aritmijas epizodi. Kaut gan, aptaujājot pa tālruni, noskaidrots, ka diviem pacientiem pēc tam bija samaņas zuduma epizodes, tomēr nevar pārliecinoši apgalvot, ka tas ir saistīts ar kardiālo patoloģiju. Tam ir vajadzīgas papildu izmeklēšanas metodes, piemēram, 12 novadījumu elektrokardiogramma miera un lēkmes laikā, fiziskas slodzes tests, Holtera monitorings 24 vai 48 stundas vai implantējamas ierīces ilgākam laikposmam, kā arī elektrofizioloģiskā izmeklēšana. Pacientiem ar diagnosticētu ventrikulāru tahiaritmiju ir indicēta kardiovertera- defibrilatora implantācija un katetrablācija.
Vizualizētas hipokinēzijas un akinēzijas zonas miokarda infarkta rētas segmentos pazemina sirds kontraktilitāti, rada kambaru tilpumu izmaiņas. Ja sirds kambari piepildās nevienmērīgi, tad arī miokarda saraušanās ir mainīta, tas var provocēt aritmijas, sirds mazspējas attīstību. Rodas arī pavājināta asins plūsma, īpaši aterosklerotiskas stenozes vietās, kas rada miokarda infarkta progresēšanu un recidivēšanu. Kreisā kambara sistolisko disfunkciju ar vai bez sirds mazspējas simptomātikas izraisa miokarda recidivējošās išēmijas epizodes, infarkta izmērs, kambaru remodelācija, “apdullis” miokards, mehāniskas komplikācijas un hibernēts miokards.
Pacienti pēc miokarda infarkta, kuriem nav sirds mazspējas un kreisā kambara disfunkcijas, salīdzinot ar pacientiem, kuriem sirds mazspēja un kambaru disfunkcija ir attīstījusies, ir augsta riska grupas pacienti, kam attīstīsies bīstami kardiāli notikumi, piemēram, sirds ruptūra, sirdsdarbības apstāšanās, insults, ilgāka hospitalizācija, kambaru aritmijas, atkārtoti miokarda infarkti, pēkšņa kardiālā nāve.
Miokarda infarkta prognoze bieži ir atkarīga no slimības gaitas, tās komplikācijām, slimnieka vecuma un blakusslimībām. Daļa pacientu pēc ārstēšanas kursa beigām var sekmīgi atgriezties iepriekšējā darbā, ja vien tas nav saistīts ar lielu fizisku piepūli vai pārmērīgām stresa situācijām. Ja ārstēšanas rezultāti nav apmierinoši, ģimenes ārsts var lemt jautājumu par strādājošo pacientu nosūtīšanu invaliditātes grupas kārtošanai. Piemēram, divi pacienti no veiktā pētījuma kārto invaliditātes grupu, jo nespēj veikt pat ikdienas darbu. Optimāla diagnostisko izmeklējumu algoritma veidošanā svarīga ir individuāla pieeja katram pacientam, lai novērtētu kardiovaskulāro notikumu risku un izvēlētos optimālu ārstēšanas stratēģiju varbūtēju koronāro notikumu novēršanai.
STEMI joprojām ir aktuāla problēma mūsu valstī, un pacientu skaits ar nozīmīgu sirds bojājumu katru gadu palielinās. Pacienti pēc STEMI ir pakļauti augstam pēkšņas nāves riskam, kā arī citiem smagiem kardiāliem notikumiem, kam pamatā ir strukturāls sirds bojājums. Daudzi literatūrā minētie pētījumi apliecina MR vēlīnās gadolīnija uzkrāšanās metodi kā efektīvu, neatkarīgu riska rādītāju pacientiem ar vai bez koronārās artērijas slimības, kas spēj prognozēt pēkšņu kardiovaskulāro nāvi. Šī metode būtiski uzlabo prognostisko rādītāju, kas iepriekš tika noteikts, izmantojot KKIF un NYHA funkcionālo klasi. Izvērtējot pacientu pēc miokarda infarkta ar MR, par paaugstinātu koronāras sirds slimības risku un turpmāko prognozi varētu liecināt šādi izmeklējuma dati:
- KK izsviedes frakcija < 30 %;
- rētas izmēri ≥ 5 % no kreisā kambara masas;
- miokarda rēta > 23,5 g/m2;
- miokarda sieniņu kustību traucējumi plašākā reģionā ar / bez perfūzijas defekta;
- perfūzijas defekts vairāk nekā vienā koronārās artērijas apasiņošanas reģionā;
- samazināta perfūzijas zona > 0,5 % no KKM.
Miokarda rēta, mikrovaskulāra obstrukcija ir labi prognostiskie rādītāji vēlīniem notikumiem, salīdzinot ar tradicionāliem riska marķieriem (vecums, dzimums, cukura diabēts, ST segmenta izmaiņas, KKIF). Analizējot rētas disfunkcionālā miokarda zonu ar MR, tika secināts, ka šīs zonas plašums ir neatkarīgs riska rādītājs KKIF samazināšanai, sieniņas kustības izmaiņām, kreisā kambara beigu diastoliskā tilpuma un kreisā kambara beigu sistoliskā tilpuma indeksa izmaiņām. Šis izmeklējums palīdz pacientiem pēc infarkta identificēt kambaru tahikardijas risku un atvieglot ablācijas veikšanu. Stabilas monomorfas kambaru tahikardijas substrāts atbilst MR VGU vizualizētiem heterogēniem audiem rētas rajonā. Zelta standarts ventrikulāras tahikardijas ārstēšanā ir kardiovertera-defibrilatora implantācija. Lielāks labums no kardiovertera-defibrilatora terapijas būtu pacientiem pēc MR izmeklējuma datiem, nevis KKIF, kas varētu ne tikai samazināt šīs terapijas izmaksas, bet arī pasargāt pacientu no procedūras komplikācijām, proaritmijas riska un invazīvas ārstēšanas, kurai nav rezultāta.
Pēc izrakstīšanas nopietnākais riska faktors, kas var veicināt sirds mazspējas rašanos vai progresēšanu, ir miokarda remodelācijas process. Pie plaša transmurāla miokarda infarkta reparācijas procesos tiek iesaistīta visa sirds, pastiprināti veidojas fibrozie audi un remodelācijas procesi arī infarkta neskartajā miokardā. Ir iespējama efektīva farmakoloģiska ārstēšana ar angiokonvertējošā enzīma inhibitoriem vai angiotenzīna receptoru blokatoriem, kas kavē miofibroblastu metabolisko aktivitāti un mazina fibrozo audu uzkrāšanos neskartajā miokardā.
Pēc Eiropas Kardiologu biedrības rekomendācijām pacientiem pēc miokarda infarkta pēkšņas kardiālās nāves primārajā profilaksē ir pierādīta efektivitāte medikamentozai terapijai: beta adrenoblokatoriem, aspirīnam, angiokonvertējošā enzīma inhibitoriem un medikamentiem, kas samazina lipīdu daudzumu (statīniem).
Lai palīdzētu pacientiem pēc miokarda infarkta uzlabot dzīves kvalitāti un pasargātu no pēkšņiem kardiovaskulāriem notikumiem, slimības progresēšanas, ir iespējams ar neinvazīvu un pierādītu metodi novērtēt pacienta stāvokli un izvēlēties atbilstošu ārstēšanu. Ar MR iegūtie dati ļauj pamatoti izvēlēties turpmāku invazīvu izmeklēšanu, optimizēt terapiju ar medikamentiem, implantēt kardioverteru-defibrilatoru un pievērst uzmanību riska faktoru modifikācijai. Latvijā ar laiku pieaug kardiovaskulāras MR izmeklējumu skaits, un, lai gūtu labus rezultātus būtu ieteicams veikt šo izmeklējumu arī pacientiem ar nopietnu sirds bojājumu pēc STEMI.
Secinājumi
Magnētiskā rezonanse ir efektīva izmeklēšanas metode pacientiem pēc miokarda infarkta, kas novērtē rētas remodelācijas procesus, atklāj aritmogēno substrātu, parāda kreisā kambara funkcionālos rādītājus.
Magnētiskās rezonanses vēlīnās gadolīnija uzkrāšanās metode ir labs prognozes rādītājs smagiem kardiāliem notikumiem. Iegūtie dati ļauj pamatoti izvēlēties turpmāku invazīvu izmeklēšanu, optimizēt terapiju ar medikamentiem, veikt kardiovertera-defibrilatora implantāciju un pievērst uzmanību riska faktoru modificēšanai.
Abstract
Informative and Predictive Value of Myocardial Magnetic Resonance in Patients with Significant Myocardial Damage after ST-elevation Myocardial Infarction: 12-month Results
Cardiovascular disease is the leading cause of death in Latvia that occurs approximately in 54–56 % of all deaths. Patient rehabilitation after myocardial infarction and secondary prevention can decrease coronary heart disease average at 20–30 %.
The aim of the study was to investigate the prognostic value of cardiovascular magnetic resonance (CMR) in patients with ST-elevation myocardial infarction (STEMI). Eighteen patients reperfused by primary coronary intervention within 24 hours after symptom onset were included in the study. CMR was performed in median 8 months after the event. Clinical follow-up was conducted in median after 12 months. The predetermined endpoint was a composite of congestive heart failure, myocardial re-infarction, post-infarction angina, atrial or ventricular arrhythmias, implantable cardioverter-defibrillator discharge, and cardiac death. The results show that ten patients (56 %) had recurrent cardiac hospitalisation. Five patients’ (28 %) notes significantly impaired the quality of life after acute myocardial infarction. Infarct size measured 15 minutes after gadolinium injection was an average 29 % of left ventricular volume. The left ventricle wall motion had changed in 15 patients (83 %), aneurysms formed in 9 patients (50 %) and average left ventricular ejection fraction was 41 %. Late gadolinium-enhanced magnetic resonance (LGE-CMR) is the technique of choice for assessing fibrosis after myocardial infarction, characterise myocardial tissue, and analyse left ventricle function. LGE-CMR detected fibrosis is a predictor of adverse outcomes in patients after STEMI. These findings have the potential to bring significant refinement in prescribing ICD therapy, to optimise medical treatment and pay attention in risk factor modification.
Literatūra
- Ashikaga H., Sasano T., Dong J. Magnetic resonance-based anatomical analysis of scar-related ventricular tachycardia: implications for catheter ablation // Circulation Research, 2007; 101: 939–947.
- Bello D., Shah D. J., Farah J. M., et al. Gadolinium cardiovascular magnetic resonance predicts reversible myocardial dysfunction and remodeling in patients with heart failure undergoing β-blocker therapy // Circulation, 2003; 108: 1945–1953.
- Dall’Armellina E., Piechnik S. K., Ferreira V. M., et al. Cardiovascular magnetic resonance by non contrast T1-mapping allows assessment of severity of injury in acute myocardial infarction // Journal of Cardiovascular Magnetic Resonance, 2012; 14 (1): 15–27.
- Dawson D. K., Hawlisch K., Prescott G. Prognostic role of CMR in patients presenting with ventricular arrhythmias // Journal of the American College of Cardiology, 2013; 6 (3): 335–344.
- De Waha S., Eitel I., Fuernau G., et al. Cardiac magnetic resonance imaging and prognosis in ST-elevation myocardial infarction: data from 1217 patients derived from multicenter studies // Journal of the American College of Cardiology, 2013; 61 (10): 108–116.
- Goldberger J. J., Cain M. E., Hohnloser S. H. Heart Rhythm Society scientific statement on noninvasive risk stratification techniques for identifying patients at risk for sudden cardiac death // Journal of the American College of Cardiology, 2008; 52: 1179–1199.
- Gorgels A. P., Gijsbers C., de Vreede-Swagemakers J., Wellens H. J. Out-of-hospital cardiac arrest-the relevance of heart failure. The Maastricht Circulatory Arrest Registry // European Heart Journal, 2003; 24: 1204–1209.
- Heusch G., Sipido K. R. Myocardial hibernation // Circulation Research, 2004; 94: 1005–1007.
- Husser O., Monmeneu J., Bonanad C., et al. Head-to-head comparison of 1 week versus 6 months CMR-derived infarct size for prediction of late events after STEMI // The International Journal of Cardiovascular Imaging, 2013; 29 (7): 1499–1509.
- Izquierdo M., et al. Value of early cardiovascular magnetic resonance for the prediction of adverse arrhythmic cardiac events after a first noncomplicated ST-segment-elevation myocardial infarction // Circulation: Cardiovascular Imaging, 2013; 6 (5): 755–761.
- Jirgensons J., Kalējs O. Klīniskā medicīna, I daļa / A. Lejnieka red. Rīga: Nacionālais apgāds, 2010. – 39.–447. lpp.
- Kadish A. H., Bello D., Finn J. P., et al. Rationale and design for the Defibrillators to Reduce Risk by Magnetic Resonance Imaging Evaluation (DETERMINE) trial // Journal of Cardiovascular Electrophysiology, 2009; 20: 982–987.
- Karpovs J., Lugovska S. Pēkšņa kardiāla nāve // Doctus, 2004, Nr. 7, 61.–67. lpp.
- Klem I., Weinsaft J. W., Bahnson T. D. Assessment of myocardial scarring improves risk stratification in patients evaluated for cardiac defibrillator implantation // Journal of the American College of Cardiology, 2012; 60: 408–420.
- Lee D. C., Goldberger J. J. CMR for sudden cardiac death risk stratification: are we there yet? // Journal of the American College of Cardiology, 2013; 6 (3): 345–348.
- Maca A., Kalejs O., Zakke I., et al. Incidence and risk factors of ventricular arrhythmias in patients with acute coronary syndrome – data from Latvian acute coronary syndrome registry 2011 // RSU Scientific Conference 2013. Riga, 2013; 102.
- Minicucci M. F., Azevedo P. S., Polegato B. F., et al. Heart failure after myocardial infarction: clinical implications and treatment // Clinical Cardiology, 2011; 7 (34): 410–414.
- Ng J., Jacobson J. T., Ng J. K. Virtual electrophysiological study in a 3-dimensional cardiac magnetic resonance imaging model of porcine myocardial infarction // Journal of the American College of Cardiology, 2012; 60 (5): 423–430.
- Perez-David E., Arenal A., Rubio-Guivernau J. L. Noninvasive identification of ventricular tachycardia-related conducting channels using contrast-enhanced magnetic resonance imaging in patients with chronic myocardial infarction: comparison of signal intensity scar mapping and endocardial voltage mapping // Journal of the American College of Cardiology, 2011; 2 (57): 184–194.
- Rubenstein J., Ortiz J., Wu E., et al. The use of periinfarct contrast-enhanced cardiac magnetic resonance imaging for the prediction of late postmyocardial infarction ventricular dysfunction // American Heart Journal, 2008; 156 (3): 498–505.
- Schwitter J., Buser P., Luechinger R., et al. CMR Update. Switzerland: Kueng Druck AG, 2008; 8–73.
- Sun Y., Weber K. T. Infarct scar: a dynamic tissue // Cardiovascular Research, 2000; 46: 250–256.
- Šipačovs P., Kupics K., Kambaru tahikardija kā miokarda infarkta vēlīnas sekas // Doctus, 2010, Nr. 9, 20.–28. lpp.
- Veselības aprūpe Latvijā / P. Apiņa red. Rīga: SIA Medicīnas apgāds, 2013. – 319 lpp.
- White J. A., Nowell M., Fine A., et al. Utility of cardiovascular magnetic resonance in identifying substrate for malignant ventricular arrhythmias // Circulation: Cardiovascular Imaging, 2012; 5: 12–20.
- Zabunova M., Mintāle I., Ratniece M. u. c. Kā precizēt KSS diagnozi un novērtēt KSS gaitu: miokarda perfūzijas scintigrāfija // Doctus, 2013, Nr. 7, 68.–76. lpp.


