Agrīnas diagnostikas iespējas bērniem ar smagām bakteriālām infekcijām slimnīcas neatliekamās palīdzības nodaļā
Kopsavilkums
Ievads. Smagas bakteriālas infekcijas ir viens no galvenajiem bērnu mirstības iemesliem. To diagnostikā un ārstēšanā pēdējo dekāžu laikā izstrādātas starptautiskas, uz pierādījumiem balstītas rīcības skalas. Pateicoties to ieviešanai un laboratoriskās diagnostikas iespēju paplašināšanai, Bērnu klīniskās universitātes slimnīcā (BKUS) izdevies sasniegt uzlabojumus smagu bakteriālu infekciju agrīnā atpazīšanā un ārstēšanā.
Darba mērķis. Izvērtēt smagu bakteriālu infekciju (SBI) agrīnas atpazīšanas iespējas BKUS Neatliekamās palīdzības nodaļā, izmantojot uz pierādījumiem balstītas rīcības skalas, kā arī pieejamo iekaisuma marķieru komplektu.
Materiāls un metodes. Retrospektīvs aprakstošs pētījums divās daļās: A daļa – agrīna bērnu ar smagām bakteriālām infekcijām rīcības skalu lietojuma izpēte slimnīcas Neatliekamās palīdzības nodaļā; B daļa – BKUS iekaisuma marķieru pieejamā komplekta izvērtējums pacientu ar SBI identificēšanai.
Rezultāti. Pēc rīcības skalu ieviešanas lielākajai daļai pacientu ar smagām bakteriālām infekcijām tika veikts asins uzsējums (82 %, iepriekš 64 %), ievadīti intravenozie šķīdumi (84 %, iepriekš 22 %), laikus uzsākta antibakteriālā terapija (63 %, iepriekš 8 %). Samazinājās stacionēšanas nepieciešamība (18 % iepriekšējo 45 % vietā) Intensīvās terapijas nodaļā (ITN), vidējais atrašanās ilgums ITN samazinājās no 12,2 līdz 3,7 dienām, hospitalizācijas ilgums – no 26,3 līdz 11 dienām, mirstība no sepses – no 24,4 % līdz 7,8 %. ROC līkņu (Receiver Operational Characteristic) AUC (laukums zem līknes, angļu val. area under the curve) analīze augstāko diagnostisko precizitāti uzrādīja C reaktīvajam proteīnam (CRP) – AUC 0,94 (95 % TI: 0,92–0,97, nenobriedušo granulocītu absolūtajam skaitam – AUC 0,82 (95 % TI: 0,77–0,88) un to procentuālajai attiecībai – AUC 0,79 (95 % TI: 0,72–0,85).
Secinājumi. Uz pierādījumiem balstītu rīcības skalu ieviešana slimnīcas Neatliekamās palīdzības nodaļā samazina kopējo hospitalizācijas laiku, ārstēšanās periodu Intensīvās terapijas nodaļā, ievērojami mazina bērnu mirstību sepses dēļ. Nenobriedušie granulocīti uzskatāmi par labu bakteriālo infekciju papildu diagnostisko marķieri.
Ievads
Pediatriskajā populācijā smagas bakteriālas infekcijas (SBI) un sepse vēl aizvien ir viens no galvenajiem mirstības iemesliem jebkura vecuma bērniem (Watson, 2003; Hartman, 2013; Kutko, 2003). Arī Amerikas Savienotajās Valstīs bakteriālas izcelsmes sepse joprojām ir ierindota starp 10 biežākajiem nāves iemesliem bērniem (Conference on Decision and Control, 2015). Pēdējo dekāžu laikā smagu bakteriālu infekciju un sepses atpazīšanas un ārstēšanas jomā panākts ievērojams uzlabojums. Iepriekšējo gadu laikā globāla mēroga iniciatīvas Surviving Sepsis Campaign (SSC) rezultātā atkārtoti publicētas starptautiskas sepses un septiskā šoka vadlīnijas, kurās akcentēti divi būtiskākie nosacījumi sepses mirstības mazināšanai – agrīna sepses pacientu atpazīšana un nekavējoši sākta ārstēšana (Dellinger, 2004; Dellinger, 2013). 2016. gadā publicētas jau trešās pēc kārtas Starptautiskās konsensus konferences (Sepsis-3) sepses un septiskā šoka definīcijas pieaugušajiem, kurās sepse definēta kā dzīvību apdraudoša orgānu disfunkcija, kuru izraisa disregulēta (dysregulated) saimnieka organisma atbildes reakcija uz infekciju (Singer, 2016). Sepsis-3 konsensus definīcijās uzsvērts, ka sākotnēji šī orgānu disfunkcija var būt klīniski neredzama jeb okulta, tāpēc ir ļoti būtiski agrīni atpazīt pacientu ar smagu bakteriālu infekciju, kas var progresēt līdz dzīvību apdraudošai situācijai (Singer, 2016).
Lai arī vienīgās bērnu sepses definīcijas publicētas konsensus konferencē 2005. gadā, klīniskajā praksē pediatri cenšas adaptēt jaunākās pieaugušo sepses pētniecības atziņas, ievērojot bērna vecuma pacientu fizioloģiskās īpatnības. Savlaicīga smagu bakteriālu infekciju atpazīšana nav viegla neviena vecuma pacientiem, bet bērniem tas ir īpaši liels klīnisks izaicinājums, ņemot vērā, ka bērniem ir daudz ilgstošākas kompensatorās spējas nekā pieaugušajiem, īpaši slimības agrīnās stadijās. Piemēram, hipotensija kā sepses diagnostiskais kritērijs bērniem nav piemērojama, jo ir jau vēlīna un dekompensēta septiska šoka pazīme. Arī citas klīniskās pazīmes bērniem sākotnēji ir grūtāk pamanāmas, atkarīgas no bērna vecuma un variablas.
Lai standartizētu sepses pacientu ārstēšanas procesu un uzlabotu sepses kā saslimšanas rezultātu, Surviving Sepsis Campaign (SSC) jau vairāk nekā pirms 10 gadiem ir izveidojusi triju un sešu stundu sepses skrīninga pakotnes (3-hour and 6-hour bundles) (SSC Executive Committee, 2015). SSC sepses pakotnes ir noteikts jebkura vecuma sepses pacientam veicamo manipulāciju komplekts, kas turklāt realizējams stingri noteiktā laika periodā. Piemēram, trīs stundu sepses pakotne ietver šādas darbības, kuras jāveic trīs stundu laikā kopš ārsta apskates brīža jebkuram pacientam ar aizdomām par smagu bakteriālu infekciju: 1) jānosaka laktāta līmenis; 2) jāpaņem asins uzsējumi pirms antibakteriālās terapijas uzsākšanas; 3) jānozīmē antibakteriālā terapija; 4) jānozīmē intravenozi ievadāms kristaloīdu šķidrums 30 ml/kg. Arī nesen publicēto Sepsis-3 konsensus definīciju kontekstā Surviving Sepsis Campaign publicējusi norādījumus, ka joprojām visbūtiskākā ir agrīna infekciju identifikācija un nekavējoša pacientu ārstēšana atbilstīgi iepriekš minētām sepses pakotnēm (SSC Executive Committee, 2015). Pētījumi plašā pieaugušo pacientu populācijā dažādās pasaules valstīs demonstrē mirstības mazināšanos sepses dēļ tajās slimnīcās, kurās tiek lietotas SSC izstrādātās pakotnes (Ferrer, 2008; Levy, 2010; Levy, 2014).
Tā kā SSC atbalsta un veicina pielāgotu lokālu sepses pakotņu izveidi, Bērnu klīniskajā universitātes slimnīcā (BKUS) jau no 2012. gada ir izveidotas rīcības skalas bērniem ar aizdomām par smagu bakteriālu infekciju, kuras paredzētas lietošanai Neatliekamās medicīnas palīdzības un observācijas nodaļā (NMPON). Šīs skalas papildus četriem SSC triju stundu pakotnes elementiem ietver arī paplašinātu bērnu klīnisku izvērtējumu.
Savukārt, lai uzlabotu agrīnu smagu bakteriālu infekciju laboratorisko diagnostiku, Rīgas Stradiņa universitātes Pediatrijas katedrā un BKUS jau ilgstoši norit SBI un sepses biomarķieru pētniecība. No 2014. gada BKUS ir pieejams automātiskais hematoloģiskais analizators, kas devis iespēju papildināt jau esošo smagu bakteriālu infekciju laboratorisko biomarķieru (leikocītu skaita, absolūtā neitrofilu skaita (ANC), C reaktīvā proteīna (CRP)) komplektu ar vēl vienu pēdējos gados pētītu bakteriāla iekaisuma parametru – nenobriedušo granulocītu procentuālo attiecību (immature granulocyte, IG %) (Fernandes, 2007; Sadik, 2011).
BKUS Neatliekamās palīdzības un observācijas nodaļā strādājošie ārsti ik dienas sastopas ar izaicinājumu atpazīt pacientus ar smagu bakteriālu infekciju ļoti intensīvas pacientu plūsmas apstākļos (2015. gadā BKUS NMPON apmeklēja 70 000 pacientu). Tāpēc saskatījām perspektīvu BKUS lietoto gan smagu bakteriālu infekciju rīcības skalu, gan BKUS pieejamo laboratorisko iekaisuma marķieru kā diagnostiska komplekta izpētē agrīnai smagu bakteriālu infekciju un sepses pacientu identificēšanai un ārstēšanai.
Pētījuma mērķis
Izpētīt agrīnas diagnosticēšanas iespējas bērniem ar smagām bakteriālām infekcijām Bērnu klīniskās universitātes slimnīcas Neatliekamās palīdzības un observācijas nodaļā, izmantojot izstrādātās rīcības skalas bērnu ar smagu bakteriālu infekciju identificēšanai, kā arī izpētīt BKUS pašreiz pieejamo iekaisuma marķieru komplektu smagu bakteriālu infekciju diagnostikai.
Materiāls un metodes
Pētījums veidots kā retrospektīvs, aprakstošs, un tas sastāv no divām daļām (A un B).
A daļa – bērnu ar smagām bakteriālām infekcijām agrīna skrīninga un terapijas skalu lietojuma izpēte slimnīcas Neatliekamās palīdzības nodaļā un to ietekme uz mirstības un stacionēšanas ilguma samazināšanu.
B daļa – BKUS pieejamā iekaisuma marķieru komplekta izvērtējums pacientu ar smagām bakteriālām infekcijām identificēšanai.
Pētījuma A daļā iekļauti bērni, kuri no 2008. gada 1. janvāra līdz 2014. gada 31. decembrim stacionēti BKUS NMPON ar aizdomām par sepsi un kuru galīgā klīniskā diagnoze atbilda pētījuma iekļaušanas kritērijiem.
Pētījuma A daļas iekļaušanas kritēriji:
- norādītā galīgā klīniskā diagnoze medicīnas kartē atbilstoši SSK-10 klasifikatoram ir sepse (A 40; A 41);
- bērna vecums ir no mēneša līdz 18 gadiem.
Pētījuma A daļas izslēgšanas kritēriji:
- bērni, jaunāki par mēnesi;
- bērni ar primāru vai sekundāru imūndeficītu;
- bērni ar hematoonkoloģiskām saslimšanām;
- bērni, kuriem sepse attīstījās nozokomiālas infekcijas rezultātā;
- bērni, kuri pārvesti uz BKUS no citām ārstniecības iestādēm.
Iekļaušanas kritērijiem atbilda un pētījumā tika iekļauti 183 bērni. Pacienti tika sadalīti 2 grupās: 1) kohorta pirms rīcības skalu ieviešanas bērnu identificēšanai ar smagām bakteriālām infekcijām (n = 76), ietverot laikposmu no 2008. līdz 2012. gadam; 2) kohorta pēc rīcības skalu ieviešanas bērnu identificēšanai ar smagām bakteriālām infekcijām (n = 107), ietverot laikposmu no 2013. līdz 2014. gadam.
Pētījuma gaitā tika analizētas pacientu medicīniskās kartes, izvērtējot demogrāfiskos datus, pacientu primāro klīnisko apskati un infekcijas lokalizāciju, veikto izmeklējumu apjomu, terapijas taktiku, kā arī ārstēšanās perioda Intensīvās terapijas nodaļā (ITN) un stacionēšanas ilgumu, slimības iznākumu.
Pētījuma B daļā retrospektīvi tika analizēti dati par bērniem ar sūdzībām par drudzi, kuri stacionēti BKUS Torņakalna novietnes NMPON nodaļā no 2014. gada 1. februāra līdz 2015. gada 31. maijam un kuri atbilda iekļaušanas kritērijiem. Pētījumā tika iekļauti pacienti ar smagām bakteriālām infekcijām, kuras tika definētas kā akūts pielonefrīts, akūts osteomielīts, akūts bakteriāls meningīts, akūts difūzs peritonīts (akūta apendicīta komplikācija), sadzīvē iegūta pneimonija, bakteriēmija, sepse. Kontroles grupai tika atlasīti bērni ar pierādītu vīrusa etioloģijas saslimšanu – Rota vīrusa gastroenterītu.
Pētījuma B daļas iekļaušanas kritēriji:
- bērni ar smagu bakteriālu infekciju diagnozi, izņemot kontroles grupu;
- bērnu vecums no mēneša līdz 18 gadiem;
- drudzis vai dati par drudzi attiecīgajā saslimšanas epizodē;
- pirmā asins analīze veikta ne vēlāk nekā 24 stundas pēc pacienta iestāšanās Neatliekamās palīdzības un observācijas nodaļā;
- pirmā veiktā asins analīze atspoguļo asinsainu ar leikocitāro formulu, kurā iekļauta nenobriedušo granulocītu procentuālā attiecība un CRP.
Pētījuma B daļas izslēgšanas kritēriji:
- bērni, kas jaunāki par mēnesi;
- bērni ir imūnkompromitēti vai pastāv aizdomas par imūndeficītu;
- bērni ar hematoonkoloģiskām saslimšanām;
- bērni ar citām hroniskām blakussaslimšanām;
- pacients pārvests no cita stacionāra, kur ticis ārstēts vairāk nekā 24 stundas.
Gan smagu bakteriālu infekciju, gan kontroles grupas pacientiem bija veikti BKUS pieejamie un plašāk lietotie bakteriālu infekciju diferencējošie laboratoriskie izmeklējumi – noteikts leikocītu skaits, absolūtais neitrofilu skaits, nenobriedušo granulocītu skaits un procentuālā attiecība un CRP līmenis. Pētījumā tika iekļauti dati par pirmajiem minētajiem laboratoriskajiem izmeklējumiem pēc pacienta iestāšanās stacionārā.
Kopumā šajā daļā tika iekļauti 226 pacienti, kuri tika sadalīti divās grupās: 1) pacienti ar smagām bakteriālām infekcijām (n = 151); 2) pacienti ar vīrusu etioloģijas saslimšanu (kontroles grupa, n = 75).
Savāktie dati tika apstrādāti, izmantojot IBM SPSS Statistics un Microsoft Excel programmu. Datu kopas tika pārbaudītas normāla sadalījuma atbilstībai, lietojot Kolmogorova–Smirnova testu. Normāli sadalīti dati tika izteikti ar vidējiem lielumiem ar standartnovirzēm (SD – standard deviation). Šādu datu salīdzināšanai tika lietots Stjudenta ttests neatkarīgām paraugkopām (independent samples t-test) un t tests atkarīgām paraugkopām (paired samples t-test). Dati ar nenormālu sadalījumu tika izteikti ar mediānu un starpkvartiļu izkliedi. Salīdzināšanai lietots Manna–Vitnija (Mann–Whitney) U tests divām neatkarīgām izlasēm, Vilkoksona (Wilcoxon) tests divām atkarīgām izlasēm, Kruskala–Volisa (Kruskal–Wallis) H tests vairāk nekā divām neatkarīgām izlasēm.
Laboratorisko rādītāju diagnostiskās precizitātes izvērtēšanai lietotas līknes (receiver operator characteristics) un noteiktas AUC (laukums zem līknes, angļu val. area under the curve) vērtības. Diagnostiskais tests ir uzskatāms par labu pie vērtībām > 0,8, bet par izcilu pie vērtībām > 0,9. Diagnostiskais tests ar AUC < 0,7 tiek uzskatīts par sliktu. Pamatojoties uz ROC līkņu analīzi, statistiski labākas robežvērtības (cut-off vērtības) tika izrēķinātas katram parametram ar attiecīgu jutības un specifiskuma noteikšanu.
Rezultāti
A daļa – bērnu ar smagām bakteriālām infekcijām agrīna skrīninga un terapijas skalu lietojuma izpēte slimnīcas Neatliekamās palīdzības nodaļā un to ietekme uz mirstības un stacionēšanas ilguma samazināšanu
Pacientu klīniskā izvērtējuma un infekcijas lokalizācijas raksturojums. Pētījuma A daļā iekļauto 183 bērnu ar aizdomām par smagu bakteriālu infekciju vidējais vecums bija 65 mēneši, mediānais vecums – 45 mēneši. No tiem 96 (52,5 %) bija zēni un 87 (47,5 %) meitenes. Jau pirms stacionēšanas 96 % (n = 175) bērnu vidēji 3,1 dienu bija novērots drudzis.
Veicot pirmo apskati, ārstam atbilstīgi BKUS ieviestām rīcības skalām bērniem jāizvērtē sistēmiskā iekaisuma atbildes sindroma kritēriji, kas ietver temperatūras mērījumu, elpošanas un sirdsdarbības frekvences noteikšanu un šo rādījumu izvērtējumu atbilstīgi bērna vecuma fizioloģiskām normām (Goldstein, 2005). Pirms rīcības skalu ieviešanas šāds pilnvērtīgs bērna vitālo klīnisko pazīmju izvērtējums nebija veikts 23 % (n = 17) no 76 bērniem, kas iekļauti pacientu grupā pirms rīcības skalu ieviešanas. Pēc rīcības skalu ieviešanas sistēmiskā iekaisuma atbildes sindroma kritēriji netika izvērtēti 6 % (n = 6) no 107 bērniem, kuri veido pacientu grupu pēc rīcības skalu ieviešanas.
Jāpiebilst, ka otrai A daļas pacientu apakšgrupai, kurā iekļauti bērni pēc rīcības skalu ieviešanas, uzlabojoties medicīniskās dokumentācijas aizpildīšanas kvalitātei BKUS, bija iespējams noteikt laiku no pacienta reģistrācijas brīža līdz pirmajai ārsta apskatei NMPON. Ārsts pacientus ar smagām bakteriālām infekcijām BKUS NMPON nodaļā apskatīja vidēji pēc 33 minūtēm, bet 15 % (n = 16) bērnu apskatīja mazāk nekā 10 minūšu laikā pēc pacienta ierašanās NMPON.
Četras biežākās iekaisuma lokalizācijas visai A daļas pacientu populācijai bija elpceļi (26 %, n = 47), vēdera dobums (24 %, n = 43), nieres un urīnceļi (23 %, n = 42), kauli un mīkstie audi (16 %, n = 29).
Izmeklējumu apjoms un terapijas taktika bērniem ar smagām bakteriālām infekcijām. Asins uzsējumu paņemšana un laktāta līmeņa noteikšana ir īpaši svarīgi laboratoriskie izmeklējumi, kas būtu veicami ikvienam pacientam ar aizdomām par smagu bakteriālu infekciju vai sepsi. Pirms rīcības skalu ieviešanas asins uzsējumi pirms antibakteriālās terapijas uzsākšanas ņemti 64 % (n = 48) pacientu ar smagām bakteriālām infekcijām; pēc rīcības skalu ieviešanas uzsējumi ņemti 82 % (n = 87) pacientu. Laktāta līmenis noteikts 73 % (n = 78) bērnu no pacientu grupas pēc rīcības skalu ieviešanas. Līdz rīcības skalu ieviešanai laktāta līmenis noteikts ļoti nedaudziem bērniem – 9 % (n = 7).
Intravenoza kristaloīdu šķidruma ievade laika periodā līdz rīcības skalu ieviešanai pirmo trīs stundu laikā uzsākta tikai 29 % (n = 22) bērnu ar SBI, bet to pacientu grupā, kurā iekļauti bērni pēc rīcības skalu ieviešanas – 84 % (n = 90) bērnu saņēma intravenozu šķidrumu pirmo trīs stundu laikā. Atzīmējams, ka 60 % (n = 54) no šiem bērniem intravenozu šķidrumu saņēma jau pirmās stundas laikā.
Antibakteriālā terapija pacientu grupā līdz rīcības skalu ieviešanai pirmo trīs stundu laikā uzsākta tikai 8 % (n = 6) bērnu, pacientu grupā pēc rīcības skalu ieviešanas antibakteriālā terapija trīs stundu laikā pēc ārsta apskates uzsākta 63 % (n = 74) pacientu.
Pēc rīcības skalu ieviešanas BKUS visi rīcības skalas elementi tiek izpildīti vidēji 79 % pacientu ar smagām bakteriālām infekcijām, iespējamu sepsi. Iepriekš visus skalas elementus izpildīja tikai vidēji 37 % pacientu ar iespējamu dzīvību apdraudošu saslimšanu.
1. tabula. Smagu bakteriālu infekciju / sepses identificēšanai paredzētas rīcības skalas elementu izpilde, % / Serious bacterial infection / sepsis bundle performance, %
| Skalas elements | Kohorta (n = 76) pirms skalas ieviešanas BKUS | Kohorta (n = 107) pēc skalas ieviešanas BKUS |
|---|---|---|
| Klīniskais izvērtējums | 77 | 94 |
| Asins uzsējums | 64 | 82 |
| Laktāta līmeņa noteikšana | 9 | 73 |
| Kristaloīdu ievade | 29 | 84 |
| Antibiotiku ievade | 8 | 63 |
| Skala pilnībā izpildīta | 37 | 79 |
Stacionēšanas ilgums un iznākums. Pirms rīcības skalu ieviešanas 45 % bērnu ar sepsi no NMPON tika pārvesti ārstēšanai uz Intensīvās terapijas nodaļu. Pēc rīcības skalu ieviešanas un nekavējošas terapijas uzsākšanas jau NMPON etapā pirmajās stacionēšanas stundās tika konstatēts ievērojams stacionēšanas Intensīvās terapijas nodaļā samazinājums – tika stacionēti tikai 18 % bērnu ar smagu bakteriālu infekciju, aizdomām par sepsi. Pirms rīcības skalu ieviešanas bērni ar sepsi, smagām bakteriālām infekcijām ITN tika ārstēti vidēji 12,2 dienas, kopumā stacionārā pavadot 26,3 dienas, bet pēc rīcības skalu ieviešanas ārstēšanas ilgums ITN un slimnīcā kopumā ievērojami samazinājies – 3,7 dienas ITN un 11 dienas slimnīcā.
Uzlabojies arī bērnu ar smagu bakteriālu infekciju un sepsi slimības iznākums. Šī pētījuma laikā 7,8 % bērnu ar sepsi konstatēts letāls iznākums. BKUS no 1995. līdz 2000. gadam letāls iznākums tika konstatēts 24,4 % bērnu ar sepsi (Gardovska, 2001).
B daļa – BKUS pieejamā iekaisuma marķieru komplekta izvērtējums pacientu ar smagām bakteriālām infekcijām identificēšanai
Pētījuma populācijas raksturojums. Atbilstoši kritērijiem pētījuma B daļā tika iekļauti 226 pacienti. Smagas bakteriālas infekcijas (SBI) grupas sastāvā bija 63 zēni (42 %) un 88 meitenes (58 %), kontroles grupā – 39 (52 %) zēni un 36 (48 %) meitenes. Vecuma mediāna SBI grupā bija 60 mēneši (13–134 mēneši), kontroles grupā – 45 mēneši (18–21 mēneši).
SBI pacientu diagnozes / infekcijas lokalizācijas vietas ir apkopotas 2. tabulā. Pacienti, kuru galīgā diagnoze bija sepse un / vai bakteriēmija bez precizētas infekcijas lokalizācijas, tika apvienoti zem diagnozes “sepse”, pārējie tika sadalīti atbilstoši infekcijas lokalizācijām.
2. tabula. Smagu bakteriālu infekciju grupas pacientu diagnozes / infekcijas lokalizācijas vietas / Focus of infection in patients of the serious bacterial infection patient group
| Diagnoze | Pacientu skaits | |
|---|---|---|
| n | % | |
| Akūts pielonefrīts | 43 | 28,5 |
| Difūzs peritonīts | 32 | 21,2 |
| Akūts osteomielīts | 24 | 15,9 |
| Pneimonija | 22 | 14,6 |
| Akūts bakteriāls meningīts | 9 | 6,0 |
| Sepse / bakteriēmija bez lokalizācijas | 10 | 6,6 |
| Sepse. Akūts otīts / akūts rinosinusīts | 4 | 2,6 |
| ≥ 2 infekcijas perēkļi | 7 | 4,6 |
| Kopā | 151 | 100 |
Laboratorisko rādītāju raksturojums un salīdzinājums smagas bakteriālas infekcijas grupā un kontroles grupā. Laboratorisko rādītāju salīdzināšanai tika izmantoti pirmo laboratorisko izmeklējumu rezultāti, pacientam iestājoties stacionārā. Starp abu grupu pacientiem tika salīdzināti šādi parametri: leikocītu skaits, absolūtais neitrofilu skaits (ANC), nenobriedušo granulocītu (IG) skaits un to procentuālā attiecība (IG %) un C reaktīvā proteīna (CRP) līmenis. Tika konstatētas statistiski ticamas atšķirības (p < 0,05) starp grupām šādos rādītājos: kopējais leikocītu skaits, absolūtais neitrofilo leikocītu skaits, nenobriedušo granulocītu procentuālā attiecība un absolūtais skaits, CRP līmenis (sk. 3. tab.).
Šo rādītāju diagnostiskās precizitātes izvērtēšanai lietota ROC līkne ar attiecīgi noteiktiem laukumiem zem līknes (AUC vērtības) (sk. 1. att.). Augstākus rezultātus uzrādīja CRP – 0,94 (95 % ticamības intervāls (TI): 0,92–0,97) un IG absolūtais skaits – 0,82 (95 % TI: 0,77–0,88), pārējo rādītāju AUC vērtības atspoguļotas 4. tabulā.
Analizējot ROC līknes, tika iegūtas laboratorisko parametru robežvērtības (cut-off) SBI diagnostikai.
Optimāla CRP noteiktā robežvērtība bija 56 mg/l (jutība 75 %, specifiskums 100 %), IG procentuālā attiecība – 0,45 % (jutība 65 %, specifiskums 84 %), IG absolūtais skaits – 0,05 × 103/μl (jutība 79 % specifiskums 81 %), ANC – 9,0 × 103/μl (jutība 70 %, specifiskums 76 %), neitrofilo leikocītu skaita – 12,7 × 103/μl (jutība 71 %, specifiskums 82 %). Diagnostisko testu robežvērtības ar attiecīgiem jutības un specifiskuma līmeņiem ir atspoguļotas 5. tabulā.
3. tabula. Laboratorisko rādītāju* salīdzinājums starp pētāmajām grupām, iestājoties stacionārā / Comparison of initial laboratory findings between the patient groups on admission
| Rādītājs | Smagu bakteriālo infekciju grupa (n = 151) | Kontroles grupa (n = 75) | p vērtība |
|---|---|---|---|
| Leikocīti, × 103/μl | 17,0 (11,0–22,0) | 9,9 (7,5–12,0) | < 0,001 |
| ANC, × 103/μl | 12,5 (7,6–16) | 7,1 (4,4–8,0) | < 0,001 |
| IG, % | 0,6 (0,4–1,2) | 0,3 (0,3–0,4) | < 0,001 |
| IG absolūtais skaits, × 103/μl | 0,1 (0,05–0,24) | 0,03 (0,02–0,04) | < 0,001 |
| CRP, mg/L | 111,0 (56,0–206,0) | 6,0 (1,4–23,8) | < 0,001 |
1. attēls. Leikocītu skaita, absolūtā neitrofilu skaita, nenobriedušo granulocītu skaita un to procentuālās attiecības un C reaktīvā proteīna līmeņa ROC līknes smagas bakteriālas infekcijas diagnostikā / ROC curves of leukocyte count, ANC, IG count, IG percentage, C-reactive protein in diagnosis of SBI
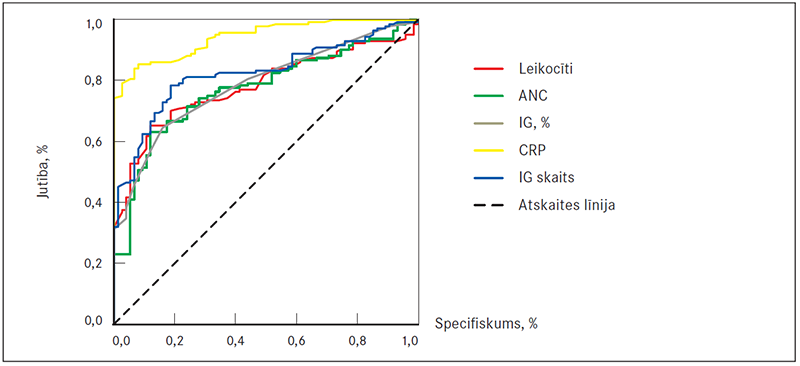
4. tabula. Iekaisuma marķieru AUC vērtības / AUC values for the inflammatory markers
| Rādītājs | AUC vērtība (laukums zem līknes) | 95 % ticamības intervāls | p vērtība |
|---|---|---|---|
| CR, mg/L | 0,94 | 0,92–0,97 | < 0,001 |
| IG absolūtais skaits, × 103/μl | 0,82 | 0,77–0,88 | < 0,001 |
| IG, % | 0,79 | 0,72–0,85 | < 0,001 |
| Leikocīti, × 103/μl | 0,78 | 0,72–0,84 | < 0,001 |
| ANC, × 103/μl | 0,77 | 0,71–0,83 | < 0,001 |
5. tabula. C reaktīvā proteīna, nenobriedušo granulocītu procentuālās attiecības un absolūtā skaita, leikocītu skaita, absolūtā neitrofilo leikocītu skaita robežvērtības smagas bakteriālas infekcijas diagnostikai / The cut-off values of CRP, IG percentage, IG count, leukocyte count and ANC for the diagnosis of SBI
| Rādītājs | Robežvērtības | Jutība, % | Specifiskums, % |
|---|---|---|---|
| CRP, mg/L | 30 | 85 | 91 |
| 50 | 77 | 97 | |
| 70 | 68 | 100 | |
| IG, % | 0,45 | 65 | 84 |
| IG, absolūtais skaits, × 103/μl | 0,05 | 79 | 81 |
| 0,065 | 70 | 84 | |
| 0,07 | 67 | 88 | |
| Leikocīti, × 103/μl | 12,0 | 71 | 78 |
| 13,0 | 68 | 81 | |
| 14,0 | 64 | 88 | |
| 15,0 | 60 | 89 | |
| ANC, × 103/μl | 8,5 | 72 | 72 |
| 9,0 | 70 | 76 | |
| 10,0 | 65 | 82 |
Diskusija
Neskatoties uz plašām pēdējo desmit gadu aktivitātēm, vēl aizvien jāatzīst, ka gan sabiedrības, gan ārstu izpratne par sepsi vērtējama kā zema. Lielā klīnisko pazīmju variabilitāte apgrūtina sepses un smagu bakteriālu infekciju diagnostiku jebkura vecuma pacientiem. Savukārt medicīnas profesionāļiem ir nepieciešami iespējami precīzi un universāli lietojami diagnostiskie rīki agrīnai sepses pacientu identifikācijai. Jaunākās Sepsis-3 konsensus definīcijās sepse definēta kā disregulēta saimnieka organisma atbildes reakcija uz infekciju (dzīvību apdraudoša orgānu disfunkcija), tajā pašā laikā uzsverot, ka joprojām nav pieejami skaidri klīniski mēri, kas atspoguļotu disregulētās saimnieka organisma atbildes konceptu (Singer, 2016). Sepsis-3 eksperti, izvērtējot klīniskos kritērijus, kas vislabāk varētu identificēt sepses pacientus, analizēja gan jau esošās iekaisuma definīcijas – sistēmiska iekaisuma atbildes sindromu (angļu val. Systemic Inflammatory Response Syndrome, SIRS), gan Sequential Organ Failure Assessment (SOFA) un Logistic Organ Dysfunction System (LODS) orgānu disfunkcijas definīcijas. Eksperti atzīmēja, ka tādi SIRS kritēriji kā leikocitoze, drudzis un tahikardija atspoguļo iekaisumu, saimnieka organisma atbildi “uz briesmām” infekcijas vai cita ievainojuma gadījumā.
Tomēr SIRS kritēriji tieši nenorāda uz disregulētu vai dzīvību apdraudošu organisma atbildi. Tāpēc Sepsis-3 eksperti, vērtējot divus iznākumus – 1) mortalitāti un 2) mortalitāti plus trīs un vairāk dienu atrašanos Intensīvās terapijas nodaļā vai abus iznākumus kopā – analizēja datus par gandrīz 150 tūkstošiem pacientu ar iespējamu infekciju Pitsburgas Medicīnas centru veselības sistēmā un datus par vairāk nekā 700 tūkstošiem pacientu ar sadzīvē un hospitālī iegūtām infekcijām veselības aprūpes iestādēs ārpus ASV. Tika secināts, ka SOFA un LODS kritēriji labāk nekā SIRS kritēriji spēja atšķirt tos pacientus, kuriem vēlāk slimības iznākums bija letāls. Jāatzīmē, ka tas bija attiecināms uz ITN pacientu populāciju, savukārt ārpus ITN, SOFA kritēriji precizitātē bija pielīdzināmi SIRS kritērijiem, lai prognozētu vēlāku pacientu mortalitāti. Sepsis-3 eksperti definē jaunus, qSOFA (quick SOFA) kritērijus, kas nodrošina vienkāršus, pie pacienta gultas izvērtējamus parametrus pieaugušo vecuma pacientu identificēšanai ar iespējamu infekciju, kuriem ar lielu varbūtību iespējams slikts slimības iznākums. qSOFA ietver elpošanas frekvenci ≥ 22 reizes minūtē, izmainītu mentālo statusu un sistolisko asinsspiedienu ≤ 100 mm Hg. Jāatzīmē, ka šie qSOFA kritēriji kā diagnostisks rīks attiecināms tikai uz pieaugušo vecuma pacientiem, un Sepsis-3 eksperti joprojām īpaši uzsver, ka SIRS kritēriji vēl arvien noder infekciju identificēšanai.
Standartizētu pacienta izvērtējumu skalu lietošana BKUS Neatliekamās palīdzības un observācijas nodaļā ievērojami samazinājusi gan kopējo laiku, kurā bērni ar smagām bakteriālām infekcijām atrodas slimnīcā, gan atrašanās laiku Intensīvās terapijas nodaļā (stacionēšanas ilgums samazinājies no 26,3 dienām līdz 11 dienām un atrašanās ITN no 12,2 līdz 3,7 dienām). Ievērojami samazinājies pacientu skaits, kuri smagu bakteriālu infekciju dēļ tiek stacionēti ITN (pirms rīcības skalu ieviešanas 45 % bērnu, pēc rīcības skalu ieviešanas 18 % bērnu). Tas norāda, ka uzlabojusies ne tikai pacientu ar sepsi agrīna atpazīšana, bet arī tai secīgi sekojoša, nekavējoša rīcības taktika – ātri uzsākta antibakteriāla terapija un intravenoza šķidruma pievade. Jāatzīmē, ka līdzīgi uzlabojumi, bet daudz plašākās pacientu populācijās, panākti arī citviet pasaulē. 2014. gadā publicēts vērienīgs 7,5 gadus ilgs attīstītās Eiropas valstīs un ASV veikts pētījums, kurā iekļauti 29 470 pacienti ar sepsi un kurā pierādīts mortalitātes samazinājums par 25 % visās tajās slimnīcās, kurās tiek lietotas Surviving Sepsis Campaign pakotnes sepses pacientu atpazīšanai un tālākai rīcībai (Levy, 2014). Arī Spānijā, ieviešot plašu sepses izglītības programmu un izvērtējot rezultātus pirms un pēc tās uzsākšanas, pētījumā iekļauti gandrīz 3000 sepses pacientu. Pēc izglītības programmas ieviešanas konstatēts ievērojams hospitālās mirstības samazinājums sepses dēļ (Ferrer, 2008). Iepriekš minētos pētījumos iekļauti pieaugušo vecuma pacienti, bet arī bērnu populācijā pierādīts, ka katra stunda, kas pediatriska sepses pacienta novērtēšanā un aprūpē aizrit, neizmantojot vadlīnijas (piemēram, PALS / APLS (Pediatric Advanced Life Support / Advanced Pediatric Life Support)), palielina letalitātes risku bērniem par 40 %. Pierādīts arī, ka katra stunda, kas bērnam ar sepsi aizrit bez atbilstošas (tai skaitā antibakteriālas) terapijas, letalitātes risku palielina par 7,6 % (Carcilo, 2009; Aneja, 2011).
Jāpiebilst, ka vienotu rīcības skalu ieviešana BKUS NMPON uzlaboja ne tikai slimības iznākumu pacientiem ar smagām bakteriālām infekcijām, bet, standartizējot lēmuma pieņemšanas procesu, atviegloja arī medicīnas personāla komplekso darbu intensīvas pacientu plūsmas apstākļos, kā arī veicināja vispārējā informētības līmeņa par sepsi uzlabošanos darbinieku vidū.
Balstoties uz pašreizējām zināšanām par smagu bakteriālu infekciju patoģenēzi, pasaulē līdz šim pētīti un atlasīti dažādi marķieri smagu bakteriālu infekciju noteikšanai, slimības smaguma izvērtēšanai, terapijas efektivitātes izvērtēšanai un iespējamā iznākuma prognozēšanai. Papildus plaši pētītajiem hematoloģiskajiem infekcijas marķieriem – leikocītu skaitam, absolūtajam neitrofilo leikocītu skaitam (Todd, 1974) – mūsdienās tiek pētīts plašs biomarķieru klāsts bakteriālu saslimšanu diferencēšanai no pašlimitējošām virālām saslimšanām (Blomkalns, 2007).
Klīnikā lietojamiem biomarķieriem jābūt objektīvi izmērāmiem, tiem jābūt definētiem references intervāliem, jābūt labi zināmai biomarķiera kinētikai, tā noteikšanas metodēm jābūt iespējami automatizētām, kā arī noteikšanas procesam jābūt izmaksu ziņā efektīvam (Cho, 2014). Starp pasaulē šobrīd plašāk lietotajiem smagas bakteriālas infekcijas un sepses noteikšanas biomarķieriem minami CRP (Sanders, 2008; Cho, 2014) un prokalcitonīns (Simon, 2004; Wacker, 2013); kā sepses un septiska šoka prognostiskais marķieris minams laktāta līmenis serumā (Nguyen, 2010). Bakteriālu infekciju diferencēšanai lietojami arī atsevišķi iekaisuma citokīni un hemokīni – tumora nekrozes faktors alfa (TNF-α), interleikīni IL-6, IL-8 un IL-1 receptora antagonists (Lacour, 2001; Cho, 2014). Bērnu klīniskās universitātes slimnīcas laboratorijā iespējams noteikt CRP, IL-6 un laktāta līmeni asins serumā, tomēr ikdienā izmaksu efektivitātes un 24 stundu pieejamības dēļ izmantojamais bioķīmiskais marķieris bakteriālo infekciju diferencēšanā bērniem ar drudzi Neatliekamās palīdzības nodaļā parasti ir tieši C reaktīvais proteīns, kura izmantošanas efektivitātes retrospektīva izvērtēšana iespējama lielākai pacientu populācijai.
Izvērtējot BKUS Neatliekamās palīdzības nodaļā pieejamos bakteriālās infekcijas marķierus, C reaktīvais proteīns tika atzīts par labāko no pētāmajiem diagnostiskajiem rādītājiem ar vislielāko AUC vērtību (0,94), tika pierādīta statistiski ticama atšķirība starp CRP vērtību pacientu grupā ar smagām bakteriālām infekcijām un tā vērtību kontroles grupā. Izmantojot ROC līkņu analīzi, CRP kā bakteriālu infekciju diagnostiskā marķiera pārākums pār leikocītu skaitu un absolūto neitrofilo leikocītu skaitu atzīts arī citos prospektīvos (Andreola, 2007; Pratt, 2007; Manzano, 2011), un retrospektīvos (Olaciregui, 2009) pētījumos par bērniem ar sūdzībām par drudzi. Taču kādā 2002. gadā ASV veiktā pētījumā CRP, leikocītu skaita un ANC efektivitāte bija līdzīga okultas bakteriēmijas diagnostikā bērnu populācijā vecumā no 3 līdz 36 mēnešiem (Isaacman, 2002).
BKUS veiktajā pētījumā optimālā CRP robežvērtība pacientu ar SBI identificēšanai bija 56 mg/l (jutība 75 %, specifiskums 100 %). Literatūrā minētās CRP robežvērtības gan ir variablas. 2008. gadā veiktā sistemātiskā pārskatā, kurā tika analizēti sešu pētījumu (ar kopējo iekļauto pacientu skaitu 1040) rezultāti par CRP precizitāti smagu bakteriālo infekciju identificēšanā bērniem ar drudzi, šī robežvērtība svārstījās no 20 līdz 70 mg/l (Sanders, 2008). Kopējā izrēķinātā jutība un specifiskums bija attiecīgi 77 % un 79 %. Lielā robežvērtību variabilitāte liecina, ka precīzai bakteriālu infekciju identificēšanai bērniem ar drudzi būtu nepieciešami arī citi diferencējoši marķieri.
Pētījumā kā nākamie labākie diagnostiskie rādītāji pēc CRP smagu bakteriālo infekciju identificēšanai sekoja IG absolūtais skaits (AUC vērtība 0,82), IG procentuālā attiecība (AUC vērtība 0,79), leikocītu skaits un absolūtais neitrofilo leikocītu skaits ar nedaudz zemākām AUC vērtībām. Leikocītu skaits un absolūtais neitrofilo leikocītu skaits jau sen tiek lietots smagu bakteriālu infekciju identificēšanā (Todd, 1974; Baraff, 1993). Taču, analizējot leikocītu skaita jutību un specifiskumu, pētījumos tie atspoguļoti kā zemi, svārstoties attiecīgi 50–69 % un 53–80 % robežās (Lacour, 2001; Isaacman, 2002; Thayyil, 2005; Andreola, 2007; Pratt, 2007; Blomkalns, 2007). BKUS pētījumā noteiktajai optimālajai leikocītu skaita robežvērtībai 12,7 × 103/μl jutība un specifiskums gan ir augstāki (attiecīgi 71 % un 82 %). Absolūtajam neitrofilo leikocītu skaitam, kas > 10 × 103 /μl, kā SBI diagnostiskam marķierim jutība un specifiskums vairākos pētījumos svārstās attiecīgi 30–40 % (95 % TI: 20–45 %) un 76–78 % (95 % TI: 73–82 %) robežās (Andreola, 2007; De, 2014), arī BKUS pētījumā noteiktās robežvērtības – 9,0 × 103/μl, jutība 70 % un specifiskums 76 % – stipri atpalika no CRP.
Pēdējos gados, attīstoties automatizētās hematoloģisko izmeklējumu analīzes iespējām, bez papildu laika ieguldījuma un papildu asins tilpuma ņemšanas iespējams noteikt nenobriedušo granulocītu (promielocītu, mielocītu un metamielocītu) procentuālo attiecību, kas bakteriālas infekcijas gadījumā liecina par paaugstinātu kaulu smadzeņu aktivitāti infekcijas aģentu izraisīto iekaisuma citokīnu produkcijas dēļ (Selig, 1995). Nenobriedušo granulocītu procentuālās attiecības un absolūtā skaita mērījumi jaunākajā literatūrā minēti kā labs potenciāls papildu marķieris bakteriālu infekciju un sepses diagnostikā. 2003. gadā publicētā pētījumā tika konstatēta statistiski ticama atšķirība nenobriedušo granulocītu procentuālās attiecības mērījumos starp neatliekamās palīdzības nodaļas pacientu grupām ar pierādītu infekciju un bez tās, kā arī starp pacientiem ar pozitīvu un negatīvu asins kultūru (Ansari-Lari, 2003). Citā, 2013. gadā publicētā, pētījumā intensīvās terapijas nodaļas pacientiem nenobriedušo granulocītu skaits uzrādīja lielāku diagnostisko vērtību infekciozas un neinfekciozas dabas iekaisuma reakciju diferencēšanā nekā CRP un IL-6 (Nierhaus, 2013).
2011. gadā publicētā retrospektīvā pētījumā par neatliekamās palīdzības nodaļas pacientiem ar sepsi IG procentuālā attiecība labāk nekā citi marķieri (leikocītu skaits, CRP, laktāta līmenis serumā) spēja diferencēt komplicētas sepses (smaga sepse ar septisku šoku) gadījumus no nekomplicētas sepses gadījumiem (Ha, 2015). Jāpiebilst, ka visi iepriekš minētie pētījumi veikti pieaugušo populācijā. 2011. gadā veiktā pētījumā, kurā iekļauta arī bērnu populācija, IG skaitam konstatēta lielāka diagnostiskā vērtība nekā leikocītu skaitam un absolūtajam neitrofilo leikocītu skaitam, taču bērnu populācijā IG absolūtā skaita un ANC diagnostiskā precizitāte bija aptuveni vienāda (Senthilnayagam, 2012). BKUS veiktajā pētījumā tika konstatēta statistiski ticama atšķirība gan IG procentuālajā attiecībā, gan absolūtajā skaitā starp SBI un kontroles grupas pacientiem (p < 0,001), kā arī IG absolūtais skaits uzrādīja labus diagnostiskās precizitātes izvērtēšanas rezultātus ar AUC 0,82, ieņemot otro vietu aiz CRP.
Nenobriedušo granulocītu procentuālās attiecības un absolūtā skaita pielietojamībai bakteriālu infekciju diagnosticēšanā būtiska ir optimālās robežvērtības un references intervālu noteikšana, kas literatūrā ir stipri variabla. 2010. gadā ambulatorās aprūpes apstākļos veiktā pētījumā rekomendētas robežvērtības IG procentuālajā attiecībā un absolūtajā skaitā attiecīgi ir 0,30 % un 40,0/μl bērniem līdz 10 gadu vecumam, pēc 10 gadu vecuma – 0,70 % un 40,0/μl (Roehrl, 2011). Minētajā 2011. gada pētījumā bakteriēmijas noteikšanai nenobriedušo granulocītu procentuālās attiecības robežvērtība pieaugušo populācijā noteikta 1,1 % ar jutību 70,37 % un specifiskumu 62,67 %, un bērnu populācijā – 0,5 % ar jutību 95,83 %, specifiskumu 21,62 % (Senthilnayagam, 2012). Citur pieaugušo populācijā IG procentuālās attiecības robežvērtība 0,5 % noteikta kā smagas sepses marķieris (Ha, 2015). Pētījumā BKUS Neatliekamās palīdzības nodaļā noteiktā IG procentuālās attiecības robežvērtība 0,45 % (ar jutību 65 %, specifiskumu 84 %) un IG absolūtā skaita robežvērtība 0,05 × 103/μl (jutība 79 %, specifiskums 81 %), ir tuvas literatūrā minētajām.
Secinājumi
- Uz pierādījumiem balstītu rīcības skalu bērniem ar smagām bakteriālām infekcijām ieviešana slimnīcas neatliekamās palīdzības nodaļā samazina kopējo hospitalizācijas laiku, ārstēšanās periodu intensīvās terapijas nodaļā, kā arī ievērojami samazina bērnu mirstību sepses dēļ.
- Ņemot vērā pētījumā noteiktos diagnostiskās precizitātes rezultātus, vieglo un ātro rezultātu iegūšanas iespēju bez papildu cilvēkresursu, asins paraugu un materiālo līdzekļu iesaistes, nenobriedušie granulocīti uzskatāmi par ticamu bakteriālo infekciju diagnostisko marķieri papildus praksē jau lietotajiem hematoloģiskajiem un biomarķieriem.
- Unificētas komplicētu pacientu klīniskās un laboratoriskās diagnostikas un izmeklēšanas metodes standartizē lēmumu pieņemšanas procesu intensīvas pacientu plūsmas apstākļos, ļaujot ļoti agrīni identificēt potenciāli smagi slimos pacientus un uzsākt nekavējošu ārstēšanu, tādējādi uzlabojot slimības iznākumu.
Pateicības
Pētījums izstrādāts Valsts pētījumu programmas “Biomedicīna sabiedrības veselībai” (BIOMEDICINE) ietvaros.
Pateicība visiem pētniecības komandas locekļiem: Dr. Ivetai Čaplinskai, doc. Dacei Zavadskai, doc. Renāram Ertam, asoc. prof. Ilzei Gropei, asoc. prof. Janai Pavārei, prof. Dacei Gardovskai, kā arī visiem Bērnu klīniskās universitātes slimnīcas Neatliekamās palīdzības un observācijas nodaļas darbiniekiem.
Abstract
Early Diagnosis of Serious Bacterial Infections in Paediatric Emergency Department
Due to the high childhood morbidity and mortality from serious bacterial infections (SBI), evidence-based guidelines and bundles for initial resuscitation have been developed in the last decades. By introducing their use in the emergency department of University Children’s Hospital in Rīga, in addition to enhanced laboratory investigations, a significant improvement of diagnosis and management of children with SBI has been observed.
The aim of the research is to evaluate the capability of early diagnosis of SBI by using evidencebased bundles as well as the available inflammatory markers.
This is a retrospective study divided in two sections: Section A – evaluation of use of SBI management bundles in care of patients in paediatric emergency department; Section B – the evaluation of available inflammatory markers in identification of patients with SBI.
After the introduction of early sepsis management bundles, blood cultures were taken from 82 % patients with SBIs instead of 64 % as previously. More patients received intravenous fluids (84 % instead of 22 %) and early antibacterial treatment (63 % instead of 8 %). A significant decrease in admissions to the intensive care unit (ICU) was observed (from 45 % to 18 %) as well as in the duration of stay in ICU (from 12.2 days to 3.7 days), in total duration of hospitalisation (from 26.3 to 11 days), and mortality from sepsis (from 24.4 % to 7.8 %). According to ROC curve analysis, CRP had the highest diagnostic value among the routine inflammatory markers with AUC (area under curve) of 0.94 (95 % CI: 0.92–0.97), followed by immature granulocyte (IG) count (AUC 0.82, 95 % CI: 0.77–0.88), and IG percentage (AUC 0.79; 95 % CI: 0.72–0.85).
The introduction of evidence-based SBI management bundles has led to decreased stay in the ICU and hospitalisation time, as well as to reduction in sepsis mortality. Immature granulocyte count and percentage can be used as an additional marker for diagnosis of bacterial infection.
Literatūra
- Andreola, B., Bressan, S., Callegaro, S., et al. Procalcitonin and C-reactive protein as diagnostic markers of severe bacterial infections in febrile infants and children in the emergency department. The Pediatric Infectious Disease Journal. 2007, 26(8), 672–677.
- Aneja, R. K. and Carcillo, J. A. Differences between adult and pediatric septic shock. Minerva Anestesiologica. 2011, 986–992.
- Ansari-Lari, M. A., Kickler, T. S., and Borowitz, M. J. Immature granulocyte measurement using the Sysmex XE-2100. Relationship to infection and sepsis. American Journal of Clinical Pathology. 2003, 120(5), 795–799.
- Baraff, L. J., Schriger, D. L., Bass, J. W., et al. Practice guideline for the management of infants and children 0 to 36 months of age with fever without source. Pediatrics. 1993, 92(1), 1–12.
- Blomkalns, A. L. Sick or not sick? Evolving biomarkers for severe bacterial infections. EMCREG monograph from the ACEP 2007 Scientific Assembly Satellite Symposia. October 2007. Seattle, Washington, 27–36. Iegūts no: http://www.emcreg.org/pdf/monographs/sbi2007.pdf [sk. 01.05.2016.].
- Carcilo, J. A., Kuch, B. A., Han, Y. T. Y., et al. Mortality and functional morbidity after use of PALS/APLS by community physicians. Pediatrics. 2009, 124, 500.
- Cho, S. Y. and Choi, J. H. Biomarkers of sepsis. Infection & Chemotherapy. 2014, 46(1), 1–12.
- De, S., Williams, G. J., Hayen, A., et al. Value of white cell count in predicting serious bacterial infection in febrile children under 5 years of age. Archives of Disease in Childhood. 2014, 99(6), 493–499.
- Dellinger, R. P., Carlet, J. M., Masur, H., et al. Surviving Sepsis Campaign Management Guidelines Committee: Surviving Sepsis Campaign Guidelines for Management of Severe Sepsis and Septic Shock. Critical Care Medicine. 2004, 32, 858–873.
- Dellinger, R. P., Levy, M. M., and Rhodes, A. Surviving Sepsis Campaign Guidelines Committee including the pediatric subgroup: Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock 2012. Critical Care Medicine. 2013, 41(2), 580–637.
- Fernandes, B. and Hamaguchi, Y. Automated enumeration of immature granulocytes. American Journal of Clinical Pathology. 2007, 128, 454–463.
- Ferrer, R., Artigas, A., Levy, M. M., et al. Edusepsis Study Group: Improvement in process of care and outcome after a multicenter severe sepsis educational program in Spain. JAMA. 2008, 299, 2294–2303.
- Gardovska, D., Laizāne, G., Grope, I., et al. Sepsis outcomes and early diagnostic peculiarities in tertiary level Children’s Hospital in Latvia. Latvijas Medicīnas akadēmija / Rīgas Stradiņa universitāte. Zinātniskie raksti. 2001, 83–85.
- Goldstein, B., Giroir, B., and Randolph, A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in paediatrics. Pediatric Critical Care Medicine. 2005, 6, 2–8.
- Ha, S. O., Park, S. H., Park, S. H., et al. Fraction of immature granulocytes reflects severity but not mortality in sepsis. Scandinavian Journal of Clinical and Laboratory Investigation. 2015, 75(1), 36–43.
- Hartman, M. E., Linde-Zwirble, W. T., Angus, D. C., et al. Trends in the epidemiology of pediatric severe sepsis. Pediatric Critical Care Medicine. 2013, 14, 686–693.
- Isaacman, D. J. and Burke, B. L. Utility of the serum C-reactive protein for detection of occult bacterial infection in children. Archives of Pediatrics & Adolescent Medicine. 2002, 156(9), 905–909.
- Kutko, M. C., Calarco, M. P., Flaherty, M. B., et al. Mortality rates in pediatric septic shock with and without multiple organ system failure. Pediatric Critical Care Medicine. 2003, 4, 333–337.
- Lacour, A. G., Gervaix, A., Zamora, S. A., et al. Procalcitonin, IL-6, IL-8, IL-1 receptor antagonist and C-reactive protein as identificators of serious bacterial infections in children with fever without localising signs. European Journal of Pediatrics. 2001, 160(2), 95–100.
- Levy, M. M., Delinger, R. P., Linde-Zwirble, W. T., et al. The Surviving Sepsis Campaign: results of an international guideline-based performance improvement program targeting severe sepsis. Critical Care Medicine. 2010, 38(2), 367–374.
- Levy, M. M., Rhodes, A., Phillips, G. S., et al. Surviving Sepsis Campaign: association between performance metrics and outcomes in a 7.5-year study. Intensive Care Medicine. 2014, 40(135), 1623–1633.
- Manzano, S., Bailey, B., Gervaix, A., et al. Markers for bacterial infection in children with fever without source. Archives of Disease in Childhood. 2011, 96(5), 440–446.
- National Center for Injury Prevention and Control, CDC: 10 leading causes of death by age group, United States-2013. Iegūts no: http://www.cdc.gov/injury/wisqars/pdf/leading_causes_of_death_by_age_group_2013-a.pdf [sk. 16.01.2016.].
- Nguyen, H. B., et al. Early lactate clearance is associated with biomarkers of inflammation, coagulation, apoptosis, organ dysfunction and mortality in severe sepsis and septic shock. Journal of Inflammation. 2010, 7(1), 1.
- Nierhaus, A., Klatte, S., Linssen, J., et al. Revisiting the white blood cell count: immature granulocytes count as a diagnostic marker to discriminate between SIRS and sepsis – a prospective, observational study. BMC Immunology. 2013, 14(1), 1.
- Olaciregui, I., Hernández, U., Munoz, J. A., et al. Markers that predict serious bacterial infection in infants under 3 months of age presenting with fever of unknown origin. Archives of Disease in Childhood. 2009, 94(7), 501–505.
- Pratt, A. and Attia, M. W. Duration of fever and markers of serious bacterial infection in young febrile children. Pediatrics International. 2007, 49, 31–35.
- Roehrl, M. H. A., Lantz, D., Sylvester, C., and Wang, J. Y. Age-dependent reference ranges for automated assessment of immature granulocytes and clinical significance in an outpatient setting. Archives of Pathology & Laboratory Medicine. 2011, 135(4), 471–477.
- Sadik, C. D., Kim, N. D., and Luster, A. D. Neutrophils cascading their way to inflammation. Trends in Immunology. 2011, 32(10), 452–460.
- Sanders, S., Barnett, A., Correa-Velez, I., et al. Systematic review of the diagnostic accuracy of C-reactive protein to detect bacterial infection in nonhospitalized infants and children with fever. The Journal of Pediatrics. 2008, 153(4), 570–574.
- Selig, C. and Nothdurft, W. Cytokines and progenitor cells of granulocytopoiesis in peripheral blood of patients with bacterial infections. Infection and Immunity. 1995, 63, 104–109.
- Senthilnayagam, B., Kumar, T., Sukumaran, J., and Rao, K. R. Automated measurement of immature granulocytes: performance characteristics and utility in routine clinical practice. Pathology Research International. 2012, 2012, article ID 483670.
- Simon, L., Gauvin, F., Amre, D. K., et al. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis. Clinical Infectious Diseases. 2004, 39(2), 206–217.
- Singer, M., Deutschman, C. S., Seymour, C. W., et al. The Third International Consensus definitions for sepsis and septic shock (Sepsis-3). JAMA. 2016, 315(8), 801–810.
- SSC Executive Committee: Surviving Sepsis Campaign bundles. Revised 4/2015. Iegūts no: http://www.survivingsepsis.org/bundles/Pages/default.aspx [sk. 29.03.2016.].
- Thayyil, S., Shenoy, M., Hamaluba, M., et al. Is procalcitonin useful in early diagnosis of serious bacterial infections in children? Acta Paediatrica. 2005, 94(2), 155–158.
- Todd, J. K., Childhood infections: diagnostic value of peripheral white blood cell and differential cell counts. American Journal of Diseases of Children. 1974, 127, 810–816.
- Wacker, C., Prkno, A., Brunkhorst, F. M., and Schlattmann, P. Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis. The Lancet Infectious Diseases. 2013, 13(5), 426–435.
- Watson, R. S., Carcillo, J. A., Linde-Zwirble, W. T., et al. The epidemiology of severe sepsis in children in the United States. American Journal of Respiratory and Critical Care Medicine. 2003, 167(5), 695–701.


